Результаты промежуточного анализа данных открытого многоцентрового исследования применения доксазозина в комбинации с Индигалом при ДГПЖ («ОДИССЕЙ»)
 9905
9905 Доброкачественная гиперплазия предстательной железы (ДГПЖ) широко распространенное патологическое состояние, поражающее преимущественно мужчин среднего и пожилого возраста. Данное заболевание сопровождается обструктивными и ирритативными симптомами, существенно снижающими качество жизни пациентов. Признаки ДГПЖ встречаются более чем у 50% пациентов в возрасте 51-60 лет, и частота встречаемости этих признаков увеличивается до 85-90% у мужчин старше 80 лет [1, 2]. Несмотря на то, что истинная этиология ДГПЖ до настоящего времени остается неясной, важную роль в развитии данного состояния связывают со стромальной и железистой пролиферацией клеток в периуретральной зоне предстательной железы [3]. С одной стороны, наблюдается нарушение оттока мочи и связанная с этим урологическая симптоматика за счет увеличения массы предстательной железы. Пролиферация, в некоторой степени, вызывается замедлением апоптоза (программированной клеточной гибелью), что приводит к увеличению объема ткани предстательной железы [4]. С другой стороны, увеличивается тонус гладкомышечных структур за счет стимуляции альфа-адренорецепторов [5]. В связи с имеющимися данными о патогенезе доброкачественной гиперплазии предстательной железы, в настоящее время интерес представляют 2 группы препаратов [6]: альфаадреноблокаторы (к ним относится, в частности, доксазозин) и антиандрогены (в эту группу входят, в частности, ингибиторы 5-а-редуктазы) [7].
Коммерческие препараты доксазозина доступны и используются в клинических целях с 1988 года [8]. Наиболее часто отмечаемые побочные эффекты головокружение, усталость, головная боль. Эти симптомы одинаково часто встречались в группах пациентов с гипертензией и нормальным артериальным давлением (АД) [8]. К настоящему времени исследования выявили, что показатели безопасности доксазозина сходны у пациентов с гипертензией, ДГПЖ или обоими заболеваниями [9].
В состав препарата Индигал («МираксБиоФарма») входят два основных действующих компонента: содержащийся в овощах семейства крестоцветных индол-3-карбинол (I3C) и наиболее активный из катехинов зеленого чая эпигаллокатехин-3-галлат (EGCG).
К настоящему времени в литературе накоплен огромный пласт экспериментального и практического материала, свидетельствующего о том, что I3C и EGCG являются противоопухолевыми соединениями, эффективными в отношении большого числа новообразований эпителиального происхождения [10, 11]. Эти субстанции уже завоевали заслуженную популярность у практикующих врачей и их пациентов в Европе и США. Экспериментально и клинически обоснованная уникальность данных соединений обусловлена их способностью осуществлять множественное блокирование молекулярных механизмов, стимулирующих патологическую клеточную пролиферацию и последующий канцерогенез [10]. В частности, I3C эффективно нормализует гормональный баланс, блокирует основные (в том числе гормон-независимые) сигнальные пути, приводящие к патологической клеточной пролиферации, и стимулирует апоптотическую гибель трансформированных клеток [10]. К настоящему моменту идентифицировано большое число биологически активных молекулярных мишеней, ингибируемых I3C и EGCG и опосредующих неопластические процессы в эпителиальных тканях.
На основании представленных выше данных о патогенезе гиперплазии предстательной железы, перспективным видится комбинированный подход, включающий терапию доксазозином и Индигалом. Изучению безопасности и эффективности этой комбинации препаратов и посвящено данное клиническое исследование.
Материалы и методы
Таблица 1. Центры проведения исследования
| Город | Клиника |
| Екатеринбург | ГОУ ВПО «Уральская государственная медицинская академия Росздрава» |
| Москва | ГОУ ВПО «Российский государственный медицинский университет Росздрава» |
| Москва | ФГУ «НИИ урологии» Минздравсоцразвития |
| Нижний Новгород | ГОУ ВПО «Нижегородская государственная медицинская академия Росздрава» |
| Новосибирск | Медицинский центр «Биовэр» |
| Санкт-Петербург | ГОУ ВПО «Санкт-Петербургский государственный медицинский университет им. И.П. Павлова Росздрава» |
| Саратов | ГОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Росздрава» |
| Уфа | ГОУ ВПО «Башкирский государственный медицинский университет Росздрава» |
Настоящее исследование проводится в 8 клинических центрах (таблица 1) с сентября 2009 года.
В соответствии с протоколом, в исследование было включено 100 пациентов, набор был завершен в июле 2010 г. На момент проведения промежуточного анализа завершили исследование полностью в соответствии с протоколом 12 пациентов, еще 6 пациентов выбыли преждевременно по различным причинам. В анализ были включены данные 80 пациентов, завершивших Визит 2 (3 месяца), в том числе 66 завершивших Визит 3 (6 месяцев) и 12 пациентов, завершивших Визит 4 (12 месяцев). Исследование представляло открытое несравнительное изучение эффективности и безопасности перорального приема комбинации препаратов в течение 6 месяцев, с последующим периодом отдаленного наблюдения, продолжительностью также 6 месяцев. Все включенные в исследование пациенты получали Индигал (по 2 капсулы 2 раза в день в течение 6 мес.) и доксазозин по 2-8 мг (1-4 таблетки) перед сном перорально, начиная с дозы 2 мг и проводя титрование дозы. Пациент получал, таким образом, 400 мг/сут. индол-3-карбинола, 180 мг/сут. эпигаллокатехин-3-галлата и 2-8 мг доксазозина. Пациенты были проинструктированы, что в случае развития нежелательных явлений они должны обратиться к врачу в исследовательский центр, который примет решение об окончательной дозе доксазозина. В случае развития у пациента признаков артериальной гипотензии (ортостатическая гипотензия, головокружение, обморочные состояния) исследователь прекращал увеличение дозы доксазозина, установив пациенту для постоянного приема максимальную хорошо переносимую дозу.
Планом исследования предусматривалось проведение 4 визитов пациента к врачу (таблица 2).
Таблица 2. График проведения процедур исследования
| Визит | V0 | V1 | V2 | V3 | V4 |
| День исследования/Процедуры | Скрининг | 0 | 90±5 | 180±5 | 360±10 |
| (-21 0 дней) дней дней | дней | дней | |||
| Информированное согласие | X | ||||
| Критерии включения/исключения | X | ||||
| Демографические данные | X | ||||
| Медицинский анамнез | X | ||||
| Физикальный осмотр | X | X | X | X | X |
| Урологический осмотр | X | X | X | X | X |
| ПСА | X | X | X | X | |
| Урофлоуметрия | X | X | X | X | |
| ТРУЗИ + остаточная моча | X | X | X | X | |
| Опросник IPSS+QoL | X | X | X | X | X |
| Общий анализ крови | X | X | X | ||
| Общий анализ мочи | X | X | X | ||
| Биохимический анализ крови | X | X | X | ||
| Электрокардиография | X | ||||
| Проверка нежелательных явлений | X | X | X | ||
Протокол проведения исследования предусматривал следующие критерии отбора пациентов.
Критерии включения:
- Возраст 45-80;
- Диагноз: «доброкачественная гиперплазия предстательной железы», в том числе с сопутствующей простатической интраэпителиальной неоплазией;
- Наличие симптомов по шкале IPSS более 10 баллов и длительностью более 3 месяцев;
- По данным урофлоуметрии во время Визита 0, Q < 5 мл/с;
- По данным ТРУЗИ объем предстательной железы более 30 см3;
- Объем мочеиспускания от 100 до 350 мл;
- Объем остаточной мочи менее 150 мл;
- ПСА сыворотки крови менее 10 нг/мл;
- Наличие письменного согласия об участии в данном исследовании.
Таблица 3. Данные опросников IPSS и значимость отличий между ними на Визитах 1 и 2 (критерий Вилкоксона)
| n | Визит 1 (до лечения), M ± m | Визит 2 (через 3 месяца), M ± m | p | |
| IPSS, вопрос 1 | 73 | 2,24 ± 1,21 | 1,52 ±1 ,14 | < 0,000001 |
| IPSS, вопрос 2 | 73 | 2,29 ± 1,14 | 1,58 ± 0,95 | 0,000001 |
| IPSS, вопрос 3 | 73 | 1,80 ± 1,25 | 1,48 ± 1,02 | 0,012010 |
| IPSS, вопрос 4 | 73 | 1,67 ± 1,20 | 1,40 ± 0,93 | 0,023349 |
| IPSS, вопрос 5 | 72 | 3,35 ± 1,29 | 2,58 ± 1,26 | 0,000013 |
| IPSS, вопрос 6 | 73 | 1,68 ± 1,37 | 1,21 ± 1,05 | 0,000335 |
| IPSS, вопрос 7 | 73 | 2,40 ± 1,02 | 1,66 ± 0,87 | < 0,000001 |
| Качество жизни | 73 | 4,05 ± 0,97 | 3,05 ± 0,91 | < 0,000001 |
| IPSS, сумма баллов | 73 | 15,39 ± 4,17 | 11,41 ± 4,19 | < 0,000001 |
Таблица 4. Данные опросников IPSS и значимость отличий между ними на Визитах 1 и 3 (критерий Вилкоксона)
| n | Визит 1 (до лечения), M±m | Визит 3 (через 6 месяцев), M±m | p | |
| IPSS, вопрос 1 | 66 | 2,19 ± 1,18 | 1,36 ± 1,06 | 0,000003 |
| IPSS, вопрос 2 | 66 | 2,44 ± 1,12 | 1,52 ± 0,95 | 0,000002 |
| IPSS, вопрос 3 | 66 | 1,88 ± 1,34 | 1,38 ± 1,09 | 0,000831 |
| IPSS, вопрос 4 | 66 | 1,74 ± 1,18 | 1,45 ± 1,03 | 0,041889 |
| IPSS, вопрос 5 | 66 | 3,47 ± 1,34 | 2,14 ± 1,11 | < 0,000001 |
| IPSS, вопрос 6 | 66 | 1,83 ± 1,42 | 1,33 ± 1,14 | 0,005362 |
| IPSS, вопрос 7 | 65 | 2,38 ± 1,04 | 1,62 ± 0,86 | 0,000002 |
| Качество жизни | 66 | 4,03 ± 0,91 | 2,82 ± 1,02 | < 0,000001 |
| IPSS, сумма баллов | 66 | 15,55 ± 4,17 | 10,79 ± 5,40 | < 0,000001 |
Таблица 5. Данные опросников IPSS и значимость отличий между ними на Визитах 1 и 4 (критерий Вилкоксона)
| n | Визит 1 (до лечения), M ± m | Визит 4 (через 12 месяцев), M ± m | p | |
| IPSS, вопрос 1 | 12 | 1,92 ± 1,44 | 1,58 ± 1,16 | 0,593955 |
| IPSS, вопрос 2 | 12 | 2,33 ± 1,43 | 1,58 ± 1,16 | 0,138642 |
| IPSS, вопрос 3 | 12 | 2,00 ± 1,54 | 1,50 ± 1,31 | 0,332880 |
| IPSS, вопрос 4 | 12 | 1,58 ± 1,44 | 1,33 ± 1,07 | 0,310495 |
| IPSS, вопрос 5 | 12 | 3,33 ± 1,37 | 1,75 ± 1,13 | 0,008720 |
| IPSS, вопрос 6 | 12 | 1,42 ± 1,62 | 1,17 ± 1,11 | 0,865772 |
| IPSS, вопрос 7 | 12 | 2,33 ± 0,89 | 1,42 ± 0,79 | 0,024391 |
| Качество жизни | 12 | 4,08 ± 1,24 | 2,75±1,14 | 0,008720 |
| IPSS, сумма баллов | 12 | 14,67 ± 3,60 | 10,33 ± 5,65 | 0,009926 |
Критерии исключения:
- Поставлен диагноз рака предстательной железы, либо обнаружены иные злокачественные новообразования;
- По данным урофлоуметрии Q < 15 мл/с;
- В последние 3 месяца перед исследованием проводилась терапия гиперплазии предстательной железы, или в последний месяц перед исследованием проводилась терапия хронического простатита;
- Острая задержка мочеиспускания;
- Нейрогенные дисфункции и дивертикулы мочевого пузыря;
- Наличие конкрементов в мочевом пузыре;
- Стриктура уретры, склероз шейки мочевого пузыря;
- Наличие в анамнезе оперативных пособий на органах малого таза;
- Инфекции мочеполовой системы в фазе активного воспаления;
- Систематический прием средств, влияющих на функцию мочевого пузыря и мочеотделение;
- Тяжелые сопутствующие заболевания, которые, по мнению исследователя, делают невозможным участие пациента в исследовании.
Пациенты не должны были принимать препараты, запрещенные данным протоколом, за 30 дней до приема первой дозы исследуемого препарата и до завершения приема исследуемых препаратов. К таким препаратам относились: ингибиторы 5а-редуктазы; препараты, содержащие эпигаллокатехин-3-галлат, эпикатехин3-галлат; селективные блокаторы а-адренорецепторов, за исключением доксазозина, предоставленного в ходе исследования; препараты, содержащие пальмы ползучей экстракт (Serenoa repens) и сливы африканской коры экстракт (Pygeum africanum).
Результаты
Влияние комбинации Индигала и доксазозина на субъективную динамику симптомов нарушения функции нижних мочевых путей и качество жизни больных
Данные о статистической значимости различий в показателях индекса IPSS между Визитом 1 (до лечения) и Визитом 2 (3 месяца) представлены в таблице 3, а между Визитом 1 (до лечения) и Визитом 3 (6 месяцев) в таблице 4. Отличия значимы по всем показателям.
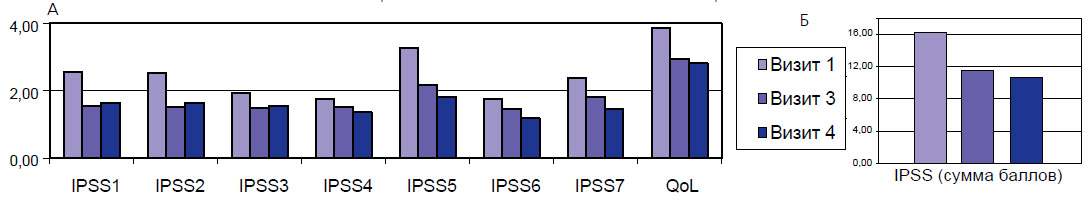
Рисунок 1. Динамика индекса IPSS и качества жизни
Данные о статистической значимости различий в показателях индекса IPSS между Визитом 1 (до лечения) и Визитом 4 (12 месяцев) представлены в таблице 5. Отличия в индексе IPSS между Визитом 1 и Визитом 4 не достигли уровня значимости по вопросам № 1, 2, 3, 4, 6. Однако, учитывая выраженную тенденцию к снижению индекса, можно предположить, что при анализе окончательной совокупности данных исследования отличия будут статистически значимы.
Общие данные по Визитам 1, 3 и 4 представлены на диаграмме 1. Тенденция к снижению отмечается по всем компонентам индекса IPSS и QoL, причем она продолжается и после завершения терапии. Ни один из пациентов не принимал в период отдаленного наблюдения препаратов, влияющих на мочеиспускание, и потому мы можем сделать вывод о том, что данная тенденция связана с примененной в исследовании терапией.
Влияние комбинации Индигала и доксазозина на основные уродинамические показатели, динамику ПСА и объем предстательной железы
Данные о статистической значимости различий в показателях урофлоуметрии, ТРУЗИ и уровне ПСА между Визитом скрининга (до лечения) и Визитом 2 (3 месяца) представлены в таблице 6, а между Визитом скрининга и Визитом 3 (6 месяцев) в таблице 7. Отличия значимы по всем показателям уродинамики и объему остаточной мочи на Визите 2, а также по величине Qmax и Qave на Визите 3. Тенденция к росту Vcom, Qmax, Qave и снижению Vres отмечается по данным Визитов 2 и 3, причем она сохраняется и после завершения терапии. Данные о статистической значимости различий в показателях урофлоуметрии, ТРУЗИ и уровне ПСА между Визитом скрининга и Визитом 4 представлены в таблице 8. К Визиту 4 значимые отличия не отмечались (по сравнению с Визитом скрининга), что, возможно, связано с небольшим числом наблюдений при этом сравнении.
Общие данные по уровню ПСА и объему простаты у пациентов, завершивших Визит 4, представлены на диаграммах 2 и 3.
Таблица 6. Данные ТРУЗИ, урофлоуметрии и определения уровня ПСА и значимость отличий между ними на Визитах 1 и 2 (критерий Стьюдента)
- Содержание простатаспецифического антигена в сыворотке крови, здесь и далее: V0 до лечения
- Содержание простатаспецифического антигена в сыворотке крови, здесь и далее: V2 на Визите 2, V3 на Визите 3, V4 на Визите 4
- Объем остаточной мочи по данным ТРУЗИ
- Объем остаточной мочи по данным ТРУЗИ
- Максимальная скорость потока мочи по данным урофлоуметрии
- Максимальная скорость потока мочи по данным урофлоуметрии
- Средняя скорость потока мочи по данным урофлоуметрии
- Средняя скорость потока мочи по данным урофлоуметрии
- Объем мочеиспускания по данным урофлоуметрии
- Объем мочеиспускания по данным урофлоуметрии
Таблица 7. Данные ТРУЗИ, урофлоуметрии и определения уровня ПСА и значимость отличий между ними на Визитах 1 и 3 (критерий Стьюдента)
| показатели | значение M ± m | n | p |
| ПСА^0, нг/мл | 2,88 ± 3,57 | 59 | 0,435781 |
| ПСА^3, нг/мл | 3,26 ± 4,35 | ||
| объем простаты V0, мл | 45,49 ± 16,09 | 54 | 0,904601 |
| объем простаты V3, мл | 45,67 ± 18,95 | ||
| Vres_V0, мл | 30,30 ± 30,12 | 53 | 0,234304 |
| Vres_V3, мл | 24,54 ± 26,93 | ||
| Qmax_ V0, мл/с | 10,41 ± 5,26 | 53 | <0,000001 |
| Qmax_ V3, мл/с | 16,95 ± 7,41 | ||
| Qave_ V0, мл/с | 5,18 ± 3,55 | 53 | 0,000001 |
| Qave_ V3, мл/с | 7,63 ± 4,22 | ||
| Vcomp_V0, мл | 200,58 ± 95,68 | 50 | 0,070764 |
| Vcomp_V3, мл | 237,70 ± 130,42 | ||
Таблица 8. Данные ТРУЗИ, урофлоуметрии и определения уровня ПСА и значимость отличий между ними на Визитах 1 и 4 (критерий Стьюдента)
| показатели | значение M ± m | n | p |
| ПСА^0, нг/мл | 4,55 ± 3,74 | 11 | 0,363985 |
| ПСА^4, нг/мл | 3,72 ± 3,03 | ||
| объем простаты V0, мл | 41,82 ± 14,58 | 10 | 0,937650 |
| объем простаты V4, мл | 42,27 ± 17,89 | ||
| Vres_V0, мл | 31,40 ± 24,80 | 10 | 0,144077 |
| Vres_V4, мл | 15,00 ± 22,11 | ||
| Qmax_ V0, мл/с | 10,99 ± 3,86 | 10 | 0,052232 |
| Qmax_V4, мл/с | 18,19 ± 9,27 | ||
| Qave_ V0, мл/с | 5,63 ± 2,84 | 10 | 0,201136 |
| Qave_ V4, мл/с | 6,86 ± 3,20 | ||
| Vcomp_V0, мл | 160,56 ± 76,97 | 9 | 0,51 6796 |
| Vcomp_V4, мл | 186,91 ± 67,54 |
Оценка безопасности Индигала на основании анализа частоты нежелательных явлений
В ходе исследования к моменту проведения промежуточного анализа было зафиксировано 1 нежелательное явление (1,37% пациентов) на Визите 2. Связь с приемом препарата может быть расценена как «вероятная». Были отмечены тошнота и изжога 1 случай (1,379%) испытуемых, 95% доверительный интервал 1,374,10%). Индигал, таким образом, является безопасным средством при применении у пациентов с ДГПЖ в виду отсутствия серьезных побочных эффектов в ходе применения.
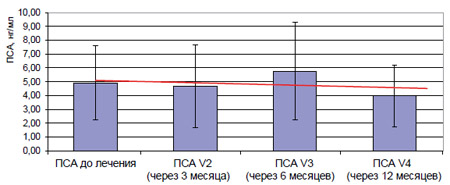
Рисунок 2. Значения уровня ПСА до лечения и Визитах 2-4 (пациенты, завершившие Визит 4, n = 10; показан 95% доверительный интервал и линия тренда)
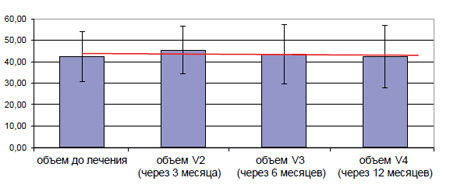
Рисунок 3. Объем простаты (мл) до лечения и Визитах 2-4 (пациенты, завершившие Визит 4, n = 9; показан 95% доверительный интервал и линия тренда)
Обсуждение
К настоящему времени получены данные нескольких многоцентровых исследований, посвященных изучению влияния доксазозина на течение ДГПЖ. В крупнейшее из них исследование MTOPS проходившее в 1993-2003 годах, было включено 3047 пациентов [12]. Средняя длительность наблюдения составила 4,5 года. Число пациентов в группе, получавшей терапию только доксазозином, составило 756 человек. Их средний возраст был 62,7 ± 7,2 года, исходный объем простаты 36,9 ± 21,6 мл, а уровень ПСА 2,4 ± 2,1 нг/мл. За период наблюдения (4,5 года) увеличение объема простаты в группах пациентов, получавших доксазозин и плацебо, было одинаково и составило 18%. Таким образом, был подтвержден вывод об отсутствии влияния доксазозина на объем предстательной железы. Естественный ход прогрессирования ДГПЖ, отмеченный в группах с приемом доксазозина или плацебо исследования MTOPS, приводил к статистически значимому приросту объема простаты на 29 ± 36% за 4,5 года. В среднем, это составляет прирост объема простаты на 6,4% в год. В исследовании MTOPS уровень ПСА прирастал в среднем на 13% за 4 года, что составляет 3,25% в год [12].
Полученные в настоящем исследовании (Инг-Уро-157) данные указывают на статистически незначимый прирост объема простаты в 4,03 ± 20,22% за полгода (5,56 ± 38,7% за 1 год). Исходный объем у пациентов, включенных в настоящее исследование, составил 45,4 ± 15,9 мл, что несколько выше, чем в исследовании MTOPS. Однако, несмотря на это, статистически значимого прироста объема простаты в данном исследовании не произошло. Полученные в настояна статистически незначимый прирост ПСА в 29,6 ± 68,4% за полгода (8,4 ± 52,2% за 1 год). Исходный уровень ПСА у пациентов, включенных в настоящее исследование, составил 3,0 ± 3,5 нг/мл, что также выше, чем в исследовании MTOPS. Однако, несмотря на это, статистически значимого прироста объема простаты в данном исследовании не произошло.
Выводы
Данные настоящего исследования указывают на отсутствие значимого прироста объема простаты и уровня ПСА в сроки до 6-12 месяцев у пациентов, получающих комбинацию доксазозина и Индигала. В связи с этим можно предположить, что Индигал препятствует прогрессированию ДГПЖ, стабилизируя объем предстательной железы, но не ведет к уменьшению объема простаты у пациентов, а также препятствует росту уровня ПСА у пациентов с ДГПЖ. Кроме того, комбинированное применение Индигала с доксазозином позволяет сохранить полученное улучшение симптоматики и качества жизни на срок до 6 месяцев после отмены терапии.
Ключевые слова: доброкачественная гиперплазия предстательной железы, индигал, доксазозин, простатаспецифический антиген, объем простаты.
Keywords: benign prostatic hyperplasia, indigal, doxazosin, prostate-specific antigen, prostate volume.
Литература
- Berry S.J., Coffey D.S., Walsh P.C., Ewing L.L. The development of human benign prostatic hyperplasia with age // J. Urol. 1984. Vol. 132. № 3. P. 474-479.
- Coffey D.S., Walsh P.C. Clinical and experimental studies of benign prostatic hyperplasia // Urol Clin North Am. 1990. Vol. 17. № 3. P. 461-475.
- Bartsch G., Müller H.R., Oberholzer M., Rohr H.P. Light microscopic stereological analysis of the normal human prostate and of benign prostatic hyperplasia // J. Urol. 1979. Vol. 122. № 4. P. 487-491.
- Brum I.S., Spritzer P.M., Brentani M.M. Molecular biology in the prostate neoplasia // Arq Bras Endocrinol Metabol. 2005. Vol. 49. № 5. P. 797-804.
- Jonler M., Riehmann M., Bruskewitz R.C. Benign prostatic hyperplasia // Current pharmacological treatment. Drugs. 1994. Vol. 47. № 1. P. 66-81.
- McVary KT. BPH: epidemiology and comorbidities // Am J Manag Care. 2006. Vol. 12. № 5, Suppl. P. 122-128.
- Rahardjo D., Soebadi D.M., Sugandi S., Birowo P., Djati W., Wahyudi I. Efficacy and safety of tamsulosin hydrochloride compared to doxazosin in the treatment of Indonesian patients with lower urinary tract symptoms due to benign prostatic hyperplasia // Int. J. Urol. 2006. Vol. 13. № 11. P. 1405-1409.
- Fulton B., Wagstaff A.J., Sorkin E.M. Doxazosin. An update of its clinical pharmacology and therapeutic applications in hypertension and benign prostatic hyperplasia // Drugs. 1995. Vol. 49. № 2. P. 295-320.
- Pfizer Pharmaceutical Inc. Doxazosin Investigator Brochure. 2001.
- Bradlow H.L., Sepkovic D.W., Telang N.T., Osborne M.P. Multifunctional aspects of the action of indole-3-carbinol as an antitumor agent // Ann N Y Acad Sci. 1999. Vol. 889. P. 204-213.
- Chinni S.R., Li Y., Upadhyay S., Koppolu P.K., Sarkar FH. Indole-3-carbinol (I3C) induced cell growth inhibition, G1 cell cycle arrest and apoptosis in prostate cancer cells // Oncogene. 2001. Vol. 20. № 23. P. 2927-2936.
- Marberger M. The MTOPS Study: New Findings, New Insights, and Clinical Implications for the Management of BPH // European Urology 2006. Supplements 5. P. 628-633.
| Прикрепленный файл | Размер |
|---|---|
| Статья в формате PDF | 598.08 кб |