Применение сосудистого окклюдера в лечении профузной макрогематурии после резекции почки у больного светлоклеточным раком
 8808
8808 Частота послеоперационных кровотечений после резекции почки различна в зависимости от вида операции, применяемых методов гемостаза и характера патологии, и варьирует от 0,3 до 7,5% [1 – 3].
В результате повреждения паренхиматозных сосудов в ходе оперативных вмешательств могут образовываться травматические артериовенозные свищи (ТАС) и/или аневризмы. ТАС впервые были описаны урологом M. E. Varela в 1928 г. [4]. ТАС приводят к длительной макрогематурии, а нередко – к профузным кровотечениям [1 – 5].
При неэффективности консервативной терапии выполняется повторная резекция почки или даже нефрэктомия. Однако повторное «открытое» вмешательство при ТАС ветвей почечной артерии сопряжено с техническими трудностями из-за, как правило, спаечного процесса и изменений ангиоархитектоники, что значительно усложняет реконструктивный результат операции. Рентгенэндоваскулярное вмешательство является альтернативным малотравматичным методом лечения и позволяет путем суперселективной окклюзии ликвидировать пострезекционную персистирующую макрогематурию с максимальным органосохраняющим эффектом [5 – 11, 12].
Описаны эндоваскулярные способы лечения ТАС бассейна почечных артерий: эмболизация полости артериовенозной аневризмы и окклюзия ветви почечной артерии на протяжении, для чего применялись в большинстве случаев эмболизирующие спирали, клеевые композиции, лишь одном случае – применение сосудистого окклюдера [1-7].
Представляем случай успешного эндоваскулярного лечения ТАС ветви правой почечной артерии с применением сосудистого окклюдера.
Больной Щ., 42 лет, поступил в Институт хирургии имени А. В. Вишневского 31.07.2014 г. с жалобами на периодические боли в правой поясничной области, беспокоящие в течение двух лет. При комплексном обследовании у больного выявлен рак правой почки I стадии, T1аN0M0. Опухоль размерами 38х29х31 мм, с четкими неровными контурами, неоднородной структуры располагалась интрапаренхиматозно на границе нижнего и заднего сегментов почки (рис. 1, 2). По данным дуплексного сканирования от 01.08.2014 г. в структуре образования лоцировались артерии с низкорезистентным кровотоком, также определялась выраженная сеть огибающих образование артерий и вен. Опухоль активно накапливала контрастный препарат при компьютерной томографии с контрастным усилением (КТ) от 01.07.2014. г. Опухоль частично деформировала и смещала среднюю и нижнюю группу чашечек почки, с КТ признаками врастания в нижние чашечки. Лоханка не вовлечена в опухолевый процесс.
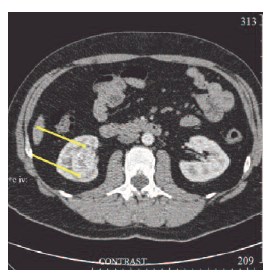
Рис. 1. КТ с контрастным усилением в аксиальной проекции. Опухолевый узел расположен в синусе почки. Стрелками обозначены границы опухолевого узла
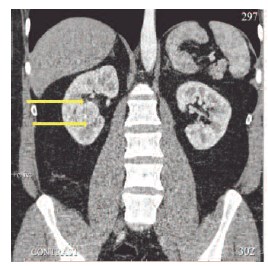
Рис. 2. КТ с контрастным усилением в корональной проекции. Опухолевый узел расположен в синусе правой почки. Стрелками обозначены границы опухолевого узла
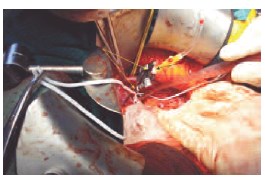
Рис. 3. Этап артерио-венозного «ареста» в условиях фармакохолодовой ишемии с перфузией раствора Кустодиол. Желтыми стрелками обозначены сосудистые зажимы на почечной артерии и вене. Черной стрелкой обозначена канюлизированная почечная артерия с подачей охлажденного раствора.
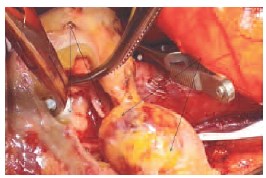
Рис. 4. Этап резекции почки. Стрелками обозначен опухолевый узел и дно резекции
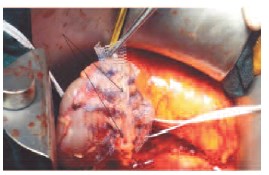
Рис. 5. Линия гемостатического шва, усиленного проленовыми протекторами. Стрелками обозначена линия гемостатического шва
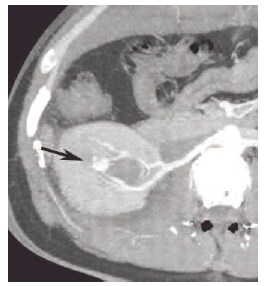
Рис. 6. КТ с болюсным контрастным усилением в аксиальной проекции, проекция максимальной интенсивности. Стрелкой обозначена артериовенозная аневризма ветви правой почечной артерии, определяется ранний сброс контраста в вену
05.08.2014 г. выполнена чрезбрюшинная интракорпоральная (Jобразный разрез справа) резекция правой почки с резекцией нижней и средней групп чашечек в условиях фармакохолодовой ишемии (с изолированной перфузией почки раствором Кустодиол), паракавальная, аортокавальная лимфаденэктомия. Дренирование забрюшинного пространства (рис. 3, 4, 5).
05.08.2014 г. в первые часы после операции у больного развилась клиническая картина внутрибрюшного кровотечения, что потребовало выполнения в экстренном порядке релапаротомии, ревизии брюшной полости, забрюшинного пространства. Выявлен источник кровотечения – венозные сосуды в области резекции почки. Остановка кровотечения произведена дополнительным прошиванием паренхимы почки в области послеоперационных швов. Линия гемостатического шва дополнительно укрыта гемостатическими губками ТАХОКОМБ и SURGICEL. Гемостаз достигнут. Забрюшинное пространство дополнительно дренировано силиконовым дренажем. Оперированная почка розовой окраски, пульсация почечной артерии сохранена, признаков тромбоза правой почечной вены и нижней полой вены нет. Выполнено послойное ушивание раны. Во время и после операции диурез адекватный, моча светлая, прозрачная. Проводилась гемостатическая и гемотрансфузионная терапия. Дренажи удалены на 5-е сутки. По данным контрольного дуплексного сканирования артериовенозный кровоток резецированной почки соответствовал срокам после операции.
17.08.2014 г., на 12-е сутки после операции, возникла профузная безболевая макрогематурия со сгустками, приведшая к гемотампонаде мочевого пузыря.
С целью выявления источника кровотечения 17.08.2014 г. выполнена КТ брюшной полости и забрюшинного пространства: свободной жидкости в брюшной полости, забрюшинном пространстве и малом тазу не определялось. При введении контрастного препарата наблюдалась экстравазация контраста в просвет нижней группы чашечек. Также в нижней группе чашечек и лоханке определялся сгусток свежей крови до 18х36 мм в сечении, свежие сгустки крови в полости мочевого пузыря (рис. 6). Установлен диагноз: травматический артерио-венознолоханоч-ный свищ ветви задней сегментарной артерии, начата гемостатическая терапия и по экстренным показаниям выполнена ангиография с эндоваскулярной окклюзией ТАС.
Выполнение релапаротомии в данном случае признано малоэффективным в виду технических трудностей поиска источника кровотечения из резецированной почки в лоханочную систему и риска выполнения нефрэктомии в результате рецидивного характера кровотечения.
17.08.2014 г. выполнена суперселективная катетеризация и ангиография правой почечной артерии и рентгенэндоваскулярная окклюзия артерио-венозно-лоханочного свища ветви правой почечной артерии.
Под комбинированной анестезией пунктирована и катетеризирована по проводнику правая общая бедренная артерия. Проводниковый катетер RDC 7 F установлен в устье правой почечной артерии. Выполнена селективная ангиография правой почечной артерии. На ангиограммах правой почечной артерии контуры ровные. На ветви, идущей кзади и книзу, контрастировалась полость неправильной каплевидной формы с последующим прямым сбросом в вену (контрастирование вены раньше паренхиматозной фазы). Диаметр артерии перед шейкой ложной аневризмы 2,5 мм (рис. 7).
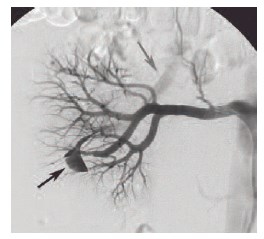
Рис. 7. Селективная ангиография правой почечной артерии в передне-задней проекции. Черной стрелкой обозначена артериовенозная аневризма ветви правой почечной артерии, ранний сброс контраста в вену. Серой стрелкой обозначена вена
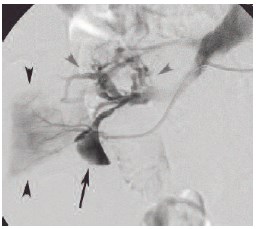
Рис. 8. Суперселективная ангиография ветви правой почечной артерии в передне-задней проекции. Длинной стрелкой обозначена артериовенозная аневризма ветви правой почечной артерии, черными короткими стрелками – область кровоснабжения паренхимы почки из бассейна этой ветви, серыми короткими стрелками – ранний сброс контраста в вены
Произведена окклюзия ветви, несущей ложную артерио-венознолоханочную аневризму. В ветвь, несущую ТАС, по проводнику проведен катетер Simmons 14 F. Выполнена селективная ангиография ветви, несущей артерио-венозно-лоханочную аневризму (рис. 8). По катетеру Simmons 14 F в нее проведен проводниковый катетер RDC 7 F, по которому перед шейкой ТАС установлен окклюдер Amplatzer Plug II диаметром 4 мм (рис. 9). При контрольной ангиографии: ложная артерио-венознолоханочная аневризма не визуализировалась, диссекции интимы нет, контрастирование артерий правой почки сохранено, отмечалось замедление контрастирования ветвей, идущих кзади и книзу. Кровотечение остановлено (рис.10). Гемотампонада мочевого пузыря ликвидирована с использованием временной катетеризации и промывания полости пузыря растворами антисептиков.
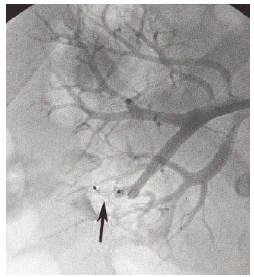
Рис. 9. Селективная ангиография правой почечной артерии в передне-задней проекции. Стрелкой обозначен имплантированный сосудистый окклюдер в ветвь правой почечной артерии
В послеоперационном периоде гематурия не повторялась, самостоятельное мочеиспускание восстановилось. По данным дуплексного сканирования правой почки артериовенозный кровоток сохранен во всех отделах почки. 25.08.2014 г. на 20-е сутки после операции больной выписан в удовлетворительном состоянии под наблюдение онкоуролога и уролога по месту жительства.
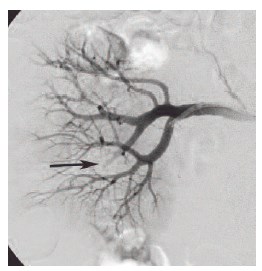
Рис. 10. Селективная ангиография правой почечной артерии в передне-задней проекции. Стрелкой обозначена ветвь правой почечной артерии после выполнения окклюзирующей операции
Периферические артериовенозные свищи создают условия для высокого венозного возврата с последующим увеличением сердечного выброса, и иногда, систолического артериального давления. Это приводит в итоге к снижению периферического сопротивления и диастолического артериального давления, как следствие к сердечной недостаточности при исчерпании компенсаторных механизмов [12-14].
Приведенное наблюдение демонстрирует эффективность эндоваскулярного лечения ТАС. Использование сосудистого окклюдера позволило достичь оптимального результата – произошла окклюзия мелких ветвей сегментарной почечной артерии, несущей артериовенозную аневризму. В отличие от спиралей, имплантацию которых сложно контролировать, сосудистые окклюдеры можно максимально точно установить перед устьем ТАС и, в случае необходимости, репозиционировать для достижения оптимального уровня окклюзии. Окклюдеры обладают компактными размерами, малой длиной, что дает возможность исключить нецелевую окклюзию артерий, тем самым максимально уменьшить зону ишемии. Они позволяют ликвидировать гематурию с максимальным органосохраняющим эффектом.
Современные технологии и инструменты, применяемые при эндоваскулярных вмешательствах, позволяют даже при сложных анатомических вариантах обеспечивать надежное разобщение артериовенозных свищей, позволяя быстро и надежно остановить кровотечения, в том числе и после операций на почках [15-16].
ЛИТЕРАТУРА
- Матвеев В.Б., Матвеев Б.П., Волкова М.И., Перлин Д.В., Фигурин К.М. Роль органосохраняющего хирургического лечения рака почки на современном этапе. // Онкоурология. 2007. N 2. C. 5 – 12.
- Thompson RH, Leibovich BC, Lohse CM. Complications of contemporary open nephron sparing surgery: a single institution experience. // J Urol. 2005. Vol. 174, N 3. P. 855 – 858.
- Ramani AP, Desai MM, Steinberg AP. Complications of laparoscopic partial nephrectomy in 200 cases. // J Urol. 2005. Vol. 173, N 1. P. 42 – 47.
- Varela ME. Aneurisma arteriovenoso de los vasos renales y asistolia consecutiva. // Rev Med Latino-Am. 1928. N 14. P. 32 – 44.
- Carrafiello G, Laganà D, Peroni G, Mangini M, Fontana F, Mariani D, Piffaretti G, Fugazzola C. Gross hematuria caused by a congenital intrarenal arteriovenous malformation: a case report. // J Med Case Rep. 2011. Vol. , 5. :510 doi:10.1186/1752-1947-5-510.
- Pappas P, Leonardou P, Papadoukakis S, Zavos G, Michail S, Boletis J, Tzortzis G.. Urgent superselective segmental renal artery embolization in the treatment of life-threatening renal hemorrhage. // J Urol Int. 2006. Vol. 77, N 1. P. 34 – 41.
- Kensella D, Kakani N, Pocock R, Thompson J, Cowan A, Watkinson A. Transcatheter embolization of a renal arteriovenous fistula complicated by an aneurysm of the feeding renal artery. // Cardiovasc Intervent Radiol. 2008. Vol. 31, N 2. P. 415 – 417.
- Morin RP, Dunnes EJ, Wright CB. Renal arteriovenous fistulas. A review of etiology, diagnosis and management. // Surgery. 1986. Vol. 99, N 1. P. 114 – 118.
- Schwartz MJ1, Smith EB, Trost DW, Vaughan ED Jr. Renal artery embolization: clinical indications and experience from over 100 cases. // BJU Int. 2007. Vol. 99, N 4. P. :881-886
- Tannouri F, Maalouly R, Salem JF, Haddad F. Renal artery pseudoaneurysm successfully treated with the outer coating of the tip of the J wire. // Vascular. 2014. Vol. 22, N 1. P. 61 – 6
- Sundarakumar DK, Kroma GM, Smith CM, Lopera JE, Suri R. Embolization of a large high-flow renal arteriovenous fistula using 035″ and 018″detachable coils.// Indian J Radiol Imaging. 2013. Vol. 23, N 2. P. :151-154.
- Hogan MB, Sprouse LR. Endovascular treatment of a traumatic renal arteriovenous fistula. // Southern association for vascular surgery 33rd Annual Meeting – January 14 – 17, 2009.
- Paschalis-Purtak K, Januszewicz M, Rokicki A, Puciłowska B, Imiela J, Cybulska I, Cieśla W, Prejbisz A, Szostek M, Januszewicz A. Arteriovenous fistula of the kidney: a case report of 47-year-old female patient treated by embolisation. // J Hum Hypertens. 2003. Vol. 17, N 4. P. 293-296.
- Zelenák K, Sopilko I, Svihra J, Kliment J. Succesful embolization of a renal artery pseudoaneurysm with arteriovenous fistula and extravasations using onyx after partial nephrectomy for renal cell carcinoma. // Cardiovasc Intervent Radiol. 2009. Vol. 32, N 1. P. 163-165.
- Теплов А.А., Русаков И.Г., Смирнова С.В., Захарова М.А., Андреева Ю.Ю., Сидоров Д.В. Органосохраняющее лечение больных раком почки. // Российский онкологический журнал. 2010. №4, C. 4-10.
- Цыганков В.Н., Францевич A.M., Варава А.Б. Эндоваскулярное лечение посттравматических артериовенозных свищей подключичной артерии. // Ангиология и сосудистая хирургия. 2013. Т.19, N 3. С. 151 – 159.
| Attachment | Size |
|---|---|
| Скачать статью | 522.08 KB |