ВВЕДЕНИЕ
Открытие Александром Флемигном в 1928 году пенициллина и последующее его выделение Говардом Флори и Эрнестом Чейном в 1945 году послужили развитию новой эры лечения инфекционных заболеваний – антибактериальной терапии. В результате применения антибактериальных препаратов, главенствующие места в структуре летальности заняли заболевания сердечнососудистой системы и злокачественные новообразования. Однако на сегодняшний день более 20-40% антибактериальных препаратов назначаются без соблюдения принципов рациональной антибиотикотерапии в лечении инфекционных заболеваний различной локализации, таких как строгие показания к назначению препаратов, адекватное дозирование и длительность применения, учет совместимости различных групп препаратов и др. [1-3]. Современное здравоохранение столкнулось с таким защитным феноменом микроорганизмов, как появление госпитальных штаммов, устойчивых к неблагоприятным условиям внешней среды, дезинфицирующим средствам и антибактериальным препаратам [4, 5]. Обсуждая проблему антибиотикорезистентности, приходится констатировать, что она находится в фокусе внимания врачей и ученых разных специальностей и интерес к этой проблеме продолжает расти.
Ежегодно в мире регистрируется более 700 тысяч смертей от инфекционных заболеваний различной локализации, преимущественно вызванными резистентными к антибактериальным препаратам штаммами. К настоящему времени инфекции мочевыводящих путей (ИМП) стали одними из наиболее часто встречаемых заболеваний, в том числе в структуре госпитальных инфекций (до 40%) [6, 7].
Лечение ИМП должно быть целенаправленным и учитывать все результаты доступных микробиологических исследований [8, 9]. Анализ чувствительности микроорганизмов к антибактериальным препаратам, наряду с изучением изменения встречаемости отдельных возбудителей, необходим в выборе рациональной терапии и позволяет прогнозировать успешность назначаемой терапии [10, 11].
Цель настоящего исследования – изучить встречаемость и резистентность к антибактериальным препаратам наиболее распространенных штаммов микроорганизмов, выделенных в посевах мочи пациентов с осложненными инфекциями мочевыводящих путей, находившихся на стационарном лечении с 2012 по 2019 гг.
МАТЕРИАЛЫ И МЕТОДЫ
В ГКБ № 1 им. Н.И. Пирогова и ГКБ № 29 им. Н.Э. Баумана – клинических базах кафедры урологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова, проведено исследование 6083 посевов мочи у 5027 пациентов с осложненными инфекциями мочевыводящих путей. Осложненными считались ИМП у пациентов с наличием постоянного катетера или дренажа (стента) в мочевых путях, интермиттирующей катетеризацией мочевого пузыря, обструктивной уропатией любой этиологии (инфравезикальной обструкцией, нейрогенным мочевым пузырем, камнями, опухолями), пузырно-мочеточниковом рефлюксом или другими функциональными нарушениями. К ним также относили ИМП после пластики мочевых путей (например, с использованием сегмента подвздошной кишки) или в послеоперационном периоде, у пациентов с почечной недостаточностью, сахарным диабетом, иммуносупрессивными состояниями, продолжительностью симптомов на момент осмотра более 7 суток, неэффективностью эмпирической антибактериальной терапии на амбулаторном этапе более 72 часов [12].
Проведенный анализ включал в себя: выделение, идентификацию, оценку чувствительности микроорганизмов к антибактериальным препаратам [13].
Лабораторный этап включал стандартизированный посев, который выполнялся петлей 10 мкл на следующие питательные среды:
- агар с добавлением 5% бараньей крови (Pronadisa, Испания);
- агар Левина (Pronadisa, Испания);
- агар Бигги (BD, США).
Последующая инкубация при 37°C проводилась в течение 18-24 часов.
Затем производился визуальный подсчет колоний. Анализ проведен согласно клиническим рекомендациям «Бактериологический анализ мочи» [14].
Положительным считали результат при выявлении:
- первичных патогенных микроорганизмов (Escherichia coli, Enterococcus spp.);
- вторичных патогенных микроорганизмов (Enteobacter spp., Klebsiella spp., Proteus mirabilis, Pseudomonas aeruginosa, Staphylococcus aureus, Acinetobacter spp.) 1х103 КОЕ/мл в моче, полученной от мужчин и 1х104 КОЕ/мл в моче, полученной от женщин;
- нетипичных возбудителей (коагулазо-негативные стафилококки, Streptococcuss spp. и др.) 1х105 и более КОЕ/мл.
На бактериологическом анализаторе Phoenix (BD, США) и диско-диффузионным методом (диски производства BD, США) произведена оценка чувствительности выделенных микроорганизмов к исследуемым антибактериальным препаратам. Оценка продуцентов β-лактамаз расширенного спектра (БЛРС) и карбапенемаз проводилась на бактериологическом анализаторе Phoenix (BD, США), методом «двойных дисков» и методом «инактивации карбапенемов».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из 6083 посевов мочи пациентов осложненными ИМП количество положительных посевов с выделенными культурами микроорганизмов составило 2640 (43,3%). После возможного устранения функциональных или обструктивных нарушений, смены длительно функционирующих дренажей антибактериальная терапия является основным методом лечения осложненных ИМП. Эффективность антимикробного лечения напрямую зависит от чувствительности к применяемым препаратам микроорганизмов в очаге воспаления.
Наиболее частыми возбудителями осложненных ИМП были Enterococcus faecalis (2012/2019 +6,3%), Escherichia coli (2012/2019 +7,1%), Klebsiella pneumonia (2012/2019 +10,3%), Proteus mirabilis (2012/2019 +1,4%). Частота встречаемости Pseudomonas aeruginosa в динамике уменьшилась на 2,6% (с 8,1% до 5,5%), Staphylococcus aureus на 2,6% (с 4,1% до 1,5%), Proteus mirabilis увеличилась на 5,1% (с 2,5% до 7,6%) (рис. 1). Значительно снизилась частота встречаемости Enterobacter cloacae на 7,9% (с 8,3% до 0,4%). Однако отмечается увеличение роста Acinetobacter baumannii у пациентов реанимационного профиля на 3,5% (с 0,9% до 4,4%) и Staphylococcus haemolyticus на 0,4% (с 1,2% до 1,6%).
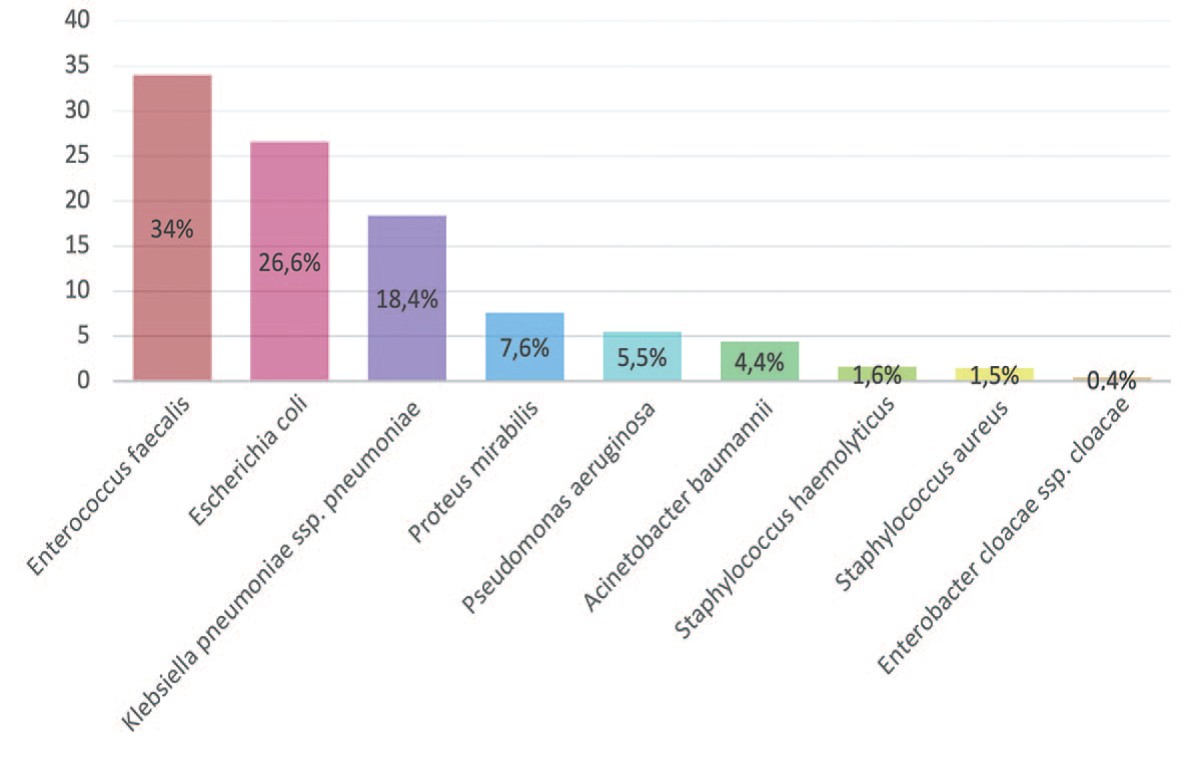
Рис. 1. Частота встречаемости микроорганизмов в посевах мочи в 2019 г. (%)
Fig. 1. Frequency of occurrence of microorganisms in urine crops in 2019 (%)
Таким образом, среди микроорганизмов, вызывающих осложненные ИМП, преимущественно встречаются представители семейств Enterococcaceae и Enterobacteriaceae. У пациентов с коралловидными камнями в 74% случаев на момент установления диагноза имеет место ИМП, из них в 72% случаев встречаются уреазо-продуцирующие возбудители. У 87% пациентов с постоянными катетерами или дренажами в мочевыделительных путях обнаружены полирезистентные ко многим антибактериальным препаратам штаммы микроорганизмов.
Кроме того, прослеживается увеличение частоты штаммов различных микроорганизмов, резистентных к определенным исследуемым группам антибактериальных препаратов.
Так, метициллин резистентные стафилококки – Methicillin (Oxacillin) Resistant Staphylococcus аureus (MRSA), которые устойчивы ко всем β-лактамным препаратам, обладают ассоциированной устойчивостью к антибактериальным препаратам групп фторхинолонов, макролидов, аминогликозидов, линкозаминов, тетрациклинов. На метициллин-резистентность исследованы 432 штамма Staphylococcus аureus. Доля MRSA в 2012 и 2019 гг. составила соответственно 35,0% и 41,0% (+6,0%).
Согласно полученным данным штаммы, вырабатывающие БЛРС или Еxtended-Spectrum-βLactamases (ESBL) стали на 21,3% встречаться чаще у Escherichia coli (с 3,2% до 24,5%) и на 35,6% среди Klebsiella pneumoniae (с 5,2% до 40,8%) (рис. 2). По данным исследования «ДАРМИС, 2018г», частота продукции БРЛС среди штаммов Escherichia coli составила в 2011 и 2018 гг. соответсвенно 2,3% и 19,5% [15]. Однако отмечается снижение частоты встречаемости данных штаммов среди Pseudomonas aeruginosa на 15,9% (с 56% до 40,1%).
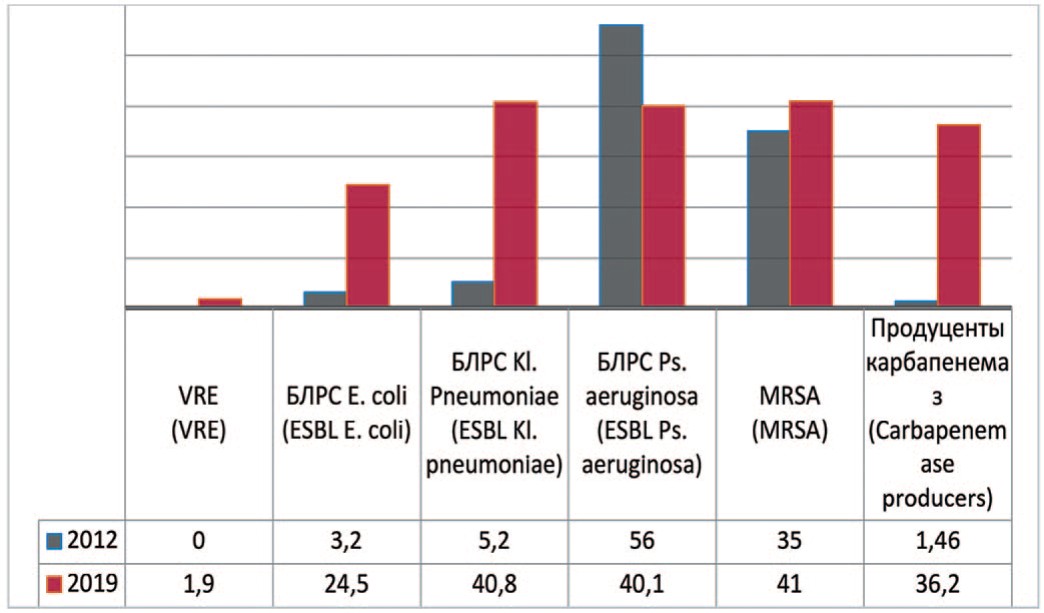
Рис. 2. Количество штаммов с факторами патогенности в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 2. Frequency of stains with pathogen factors: 2012-2019, the ordinate - stains frequency
Первый в России штамм ванкомицин-резистентного энтерококка (VRE) обнаружен еще в 2002 г. В 2019 г. в ГКБ №1 им. Н.И. Пирогова было исследовано 264 штамма энтерококка, среди которых выявлены 5 (1,9%) штаммов VRE.
Зафиксирована динамика существенного роста числа микроорганизмов, которые продуцируют карбапенемазы. В 2012 г. исследованы 342 штамма микроорганизмов, из которых карбапенемазы продуцировали только 5 (1,46%). В 2018 году исследованы 533 штамма, из которых 44 (8,25%) явились продуцентами карбапенемаз, а в 2019 году из 432 исследованных штаммов выявлены 157 (36,2%) штаммов, продуцирующих карбапенемазы.
Enterococcus — род бактерий семейства Enterococcaceae являются основными симбиотическими организмами кишечника человека. У пациентов с осложненными ИМП, при изучении выделенных штаммов Enterococcus faecalis с 2012 по 2019 гг. прослеживается несущественное увеличение резистентности к ванкомицину (до 2,0%), тигециклину (до 0,9%), нитрофурантоину на 4,9% (с 4,1% до 9,0%), имипенему (до 4,5%), гентамицину на 6,1% (с 32,6% до 38,7%), ампициллину на 0,4% (с 12,2% до 12,6%) (рис. 3). Одновременно отмечается снижение резистентности к препаратам группы фторхинолонов – ципрофлоксацину на 29,4% (с 53,3% до 23,9 %) и левофлоксацину на 27,3% (с 48% до 20,7%).
Escherichia coli — грамотрицательная бактерия, факультативный анаэроб, не образующая эндоспор. Проводя анализ динамики чувствительности Escherichia coli к антибактериальным препаратам выявлено повышение резистентности микроорганизма к карбапенемам (меропенему) – до 4,5%, к амоксициллину/клавулоновой кислоте – на 4,1% (с 21,4 % до 25,5%), амикацину – на 4,8% (c 7,3% до 12,1 %), цефтазидиму – на 43,8% (с 23,2% до 67,0%) (рис. 4). Кроме того, отмечается значительный рост резистентности к фторхинолонам – левофлоксацину на 18,5% (с 34,9% до 53,4%), ципрофлоксацину – на 8,3% (с 46,5% до 54,8%), а также к нитрофурантоину – на 33,6% (с 8,5% до 42,1%) и ко-тримоксазолу (бисептолу) – на 63,3% (до 100%).
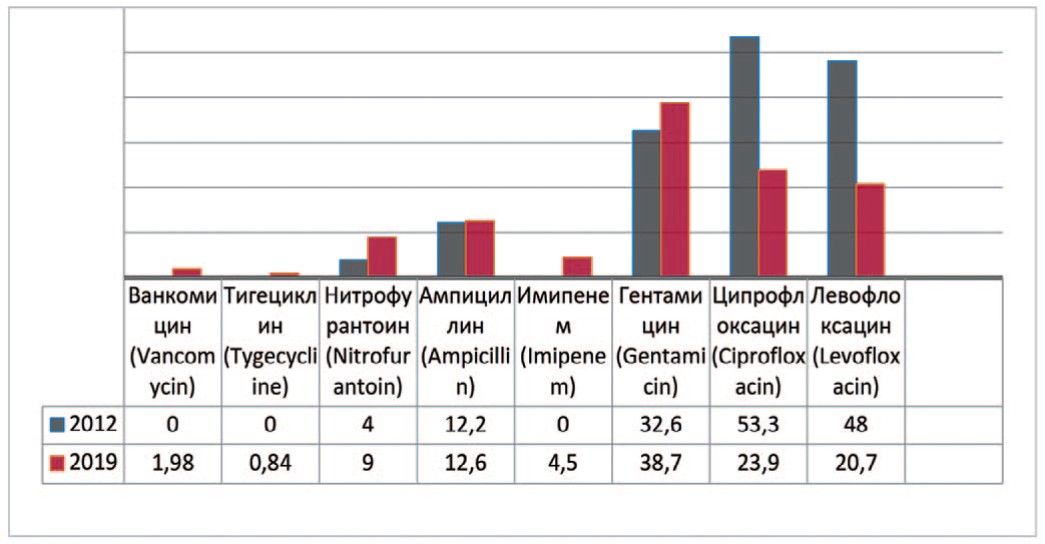
Рис. 3. Резистентность Enterococcus faecalis к антибиотикам в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 3. Antibiotic resistance of Enterococcus faecalis: 2012-2019, the ordinate - stains frequency
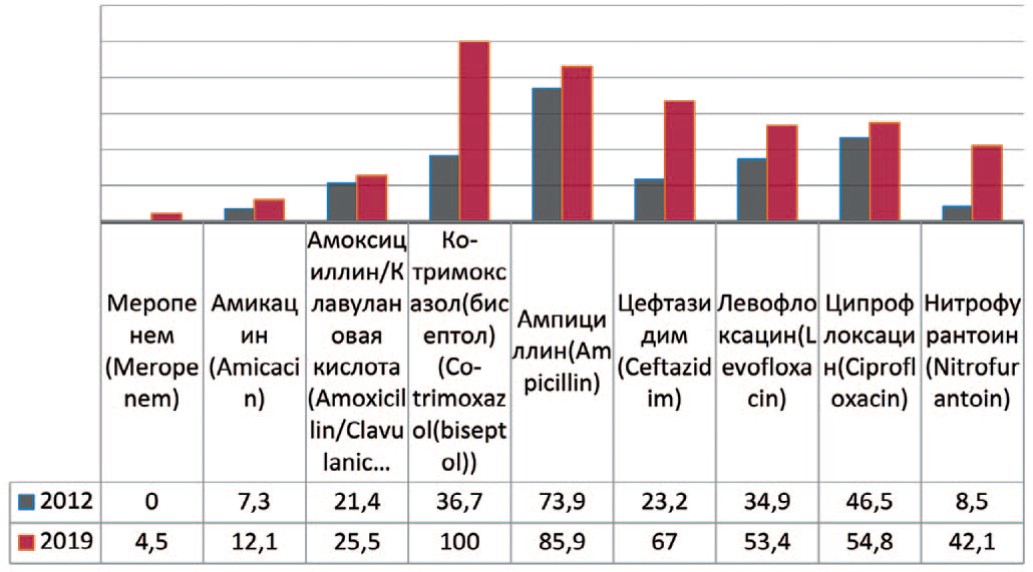
Рис. 4. Резистентность Escherichia coli к антибиотикам в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 4. Antibiotic resistance of Escherichia coli: 2012-2019, the ordinate - stains frequency
Klebsiella pneumonia, выделенная в 1882 г. Карлом Фридлендером, вид грамотрицательных факультативноанаэробных палочковидных бактерий, которые не образуют спор, неподвижны, способны к образованию капсулы. Анализируя чувствительность Klebsiella pneumoniae к антибактериальным препаратам выявлено увеличение резистентности к амикацину на 12% (с 18,6% до 30,6%), меропенему – на 27,3% (с 1,4% до 28,7%), имипенему – до 24,6%, цефтазидиму – на 35,3% (с 12,8% до 48,1%), амоксициллину/клавулановой кислоте – на 21% (с 41,8% до 62,8%), тигециклину – до 100%, левофлоксацину – на 19,2% (с 33,8% до 53%) (рис. 5). Одновременно отмечается снижение резистентности к ампициллину – на 11,5% (с 85,7% до 74,2%), незначительно к бисептолу – на 0,2% (с 45,4% до 45,2%) и ципрофлоксацину на 18,5% (с 76,5% до 58%).
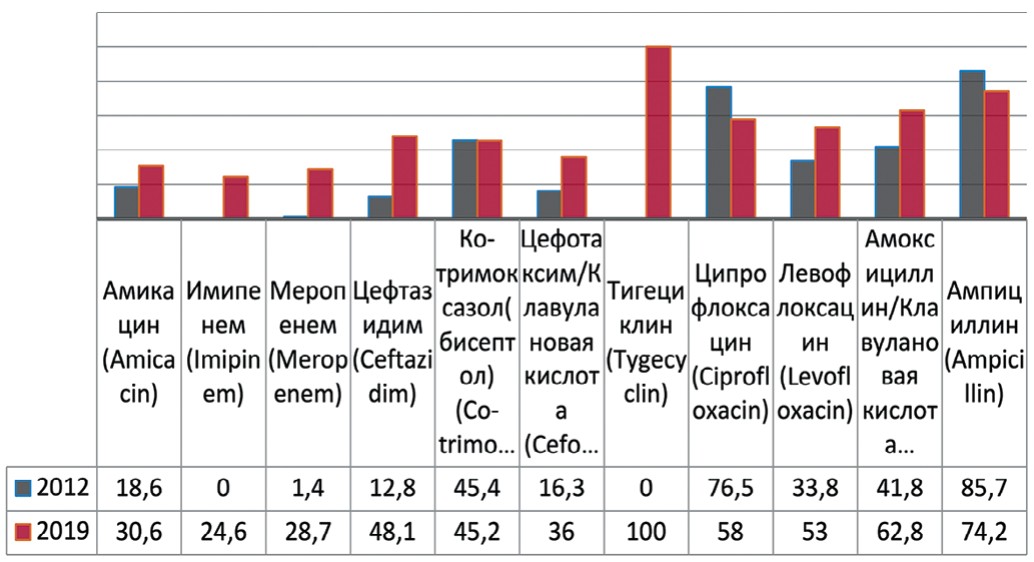
Рис. 5. Резистентность Klebsiella pneumoniae к антибиотикам в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 5. Antibiotic resistance of Klebsiella pneumoniae: 2012-2019, the ordinate - stains frequency
В когорте пациентов отделений реанимации и интенсивной терапии с генерализацией инфекционного процесса и развитием сепсиса прослеживается увеличение резистентности выделенных штаммов Klebsiella pneumonia к амикацину на 39,3% (с 25% до 64,3%), меропенему – до 59,7%, цефтазидиму – до 100%, амоксициллину/клавулановой кислоте – на 4,0% (с 79,0% до 83,0%), имипенему – до 50,3%, цефотаксиму/клавулановой кислоте – на 3,5% (с 30,8% до 34,3%), левофлоксацину – на 2,0% (c 73,7% до 75,7%). Таким образом, при выявлении у данной когорты пациентов штаммов Klebsiella pneumonia показано проведение длительной комбинированной антибактериальной терапии, преимущественно с использованием оригинальных препаратов, согласно полученным результатам посевов мочи и крови.
Proteus mirabilis — вид грамотрицательных, споронеобразующих, факультативно анаэробных уреазо-продуцирующих бактерий, представитель условно-патогенной микрофлоры кишечника человека. У пациентов с выделенным Proteus mirabilis демонстрируется увеличение резистентности возбудителя к амикацину на 16,8% (с 6,7% до 23,5%), меропенему – до 2,7%, имипенему – до 1,5%, амоксициллину/клавулановой кислоте – на 20,6% (с 17,1% до 37,7%), левофлоксацину – на 4,6 % (с 23,4% до 28%), ципрофлоксацину – на 39,6% (с 27,3% до 66,9%), ампициллину – на 15,2% (с 60,9% до 76,1%), цефтазидиму – на 12,8% (с 0,2% до 13%), бисептолу – на 10,0% (с 59,9% до 69,9%) (рис. 6).
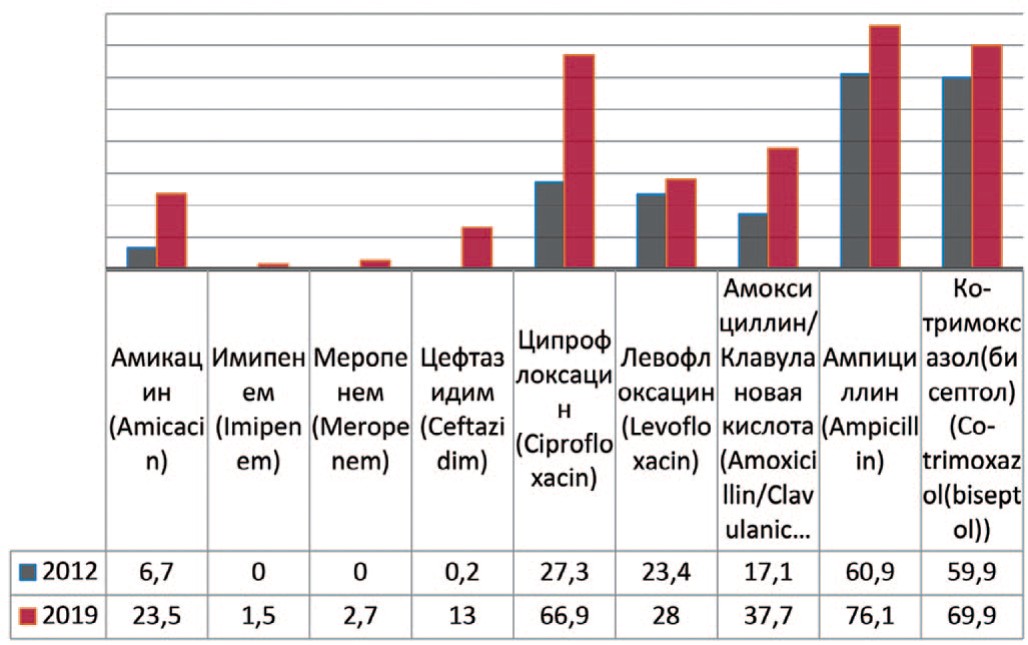
Рис. 6. Резистентность Proteus mirabilis к антибиотикам в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 6. Antibiotic resistance of Proteus mirabilis: 2012-2019, the ordinate - stains frequency
Staphylococcus aureus — группа положительных, неподвижных, анаэробных, условно-патогенных для организма человека микроорганизмов, не образующих спор и капсул. При анализе выделенных штаммов Staphylococcus aureus прослеживается увеличение их резистентности к амикацину на 29,1% (с 14% до 43,1%), цефуроксиму – на 35,0% (с 7,1% до 43,1%), левофлоксацину – на 17,5% (с 14,3% до 31,8%), оксациллину – на 27,8% (с 35,7% до 63,5%), эритромицину – на 6,4% (с 38,8% до 44,4%) (рис. 7). Снижение резистентности отмечается к амоксициллину/клавулановой кислоте – на 6,9% (с 21,4% до 14,5%), бисептолу – на 12,2% (с 24,7% до 12,5%).
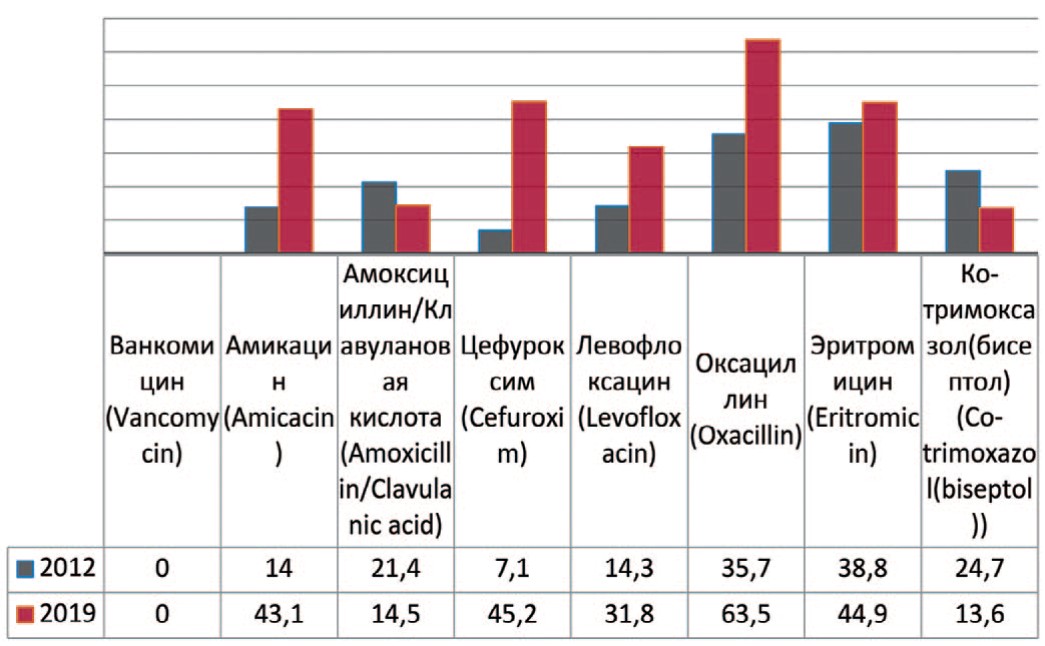
Рис. 7. Резистентность Staphylococcus aureus к антибиотикам в 2012, 2019 гг., по оси ординат – количество штаммов
Fig. 7. Antibiotic resistance of Staphylococcus aureus: 2012-2019, the ordinate – stains frequency
Pseudomonas aeruginosa — вид грамотрицательных подвижных палочковидных бактерий, условно патогенных для человека, возбудитель нозокомиальных инфекций у человека. Pseudomonas aeruginosa устойчива к действию многих беталактамов, аминогликозидов, фторированных хинолонов. В 2019 г. прослеживается увеличение резистентности к амикацину на 12,0% (с 34,9% до 46,9%), левофлоксацину – на 6,4% (с 65,8% до 72,2%), ципрофлоксацину – на 6,7% (с 60,0% до 66,7%), меропенему – на 38,4% (с 11,6% до 50,0%), эртапенему – на 38,6% (с 10,9% до 49,5%) (рис. 8). Одним из препаратов выбора при лечении пациентов с выделенными штаммами Pseudomonas aeruginosa остается полимиксин Е.
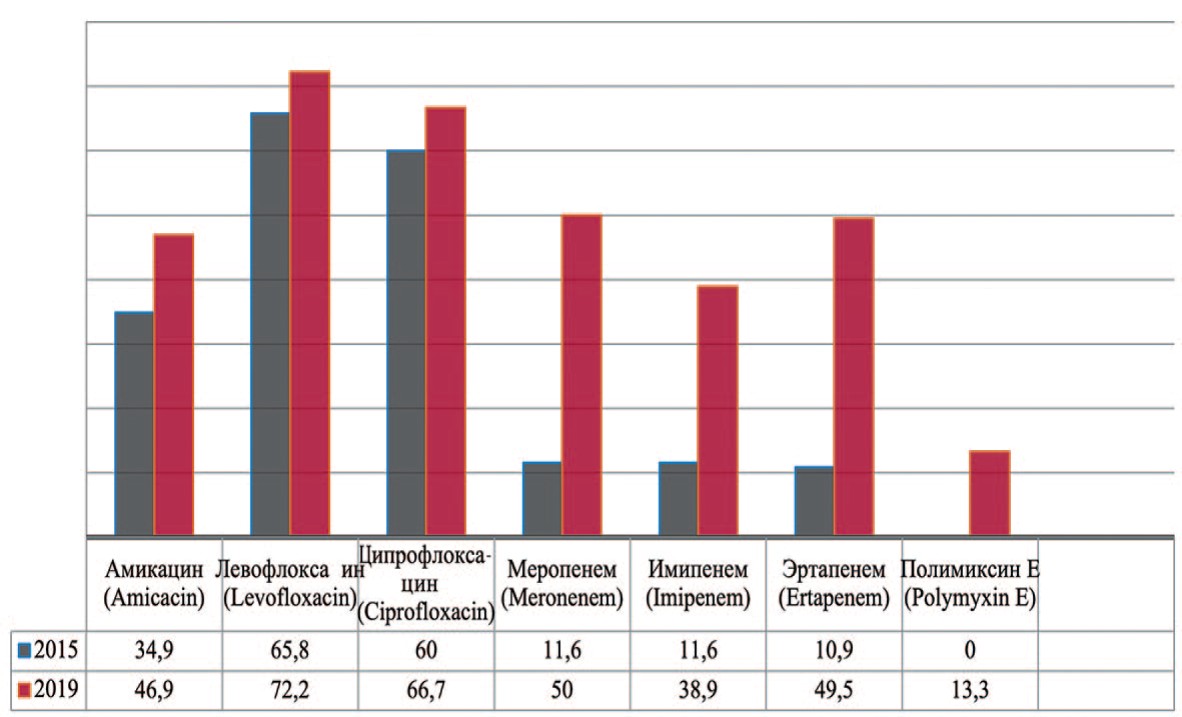
Рис. 8. Резистентность Pseudomonas aeruginosa к антибиотикам в 2015, 2020 гг., по оси ординат - количество штаммов
Fig. 8. Antibiotic resistance of Pseudomonas aeruginosa: 2015-2020, the ordinate - stains frequency
Acinetobacter — род грамотрицательных бактерий из семейства Moraxellaceae, строгие аэробы, резистентные к многим антибактериальным препаратам. Предшествующие госпитализации в ОРИТ и хирургическое вмешательство в разы повышают риск инфицирования. Анализируя полученные данные выявлено увеличение резистентности данных штаммов к амикацину на 52,5% (с 43,1% до 95,6%), имипенему – на 82,6% (с 9,7% до 92,3%), амоксициллину/ клавулоновой кислоте – до 100%, меропенему – на 71,5% (с 23,6% до 95,1%), эртапенему – до 100%, цефотаксиму – на 76,4% (с 13,6 до 90,2%) (рис. 9). В случаях выявления в посевах крови и мочи пациентов штаммов Acinetobacter baumannii препаратами выбора остаются полимиксин Е и тигециклин.
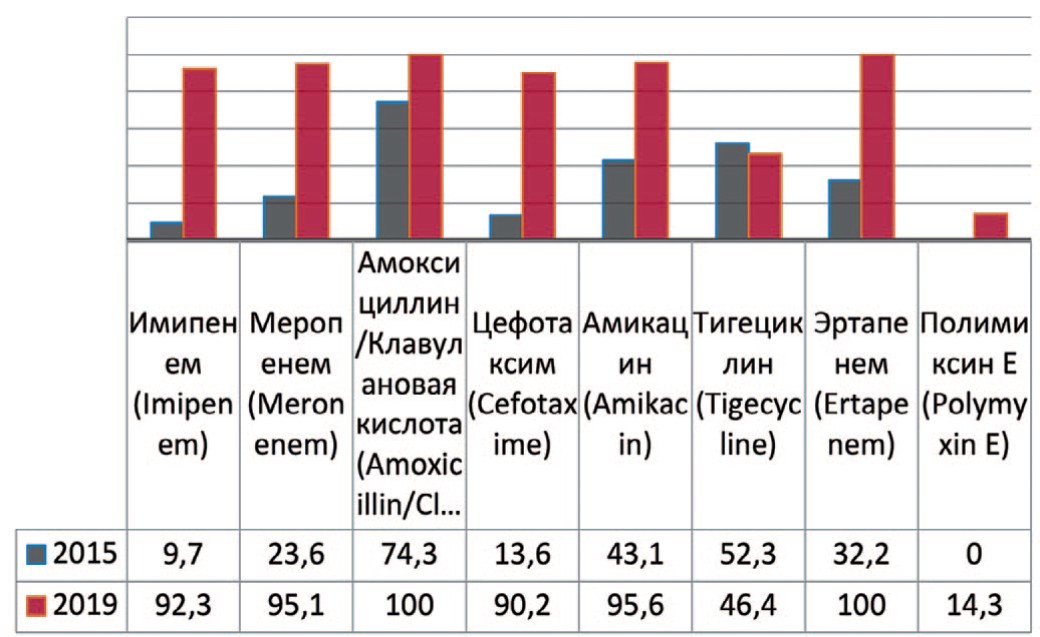
Рис. 9. Резистентность Acinetobacter baumannii к антибиотикам в 2015, 2020 гг. в отделении ОРИТ, по оси ординат - количество штаммов
Fig. 9. Antibiotic resistance of Acinetobacter baumannii: 2015-2020 in intensive care units, the ordinate - stains frequency
ОБСУЖДЕНИЕ
Резюмируя полученные данные можно утверждать, что в возникновении осложненных ИМП наиболее частыми возбудителями в 2019 году явились представители семейств Enterococcaceae и Enterobacteriaceae. В отношении Enterococcus faecalis (выявлена у 34% случаев) наибольшую активность продемонстрировали препараты: ванкомицин (98,1%), тигециклин (99,0%), из фторхинолонов – левофоксацин (79,3%); максимальная чувствительность Escherichia coli (выявлена у 26,6% случаев) отмечена к меропенему (95,5%), амикацину (87,9%), амоксицллину/клавулановой кислоте (74,5%). В отношении Klebsiella pneumonia (выявлена у 18,4% пациентов) лучшую активность демонстрируют препараты: амикацин (69,4%), имипенем (75,4%), цефотаксим/ клавулановая кислота (64,5%). Частота встречаемости Proteus mirabilis составила 7,6%. Данный микроорганизм чувствителен к имипенему (98,5%), амикацину (76,5%), левофлоксацину (72%).
Также прослеживается увеличение числа штаммов, резистентных к определенным группам антибактериальных препаратов: мецитиллин-резистентных стафилококков (на +6%), продуцентов β-лактамаз (на +21,3% для E. coli и на + 35,6% для Klebsiella рneumoniae), ванкомицин-резистентных энтерококков (на 1,9%) и продуцентов карбапенемаз (на 34,7%).
У пациентов реанимационного профиля встречаются такие возбудители, как Pseudomonas aeruginosa (5,5%) и Acinetobacter baumannii (4,4%), демонстрируя панрезистентность. Отдельно можно отметить резкий прирост резистентности к карбапенемам (на 24,6%).
При сопоставлении полученных результатов с данными интернет-платформы «Карта антибиотикорезистентности. AMR map» за 2012-2019 гг. отмечаются сопоставимые данные о встречаемости и резистентности микроорганизмов [16, 17]. Согласно данным «Карты антибиотикорезистентности. AMR map», наиболее частыми видами микроорганизмов у пациентов с осложненными ИМП являются Escherichia coli (30,6%) и Klebsiella pneumoniae (25,1%). Доля штаммов Enterococcus faecalis составила 9,1%. Из парентеральных препаратов наибольшей активностью в отношении Escherichia coli обладают имипенем и амикацин (98,1% и 88,1%), чувствительность к ципрофлоксацину составила 36,3%. Встречаемость Pseudomonas aeruginosa составляет 12,3%, максимальную чувствительность демонстрируют амикацин (49,4%) и меропенем (из карбапенемов (47,0%)). Частота продукции БЛРС среди штаммов Escherichia coli в субпопуляции пациентов с осложненными ИМП составила 42,6%.
Особую настороженность вызывают высокая частота резистентности бактерий к препаратам группы фторхинолонов и относительно высокий процент встречаемости штаммов БЛРС у энтеробактерий. Следовательно, препараты группы фторхинолонов не могут применяться в качестве эмпирической терапии больных с осложненными ИМП, исключение могут составлять безальтернативные случаи аллергических реакций у пациентов на другие группы антибактериальных препаратов. Широкое применение таких препаратов резерва как карбапенемы, полимиксин Е, тигециклин, линезолид, в том числе и дженериков, у пациентов с осложненными ИМП привело к появлению панрезистентных штаммов, таких как Klebsiella pneumoniae и Acinetobacter baumannii [18, 19]. Схемы терапии пациентов, с выделенными панрезистентными штаммами, сопряжены с высокой частотой неблагоприятных результатов лечения.
Учитывая столь широкое распространение резистентных к этиотропным препаратам штаммов микроорганизмов, большое количество пациентов с иммуносупрессивными состояниями, рост рецидивирующих инфекций, современное здравоохранение возлагает надежды на эффективность «новых» антибактериальных препаратов, таких как имипенем/релебактам (карбапенем/ингибитор бета-лактамаз); эравациклин (синтетический тетрациклин); плазомицин (группа аминогликозидов), делафлоксацин (группа фторхинолонов); омадациклин (полусинтетический тетрациклин), цефтолозан/тазобактам, обладающий антисинегнойной активностью и др. [20].
ВЫВОДЫ
С целью замедления темпа резистентности микроорганизмов к антибактериальным препаратам необходим постоянный контроль спектра резистентности штаммов в каждом стационаре и на этапе амбулаторного звена. С целью повышения эффективности лечения больных осложненных ИМП необходимо избавление пациентов от дренажей и катетеров в короткие сроки, коррекция сопутствующих заболеваний, осложняющих течение инфекционных процессов. Важно и строгое соблюдение правил асептики и антисептики на этапах хирургического лечения пациентов, с целью профилактики послеоперационных осложнений. Следуя современным стратегиям рациональной антибиотикотерапии, необходимо продолжать мониторить антибиотикорезистентность микроорганизмов, выявлять резистентные штаммы, широко вводить в практику ускоренной лабораторной диагностики маркеры резистентности бактерий. Кроме того, в комплексной терапии больных ИМП, с целью повышения эффективности лечения, необходимо широко применять альтернативные схемы, такие как физиотерапия, фитотерапия, иммуноактивная профилактика, бактериофаготерапия.
ЛИТЕРАТУРА
- Choe HS, Lee SJ, Cho YH, Çek M, Tandoğdu Z, Wagenlehner F, et al. Aspects of urinary tract infections and antimicrobial resistance in hospitalise urology patient in Asia: 10-year’s results of the global prevalence study of infections in urology (GPIU). J Infect Chemother 2018;24(4):278-283. https://doi.org/ 10.1016/ j.jiac.2017.11.013.
- Малхасян В.А., Иванов В.Ю., Ходырева Л.А., Дударева А.А., Куприянов Ю.А., Редькович В.И., и др. Анализ оказания специализированной медицинской помощи пациентам с острым обструктивным пиелонефритом в урологических стационарах г. Москвы. Экспериментальная и клиническая урология 2016;(4):6-31. [Malkhasian VA, Ivanov VYu, Khodyreva LA, Dudareva AA, Kupriianov YuA, Redkovich VI, et al. Analysis of specialized medical care for patients with acute obstructive pyelonephritis in urological hospitals in Moscow. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2016;(4):6-31. (In Russian)].
- McLellan LK, Hunstad DA. Urinary tract infection: pathogenesis and outlook. Trends Mol Med 2016;22(11):946-957. https://doi.org/10.1016/ j.molmed.2016.09.003.
- Яковлев С.В., Суворова М.П. Обоснование антибактериальной терапии нозокомиальных инфекций, вызванных полирезистентными микроорганизмами. Клиническая фармакология и терапия 2011;20(2):1-10. [Yakovlev SV, Suvorova MP. Justification of antibacterial therapy of nosocomial infections caused by polyresistant microorganisms. Klinicheskaia farmakologiia i terapiya = Clinical Pharmacology and Therapy 2011;20(2):1-10. (In Russian)].
- Агеевец В.А., Партина И.В., Лисицына Е.С. и др. Чувствительность грамотрицательных бактерий, продуцентов карбапенемаз, к антибиотикам различных групп. Антибиотики и химиотерапия 2013;58(3-4):3-6. [Ageevets VA, Partina IV, Lisicyna ES. Sensitivity of gram-negative bacteria, producers of carbapenemases, to various groups of antibiotics. Antibiotiki i khimioterapiya = Antibiotics and Chemotherapy 2013;58(3-4):3-6. (In Russian)].
- Аляев Ю.Г., Глыбочко П.В., Пушкарь Д.Ю. Урология. Российские клинические рекомендации. М.: ГЭОТАР-Медиа, 2016. 496 с. [Alyaev YuG, Glybochko PV, Pushkar DYu. Urology. Russian clinical guidelines. Moscow: GEOTAR-Media, 2016. 496 s. (In Russian)].
- Masajtis-Zagajewska A, Nowicki M. New markers of urinary tract infection. Clin Chim Acta 2017;471:286-291. https://doi.org/10.1016/j.cca.2017.06.003.
- Кулмагамбетов И.Р., Сарсенбаева С.С., Рамазанова Ш.Х., Есимова Н.К. Современные подходы к контролю и сдерживанию антибиотикорезистентности в мире. Международный журнал прикладных и фундаментальных исследований 2015;(9-1):54-59. [Kulmagambetov IR, Sarsenbaeva SS, Ramazanova ShH, Esimova NK. Modern approaches to the control and containment of antibiotic resistance in the world. Mezhdunarodnyi zhurnal prikladnykh i fundamentalnykh issledovanii = International journal of Applied and Fundamental Research 2015;(9-1):54-59. (In Russian)].
- Каприн А.Д., Аполихин О.И., Сивков А.В., Солцева Е.В., Комарова В.А. Анализ уронефрологической заболеваемости и смертности в Российской Федерации за период 2002–2014 гг. по данным официальной статистики. Экспериментальная и клиническая урология 2016;(3):4-13. [Kaprin AD, Apolikhin OI, Sivkov AV, Soltseva EV, Komarova VA. Analysis of uronephrological morbidity and mortality in the Russian Federation for the period 2002-2014 according to official statistics. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2016;(3):4-13. (In Russian)].
- Caskurlu H, Culpan M, Erol B, Turan T, Vahaboglu H, Caskurlu T. Changes in antimicrobial resistance of urinary tract infections in adult patients over a 5-year period. Urol Int 2020;104(3-4):287-292. https://doi.org/10.1159/000504415.
- Глыбочко П.В., Коган М.И., Набока Ю.Л. (под ред.) Инфекции и воспаления в урологии. М.: Медфорум, 2019. 888 с. [Glybochko PV, Kogan MI, Naboka YuL. (ed.) Infections and inflammations in urology. Moscow: Medforum, 2019. 818 s. (In Russian)].
- Котов С.В., Хачатрян А.Л., Гуспанов Р.И., Пульбере С.А., Беломытцев С.В., Юсуфов А.Г., Котова Д.П. Оценка частоты послеоперационных хирургических осложнений у пациентов, подвергшихся радикальной цистэктомии. Онкоурология 2018;14(4):95-102. [Kotov SV, Khachatryan AL, Guspanov RI, Pulbere SA, Belomyttsev SV, Yusufov AG, Kotova DP. Evaluation of the frequency of postoperative surgical complications in patients undergoing radical cystectomy. Onkourologiya = Cancer Urology 2018;14(4):95-102. (In Russian)]. https://doi.org/10.17650/1726-9776-2018-14-4-95-102.
- Определение чувствительности микроорганизмов к антимикробным препаратам. Клинические рекомендации. Версия 2018-03. 206 с. [Determination of the sensitivity of microorganisms to antimicrobial drugs. Clinical recommendations. Version 2018-03. 206 s. (In Russian)].
- EUCAST Guidelines for the identification of resistance and resistance mechanisms of particular clinical and/or epidemiological significance Version 2.01. July 2017.
- Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Перепанова Т.С., Козлов Р.С. Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «Дармис-2018» Клиническая микробиология и антимикробная химиотерапия 2019;21(2):134-146. [Palagin IS, Sukhorukova MV, Dekhnich AV, Eidelstein MV, Perepanova TS, Kozlov RS. Antibiotic resistance of pathogens of community-acquired urinary tract infections in Russia: results of the multicenter study «Darmis-2018». Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya = Clinical Microbiology and Antimicrobial Chemotherapy 2019;21(2):134-146. (In Russian)]. https://doi.org/10.36488/cmac.2019.2.134-146.
- Кузьменков А.Ю., Трушин И.В., Авраменко А.А., Эйдельштейн М.В., Дехнич А.В., Козлов Р.С. AMRmap: интернет-платформа мониторинга антибиотикорезистентности. Клиническая микробиология и антимикробная химиотерапия 2017;19(2):84-90. [Kuzmenkov AYu, Trushin IV, Avramenko AA, Eidelstein MV, Dekhnich AV, Kozlov RS. AMRmap: an online platform for monitoring antibiotic resistance. Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya = Clinical Microbiology and Antimicrobial Chemotherapy 2017;19(2):84-90. (In Russian)].
- Виноградова А.Г., Кузьменков А.Ю. Практическое применение AMRmap: элементы подхода «от общего к частному» на примере Klebsiella pneumoniae. Клиническая микробиология и антимикробная химиотерапия 2019;21(2):181-186. [Vinogradova AG, Kuzmenkov AYu. Practical application of AMRmap: elements of the "from General to particular" approach on the example of Klebsiella pneumoniae. Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya = Clinical Microbiology and Antimicrobial Chemotherapy 2019;21(2):181-186. (In Russian)]. https:// doi.org/10.36488/cmac.2019.2.181-186.
- Lenhard JR, Bulitta JB, Connell TD, King-Lyons N, Landersdorfer CB, Cheah SE, et al: High-intensity meropenem combinations with polymyxin B: new strategies to overcome carbapenem resistance in Acinetobacter baumannii. J Antimicrob Chemother 2017;72(1):153-65. https://doi.org/10.1093/jac/dkw355.
- Ni W, Han Y, Zhao J, Wei C, Cui J, Wang R, Liu Y. Tigecycline treatment experience against multidrug-resistant Acinetobacter baumannii infections: a systematic review and meta-analysis. Int J Antimicrob Agents 2016;47(2):107-16. https://doi.org/ 10.1016/j.ijantimicag.2015.11.011.
- Перепанова Т.С., Шадеркина В.А. Отчет о ХII Всероссийской научно-практической конференции с международным участием «Рациональная фармакотерапия в урологии». Экспериментальная и клиническая урология 2018;(1):124-127. [Perepanova TS, Shaderkina VA. Report on the XII all-Russian scientific and practical conference with international participation «Rational pharmacotherapy in urology». Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2018;(1):124-127. (In Russian)].







