ВВЕДЕНИЕ
Заболевания предстательной железы (ПЖ) являются лидирующей урологической патологией у мужчин среднего и пожилого возраста [1, 2]. В течение последних десятилетий применение малоинвазивных методов лечения рака (РПЖ) и доброкачественной гиперплазии предстательной железы (ДГПЖ) стало «золотым стандартом» [1, 5-7].
Лапароскопическая радикальная простатэктомия и лапароскопическая аденомэктомия доказали свою высокую эффективность в лечении заболеваний ПЖ. Несмотря на минимальную инвазивность, трансперитонеальная лапароскопия связана с потенциальными внутрибрюшными осложнениями. Во избежание отрицательных сторон трансперитонеального доступа был разработан экстраперитонеальный (внебрюшинный) доступ к ПЖ [2, 3, 7, 8].
Трансперитонеальный доступ предпочитают из-за большого рабочего пространства и знакомых ориентиров таза и его содержимого. Экстраперитонеальный доступ, в свою очередь, дает возможность избежать контакта с органами брюшной полости [4, 7-10].
Немаловажным недостатком экстраперитонеоскопического доступа является необходимость создания артифициальной полости, что имеет свои сложности [9-11]. Наличие цистостомического свища способно значительно затруднить формирование предбрюшинного рабочего пространства.
Цель исследования: разработать методику создания внебрюшинного доступа к ПЖ при наличии цистостомического свища и оценить ее предварительные результаты.
МАТЕРИАЛЫ И МЕТОДЫ
За период с 2015 по 2019 год нами были прооперированы 153 пациента с использованием внебрюшинного доступа к ПЖ, 13 из них на момент операции имели цистостомический свищ.
Во всех случаях цистостома ранее была установлена троакарным путем.
Более подробная характеристика пациентов, имевших цистостомический свищ, представлена в таблице 1.
Таблица 1. Характеристика пациентов с цистостомическим свищoм
Table 1. Patient’s profile with cystostomy fistula
| Возраст, лет Age, years |
71±4,38 |
| Объем предстательной железы, мл Prostate volume, ml |
90±18,34 |
| Индекс массы тела BMI |
29±5,16 |
У 10 пациентов из 13 имел место рост бактериальной флоры в титре ≥104 КОЕ/мл. Больным с наличием мочевой флоры за 2 дня до вмешательства, после смены дренажа назначалась антибактериальная терапия.
9 пациентов были оперированы по поводу ДГПЖ, четверо имели РПЖ группы низкого риска. Пациентам выполнялось экстраперитонеоскопическое вмешательство: при ДГПЖ – аденомэктомия, при РПЖ – радикальная простатэктомия.
Описание методики экстраперитонеального доступа к предстательной железе
Пациент находится в положении на спине. Перед обработкой операционного поля раствором антисептика удаляется цистостомический дренаж. После подготовки операционного поля в мочевой пузырь устанавливался катетер Фолея 18 Ch.
В околопупочной области выполняется вертикальный разрез длиной 3 см таким образом, чтобы его верхний край находился на 1 см ниже и латеральнее пупка (рис. 1).
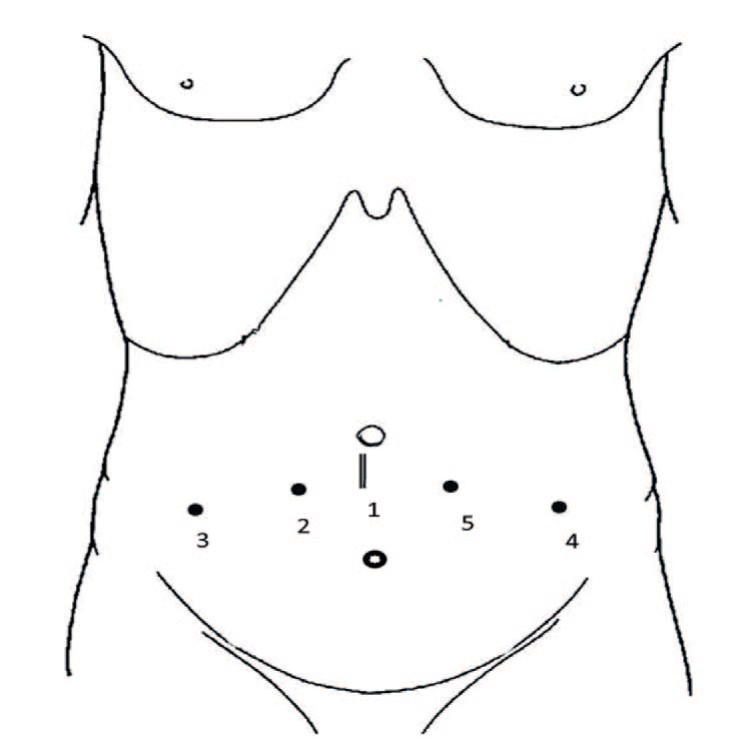
Рис. 1. Схема и последовательность (1-5) постановки троакаров
Fig.1. Overview and sequence (1-5) of troacar placement
После выделения передней стенки влагалища прямой мышцы живота, его передний листок рассекается параллельно белой линии на протяжении 1,5–2 см. Прямая мышца живота отводится медиально, обнажая переднюю поверхность заднего листка влагалища прямой мышцы живота (рис. 2).
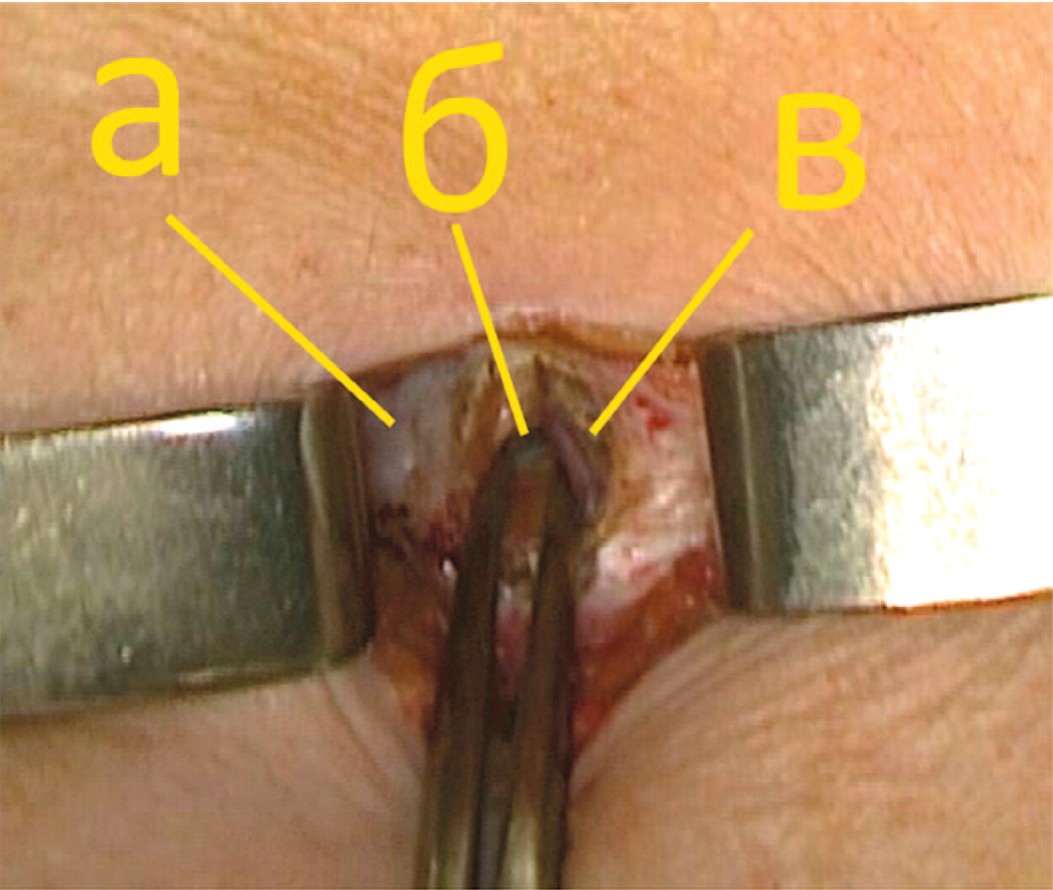
Рис. 2. Вскрытие влагалища прямой мышцы живота. (а – белая линия, б – задний листок апоневроза прямой мышцы, в – медиальный край прямой мышцы)
Fig. 2. Opening of the anterior layer of rectus sheath (a – linea alba, b – posterior layer of rectus sheath, c – rectus muscle)
В пространство между прямой мышцей и задним листком ее влагалища вводится 10 мм троакар без стилета. Передний листок влагалища герметично ушивается вокруг троакара одним или двумя узловыми швами (рис. 3). Кожа с подкожной клетчаткой ушиваются П-образным швом ниже троакара, обеспечивая дополнительную герметичность. Возможность отхождения троакара ограничивается путем его фиксации за канюлю подачи газа лигатурой кожного шва.
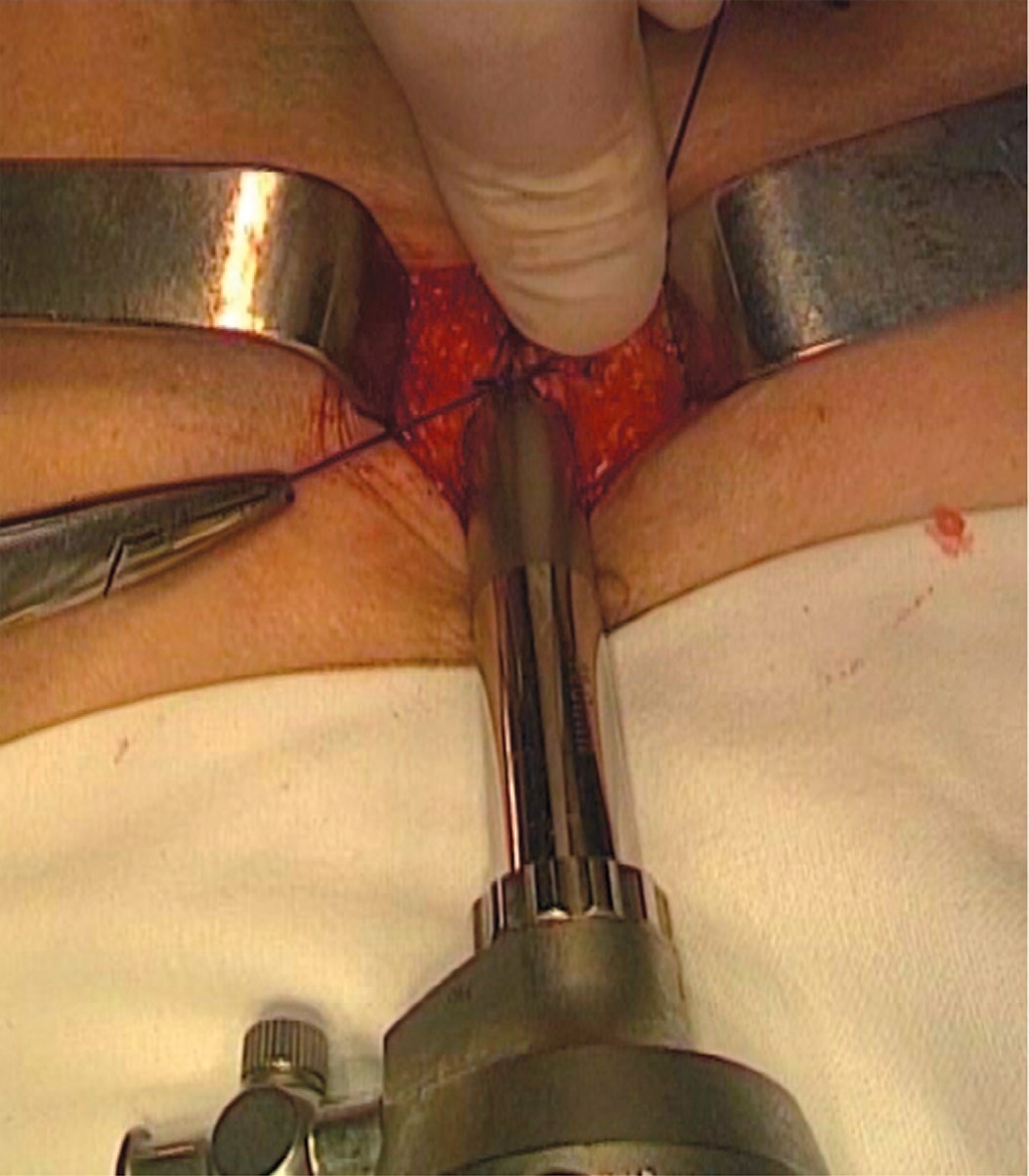
Рис. 3. Ушивание переднего листка влагалища прямой мышцы над троакаром
Fig. 3. Suturing anterior layer of rectus sheath over the troacar
В троакар вводится лапароскоп и начинается инсуффляция углекислого газа под давлением 12–14 мм рт.ст. При помощи лапароскопа пространство расширяется в латеральном направлении до края прямой мышцы, а в дистальном – до лонной кости. Под визуальным контролем, с целью избежать ранения нижних эпигастральных сосудов, в сформированную полость, на 6 см латеральнее и несколько дистальнее оптического, устанавливается второй 10 мм троакар (рис. 1).
Следующим устанавливается 5 мм троакар в правой подвздошной области. В последний вводятся ультразвуковые ножницы, которыми проводится отделение передней стенки мочевого пузыря от прямых мышц живота. При наличии цистостомического дренажа последний пересекался со смещением мочевого пузыря дорсально (рис. 4).
Далее, по стандартной методике, проводилось формирование пространства на контралатеральной стороне с установкой двух 5 мм троакаров. Свищевое отверстие в мочевом пузыре ушивается 8-образным швом рассасывающейся нитью (викрил 2-0), после чего выполняется проверка герметичности посредством введения в мочевой пузырь 200 мл физиологического раствора (рис. 5).
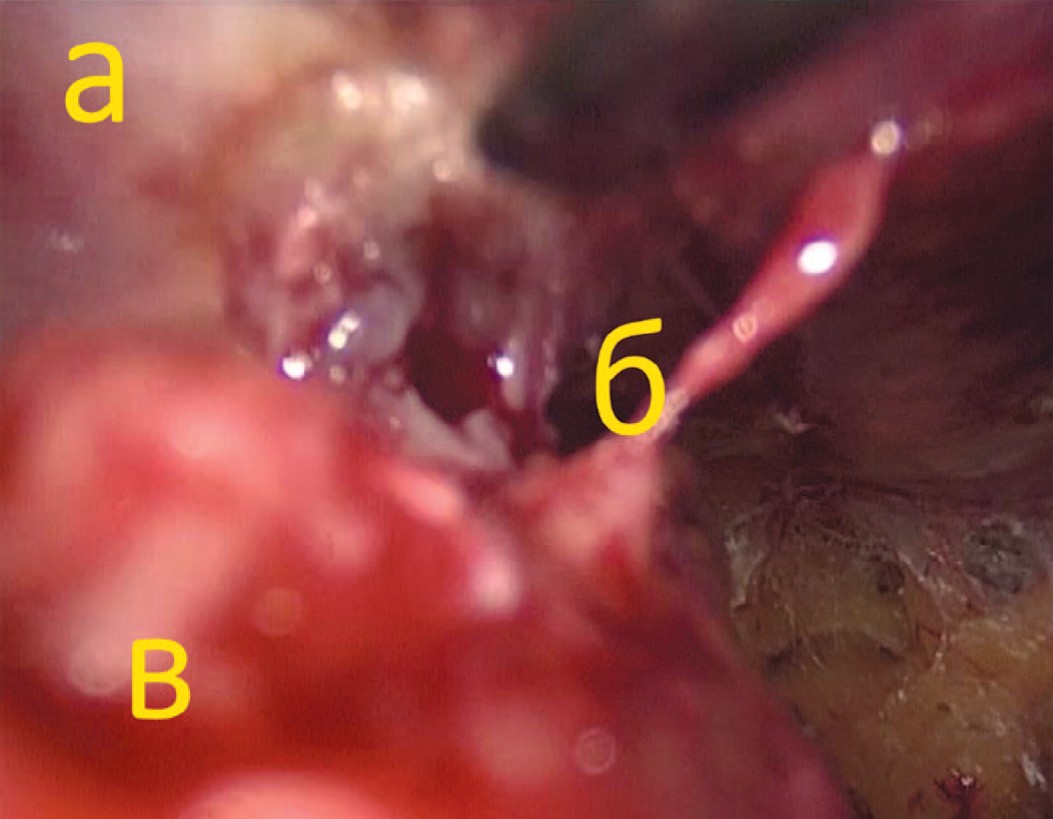
Рис. 4. Пересечение цистостомического свища со стороны предбрюшинного пространства (а – передняя брюшная стенка, б – частично пересеченный свищ, в – мочевой пузырь)
Fig. 4. Cystostomy passage transection via extraperitoneal cavity (a – abdominal wall, b - transected cystostomy passage, c – bladder)
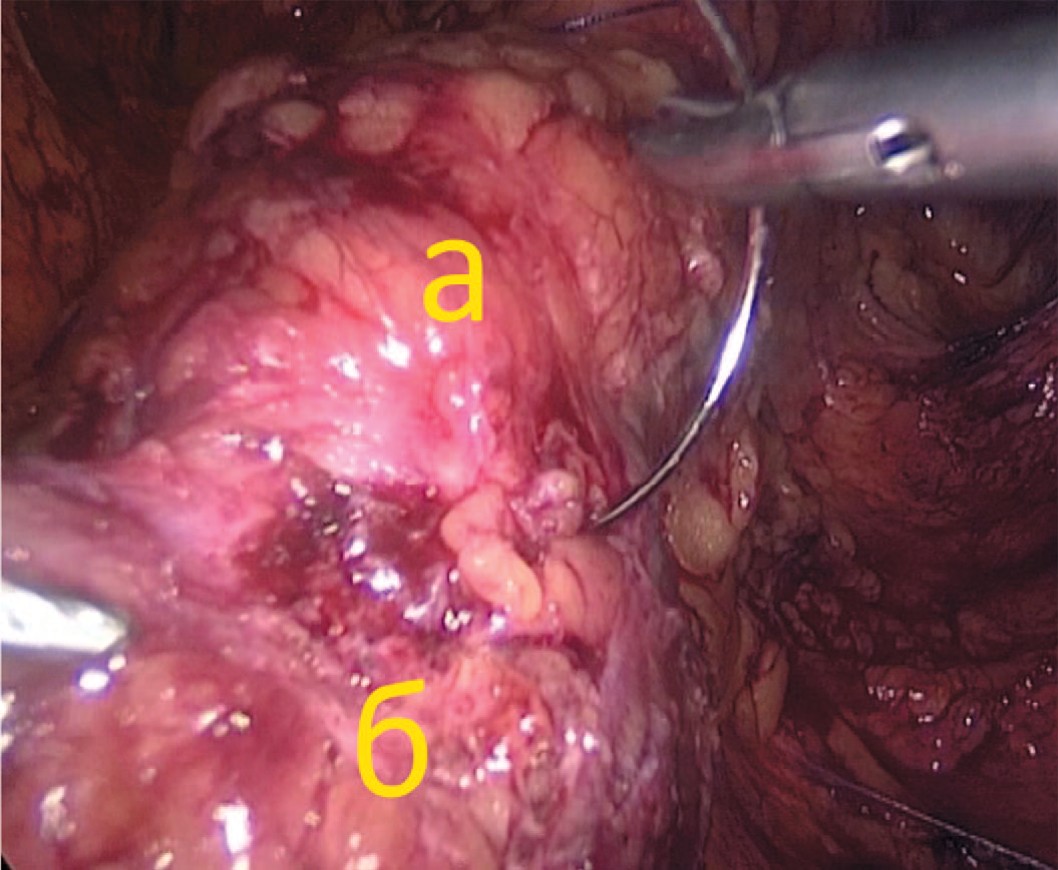
Рис. 5. Ушивание свища на передней стенке мочевого пузыря (а – мочевой пузырь, б – отверстие свища)
Fig. 5. Cystostomy passage closure (a – bladder, b - cystostomy hole)
Отверстие в брюшной стенке можно не ушивать, поскольку потеря газа через него либо отсутствует, либо пренебрежительно мала.
Дальнейший ход операции не отличается от обычного. Операцию заканчивали дренированием мочевого пузыря двухходовым катетером после простатэктомии и трехходовым – после аденомэктомии. Страховой дренаж на сутки устанавливали всем пациентам.
Ведение послеоперационного периода не отличалось от такового у пациентов без свища: при простатэктомии катетер удаляли на 14 сутки, при аденомэктомии использовали ирригацию мочевого пузыря в течение 16–24 часов с удалением катетера на 3–6-e сутки.
РЕЗУЛЬТАТЫ
В группе из 140 пациентов, не имевших цистостомического свища, создание экстраперитонеального рабочего пространства осуществлялось по стандартной методике. При этом время создания артифициальной полости сокращалось по мере накопления опыта, и составило, в среднем, 18,3 мин (±6,8 мин). Непреднамеренное вскрытие брюшины произошло в 26 случаях (18,5%) и, в большинстве случаев, не имело значимого влияния на продолжительность операции. При сложностях с поддержанием объема внебрюшинного пространства, последнее широко объединяли с брюшной полостью и несколько увеличивали угол наклона операционного стола в положение Тренделенбурга до 15–200 . В дальнейшем вмешательства продолжались согласно общепринятой методике.
По мере освоения методики экстраперитонеального доступа у пациентов с неизмененной передней брюшной стенкой, мы овладели данной методикой у пациентов с цистостомическим свищем.
Во всех 13 случаях нам удалось сформировать рабочее пространство, достаточное для хирургического вмешательства. При этом в 10 (77%) случаях создание доступа прошло успешно, в 3 случаях (23%) произошло вскрытие брюшины, потребовавшее формирования окна в брюшную полость для выравнивания давления. Время создания доступа составило 24 (±10,18) мин.
Таким образом, разница во времени и частоте вскрытия брюшины у пациентов со свищом не сильно отличалась от таковой в группе больных, не имевших цистостомы.
В одном случае, у пациента после аденомэктомии, имело место подтекание мочи по страховому дренажу в течение недели. Ревизия зоны вмешательства показала, что причиной явилась несостоятельность шва в области капсулотомии – выполнено повторное ушивание капсулы. Осложнений, связанных с созданием предбрюшинного пространства, не отмечено.
ОБСУЖДЕНИЕ
Стремление осуществлять вмешательства на внебрюшинном органе внебрющинным доступом вполне оправдано.
К преимуществам внебрюшинного эндоскопического доступа к ПЖ можно отнести следующие:
- минимизация риска повреждения органов брюшной полости;
- отсутствие повышения внутрибрюшного давления;
- минимальное влияние на сердечно-сосудистую систему;
- отсутствие контакта с последствиями ранее перенесенных трансперитонеальных вмешательств ввиде рубцово-спаечного процесса;
- значимое уменьшение угла наклона в положении Тренделенбурга (0-150, вместо 15-250);
- естественное отграничение брюшной полости от зоны хирургического вмешательства;
- снижение риска тромбоза глубоких вен нижних конечностей [9-14].
Большинство системных изменений, связанных с лапароскопией, возникают по причине наложения и поддержания пневмоперитонеума. Углекислый газ поглощается брюшиной и может вызвать гиперкапнию. Увеличение внутрибрюшного давления приводит к росту внутригрудного давления и сосудистого сопротивления, что вызывает усиление легочного и системного сосудистого сопротивления, повышение артериального давления и снижение сердечного выброса. Помимо этого, снижается органный и почечный кровоток, увеличивается концентрация в плазме крови катехоламинов, кортизола, пролактина, отмечается рост уровня глюкозы. Пневмоперитонеум уменьшает венозный отток от нижних конечностей, повышая риск развития тромбоэмболических осложнений.
Позиция Тренделенбурга также вносит свой вклад в изменение работы сердечно-сосудистой системы. При выраженном наклоне операционного стола центральное венозное давление повышается, причем системное артериальное давление и сердечный выброс уменьшаются. Влияние на дыхательную систему зависит от возраста пациента, его веса, функции внешнего дыхания и угла наклона [10, 11].
Использование экстраперитонеального доступа позволяет избегать значимого наклона операционного стола, поскольку нет необходимости в краниальном смещении петель кишечника. Рядом авторов показано, что при внебрюшинном доступе, пациенты значительно легче переносят гипрекапнию [11].
ВЫВОДЫ
Внебрюшинный доступ к предстательной железе при наличии цистостомического свища может быть безопасно создан в большинстве случаев, без значимого удлинения времени операции. Вскрытие брюшины, частота которого в данной ситуации оказалась выше, чем в группе пациентов без свища, определяет возникновение пневмоперитонеума и необходимость дополнительного наклона операционного стола.
ЛИТЕРАТУРА
- Пушкарь Д. Ю., Колонтарев К. Б. Робот-ассистированная радикальная простатэктомия. М.:ГЭОТАР-Медиа 2014. с. 384 [Pushkar D. Yu., Kalantari K. B. etc. Robot-assisted radical prostatectomy. Moscow: GEOTAR-Media Publishing house 2014. P. 384 (In Russian)].
- Котов С. В., Мамаев И. Э., Юсуфов А. Г., Гуспанов Р. И., Перов Р. А., Беломытцев С. В. и др. Лапароскопический доступ при позадилонной аденомэктомии в сравнении с традиционным – малый опыт на фоне большого. Экспериментальная и клиническая урология 2018;(1):92-98. [Kotov SV, Mamaev IE, Yusufov AG, Gubanov RI, Perov RA, Belomyttsev SV, et al. Laparoscopic access for posadilon adenomectomy in comparison with the traditional approach is a small experience compared to a large one. Eksperimentalnaya i klinicheskaya urologiya= Experimental and Сlinical urology 2018;(1):92-98 (In Russian)]. https://doi.org/10.29188/2222-8543-2018-9-1-92-98.
- Сероухов А.Ю., Пронкин Е.А., Глинин К.И., Мамаев И.Э. Лапароскопическая аденомэктомия (предварительные результаты). Вестник урологии 2016;(1):24-31. [Serpukhov AYu, Pronkin EA, Glinin KI, Mamaev IE. Laparoscopic adenomectomy (preliminary results). Vestnik urologii = Bulletin of urology 2016;(1):24-31. (In Russian)]. https://doi.org/10.21886/2308-6424-2016-0-1-24-31.
- Hong CD, Ren LL, Qiang W, Jia W, Chun HY, Lu Y, et al. Comparison of efficacy and safety of conventional laparoscopic radical prostatectomy by the transperitoneal versus extraperitoneal procedure. Sci Rep 2015 Oct 13;5:14442. https://doi.org/10.1038/srep14442.
- Stolzenburg JU, Do M, Pfeiffer H, Konig F, Aedtner B, Dorschner W. The endoscopic extraperitoneal radical prostatectomy (EERPE): technique and initial experience. World J Urol 2002;20(1):48–55. https://doi.org/10.1007/s00345-002-0265-4.
- Guillonneau B, Vallancien G. Laparoscopic radical prostatectomy: the Montsouris experience. J Urol 2000;163(6):418-22. https://doi.org/10.1016/ s0022-5347(05)67512-x.
- Bollens R, Vanden Bossche M, Roumeguere T, Damoun A, Ekane S, Hoffmann P, et al. Extraperitoneal laparoscopic radical prostatectomy. Results of 50 cases. EurUrol 2001;40(1):65–69. https://doi.org/10.1159/000049750.
- Stolzenburg JU, Truss MC. Technique of laparoscopic (endoscopic) radical prostatectomy. BJU Int 2003;91(8):749–757. https://doi.org/10.1046/j.1464- 410X.2003.04206.x.
- Stolzenburg JU, Rabenalt R, Do M, Lee B, Truss MC, Schwaibold H, et al. Categorisation of complications of endoscopic extraperitoneal and laparoscopic transperitoneal radical prostatectomy. World J Urol 2006;24(1):88-93. https://doi.org/10.1007/s00345-005-0036-0.
- Stolzenburg JU, Aedtner B, Olthoff D, Koenig F, Rabenalt R, Filos KS, et al. Anaesthetic considerations for endoscopic extraperitoneal and laparoscopic transperitoneal radical prostatectomy. BJU Int 2006;98(3):508-513. https://doi.org/10.1111/j.1464-410X.2006.06223.x.
- Stolzenburg JU, Ho KM, Do M, Rabenalt R, Dorschner W, Truss MC. Impact of previous surgery on endoscopic extraperitoneal radical prostatectomy. Urology 2005;65(2):325-331.
- Wang K, Zhuang Q, Xu R, Lu H, Song G, Wang J, Gong P. Transperitoneal versus extraperitoneal approach in laparoscopic radical prostatectomy. Medicine 2018;97(29):e11176. https://doi.org/10.1097/md.0000000000011176.
- Rapoport L, Yossepowitch O, Shpot E, Chinenov D, Chernov Ya, Yurova M, Enikeev D. Radical prostatectomy performed via robotic, transperitoneal and extraperitoneoscopic approaches: functional and early oncological outcomes. Cent European J Urol 2018;71:378-385. https://doi.org/10.5173/ ceju.2018.1739.
- Hong CD., Ren LL, Qian, W, Jia W, Chun HY, Lu Y, et al. Comparison of efficacy and safety of conventional laparoscopic radical prostatectomy by the transperitoneal versus extraperitoneal procedure. Sci Rep 2015;13(5):14442. https://doi.org/10.1038/srep14442.







