ВВЕДЕНИЕ
Одними из урологических заболеваний у взрослого населения, приводящими к терминальной стадии хронической почечной недостаточности (ТХПН), являются мочекаменная болезнь (МКБ) и гидронефротическая трансформация различного генеза (инфравезикальная и суправезикальная обструкция). Доля таких пациентов среди общего количества больных с ТХПН невелика и составляет не более 10%, однако они являются наиболее тяжелыми [1]. Поскольку основное урологическое заболевание, осложнённое ХПН, характеризуется неравномерным поражением почек, склонностью к более или менее продолжительным ремиссиям, особенно после восстановления пассажа мочи, то ТХПН у этих больных проявляется в более пожилом возрасте и при наличии сопутствующих заболеваний, увеличивающих коморбидность [2, 3].
Наиболее сложными в отношении определения хирургической тактики являются пациенты, которым начат программный гемодиализ и у которых имеются постоянные мочевые дренажи в верхних мочевых путях (стенты, нефростомы), либо отмечается рецидивирующее течение пиелонефрита. В отношении больных, которым возможна трансплантация почки, лечебный подход однозначен и подразумевает выполнение нефрэктомии до пересадки почки [4, 5]. Однако в отношении пожилых пациентов с отягощенным соматическим статусом вопрос о хирургической тактике остается открытым, а в литературе данная проблема практически не освещается. С одной стороны, на фоне сниженного иммунного ответа, постоянных дренажей в почках с микробными биофильмами имеется высокий риск сепсиса и летального исхода, с другой – высокая коморбидность, риск анестезиологохирургических осложнений ставят под сомнение потенциальную пользу от нефрэктомии.
Диагностика пиелонефрита у этой категории пациентов также представляет определенные трудности. При наличии мочевых дренажей ориентироваться на изменения в общем анализе мочи и на результаты бактериологического исследования мочи нельзя, так как даже при латентном течение пиелонефрита всегда будет присутствовать инфекция, обусловленная наличием биоплёнок на внутренней поверхности дренажа [6]. При отсутствии дренажей степень пиурии не коррелирует со степенью активности пиелонефрита, наличие лейкоцитурии, нитритурии наблюдается и при латентном течение пиелонефрита у пациентов, получающих лечение гемодиализом [7]. Ультразвуковое исследование (УЗИ) почек в большинстве случаев не позволяет выявить классические эхо-признаки пиелонефрита в виду наличие нефросклероза, истончения паренхимы почек, имеющегося паранефрита в результате неоднократно перенесенных операций [8]. Наиболее информативным методом на сегодняшний день считается МРТ-ДВИ [9, 10].
До недавнего времени выполнение лапароскопической нефрэктомии у пациентов с воспалительными заболеваниями почек, перенесших неоднократные оперативные вмешательства на верхних мочевых путях и получающих лечение гемодиализом, считалось сложной задачей [11]. Однако совершенствование лапароскопического инструментария, накопление мирового опыта показало, что данная задача решаема без каких-либо негативных последствий для пациента.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 58 пациентов с ТХПН, находящиеся на лечении гемодиализом, которым выполнена нефрэктомия в ГБУЗ ГКБ №52 ДЗМ в период с 2013 по 2020 гг. У всех больных показанием к операции было активное, рецидивирующее течение пиелонефрита. У 49 (84,5%) пациентов имелись постоянные дренажи в верхних мочевых путях, в 4 случаях – стенты мочеточника, в 45 – нефростомы.
Распределение пациентов в зависимости от заболевания, приведшего к ТХПН, представлено на рисунке 1. Наиболее частой причиной была мочекаменная болезнь (МКБ). 47 (81%) пациентов в анамнезе имели неоднократные оперативные вмешательства.
Мужчин было 26 (44,8%), женщин – 32 (55,2%). Медиана возраста пациентов составила 65,5 лет (Q1-Q3: 56-71), медиана периода гемодиализа до нефрэктомии – 2 мес. (Q1-Q3: 1-12 мес). Для оценки коморбидности мы использовали индекс Чарлсона. Он представляет собой бальную систему оценки возраста и наличия определенных сопутствующих заболеваний. При его расчете суммируются баллы, соответствующие сопутствующим заболеваниям, а также добавляется один балл на каждую декаду жизни при превышении пациентом сорокалетнего возраста. Пациенты, находящиеся на лечении гемодиализом, изначально имеют значения индекса «2» непосредственно за счет наличия ТХПН [12].
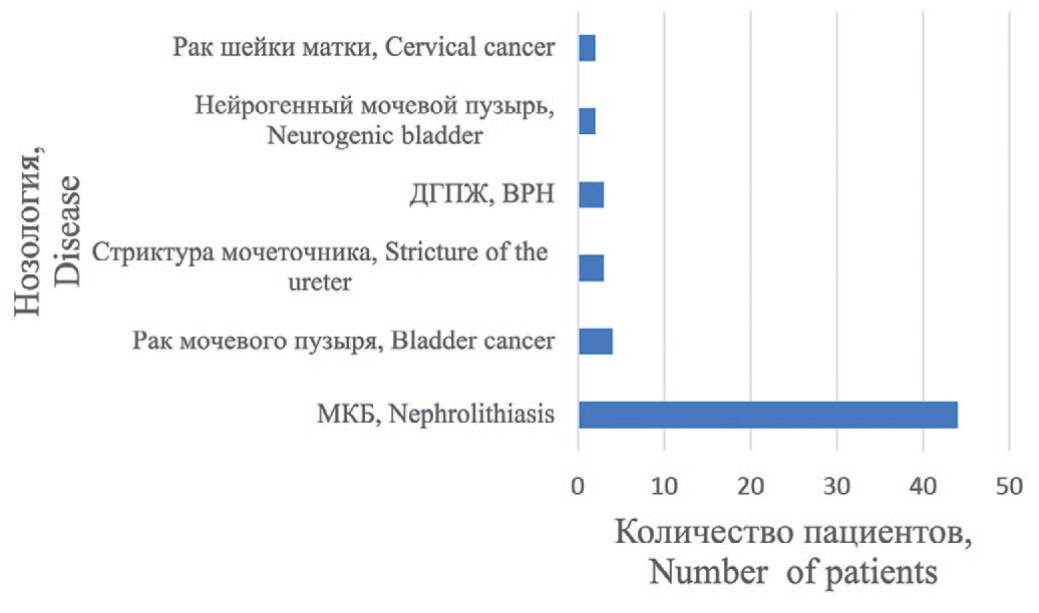
Рис. 1. Распределение пациентов в зависимости от заболевания, приведшего к развитию ТХПН
Fig. 1. Distribution of patients depending on the disease leading to the development of ESRD
Диагностика пиелонефрита осуществлялась с помощью лабораторных методов, бактериологического исследования мочи, УЗИ почек. Для уточнения состояния паренхимы почек, верхних мочевых путей МРТДВИ выполнена у 17 пациентов, мультиспиральная компьютерная томография (МСКТ) с внутривенным контрастным усилением проведена у 43 больных.
Пациенты оперированы в экстренном (n=21, 36,2%) и плановом порядке (n=37, 63,8%). У 11 (19%) пациентов на момент операции имелся сепсис. У 31 (53,4%) больного на момент операции проводилась антибактериальная терапия более 2-х недель. Эти больные в подавляющем большинстве поступали переводом из других стационаров. Билатеральная нефрэктомия выполнена у 22 (37,9%) пациентов, односторонняя – у 36 (62,1%). Лапароскопическая нефрэктомия предпринята у 22 (37,9%) пациентов, из них у 13 – билатеральная. Открытая нефрэктомия осуществлялась из люмботомического доступа по Федорову. Лапароскопическое вмешательство проводилось в плановом порядке, за исключением одного пациента (рис. 2).
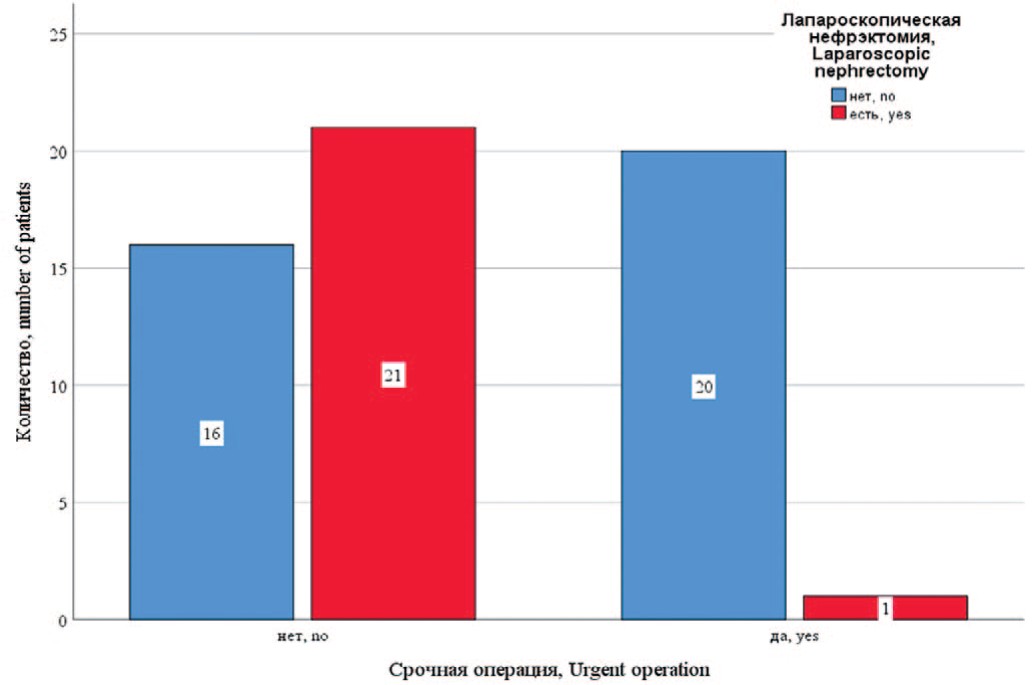
Рис. 2. Распределение открытой и лапароскопической нефрэктомии в зависимости от характера операции
Fig. 2. The distribution of open and laparoscopic nephrectomy depending on the nature of the operation
Для статистической обработки данных использовалась программа SPSS 26 версии (IBM, USA). При нормальном распределении количественных данных использовали Т-критерий Стьюдента, если количественные данные отличались от нормального распределения применяли критерий Манна-Уитни (группирующий признак всегда был бинарным). Анализ номинальных данных оценивали с помощью критерия Фишера, так как всегда минимальное предполагаемое число было менее 10. Различия показателей считались статистически значимы при p<0,05. Силу связи (effect size) номинальных признаков оценивали по критерию Крамера (Cramer’s V). Сильной связью считали V>0,4 согласно рекомендациям Rea & Parker. С целью выявления факторов риска летального исхода после нефрэктомии, риска развития сепсиса, инфекционно-воспалительных осложнений после нефрэктомии была использована бинарная логистическая регрессия с исключением факторов по Вальду. Для оценки зависимости вероятности летального исхода от количественных факторов использован ROC-анализ.
РЕЗУЛЬТАТЫ
Диагностическая эффективность мультиспиральной компьютерной томографии (МСКТ) с внутривенным контрастированием в верификации активного течения пиелонефрита, пионефроза (в качестве оценки эффективности использовалось гистологическое заключение) была низкой – 58% (специфичность – 100%, чувствительность – 41,2%). Диагностическая эффективность МРТ-ДВИ оказалась значительно выше – 94% (чувствительность – 100%, специфичность – 50%). В качестве примера приводим результаты МСКТ и МРТ пациента с пионефрозом слева, по заключению МСКТ имел место терминальный гидронефроз, по данным МРТ-ДВИ – пионефроз (рис. 3).
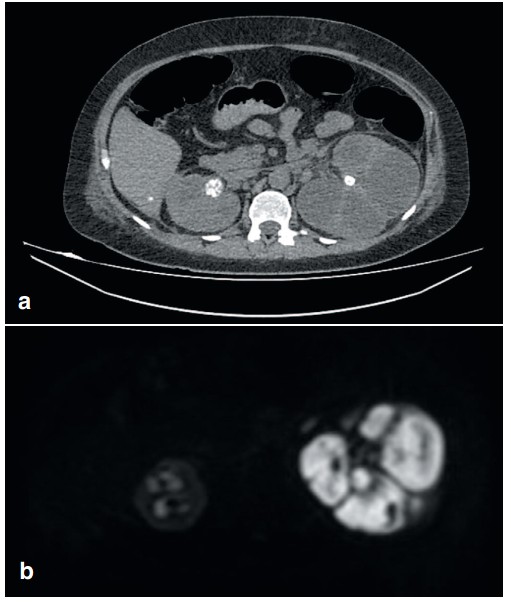
Рис. 3. (a) МСКТ венозная фаза, терминальный гидронефроз слева; (b) МРТ-ДВИ режим, пионефроз слева
Fig. 3. (a) MSCT, kidney venous phase, terminal hydronephrosis on the left; (b) MRI-DWI mode, pyonephrosis on the left
При односторонней лапароскопической нефрэктомии среднее время операции составило 123±9 мин. (95% ДИ 115-131), средняя длительность стационарного лечения – 6,75±3 дней (95%ДИ 4,2-9,2), при люмботомии медиана времени операции составила 87,5 мин (Q1-Q2 80-97,5), а продолжительность стационарного лечения – 21,5±11 дней (95% ДИ 17,2-25,7). Данные различия были статистически достоверны: для времени операции – p<0,001, для продолжительности стационарного лечения – p<0,001.
При билатеральной лапароскопической нефрэктомии среднее время операции составило 199±67 мин (95% ДИ 160-238), медиана длительности стационарного лечения – 11 дней (Q1-Q3 7-25), при люмботомии медиана времени операции составила 147 мин (Q1-Q2 117-170), а продолжительность стационарного лечения – 21 день (Q1-Q3 15-27). Различия в длительности операции были статически достоверны (p=0,047), в продолжительности стационарного лечения достоверного отличия не наблюдалось (р=0,274).
Интраоперационные осложнения отмечены у 4 пациентов (у трех при открытой и у одного – при лапароскопической нефрэктомии), в трех случаях кровопотеря составила 1000-1500 мл, в одном случае отмечено вскрытие плеврального синуса. Наиболее частым послеоперационным осложнением был антибиотик-ассоциированный колит (n=9, 15,5%), который при однофакторном анализе достоверно ассоциировался с длительной антибактериальной терапией до операции (p=0,02, V Крамера 0,4). Инфекционно-воспалительные осложнения со стороны послеоперационной раны отмечены у 15 (28,9%) пациентов. При многофакторном анализе связи инфекционно-воспалительных осложнений с различными факторами отмечена достоверная связь только для длительной предоперационной антибактериальной терапии, которая в 14 раз повышала шансы (AOR 14,1; 95% ДИ 1,6 – 124; p=0,017), и для гнойной формой пиелонефрита, который повышал шансы в 6,7 раз (AOR 6,75; 95% ДИ 1,3-37,5; p=0,29).
После оперативного лечения летальность составила 25,9% (n=15). При анализе танатогенеза во всех случаях смерть наступила от прогрессирования системной воспалительной реакции (СВР). При многофакторном анализе достоверными предикторами смерти были только уровень СРБ до операции (AOR 1,019; 95% ДИ 1,04-1,033; p=0,011) и индекс коморбидности (AOR 3,17; 95%ДИ 1,49-6,75; p=0,003). При увеличении СРБ на 1 мг/л вероятность смерти увеличивалась в 1,019 раза, а при увеличении индекса коморбидности на 1 балл – в 3,17 раза. В анализируемой прогностической модели проведение предварительного дренирования верхних мочевых путей (OAR = 0,038) снижало вероятность летального исхода в 26 раз, однако этот показатель не был статистически достоверным (p=0,063).
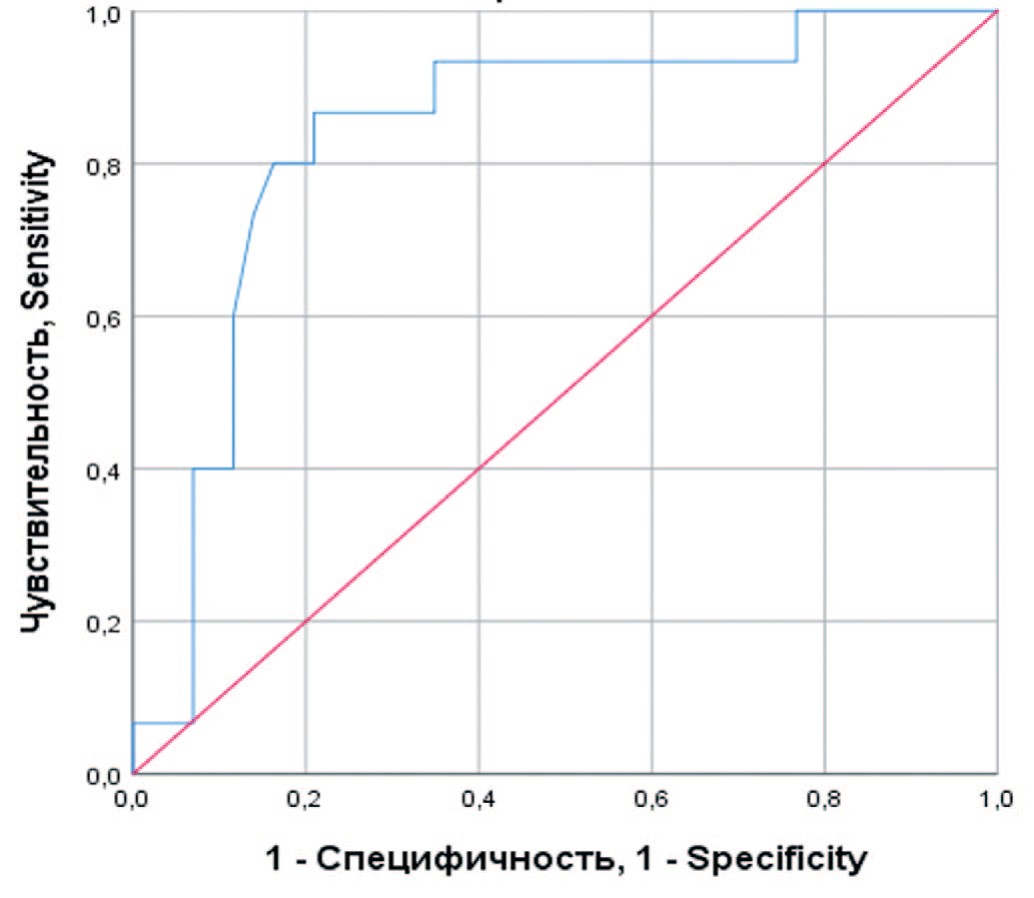
Рис. 4. ROC-кривая, характеризующая зависимость вероятности послеоперационной смерти от уровня СРБ
Fig. 4. ROC curve characterizing the dependence of the probability of postoperative death on the level of CRP
Проведена оценка зависимости вероятности летального исхода от уровня СРБ до операции с помощью ROCанализа, на рисунке 4 приведена ROC-кривая этой зависимости. Площадь под ROC-кривой составила 0,84±0,06 (95% ДИ: 0,72-0,96), прогностическая модель была статистически значимой (p<0,001). Значение уровня СРБ в точке cut-off составило 95 мг/л. У пациентов с уровнем СРБ выше 95 мг/л предполагался повышенный риск летального исхода после операции. При уровне СРБ до 95 мг/д риск смерти считался незначительным. Чувствительность и специфичность полученной модели составляли 80% и 80%, соответственно.
При оценке зависимости вероятности летального исхода от значения индекса коморбидности с помощью ROC-анализа была получена кривая, представленная на рисунке 5.
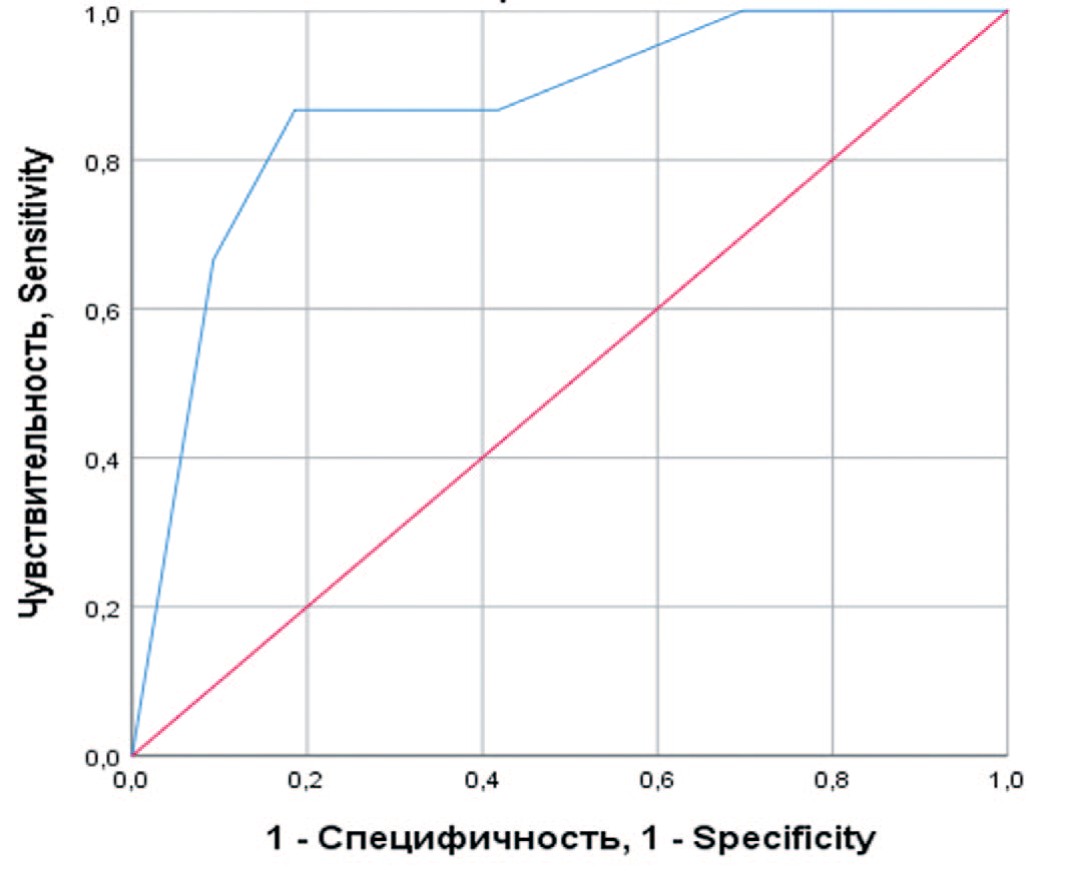
Рис. 5. ROC-кривая, характеризующая зависимость вероятности послеоперационной смерти от значения индекса коморбидности по Чарлсону
Fig. 5. ROC curve characterizing the dependence of the probability of postoperative death on the Charlsson index of comorbidity
Площадь под ROC-кривой составила 0,87±0,06 (95% ДИ: 0,76-0,97), прогностическая модель была статистически значимой (p<0,001). Значение индекса коморбидности в точке cut-off составило 5,5. У пациентов с индексом коморбидности от 6 и выше предполагался повышенный риск летального исхода после операции. При значении индекса до 5 риск смерти считался незначительным. Чувствительность и специфичность полученной модели составляли 87% и 81%, соответственно.
Из 11 пациентов, оперированных на фоне сепсиса, 10 скончались после нефрэктомии в результате прогрессирования полиорганной недостаточности. При многофакторном анализе достоверным предиктором сепсиса до операции был только индекс коморбидности (AOR 2,74; 95% ДИ 1,4-5,3; p=0,003). При однофакторном анализе отмечена статически достоверная, средней силы связь длительной антибактериальной терапии с сепсисом (p<0,001, V Крамера = 0,45).
Неэффективность антибактериальной терапии в подавляющем большинстве случаев была обусловлена наличием полирезистентной флоры. Наиболее частым возбудителем была Klebsiella pneumoniae, наибольшую активность в отношении нее проявляли тигециклин и колистин, половина выделенных штаммов была устойчива к карбапенемам.
ОБСУЖДЕНИЕ
Как показало наше исследование и ряд других публикацией [9, 10], оптимальным методом диагностики воспалительных изменений почек у пациентов, находящихся на лечении гемодиализом, является МРТ-ДВИ, с которой целесообразно начинать обследование пациентов с ТХПН и подозрением на активное течение пиелонефрита.
Принимая во внимание, что у пациентов с уровнем СРБ более 95 мг/л или индексом коморбидности более 5 высока вероятность летального исхода после нефрэктомии, вполне очевидно, что для улучшения результатов лечения необходимо выполнять оперативное вмешательство до манифестации СВР.
Проведение системной антибактериальной терапии не целесообразно, во-первых, из-за того, что присутствие мочевых дренажей в верхних мочевых путях не позволит добиться полной элиминации инфекции, во-вторых инфекция мочевых путей у этой категории больных, как правило, обусловлена полирезистеной флорой, в-третьих, как показала наша работа, длительная антибактериальная терапия ассоциирована с развитием сепсиса, колита и инфекционно-воспалительными осложнениями со стороны послеоперационной раны [6].
Учитывая тот факт, что у пациентов, находящихся на лечении гемодиализом, в десятки раз выше риск развития сепсиса чем в общей популяции, принимая во внимание, что наиболее оптимальным методом лечения катетер-ассоциированной инфекции мочевых путей является избавление от постоянного катетера, а также учитывая результаты нашего исследования, мы считаем, что пациенты с постоянными мочевыми катетерами в почках после начала лечения гемодиализом должны быть подвергнуты нефрэктомии [6, 13]. Однако, у пожилых пациентов, с отягощенным соматическим статусом выполнять нефрэктомию необходимо по строгим показаниям, учитывая высокую летальность после операции даже в отсутствии СВР. Мы полагаем, что при латентном течении пиелонефрита должна приниматься выжидательная тактика, при появлении признаков СВР диагностику необходимо начинать с МРТ-ДВИ почек, при выявлении активного течения пиелонефрита необходимо минимизировать курс антибактериальной терапии и выполнять нефрэктомию.
В нашей работе на выбор между лапароскопической и открытой нефрэктомией влияли три фактора: характер операции (плановая или экстренная), степень коморбидности и опыт хирурга. На наш взгляд, основным преимуществом открытой нефрэктомии является быстрота выполнения, а соответственно более короткий период общей анестезии, что важно в условиях выраженной СВР и высокого индекса коморбидности, а преимуществом лапароскопического пособия – сокращение сроков стационарного лечения, быстрая послеоперационная реабилитация пациента. Ранее перенесенные вмешательства на почках, выраженность педункулита не являлись лимитирующим фактором для лапароскопического доступа, что согласуется с результатами исследования ряда авторов. Так, T. Manohar и соавт. в 2007 г провели, пожалуй, одно из самых крупных исследований, оценивающих результаты нефрэктомии у 178 пациентов с воспалительными заболеваниями почки, 84 пациента были прооперированы лапароскопическим доступом. Наиболее выраженный спаечный процесс в области почечной ножки авторы отметили при ксантогранулематозном пиелонефрите и туберкулезе. В тоже время при пионефрозе и калькулезном пиелонефрите почечная ножка была не так сильно изменена. Конверсия потребовалась в 8 случаях (аутосомно-доминантная поликистозная болезнь почек – 3, пионефроз – 2, ксантогранулематозный пиелонефрит и калькулезный пиелонефрит – 3). Кишечная непроходимость, потребовавшая лапаротомии и адгезинолиза, развилась у одного пациента в лапароскопической группе [14]. С целью снижения риска осложнений при массивном рубцово-спаечном процессе в области ворот почки, при вовлечение соседних органов ряд авторов предлагают выполнять лапароскопическую субкапсулярную нефрэктомию [15, 16]. М. Liang и соавт. предлагают выполнять нефрэктомию единым блоком с фасцией Герота без прецизионного выделения почечной ножки, отсекая ее сшивающим эндоскопическим аппаратом EndoGIA. Авторы прооперировали таким способом 33 пациента. У 17 больных показанием был хронический пиелонефрит (12 случаев на фоне МКБ), в 8 случаях - туберкулез почек, у 4 больных – пионефроз, у 3 – ксантогранулематозный пиелонефрит и одного больного – почечно-кишечный свищ. У трех пациентов потребовалась ручная ассистенция, в одном случае – конверсия [17].
Двумя основными факторами, которые в значительной степени увеличивали продолжительность стационарного лечения, были антибиотик-ассоциированный колит и инфекционно-воспалительные осложнения со стороны послеоперационной раны. Оба эти фактора были связаны с длительной предоперационной антибактериальной терапией, что еще раз подчеркивает необходимость ее минимизации по поводу осложненной инфекции мочевых путей у пациентов на гемодиализе.
ВЫВОДЫ
У пациентов с постоянными мочевыми дренажами в верхних мочевых путях, рецидивирующим течением пиелонефрита начало лечения гемодиализом должно рассматриваться как показание к нефрэктомии. Исключение составляют больные с высоким индексом коморбидности, для которых, в случае латентного течения пиелонефрита, может быть рассмотрена выжидательная тактика. Наиболее информативным методом диагностики пиелонефрита при ТХПН является МРТ-ДВИ. Результаты операции зависят от степени выраженности СВР и величины индекса коморбидности по Чарлсону. При СРБ выше 95 мг/л, индексе коморбидности более 5 прогнозируется высокая вероятность летального исхода после операции. Длительная антибактериальная терапия до операции ухудшает прогноз заболевания, достоверно ассоциирована с повышенным риском сепсиса, антибиотик-ассоциированного колита и инфекционно-воспалительными осложнениями со стороны послеоперационной раны. Лапароскопическая нефрэктомия по поводу воспалительных заболеваний почек у больных с ТХПН является безопасным и эффективным методом лечения.
ЛИТЕРАТУРА
- Schieppati A, Remuzzi G. Chronic renal diseases as a public health problem: epidemiology, social, and economic implications. Kidney Int Suppl 2005;(98):7-10. https://doi.org/10.1111/ j.1523-1755.2005.09801.x.
- Pipili C, Kiriakoutzik I, Petychaki F, Koutsovasili A. Nephrolithiasis-related end stage renal disease. Minerva Urol Nefrol 2013;65(2):101-7.
- Jungers P, Joly D, Barbey F, Choukroun G, Daudon M. ESRD caused by nephrolithiasis: prevalence, mechanisms, and prevention. Am J Kidney Dis 2004;44(5):799-805.
- Shoma AM, Eraky I, El-Kappany HA. Pretransplant native nephrectomy in patients with end-stage renal failure: assessment of the role of laparoscopy. Urology 2003;61(5):915-20. https://doi.org/10.1016/s0090-4295(02)02556-6.
- Rosenberg JC, Azcarate J, Fleischmann LE, McDonald FD, Menendez M, Pierce JM Jr, et al. Indications for pretransplant nephrectomy. Arch Surg 1973;107(2):233-41. https://doi.org/10.1001/archsurg.1973.01350200097022.
- Lo E, Nicolle LE, Coffin SE, Gould C, Maragakis LL, Meddings J, et al. Strategies to prevent catheter-associated urinary tract infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol 2014;35(2):32-47.
- Oikonomou KG, Alhaddad A. The Diagnostic Value of Urinalysis in Hemodialysis Patients with Fever, Sepsis or Suspected Urinary Tract Infection. J Clin Diagn Res 2016;10(10):11-13. https:// doi.org/10.7860/JCDR/2016/21992.8617.
- Petrucci I, Clementi A, Sessa C, Torrisi I, Meola M. Ultrasound and color Doppler applications in chronic kidney disease. J Nephrol 2018;31(6):863-879. https://doi.org/10.1007/s40620-018-0531-1.
- Caroli A, Schneider M, Friedli I, Ljimani A, De Seigneux S, Boor P, et al. Diffusion-weighted magnetic resonance imaging to assess diffuse renal pathology: a systematic review and statement paper. Nephrol Dial Transplant 2018;33(2):29-40. https://doi.org/10.1093/ndt/gfy163.
- Faletti R, Cassinis MC, Fonio P, Grasso A, Battisti G, Bergamasco L, et al. Diffusion-weighted imaging and apparent diffusion coefficient values versus contrast-enhanced MR imaging in the identification and characterisation of acute pyelonephritis. Eur Radiol 2013;23(12):3501-8. https://doi.org/10.1007/s00330-013-2951-6.
- Wolf JS Jr, Moon TD, Nakada SY. Hand assisted laparoscopic nephrectomy: comparison to standard laparoscopic nephrectomy. J Urol 1998;160(1):22-7.
- Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis 1987;40(5):373-83. https://doi.org/10.1016/0021-9681(87)90171-8.
- Sakhuja, A., Nanchal, R. S., Gupta, S., Amer, H., Kumar, G., Albright, R. et al. Trends and Outcomes of Severe Sepsis in Patients on Maintenance Dialysis. American journal of nephrology 2016:43(2);97–103. https://doi.org/10.1159/000444684.
- Manohar T, Desai M, Desai M. Laparoscopic nephrectomy for benign and inflammatory conditions. J Endourol 2007;21(11):1323-8. https://doi.org/10.1089/end.2007.9883.
- Xu Z, Xin M, Hong-Zhao L, Zhong C, Li LC, Ye ZQ. Retroperitoneoscopic subcapsular nephrectomy for infective nonfunctioning kidney with dense perinephric adhesions. BJU In 2004;94(9):1329-31. https://doi.org/10.1111/j.1464-410X.2004.05166.x.
- Hemal AK, Mishra S. Retroperitoneoscopic nephrectomy for pyonephrotic nonfunctioning kidney. Urology 2010;75(3):585-8. https://doi.org/10.1016/j.urology.2008.07.054.
- Ma L, Yu Y, Ge G, Li G. Laparoscopic nephrectomy outside gerota fascia and En bloc ligation of the renal hilum for management of inflammatory renal diseases. Int Braz J Urol 2018;44(2):280-287. https://doi.org/ 10.1590/S1677-5538.IBJU.2017.0363.







