Техника трансперинеального внедрения радиоактивных частиц в предстательную железу впервые была применена в 1985 г. John Blasko совместно с Haakon Ragde в Северо-Западном госпитале в Сиэтле. Они адаптировали уже существовавший на тот момент метод, и использовали его для лечения РПЖ (Blasko J.C., 2002).
В конце 80-х годов прошлого века, когда в США был широко внедрен скрининг РПЖ при помощи измерения уровня ПСА среди правительственных организаций и институтов, например, в Национальном институте рака, возникло беспокойство. Оно было обусловлено тем, что среди сотен тысяч пациентов, перенесших РПЭ по поводу РПЖ, наблюдался высокий уровень осложнений, а смертность была сравнима с онкоспецифической смертностью (Blasko J.C., 2002, Grimm P.D., 2001).
Когда брахитерапия пришла в США, это был единственный минимально-инвазивный способ лечения РПЖ (Blasko J.C., 2002). Существует огромное количество исследований, посвященных брахитерапии, и все они говорят о высокой эффективности и приемлемом профиле осложнений, что и обеспечило быстрое принятие брахитерапии на вооружение.
В настоящее время для выполнения брахитерапии применяется несколько радиоактивных изотопов. Первым из них был I-125, который используется уже на протяжении нескольких десятилетий (Blasko J.C., 2003, Sylvester J., 2000). В 80-е годы XX века стал доступен к применению Pd-103, хотя существовали некоторые трудности его внедрения в клиническую практику вплоть до 1990-х гг., связанные, в том числе, с логистикой доставки и быстрым периодом распада препарата (Cavanagh W., 2000, Sylvester J., 1999, Blasko J.C., 2000, Ragde H., 1997). С 1965 г. появился изотоп Cs-137. Причина, по которой он считается потенциально очень важным для брахитерапии – это сочетание проникающей в ткани энергии изотопа, что является важным показателем для определения радикальности лечения, и безопасностью, связанной с коротким временем полураспада (таблица 1).
Изотоп Сs-131
Почему же Сs-131 – это не просто очередной изотоп для брахитерапии РПЖ? Когда мы говорим о короткоживущем изотопе для брахитерапии, какие преимущества перед долгосрочной брахитерапией мы имеем в виду? Радиобиологи, говоря об опухоли, в первую очередь обращают внимание на массу клеток, бесконтрольно делящуюся и увеличивающуюся в объеме. Брахитерапия – это внедрение радиоактивного изотопа в опухоль (Cavanagh W.,1997). Она позволяет доставить большую дозу облучения непосредственно в ткань новообразования. Однако, до получения летальной дозы ионизирующей радиации, клетки опухоли все еще могут продолжать делиться и расти.
У каждого вида опухоли есть определенная скорость роста. И чем она выше, тем чувствительнее опухоль к облучению. Существуют различные модели для описания этой зависимости. Если после имплантации радиоактивных зерен опухоль увеличилась в размерах, это означает, что на 1 г ее ткани придется меньшая доза облучения. Если опухоль растет быстро, то биологически активная доза облучения, полученная при брахитерапии, будет уменьшаться. Для I-125, который принят в качестве «золотого стандарта», биологически эффективная доза, в основном, близка к необходимой только в случае, если опухоль растет очень медленно (Cavanagh W., 1996). Для Au - 95 биологически эффективная доза также эквивалентна предписанной только для медленно растущей опухоли (рисунок 1).
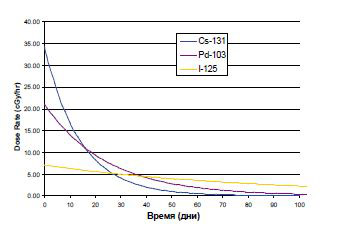
Рисунок 1. Изменение мощности дозы по времени
В случае быстрого роста опухоли, она получает только часть той дозы облучения, которая необходима для ее подавления. Именно поэтому мы должны использовать высокоэнергетические изотопы с коротким периодом полураспада. Такой подход основан на радиобиологии опухолевой ткани. Уровень излучаемой изотопом энергии имеет квадратичную зависимость, и с этих позиций короткоживущие изотопы обладают преимуществом, потому что они обеспечивают более быструю доставку биологически активной дозы в ткань (Blasko J.C., 1995).
Сегодня клинический опыт применения Cs-131 насчитывает более 1000 пациентов. В одном из исследований в период с 2004 по 2006 гг. приняли участие 100 пациентов с локализованным РПЖ. Им была произведена имплантация Cs-131. Исходный уровень ПСА был менее 20 нг/мл, а сумма баллов по Глисону не превышала 7. Анализ данных показал, что уровень биохимического контроля составил 97,9% при сроке наблюдения в 60 месяцев (рисунок 2).
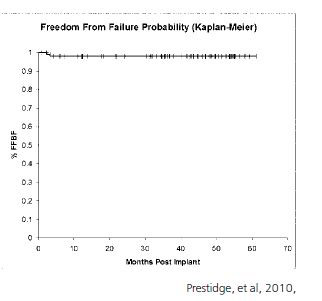
Рисунок 2. Пятилетние результаты биохимического контроля после перманентной брахитерапии Cs-131
И это очень хороший показатель, свидетельствующий о высокой эффективности данного метода (Cavanagh W., 2010).
Среди 100 пациентов мы наблюдали только 2 случая рецидива заболевания. У этих мужчин, также, как и у всех остальных, наблюдалось резкое снижение уровня ПСА. Однако через 2-3 месяца после имплантации вновь был отмечен рост его уровня. Оба пациента входили в группу высокого риска и имели сумму баллов по Глисону равную 7, и предоперационный уровень ПСА 13-14 нг/мл. Поэтому, такие результаты лечения у этих больных были, в какой-то степени, ожидаемы (Cavanagh W., 2010).
Существует множество исследований, в которых специалисты в области радиационной онкологии детально изучают время полураспада, энергию изотопов, их преимущества/недостатки с точки зрения радиобиологии. Многие из этих факторов в брахитерапии никак не связаны с клиническим применением метода.
В 2010 г. Moran провел исследование по брахитерапии Cs-131 у пациентов с РПЖ промежуточного риска. Это исследование показало очень хорошие результаты. Биохимическая безрецидивная выживаемость в течение 4 лет составила 91%. Появляющиеся новые данные подтверждают высокий уровень эффективности и низкую частоту осложнений монотерапии Cs-131 (Moran, 2010).
Вывод Популярность брахитерапии заключается в том, что это минимально-инвазивная техника лечения РПЖ, с небольшим числом осложнений, особенно по сравнению с радикальной простатэктомией. Результаты новейших исследований показывают, что брахитерапия может стать не только альтернативой хирургическому вмешательству, но и выступать в качестве адъювантной терапии. Это принципиально новый подход, суть которого заключается в размещении радиоактивных зерен по краю резекции органа, что значительно улучшает локальный контроль над опухолью. Подобные работы были проведены при раке легких, однако, я считаю, что в скором будущем могут появиться подобные исследования и среди больных РПЖ. Исключая урологию, другой областью применения брахитерапии является нейроонкология, в частности, лечение глиобластомы. Брахитерапия также применяется при локализованном раке молочной железы. В результате проведенных исследований «органосберегающая» лучевая терапия с имплантацией источников Cs-131 показал себя эффективным и безопасным методом лечения локализованного рака.
Ключевые слова: рак предстательной железы, брахитерапия, Cs-131, Pd-103. Keywords:cancer prostate, brachytherapy, Cs-131, Pd-103.






