Рак предстательной железы (РПЖ) наиболее распространенное злокачественное новообразование у мужчин. Тенденция к увеличению продолжительности жизни населения в развитых странах, современные диагностические медицинские технологии и результат работы скрининговых программ по ранней выявляемости злокачественных новообразований являются основными причинами прогрессивного прироста уровня заболеваемости РПЖ в индустриально развитых странах, в том числе и России, с достижением уровня заболеваемости более 30 на 100 тыс. мужского населения [1, 2].
Пик заболеваемости РПЖ приходится на возрастную категорию 70 – 75 лет и выше. Ожидаемая продолжительность жизни менее 10 лет и выраженная соматическая патология ограничивают использование радикальной простатэктомии и наружной лучевой терапии.
Оптимизация существующих и поиск новых малоинвазивных методов лечения, которые отличаются малой травматичностью, быстротой проведения, сокращением времени проведения или отсутствием необходимости анестезиологического пособия, а также позволяющих достичь максимальной эффективности и радикальности без существенного снижения качества жизни является одной из актуальных задач современной медицины.
В последние годы отмечается повышенный интерес врачей различных специальностей к новой отрасли медицины – эндоваскулярной хирургии, называемой так же рентгенохирургией или интервенционной радиологией. Основа данного направления была заложена в 50-ые годы прошлого столетия С. Сельдингером, разработавшим методику чрезкожной пункции кровеносного сосуда с последующей его катетеризацией. Достоинствами эндоваскулярных вмешательств являются минимальная инвазивность, низкий операционный риск, сокращение времени восстановительного периода, отсутствие необходимости в проведении анестезиологического пособия, возможность проведения у пожилых людей и у пациентов с тяжелой соматической патологией.
Первоначально использование эндоваскулярной эмболизации в урологической практике нашло свое применение при купировании опасных для жизни кровотечений из мочевого пузыря и предстательной железы (ПЖ). Эмболизация артерий ПЖ использовалась в течение многих лет для остановки кровотечения в связи с прогрессирующим РПЖ, а также для остановки кровотечения после операций на ПЖ [3].
Эмболизация артерий ПЖ при доброкачественной гиперплазии предстательной железы (ДГПЖ) показала хорошую эффективность и безопасность, что подтверждено исследованиями отечественных и зарубежных авторов [4, 5, 6, 7, 8].
Основным источником кровоснабжения ПЖ является нижняя пузырная артерия – ветвь внутренней подвздошной артерии, от которой к железе отходит от 2 до 5 и более артерий. Дополнительными источниками являются ветви средней прямокишечной, внутренней половой и запирательной артерий (рис 1).
Возможности суперселиктивной катетеризации мелких артериальных сосудов позволяют не только проводить эмболизацию, но и вводить лекарственные препараты непосредственно в ткань органа.
Химиоэмболизация (ХЭ) – это инновационный метод лечения злокачественных новообразований различной локализации, сочетающий в себе эмболизацию артерии, питающей опухол, эмболизирующим материалом, в состав которого введен противоопухолевый препарат.
Целью данного исследования явилась оценка эффективности и безопасности проведения суперселективной рентгенэндоваскулярной химиоэмболизации у пациентов с локализованным раком предстательной железы.
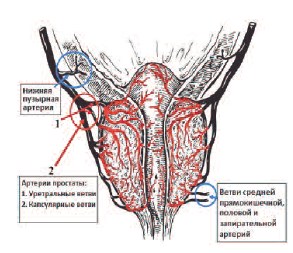
Рис. 1. Кровоснабжение предстательной железы
МАТЕРИАЛЫ И МЕТОДЫ
ХЭ артерий ПЖ выполнялась под местной анестезией трансфеморальным доступом по методике Сельдингера. Под рентгеновским контролем проводилась суперселективная катетеризация ветвей внутренней подвздошной артерии (ВПА) поочередно с обеих сторон с последующей химиоэмболизацией сосудов, питающих ПЖ, путем введения химиопрепарата и полимерных микросфер (рис. 2, 3, 4). Химиопрепаратом для проведения данной процедуры служил веромитомицин в дозировке 20 мг. В качестве источника транспортировки химиопрепарата применялись микросферы HepaSphere™ (Гепасферы) – это новейший эмболизационный материал размером микросфер 300-500 мкм и высокими абсорбционными свойствами, производимый компанией Biosphere Medical (Франция).
На базе отделения рентгеноперационных методов диагностики и лечения Краевой клинической больницы в период с 2011 по 2014 гг. проведено лечение 36 пациентов с РПЖ методом рентгенэндоваскулярной химиоэмболизации. Все пациенты имели верифицированный РПЖ: стадии T2а – 6 пациентов и стадии T2с – 30 пациентов. Средний возраст пациентов составил 72,3±2,06 года. Все пациенты имели выраженную сопутствующую патологию, что являлось препятствием к выполнению радикальных методов лечения. Уровень простатспецифического антигена (ПСА) колебался от 0,8 до 17 нг/мл, средний – 13,1±3,9 нг/мл. Объем ПЖ был от 41 до 93 см3 (средний – 59±9,3 см3). Отсутствие генерализации опухолевого процесса подтверждено результатами магнитнорезонансной томографии, ультразвуковым исследованием внутренних органов и ПЖ, остеосцинтиграфией, рентгенографией или компьютерной томографией легких.
Противопоказаниями для выполнения суперселективной химиоэмболизации явились:
- непереносимость рентгенконтрастных веществ;
- наличие острых инфекционновоспалительных заболеваний;
- декомпенсированная патология внутренних органов (сердечно-сосудистой системы, паренхиматозных органов);
- декомпенсированная патология эндокринной системы;
- нарушения сердечного ритма независимо от причины;
- тяжелая форма бронхиальной астмы;
- состояние после перенесенного инфаркта миокарда или острого нарушения мозгового кровообращения в срок до 6 месяцев;
- наличие флотирующих тромбов в бассейне вен нижних конечностей;
- анемия;
- окклюзионно-стенотические поражения подвздошных сосудов;
- аномалии анатомического строения подвздошных сосудов, не позволяющие выполнить операцию.
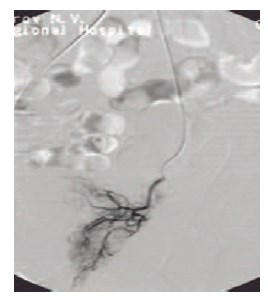
Рис. 2. Ангиографический катетер подведен суперселективно к простатическим ветвям нижней мочепузырной артерии
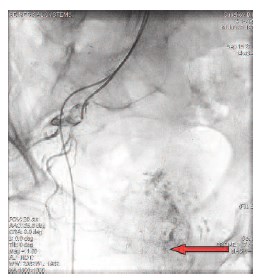
Рис. 3. Выполнена химиоэмболизация слева (зеленая стрелка). Суперселективная катетеризация простатических артерий справа (красная стрелка)
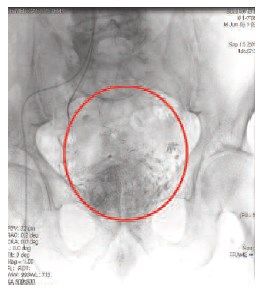
Рис. 4. Накопление химиоэмболизата в тканях предстательной железы
До проведения ХЭ 8 пациентов получали антиандрогенную терапию в монорежиме, 4-м – была выполнена хирургическая кастрация. У 24 (66,6%) пациентов отмечены симптомы нарушения функции нижних мочевыводящих путей, у 4-х – имелись цистостомические дренажи.
Срок наблюдения за больными после ХЭ составил от 3 до 24 месяцев. Результаты лечения оценивалась по динамике уровня ПСА в сыворотке крови, данным трансректального ультразвукового исследования ПЖ (степень редукции объема ПЖ, ее эхоструктура и васкуляризация), анкетирования по международной системе суммарной оценки симптомов при заболеваниях простаты (IPSS), данным урофлоуметрии. Контрольными точками для оценки эффективности лечения стали: 1, 3, 6, 9, 12, 18 и 24 месяца. 16 (44,4%) пациентам выполнена контрольная трансректальная мультифокальная биопсия ПЖ.
Для статистической обработки результатов исследования использовали пакеты программ «МС EXEL» и «STATISTICA 6,0». Показатель достоверности различий (р) определялся с использованием критерия Стьюдента. Различия оценивались как достоверные при вероятности 95% (р < 0,05) и выше.
РЕЗУЛЬТАТЫ
Положительный эффект от проведения суперселективной рентгенэндоваскулярной химиоэмболизации достигнут у 30 (83,3%) пациентов. Объективный ответ получен по результатам снижения уровня ПСА, уменьшения объема ПЖ по данным трансректального ультрозвукового исследования и улучшения качества мочеиспускания. Снижение уровня ПСА отмечено уже через один месяц после проведения химиоэмболизации, при этом средний уровень составил 9,2±0,8 нг/мл. Максимальное снижение уровня ПСА отмечено к 6-му месяцу после проведения химиоэмболизации. Медиана ПСА через 6 месяцев составила 3,4±0,02 нг/мл. При дальнейшем наблюдении было выявлено достоверное снижение уровня ПСА до 60 % от первоначального уровня (p < 0,05).
Достоверное уменьшение объема ПЖ отмечено через 3 месяца после химиоэмболизации (р < 0,05) и составило 49,1% от первоначального (29,6±4,8 см3). Среднее значение объема ПЖ через 1 месяц – 39,8±8,6 см3. На протяжении всего периода наблюдения значимого увеличения объема ПЖ не наблюдалось (рис. 5).
Через 6 месяцев после ХЭ определялись следующие эхографические признаки: нечеткие, неровные контуры ПЖ, усиление неоднородности эхоструктуры за счет участков неравномерного повышения эхогенности. У всех пациентов, у которых наблюдался положительный эффект от проведения ХЭ, не выявлялись участки с гиперваскуляризацией ПЖ.
После проведения химиоэмболизации отмечено улучшение качества мочеиспускания, что подтверждается данными урофлоуметрии и оценкой симптомов нижних мочевыводящих путей по шкале IPSS (табл. 1).
Таблица 1. Динамика максимальной скорости мочеиспускания и баллов суммарной оценки симптомов нарушения функции нижних мочевыводящих путей после ХЭ
| Показатели | Сроки лечения | ||||
|---|---|---|---|---|---|
| До лечения | 3 месяца | 6 месяцев | 12 месяцев | 24 месяца | |
| Qmax (мл/сек) |
9,6±2,2 | 14,6±0,8 |
15,8±1,2 |
15,2±0,6 |
14,8±0,4 |
| р |
0,031 |
0,024 |
0,028 |
0,030 |
|
| IPSS (баллы) |
12,8±1,6 | 8,6±0,4 |
5,8±0,9 |
6,2±0,4 |
6,4±0,5 |
| р | 0,041 | 0,018 | 0,022 | 0,024 | |
* р – уровень значимости различия между показателями до лечения и в различные сроки после лечения
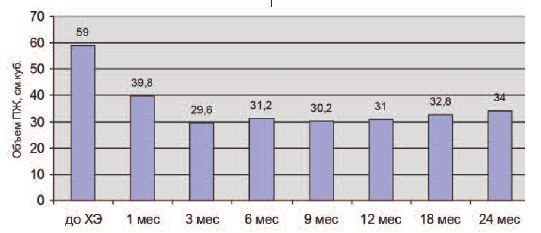
Рис. 5. Динамика объема ПЖ по результатам ТРУЗИ
У всех пациентов, имеющих обструктивную симптоматику, отмечено улучшение мочеиспускания. Максимальное улучшение показателей Qmax и баллов IPSS наблюдалось через 6 месяцев после ХЭ. При дальнейшем наблюдении не было отмечено ухудшения мочеиспускания. Всем пациентам, имеющим цистостомические дренажи, восстановлено самостоятельное мочеиспускание. Одному пациенту перед удалением цистостомы выполнена биполярная трансуретральная резекция ПЖ.
В первые 10 дней после химиоэмболизации у 18 (50%) пациентов наблюдался болевой синдром, не требующий применения наркотических анальгетиков; у 8 (22,2%) – гипертермия, у 6 (16,6%) – лейкоцитоз, ускорение СОЭ. У одного (2,7%) пациента отмечена гематома небольших размеров в области пункции бедренной артерии, не потребовавшая хирургического вмешательства. Через 14 дней после проведения химиоэмболизации у одного пациента мы наблюдали ишемию и частичный некроз головки полового члена. Данное состояние купировано консервативными методами. Других осложнений не было.
Через 12 месяцев 16 пациентам выполнена контрольная биопсия, по результатам которой в 12 случаях наблюдался фиброз и дистрофия эпителия без признаков атипии, в 2-х – лечебный патоморфоз. В двух препаратах сохранялась картина мелкоацинарной аденокарциномы без клинической прогрессии заболевания (рис. 6, 7).
У 6 пациентов, перенесших ХЭ, не было достигнуто положительного эффекта, что связано с трудностями транспортировки химиоэмболизата в ткань ПЖ в связи с особенностями кровообращения ПЖ (разветвленная сосудистая сеть). Неэффективность ХЭ оценивалась во время самой процедуры (отсутствие достаточного накопления химиоэмболизата в ткани ПЖ на контрольных ангиограммах). Этим пациентам предложены другие варианты лечения.
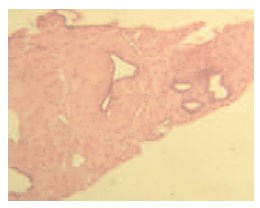
Рис. 6. Морфологические изменения в ткани ПЖ после химиоэмболизац: фиброзная ткань, в которой встречается единичные и группы простатических мелких желез с атрофией эпителия без атипии, очаговые лимфоидные инфильтраты
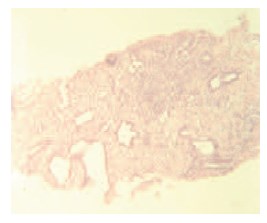
Рис. 7. Биопсия ПЖ: аденокарцинома, сумма баллов по Глисону – 4
ОБСУЖДЕНИЕ
Проблема лечения пациентов с РПЖ, имеющих выраженную сопутствующую патологию и не подлежащих радикальному лечению и/или гормональной терапии, является актуальной в онкоурологии. На сегодняшней день таким пациентам предлагаются альтернативные методы лечения, такие как HIFU-терапия, криотерапия и радиочастотная аблация. Химиоэмболизация при РПЖ является довольно новым и эффективным методом лечения, расширяющими возможности медицинской помощи различным группам пациентов. Опыт химиоэмболизации при РПЖ показал эффективность и безопасность ее применения у пациентов, не подлежащих радикальному лечению.
Возникновение методики химиоэмболизации было бы невозможно без использования всей совокупности научных и клинических исследований, проводившихся учёными на протяжении столетий в области других методик. По сути химиоэмболизация в ее современном виде возникла на основе опыта внутрисосудистых исследований, интервенционной радиологии, системной химиотерапии и эмболотерапии.
Разработка метода внутриартериальной регионарной химиотерапии проводилась еще в 70-е годы XX столетия [9]. Показаниями к ней считались местнораспространенные опухоли, рецидивы в зоне первичной опухоли или региональных лимфатических узлах, а также единичные отдаленные метастазы, выявленные после хирургического лечения. При раке прямой кишки проводили внутриартериальную инфузию 5-фторурацила в нижнюю брыжеечную артерию перед оперативным лечением [10], а также длительную инфузию адриабластина и 5-фторурацила в верхнюю прямокишечную артерию [11]. Такая терапия улучшала абластичность хирургического вмешательства и снижала риск метастазирования [12].
Популярность метода ХЭ обусловливается малой травматичностью, а также низкой частотой осложнений. Однако для получения максимального эффекта от химиоэмболизации необходимо учитывать такие показатели как тип опухоли, ее происхождение, локализацию, чувствительность пораженной ткани к химиопрепаратам, а также тип и количество эмболизирующего носителя препарата.
Исследования последних лет продемонстрировали хороший и стойкий эффект от проведения эмболизации артерий ПЖ при ДГПЖ. Достижения интервенционной хирургии при ДГПЖ позволили разработать новый метод лечения РПЖ, связанный с суперселективной катетеризацией артерий ПЖ и введением в ткань ПЖ химиопрепарата совместно с эмболизирующим материалом, что позволяет непосредственно воздействовать на опухолевые клетки и значительно уменьшать кровоток в ПЖ. Для оценки онкологических результатов химиоэмболизации при РПЖ необходимо большее количество пациентов и более длительный период наблюдения.
ЗАКЛЮЧЕНИЕ
На сегодняшний день методика химиоэмболизации получила широкое распространение при лечении опухолей различной локализации. Это объясняется ее эффективностью, т.к. химиоэмболизация сочетает в себе механизмы регионарной химиотерапии и эмболизации питающих опухоль сосудов, ведущей к ишемии и некрозу пораженной ткани. Первый опыт химиоэмболизации при локализованном РПЖ показал эффективность и безопасность применения у пациентов, не подлежащих радикальному лечению.
ЛИТЕРАТУРА
- Состояние онкологической помощи населению России в 2013 году [Под ред. Каприна А.Д., Старинского В.В., Петровой Г.В.] М., 2015. Табл. 7.
- Bolla M, Collette L, Blank L, Warde P, Dubois JB, Mirimanoff RO, Storme G, Bernier J, Kuten A, Sternberg C, Mattelaer J, Lopez Torecilla J, Pfeffer JR, Lino Cutajar C, Zurlo A, Pierart M. Longterm results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. // Lancet. 2002. Vol. 360, N. 9327. P. 103-106.
- Jeong CW, Park YH, Ku JH, Kwak C, Kim HH. Minimally invasive management of postoperative bleeding after radical prostatectomy: transarterial embolization. // J Endourol. 2010. Vol. 24, N. 9. P. 1529-1533.
- Pisco JM, Pinheiro LC, Bilhim T, Duarte M, Mendes JR, Oliveira AG. Prostatic arterial embolization to treat benign prostatic hyperplasia. // J Vasc Interv Radiol. 2011. Vol. 22, N. 1. Р. 11–19.
- Е. А. Яковец, А. И. Неймарк, А. А. Карпенко, Я. В. Яковец. Эмболизация артерий предстательной железы в лечении больных аденомой предстательной железы с высоким хирургическим риском. // Андрология и генитальная хирургия. 2010. № 1. С. 38–43.
- Carnevale FC, Motta Leal Filho JM, Antunes AA, Cerri LM, Baroni RH, Marcelino AZ. Quality of life and symptoms relief support prostatic artery embolization for patients with acute urinary retention due to benign prostatic hyperplasia. // J Vasc Interv Radiol. 2012. Vol. 23, N. 3. P. 4.
- Pisco JM, Rio Tinto H, Campos Pinheiro L, Bilhim T, Duarte M, Fernandes L, Pereira J, Oliveira AG. Embolisation of prostatic arteries as treatment of moderate to severe lower urinary symptoms (LUTS) secondary to benign hyperplasia: results of shortand midterm follow-up. // Eur Radiol. 2013. Vol. 23, N. 9. P. 2573-2574.
- Gao YA, Huang Y, Zhang R, Yang YD, Zhang Q, Hou M, Wang Y. Benign prostatic hyperplasia: prostatic arterial embolization versus transurethral resection of the prostate-a prospective, randomized, and controlled clinical trial. // Radiol. 2014. Vol. 270, N. 3. P. 920-928.
- Гаспарян С.А., Островерхов Г.Е., Трапезников Н.Н. Региональная длительная внуриартериальная химиотерапия злокачественных опухолей. М.: Медицина, 1979. 208 c.
- Мосидзе Б.А. Пути улучшения комбинированного лечения рака прямой кишки. Автореф. дисс. … д-ра мед. наук. Л.,1987. 29с.
- Югринов О.Г., Троицкий И.Л., Браун Е.М. Предоперационная внутриартериальная химиотерапия в комбинированном лечении местнораспространенного рака прямой кишки. Украинский реферативный журнал. 1993. №. 1. С. 48–50.
- Таразов П.Г. Опухоли желудка и кишечника. // В кн.: Интервенционная радиология в онкологии (пути развития и технологии) [Под ред. Гранова А.М., Давыдова М.И.]. СПб.: Фолиант, 2007. С. 275–281.







