Органосохраняющая хирургия локализованного рака почки с предварительной суперселективной эмболизацией ветви почечной артерии, питающей опухоль DOI: 10.29188/2222-8543-2023-16-2-44-51
- Попов С.В. – д.м.н., главный врач СПб ГБУЗ Клиническая больница Святителя Луки; профессор кафедры урологии ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова»; Санкт-Петербург, Россия; РИНЦ Author ID 211507; https://orcid.org/0000‑0003‑2767‑7153
- Гусейнов Р.Г. – к.м.н., заместитель главного врача по научной деятельности СПб ГБУЗ Клиническая больница Святителя Луки; ассистент кафедры госпитальной хирургии Санкт-Петербургского государственного университета; Санкт-Петербург, Россия; РИНЦ Author ID 1083364; https://orcid.org/0000‑0001‑9935‑0243
- Орлов И.Н. – к.м.н., заместитель главного врача по медицинской части СПб ГБУЗ Клиническая больница Святителя Луки; Санкт-Петербург, Россия; РИНЦ AuthorID 105712; https://orcid.org/0000‑0001‑5566‑9789
- Винцковский С.Г. – заведующий отделением рентгенохирургических методов диагностики и лечения СПб ГБУЗ Клиническая больница Святителя Луки; Санкт-Петербург, Россия
- Помешкин Е.В. – к.м.н., заведующий урологическим отделением №2 СПб ГБУЗ Клиническая больница Святителя Луки; Санкт-Петербург, Россия; РИНЦ AuthorID 910313; https://orcid.org/0000‑0002‑5612‑1878
- Скрябин О.Н. – д.м.н., профессор; главный онколог СПб ГБУЗ Клиническая больница Святителя Луки, научный руководитель центра эндоскопической урологии и новых технологий; Санкт-Петербург, Россия; РИНЦ AuthorID 437531; https://orcid.org/0000‑0002‑6664‑2861
- Неймарк Б.А. – д.м.н., профессор кафедры урологии и андрологии с курсом ДПО ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России; Барнаул, Россия; РИНЦ AuthorID 737759; https://orcid.org/0000‑0001‑8009‑3777
- Перепелица В.В. – к.м.н., врач-уролог СПб ГБУЗ Клиническая больница Святителя Луки; Санкт-Петербург, Россия; РИНЦ AuthorID 1125078; https://orcid.org/0000‑0002‑7656‑4473
- Архипов А.Н. – врач по рентгенэндоваскулярным диагностике и лечению СПб ГБУЗ Клиническая больница Святителя Луки; Санкт-Петербург, Россия
- Мирзабеков М.М. – врач-уролог СПб ГБУЗ Клиническая больница Святителя Луки; Санкт-Петербург, Россия; https://orcid.org/0000‑0001‑5792‑1589
- Катунин А.С. – врач-уролог СПб ГБУЗ Клиническая больница Святителя Луки; Санкт-Петербург, Россия; РИНЦ AuthorID 1103007; https://orcid.org/0000‑0003‑3676‑6246
- Сивак К.В. – д.б.н., ведущий научный сотрудник СПб ГБУЗ Клиническая больница Святителя Луки; заведующий отделом доклинических исследований ФГБУ Научноисследовательский институт гриппа им. А.А. Смородинцева; Санкт-Петербург, Россия; РИНЦ AuthorID 546323; https://orcid.org/0000‑0003‑4064‑5033
- Буненков Н.С. – научный сотрудник СПб ГБУЗ Клиническая больница Святителя Луки; врач-хирург НИИ детской онкологии, гематологии и трансплантологии имени Р.М. Горбачевой ФГБОУ ВО Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова Минздрава России; Санкт-Петербург, Россия; РИНЦ AuthorID 884269
- Улитина А.С. – к.м.н., старший научный сотрудник СПб ГБУЗ Клиническая больница Святителя Луки; старший научный сотрудник отдела молекулярно-генетических и нанобиологических технологий ФГБОУ ВО Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова Минздрава России; Санкт-Петербург, Россия; РИНЦ AuthorID 153529; https://orcid.org/0000‑0003‑3011‑1812
 726
726 ВВЕДЕНИЕ
При хирургическом лечении локализованного почечно-клеточного рака (ПКР) одним из двух методов выбора является резекция почки, онкологические результаты которой, по данным многих исследователей, полностью сопоставимы с таковыми для радикальной нефрэктомии (РНЭ), которая считается «золотым стандартом» оперативного лечения ПКР. У лиц, перенесших РНЭ, ожидаемым, неизбежным и важнейшим следствием удаления почки становится защитно-приспособительная гиперфункция нефронов парного органа. Однако этот универсальный механизм не всегда приводит к компенсации функций удаленной почки [1–6]. После резекции почки (парциальной нефрэктомии) вероятность формирования почечной недостаточности также имеет место, но ее причиной является не хирургически обусловленная утрата функционирующих нефронов, а ишемически-реперфузионная альтерация сохраняемого во время вмешательства клубочково-канальцевого аппарата, вызванная тепловой ишемией почки (ТИП) элемента резекции почки, применяемого с целью уменьшения интраоперационной паренхиматозной кровопотери, получения качественной визуализации операционного пространства, облегчения доступа к полостной системе и ушивания паренхимы в области ложа резецируемой опухоли [7–10]. Традиционной методикой создания ТИП считается интраоперационное пережатие почечной артерии с тотальным обескровливанием органа. В таких случаях формируются условия для ишемически-реперфузионного поражения максимально возможной массы нефронов с прямой зависимостью степени этого поражения от продолжительности ТИП. В настоящее время задача снижения риска развития ТИП-ассоциированного ишемическиреперфузионного поражения при органосберегающем лечении локализованного ПКР сохраняет свою актуальность. В качестве одного из решений этой задачи сейчас рассматривается технология селективного обескровливания новообразования, подлежащего иссечению, или части почки, в которой расположено это новообразование, путем суперселективной эмболизации (ССЭ) сегментарного сосуда, питающего опухоль [11–13].
Согласно данным В.В. Базаева и соавт., А.В. Максимова и соавт., В.Л. Асташова и соавт., других исследователей, ССЭ ветвей почечной артерии, кровоснабжающих злокачественное новообразование, является эффективным инструментом интраоперационного гемостаза во время резекции почки. Использование ССЭ практически полностью исключает необходимость ТИП и при этом позволяет выполнить органосохраняющее иссечение опухоли не только низкой, но и средней сложности с результатом нефрометрии по шкале R.E.N.A.L, равным или превышающим 6 баллов, уменьшить продолжительность самого вмешательства и периода реабилитации [14–20].
В нашем лечебном учреждении – Санкт-Петербургское государственное бюджетное учреждение здравоохранения Клиническая больница Святителя Луки (КБ Святителя Луки) – внедрение в практику хирургического лечения ПКР технологии ССЭ артериальных сосудов, питающих опухоль, стало возможным после открытия в апреле 2022 г. на базе КБ Святителя Луки отделения рентгенхирургических методов диагностики и лечения (РХМДиЛ), оснащенного современным ангиографическим стационарным комплексом экспертного класса GE Discovery IGS 7 в составе гибридной операционной. В течение трех месяцев, прошедших после этого события, в гибридной операционной отделения РХМДиЛ иссечение злокачественного новообразования ренальной паренхимы после предварительной ССЭ ветвей почечной артерии было выполнено у трех пациентов с ПКР.
Целью данной работы явилась оценка результатов органосохраняющего лечения ПКР в условиях ССЭ сегментарного сосуда, питающего опухоль.
МАТЕРИАЛЫ И МЕТОДЫ
За период с мая по июль 2022 г. в условиях гибридной операционной отделения рентгенхирургических методов диагностики и лечения КБ Святителя Луки специалистами отделений урологии и РХМДиЛ трем пациентам мужского пола с локализованным раком почки была проведена лапароскопическая резекция содержащей новообразование ренальной ткани. В начале, на первом этапе каждого из вмешательств, в целях предупреждения интраоперационного кровотечения всем пациентам выполнялась ССЭ ветви почечной артерии, питающей злокачественную опухоль. Затем, на втором этапе, не выводя больного из операционной, осуществляли лапароскопическую резекцию почки (ЛРП) с временной баллонной окклюзией ствола почечной артерии без тотальной механической ТИП. Показанием к вмешательству считали наличие солитарного образования со стволовым типом кровоснабжения. За критерии исключения из исследования принимали нарушение функции почек, неконтролируемую медикаментозно гиперфункцию щитовидной железы и непереносимость йода. Пациенты были в возрасте 62 , 48 и 54 лет, в среднем 54,7±7,0 лет.
Обследование перед началом лечебных мероприятий включало в себя ультразвуковое исследование (УЗИ) почек и надпочечников, компьютерную томографию (КТ) мочевыделительной системы (МВС), органов брюшной полости и грудной клетки, электрокардиографию, лабораторные исследования клеточного и биохимического состава крови и мочи, осмотр терапевта и проведение онкологического консилиума. Кроме того, выполнялось прижизненное патологоанатомическое (гистологическое) исследование операционного материала – резецированной части почечной паренхимы, содержащей злокачественное разрастание.
У каждого из пациентов новообразование, послужившее поводом для оперативного лечения, было выявлено при предоперационном ультразвуковом исследовании (УЗИ) почек и надпочечников и компьютерной томографии (КТ) МВС. У двух пациентов в возрасте 62 и 48 лет опухоль находилась в области передней поверхности верхнего сегмента левой почки, у одного 56-летнего больного – в области задней поверхности правой почки. Размеры новообразований составили 45 х 56 х 38 мм, 24 х 28 х 22 мм и 43 х 58 х 46 мм соответственно. Расстояние между почечным синусом и опухолью у одного пациента из трех превышало 7 мм, у двух других – находилось в пределах 4–7 мм. Показатели нефрометрии по шкале R.E.N.A.L равнялись 9, 6 и 7 баллам соответственно. У всех пациентов хирургические вмешательства проводились в плановом порядке. Средние значения количественных переменных представлены в виде (М ± σ), где М – среднее арифметическое, σ – стандартное отклонение.
РЕЗУЛЬТАТЫ
ЛРП с предварительной ССЭ артерии, питающей опухоль, всем пациентам проводилась в один операционный сеанс двухэтапно. На первом этапе выполнялась ССЭ, на втором – непосредственно иссечение фрагмента ренальной паренхимы, содержащей злокачественное новообразование.
Продолжительность ССЭ колебалась от 36 мин до 62 мин, в среднем 47,7 ± 13,2 мин; время ЛРП – от 120 до 148 мин, в среднем 134,0 ± 14,0 мин. Во время ЛРП ни у одного из пациентов не потребовалось конверсии в открытое хирургическое вмешательство, отсутствовала необходимость в тотальном обескровливании органа, так как эндоваскулярная окклюзия обеспечивала достаточно высокое качество визуального контроля операционных действий при сравнительно низком объеме интраоперационной кровопотери: для каждого из троих пациентов 34 мл, 50 мл и 72 мл, в среднем 52,0 ±19,1 мл.
При гистологическом исследовании операционного материала в каждом из случаев был верифицирован ПКР в стадии Т1 с отсутствием признаков положительного хирургического края.
Период наблюдения после выполнения ССЭ и ЛРП составил 3 месяца. За это время ни у одного из участников не было выявлено признаков послеоперационных осложнений, ассоциированных с ССЭ (транзиторная гипертензия, повышение температуры тела, гематомы паховой области и др.) и/или непосредственно с ЛРП (формирование временных или постоянных мочевых свищей, геморрагии, инфекционно-воспалительные осложнения, проявления острой почечной недостаточности и др.). Рецидивы злокачественного роста у всех прооперированных мужчин отсутствовали. После рентгенхирургического вмешательства больные оставались в стационаре в течение 7 суток, затем в удовлетворительном состоянии и с соответствующими рекомендациями были выписаны под наблюдение уролога, онколога и кардиолога по месту жительства.
В качестве примера приводим описание одного из трех рассматриваемых клинических случаев. Пациент Н., 60 лет, обратился за медицинской помощью с жалобами на периодические боли в левой поясничной области и в плановом порядке поступил в урологическое отделение КБ Святителя Луки. Согласно результатам проведенного УЗИ почек и надпочечников, у больного со стороны латеральной поверхности среднего сегмента левой почки визуализировалось гиперваскулярное неоднородное образование размером до 4 х 5 см с неровными четкими контурами; было сделано заключение о наличии новообразования левой почки. При КТ с внутривенным контрастированием было выявлено типичное расположение почек с формой и размерами, соответствовавшими статистической норме; паренхима данных органов имела обычную плотность без признаков истончения. В верхнем сегменте левой почки определялось солидное образование до 45х56х38 мм плотностью до 39-42 HU, имевшее бугристый контур и неравномерно накапливавшее контраст до 158 HU. Признаки расширения и/или деформации чашечно-лоханочных структур обеих почек отсутствовали. В верхней трети левого мочеточника на уровне L2–L3 определялся конкремент до 4,5х5,0х5,0 мм и до 1250 HU. Состояние после стентирования мочеточника. Положение стента не имело каких-либо особенностей. Признаки расширения мочеточников не регистрировались.
На основании результатов УЗИ почек и надпочечников и КТ МВС, а также заключения терапевта был установлен следующий диагноз:
Основное заболевание: Образование верхнего полюса левой почки с вовлечением латерального края левой почки.
Сопутствующие заболевания: Мочекаменная болезнь, камень верхней трети левого мочеточника, внутренний мочеточниковый стент слева. Хронический пиелонефрит, вне обострения, гидронефроз 2 степени слева Гипертоническая болезнь II стадии, артериальная гипертензия 1 степени, риск 3. Хроническая сердечная недостаточность, функциональный класс 0 по классификации NYHA.
Первоначально больному проводилось оперативное лечение мочекаменной болезни в объеме трансуретральной эндоскопической уретеролитотрипсии с литоэкстракцией слева. Затем участник исследования был проконсультирован онкоурологом, сделавшем заключение о том, что пациенту показано оперативное лечение в объеме лапароскопической резекции опухоли левой почки.
Рентгенхирургическое вмешательство было начато с предварительной эмболизации сосуда, кровоснабжающего опухоль. С этой целью, в условиях гибридной операционной и в положении пациента лежа на спине, под местной анестезией была выполнена пункция правой общей бедренной артерии, по методике Сельдингера установлен интродьюсер 6 Fr, через который в устье левой почечной артерии заведен ангиографический катетер. Далее выполнена ангиография почечной артерии и ее ветвей с применением 10 мл неионного рентгенконтрастного препарата Омнипак (концентрация йода в препарате 240 мг/мл). Согласно результатам исследования, в верхнем полюсе с переходом на латеральный край левой почки было выявлено объемное образование с патологической васкуляризацией размером 5,5х5,0х6,0 см (рис. 1). При помощи микрокатетера 2,4 Fr афферентный сосуд был суперселективно катетеризирован (рис. 2) и эмболизирован частицами поливинилалкоголя (PVA) 500–700 мкм до полной его окклюзии (рис. 3). Далее по микропроводнику 0,014” в ствол левой почечной артерии был заведен баллонный катетер 5,5 х 15 мм и раздут до давления 8 атм., что по данным ангиографии привело к субтотальной окклюзии почечной артерии со значительной редукцией кровотока по ее дистальным отделам (рис. 4). После чего баллон сдут, система доставки фиксирована к коже правого бедра. На этом первый этап вмешательства был закончен.
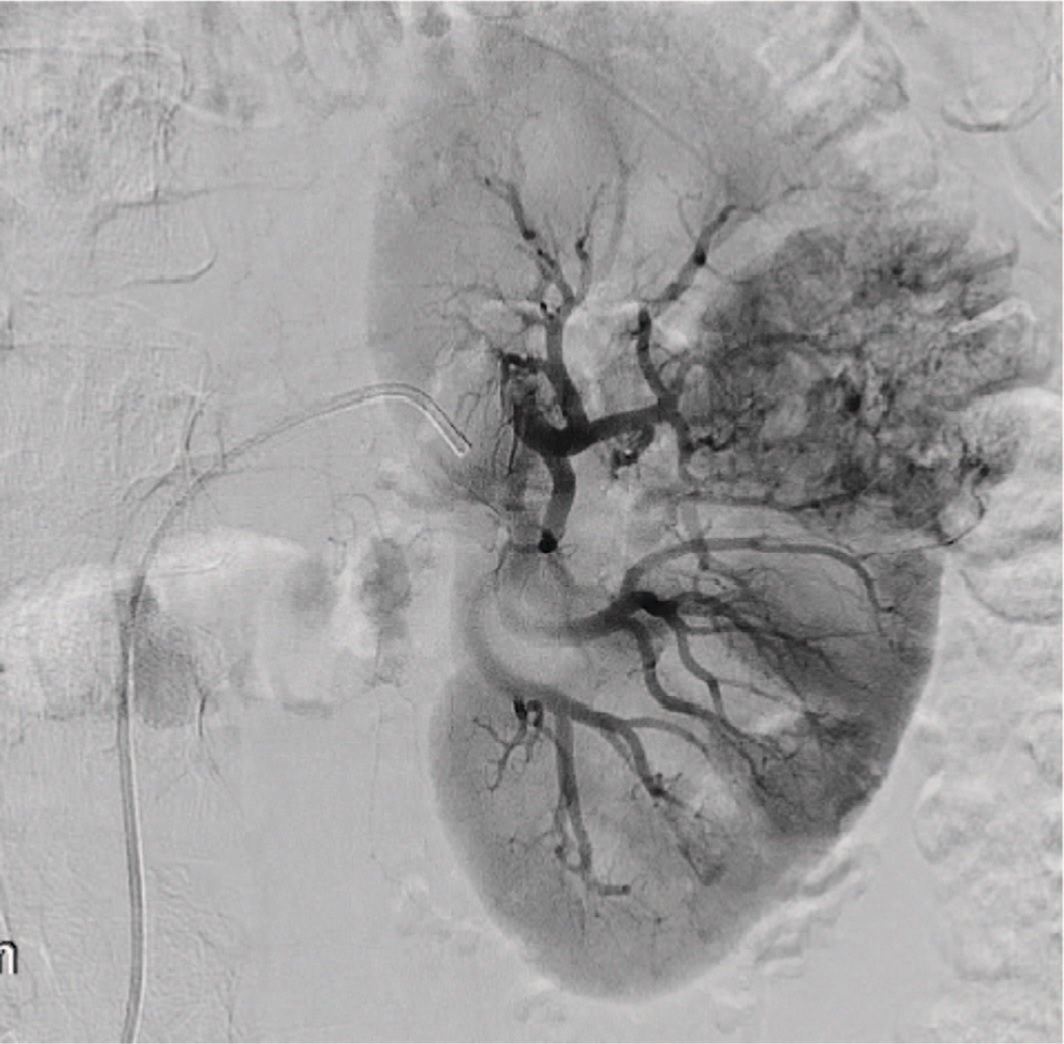
Рис. 1. Селективная ангиограмма почечной артерии с локализованным злокачественным новообразованием почки
Fig. 1. Selective angiogram of the renal artery with a localized malignant neoplasm of the kidney
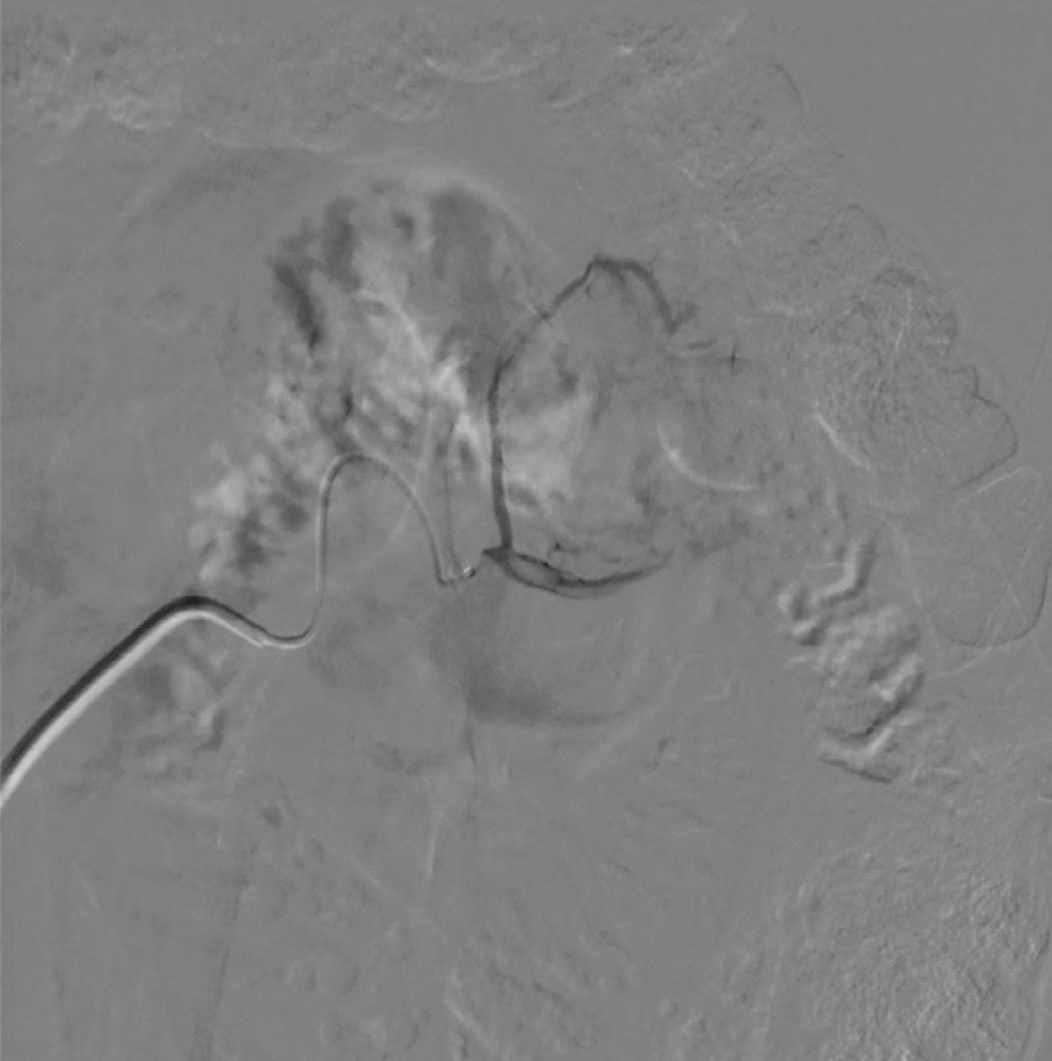
Рис.2. Суперселективная катетеризация афферентной артерии
Fig. 2. Superselective catheterization of the afferent artery
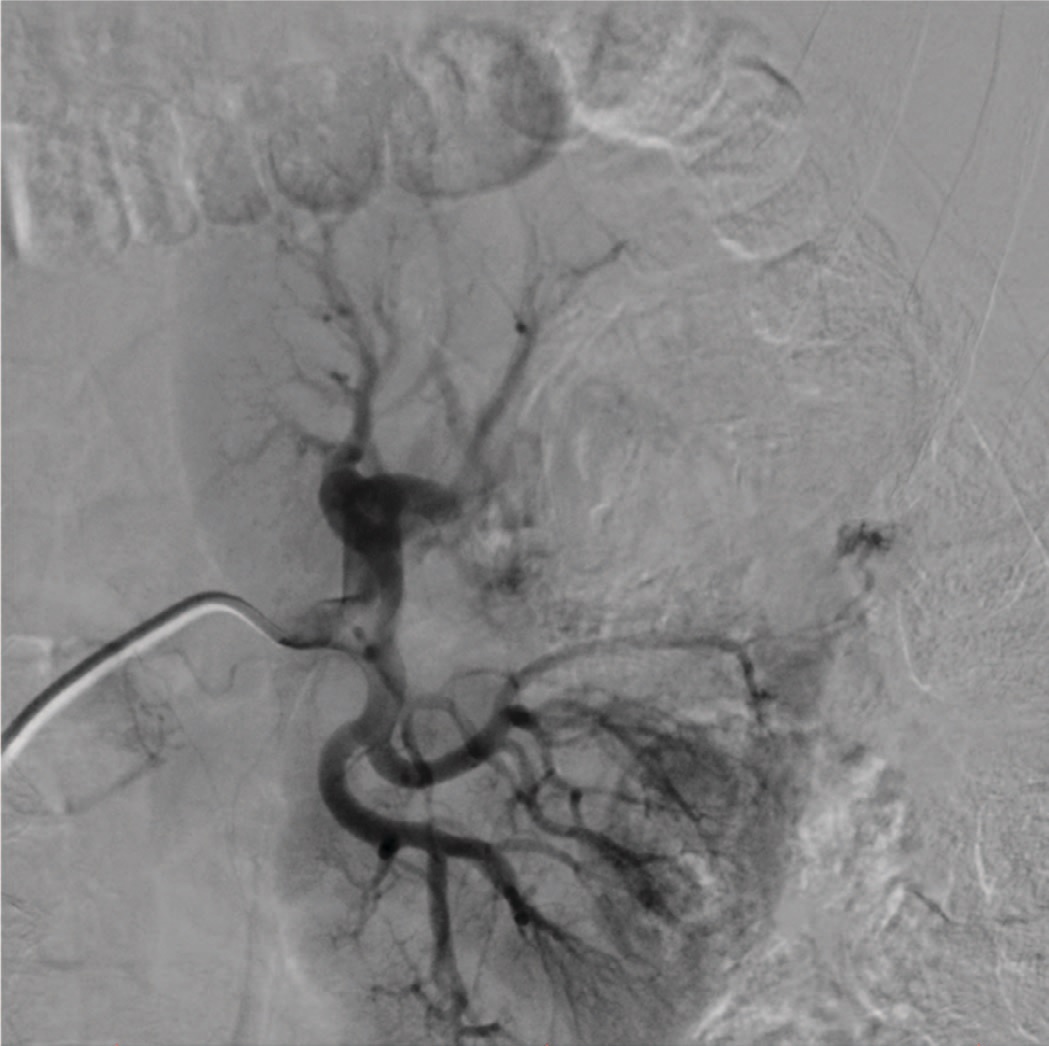
Рис. 3. Ангиограмма после селективной эмболизации афферентного сосуда
Fig. 3. Angiogram after the selective embolization of the afferent vesse
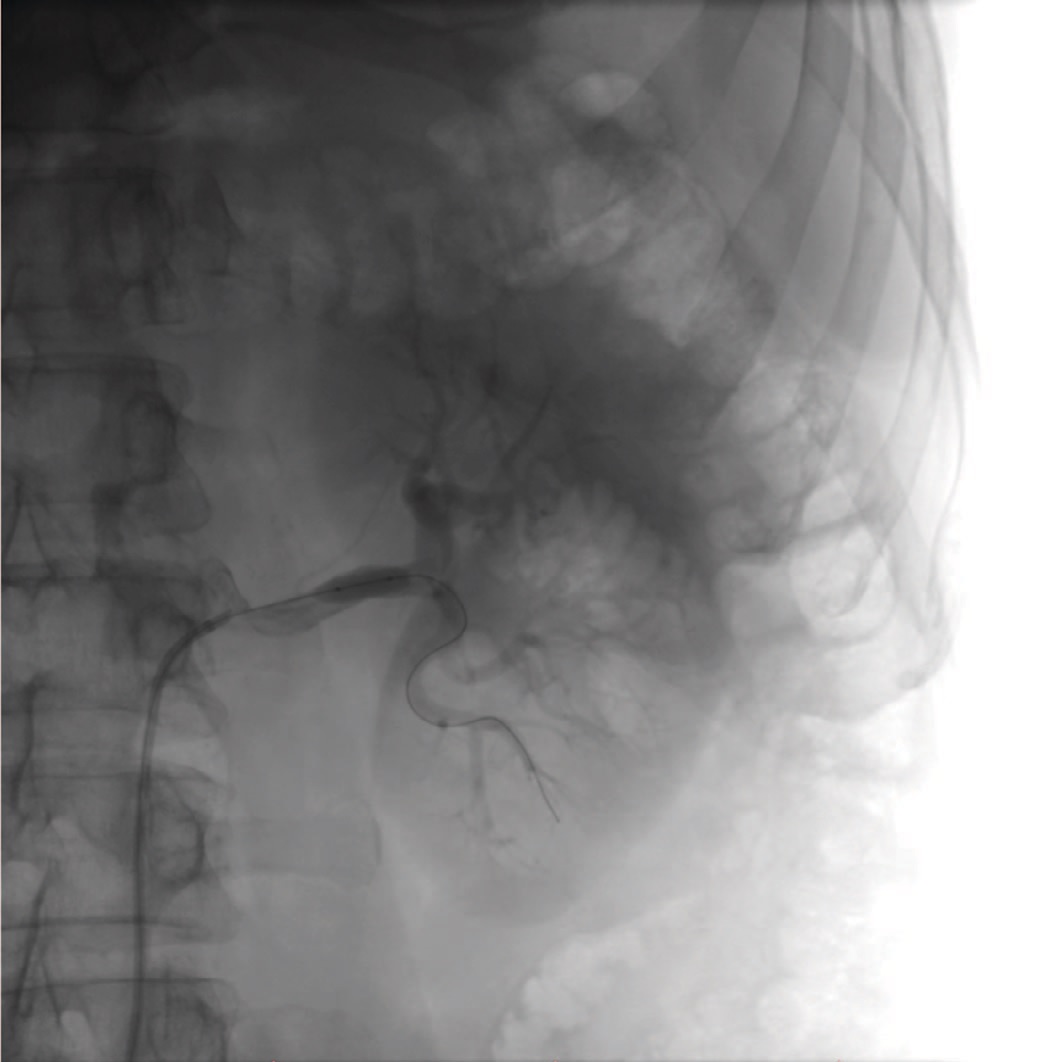
Рис. 4. Раздутый баллонный катетер в просвете почечной артерии
Fig. 4. Inflated balloon catheter in the lumen of the renal artery
На втором этапе оперативного лечения под эндотрахеальным наркозом пациент был переведен в латеропозицию на правом боку для выполнения стандартной лапароскопической резекции новообразования левой почки. Первый лапароскопический порт устанавливали по методике Хассона. После этого в брюшную полость инсуффлировали углекислый газ до 12 мм рт. ст., затем под визуальным контролем с использованием диафаноскопии было установлено два порта по 5 мм для манипуляторов. Далее следовала мобилизация нисходящего отдела ободочной кишки и скелетирование верхнелатеральной поверхности левой почки, затем – интраоперационная УЗ-визуализация опухоли левой почки.
Перед непосредственным выполнением резекции опухоли баллон, находящийся в стволе левой почечной артерии, был раздут до 8 атм. С целью профилактики тромбообразования внутривенно было введено 2500 ЕД гепарина. Результатом явилась редукция кровотока по почечной артерии с сохранением минимального кровообращения в паренхиме левой почки. Затем новообразование было иссечено с помощью лапароскопических ножниц, ложе удаленной опухоли ушито полисорбом 2.0 с укреплением клипсами Hem-o-Lock, окклюзионный баллон сдут. Время относительной ТИП составило 15 минут. Иссеченные фрагменты ткани поместили в контейнер, далее инспектировали операционное поле. После десуффляции и контроля гемостаза (сухо) контейнер с препаратом эвакуировали через минилапаротомный доступ, послойно ушивали рану, обрабатывали ее йодом и наложили асептическую повязку. Из сосудов удалены эндоваскулярные инструменты, выполнен мануальный гемостаз, наложена давящая повязка в области пункции.
Согласно результатам прижизненного патологоанатомического исследования операционного материала, размер опухоли в наибольшем измерении составлял 5,0 см. Опухоль (светлоклеточный ПКР, G3, рT1b) была ограничена капсулой почки, не прорастала в паранефральную жировую клетчатку. Хирургический (окрашенный) край резекции не имел признаков опухолевого поражения.
Ранний послеоперационный период протекал гладко, без особенностей. Дренирование раны было прекращено уже на первые послеоперационные сутки. Спустя еще 24 часа, то есть через 2 дня после вмешательства, был удален уретральный катетер, после чего, также на вторые сутки, произошло восстановление самостоятельного мочеиспускания. Швы сняли на седьмые послеоперационные сутки, раны зажили первичным натяжением. К моменту выписки признаки нарушения уродинамики отсутствовали, состояние пациента расценивалось как удовлетворительное. Пациент был выписан через 1 неделю после операции под амбулаторное наблюдение уролога и онколога.
ОБСУЖДЕНИЕ
В КБ Святителя Луки метод ЛРП был внедрен в хирургическую практику более 15 лет назад. С тех пор в этом учреждении осуществляется 60–90 ЛРП в год. Во время проведения данных операций примерно в трех случаях из четырех (75%) для профилактики паренхиматозного кровотечения при иссечении опухоли используется пережатие основного ствола почечной артерии. В нашей статье от 2022 г. были представлены периоперационные результаты ЛРП с временной тотальной ТИП (n=78), выполненных в КБ Святителя Луки за 2019 г. Среди изучавшихся показателей оценивались время вмешательства (мин), объем интроперационной кровопотери (ОИК, мл), продолжительность послеоперационного дренирования мочевого пузыря уретральным катетером (ДМПУК, часы), частота ранних инфекционно-воспалительных осложнений (РИВО, %), продолжительность пребывания пациентов в стационаре после вмешательства (койко-дни). Согласно опубликованным данным, в среднем продолжительность ЛРП, проведенных в условиях тотальной ТИП, составила 145,5 (90–120) мин, ОИК, время ДМПУК и частота РИВО были равны 152,6 (112–236) мл, 23,3 (17–70) час и 6,3%, соответственно; число послеоперационных койко-дней варьировало от 5 до 15 и в среднем составляло 5,6. [21]. При сравнении этих данных с результатами соответствующих измерений для ЛРП с ССЭ ветви почечной артерии, питающей объект иссечения, считаем необходимым отметить:
- меньший примерно в 3 раза объем кровопотери во время ЛРП на фоне ССЭ;
- одинаковую длительность ЛРП с тотальной ТИП и с эндоваскулярной окклюзией, а также радикальность вмешательства у всех трех пациентов, перенесших ССЭ, что косвенно подтверждает высокую эффективность ССЭ в плане улучшения условий оперирования, в том числе визуализации границ новообразования и контроля за линией разреза паренхимы;
- предположительно более низкую вероятность ЛРП-ассоциированных ранних инфекционно-воспалительных осложнений (они отсутствовали у всех пациентов, перенесших ЛРП с предоперационной ССЭ, но имели место у 6,3% больных, оперированных в условиях тотальной ТИП);
- сопоставимую с таковой для ЛРП с тотальной ТИП продолжительность нахождения в стационаре (не более двух недель) после резекции почки с предварительной эндоваскулярной окклюзией.
Кроме того, важными преимуществами ЛРП, выполняемой в условиях ССЭ, являются отсутствие риска повреждения структур, составляющих почечную ножку, без скелетирования которой невозможно создание тотальной ТИП, и отсутствие риска ишемически-реперфузионной альтерации сберегаемой ренальной ткани.
Полученные нами данные согласуются с результатами исследований А.В. Максимова и соавт., В.В. Землянского и соавт., В.Л. Асташова и соавт. и др. [13,14, 15–18].
ЗАКЛЮЧЕНИЕ
При хирургическом органосохраняющем лечении локализованного почечно-клеточного рака суперселективная эмболизация ветви почечной артерии, кровоснабжающей новообразование, проводимая перед лапароскопической резекцией почки, является фактором, способным улучшить функциональные результаты вмешательства за счет значительного снижения объема интраоперационной кровопотери, полного исключения вероятности повреждения сосудисто-нервных структур почечной ножки и сохранения на дооперационном уровне функциональной активности сберегаемой части нефронов.
ЛИТЕРАТУРА
1. Волкова М.И., Скворцов И.Я., Климов А.В., Комаров М.И., Черняев В.А., Матвеев В.Б. Функциональные результаты радикальной нефрэктомии при клинически локализованном раке почки. Экспериментальная и клиническая урология 2013;(4):16-20. [Volkova M.I., Skvortsov I.Ya, Klimov A.V., Komarov M.I., Chernyaev V.A., Matveev V.B. Functional outcomes of the radical nephrectomy in patients with clinically localized kidney cancer. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2013;(4):16-20. (In Russian)].
2. Гусев А.А., Евсеев С.В., Коган М.И. Оценка почечных функций и оперативное лечение почечно-клеточного рака. Онкоурология 2013;(1):17-24. [Gusev A.A., Evseev S.V., Kogan M.I. Evaluation of renal functions and surgical treatment for renal cell carcinoma. Onkourologija = Cancer urology 2013;(1):17-24. (In Russian)].
3. Miller DC, Schonlau M, Litwin MS, Lai J, Saigal CS. Renal and cardiovascular morbidity after partial or radical nephrectomy. Cancer 2008;112(3):511-20. https://doi.org/10.1002/cncr.23218.
4. Krebs RK, Andreoni C, Ortiz V. Impact of radical and partial nephrectomy on renal function in patients with renal cancer. Urol Int 2014;92(4):449-54. https://doi.org/10.1159/000355609.
5. Scosyrev E, Messing EM, Sylvester R, Campbell S, Van Poppel H. Renal function after nephron-sparing surgery versus radical nephrectomy: results from EORTC randomized trial 30904. Eur Urol 2014;65(2):372-7. https://doi.org/10.1016/j.eururo.2013.06.044.
6. Mir M.C., Ercole C., Takagi T., Zhang Z., Velet L., Remer E.M., et al. Decline in renal function after partial nephrectomy: etiology and prevention. J Urol 2015;193(6):1889-98. https://doi.org/10.1016/j.juro.2015.01.093.
7. Shikanov S, Lifshitz D, Chan AA, Okhunov Z, Ordonez MA, Wheat JC, et al. Impact of ischemia on renal function after laparoscopic partial nephrectomy: a multicenter study. J Urol 2010;183(5):1714-8. https://doi.org/10.1016/ j.juro.2010.01.007.
8. Patel AR, Eggener SE. Warm ischemia less than 30 minutes is not necessarily safe during partial nephrectomy: every minute matters. Urol Oncol 2011;29(6):826-8. https://doi.org/10.1016/j.urolonc.2011.02.015.
9. Volpe A, Blute ML, Ficarra V, Gill IS, Kutikov A, Porpiglia F, et al. Renal ischemia and function after partial nephrectomy: a collaborative review of the literature. Eur Urol 2015;68(1):61-74. https://doi.org/10.1016/ j.eururo.2015.01.025.
10. Zhang Z, Ercole CE, Remer EM, Mir MC, Takagi T, Velet L, et al. Analysis of atrophy after clamped partial nephrectomy and potential impact of ischemia. Urology 2015;85(6):1417-22. https://doi.org/10.1016/ j.urology.2015.02.040.
11. Мосоян М.С., Аль-Шукри С.Х., Семенов Д.Ю., Есаян А.М., Ильин Д.М. Селективная ишемия почечной паренхимы как альтернатива традиционному пережатию сосудистой ножки при резекции почки. Вестник урологии 2014;(3):3-10. [Mosoyan M.S., Al-Shukri S.K., Semenov D.Y., Essaian A.M., Ilin D.M. Selective parenchyma clamping technique as an alternative to traditional vascular clamping during partial nephrectomy. Vestnik Urologii = Urology Herald 2014;(3):3-10. (In Russian)].
12. Перлин Д.В., Сапожников А.Д.,Зипунников В.И., Люляев А.М., Шевченко О.Н. Органосохраняющие лапароскопические операции при раке почки с использованием посегментной ишемии. Эндоскопическая хирургия 2014;20(6):9-13. [Perlin D.V., Sapozhnikov A.D., Zipunnikov V.P., Lialiuev A.M., Shevchenko O.N. Organ-preserving laparoscopic surgeries for renal cancer with the use of segment-by-segment ischemia. Endoskopicheskaya Khirurgiya = Endoscopic Surgery 2014;20(6):9-13. (In Russian)].
13. Аляев Ю.Г., Сорокин Н.И., Кондрашин С.А., Шпоть Е.В., Сирота Е.С. Суперселективная эмболизация сосудов, питающих опухоль, перед резекцией почки. Вестник урологии 2016;(2):13-28. [Alyaev Yu.G., Sorokin N.I., Kondrashin S.A., Shpot E.V., Sirota E.S. Superselective embolization of tumor-feeding vessels before kidney resection. Vestnik Urologii = Urology Herald 2016;(2):13-28. (In Russian)].
14. Базаев В.В., Гегенава Б.Б., Бычкова Н.В., Денисова Л.Б., Виноградов А.В. Суперселективная эмболизация сосудов внутрипаренхиматозной опухоли почки с ее последующей энуклеацией (клиническое наблюдение). Диагностическая и интервенционная радиология 2019; 13(3); 94-100. [Bazaev V.V., Gegenava B.B., Bychkova N.V., Denisova L.B., Vinogradov A.V. Superselective embolization of vessels of intraparenchymal tumor of the kidney with its subsequent enucleation (clinical case). Diagnosticheskaja i intervencionnaja radiologija = Diagnostic and Interventional Radiology 2019; 13(3); 94-100. (In Russian)]. https://doi.org/10.25512/DIR.2019.13.3.11.
15. Максимов А.В., Мартов А.Г., Иванов П.М., Неустроев П.А., Тотонов А.М., Кладкин Н.П. Безопасность суперселективной баллонной эмболизации сегментарной почечной артерии при резекции почки. Экспериментальная и клиническая урология 2019;(3):79-83. [Maksimov A.V., Martov A.G., Ivanov P.M., Neustroyev P.A., Totonov A.M., Kladkin N.P. Safety of superselective balloon embolization of segmentary renal artery in partial nephrectomy. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology = Experimental and Clinical Urology 2019;(3):79-83. (In Russian)]. https://doi.org/10.29188/2222-8543-2019-11-3-79-83.
16. Шорманов И.С., Лось М.С. Способы противоишемической защиты почки при органосохраняющем хирургическом лечении больных почечно-клеточным раком. Урологические ведомости 2019;9(3):39–47. [Shormanov I.S., Los M.S. Approaches to kidney anti-ischemic protection in organ-preserving surgical treatment of patients with renal cell cancer. Urologicheskie Vedomosti = Urology Reports 2019;9(3):39–47. (In Russian)]. https://doi.org/10.17816/uroved9339-47.
17. Землянский В.В., Жуков О.Б., Курманов Т.А., Жумагазин Ж.Д., Чиналиев А.М. Лапароскопическое удаление опухоли почки после суперселективной эмболизации сосудов почки. Андрология и генитальная хирургия 2020;21(1):65-69. [ZemlyanskyV.V., Zhukov O.B., Kurmanov T.A., Zhumagazin Zh.D., Chinaliev A.M. Laparoscopic removal of a kidney tumor after superselective embolization of the kidney vessels. Andrologija i Genital'naja Hirurgija = Andrology and Genital Surgery 2020;21(1):65-69. (In Russian)]. https://doi.org/10.17650/2070-9781-2020-21-1-65-69.
18. Асташов В.Л., Шаповалов В.В., Баланюк В.В., Загорулько А.И., Козлов Д.В., Андреева М.А. и др. Первый опыт суперселективной эмболизации артерий, кровоснабжающих опухоль, с последующей лапароскопической резекцией почки. Онкоурология 2021;17(3):30-36. [Astashov V.L., Shapovalov V.V., Balanyuk V.V., Zagorul'ho A.I., Kozlov D.V., Andreeva M.A. First experience of superselective embolization of renal arteries supplying the tumor with subsequent laparoscopic kidney resection. Onkourologija = Cancer urology 2021;17(3):30-36. (In Russian)]. https://doi.org/10.17650/1726-9776-2021-17-3-30-36.
19. Simone G, Papalia R, Guaglianone S, Carpanese L, Gallucci M. Zero ischemia laparoscopic partial nephrectomy after superselective transarterial tumor embolization for tumors with moderate nephrometry score: long-term results of a single-center experience. J Endourol 2011;25(9):1443-6. https://doi.org/10.1089/end.2010.0684.
20. Ukimura O, Nakamoto M, Gill IS. Three-dimensional reconstruction of renovascular-tumor anatomy to facilitate zero-ischemia partial nephrectomy. Eur Urol 2012;61(1):211-7. https://doi.org/10.1016/j.eururo.2011.07.068.
21. Попов С.В., Гусейнов Р.Г., Орлов И.Н., Топузов Т.М., Скрябин О.Н., Перепелица В.В., Катунин А.С., Яшева С.Ю., Зайцев А.С. Симультанные вмешательства в урологической практике. Урология 2022;(3):5-14. [Popov S.V., Guseynov R.G., Orlov I.N., Topuzov T.M., Skryabin O.N., Perepelitsa V.V., Katunin A.S., Yasheva S.Yu., Zaycev A.S. Simultaneous procedures in urological practice. Urologija = Urologiia 2022;(3):5-14. (In Russian)]. https://dx.doi.org/10.18565/urology.2022.3.5-14.
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 1.18 Мб |