Оценка результатов лапароскопической пиелопластики при первичных стриктурах лоханочно-мочеточникового сегмента DOI: 10.29188/2222-8543-2023-16-4-26-33
- Панферов А.С. – к.м.н., руководитель Центра урологии медицинского центра «Медассист»; Курск, Россия; https://orcid.org/0000‑0001‑8258‑3454
- Бекреев Е.А. – заведующий урологическим отделением Центра урологии медицинского центра «Медассист»; Курск, Россия; РИНЦ Author ID 1040815, https://orcid.org/0000‑0002‑4405‑5877
- Малхасян В.А. – д.м.н., профессор кафедры урологии Московского государственного медико-стоматологического университета имени А.И. Евдокимова Минздрава России; Москва, Россия; РИНЦ Author ID 943857, https://orcid.org/0000‑0002‑2993‑884X
 645
645 ВВЕДЕНИЕ
Стеноз лоханочно-мочеточникового сегмента (ЛМС), может быть обусловлен как функциональными, так и анатомическими нарушениями транспорта мочи из полостной системы почки в мочеточник. Данная патология диагностируется в детском возрасте, но нередко встречается и у пациентов старшей возрастной группы. Причинаой данного заболевания может быть фиброз стенки мочеточника, наличие добавочного перекрестного сосуда, полипы слизистой оболочки мочеточника, высокое отхождение мочеточника от лоханки [1, 2].
Хирургия гидронефроза за свою историю претерпела ряд изменений от пункции и аспирации гидронефроза, нефрэктомии до различных вариантов пиелопластики [3].
Эндопиелотомия, предложенная как метод коррекции стриктуры лоханочно-мочеточникового сегмента, несмотря на малую инвазивность, по данным литературы, имеет эффективность от 41 до 86%. При этом доступ к суженному участку может быть осуществлен как ретроградно, так и антеградно (перкутанно), а для пиелотомии могут быть использованы различные виды энергии [4].
После первого сообщения о пластике по поводу гидронефроза было предложено большое количество вариантов коррекции данного состояния. При этом все описанные варианты можно разделить на расчленяющие, лоскутные и редуцирующие. Наибольший интерес в связи с высоким показателем эффективности представляет метод предложенный Хайнсом и Андерсоном (операция Hynes-Anderson) [5]. С развитием и внедрением малоинвазивных технологий в медицинскую практику появилась возможность реализации принципов открытой хирургии с уменьшением оперативной травмы без потери эффективности. В 1993г W.W. Schuessler и соавт. сообщили о лапароскопической пиелопластике, с того времени количество вмешательств, выполненных подобным доступом, значительно возросло [6, 7]. В сравнении с открытой лапароскопическая пиелопластика имеет схожую эффективность при меньшей потребности в анальгетиках и сроках реабилитации, хотя при этом увеличивается время операции [8].
Как и при открытой пиелопластике, использование лапароскопического доступа не исключает возможных осложнений, включая ранние: мочевой затек, несостоятельность анастомоза, и отдаленные: рестеноз и облитерация просвета мочеточника, которые могут развиваться вследствии ишемии из-за избыточного натяжении тканей [9].
Для решения вопроса дефицита тканей при пластиках мочеточника предложены такие варианты, как буккальный лоскут, аппендикулярная или кишечная пластики, что чаще всего используется при лечении протяженных вторичных или рецидивных стриктур мочеточника [10-12].
В литературе встречаются редкие упоминания о положительном влиянии предстентирования на результаты пиелопластики за счет развития пассивной дилатации на фоне арефлексии мочеточника [8, 13].
Цель исследования: оценка результатов лапароскопической пиелопластики у пациентов без предстентирования и с предстентированием верхних мочевых путей.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе исследования был проведен ретроспективный анализ лечения 73 пациентов со стриктурой лоханочно-мочеточникового сегмента, находившихся на лечении в Центре урологии МЦ «Медассист» г. Курск с 2018 по 2022 г.
При этом были определены следующие критерии включения в исследование:
- врожденные стриктуры лоханочно-мочеточникового сегмента, с одно- или двусторонним поражением;
- наличие данных динамической нефросцинтиграфии (ДНСГ) до и после хирургического лечения;
- удовлетворительная функция почки на стороне поражения по данным динамической нефросцинтиграфии (раздельная функция заинтересованной почки ≥15%) и мультиспиральной компьютерной томографии (МСКТ) с внутривенным контрастированием;
- нарушение экскреторной функции по типу обструкции при динамической нефросцинтитграфии;
- степень анестезиологического риска по классификации ASA (Американское общество анестезиологов) – 1 и 2 класс.
Критерии невключения пациентов в исследование:
- оперативные вмешательства на верхних мочевых путях и забрюшинном пространстве в анамнезе;
- опухоли верхних мочевых путей;
- наличие нефростомического дренажа на момент хирургического лечения.
С учетом данных критериев все пациенты были разделены на две группы: I (основная) – 17 пациентов, у которых на момент оперативного вмешательства верхние мочевые пути были дренированы мочеточниковым стентом (полиуретановый стент, 6Ch) на стороне поражения по поводу стойкого болевого синдрома или обструктивного пиелонефрита, II (контрольная группа) – 56 пациентов, которым ранее не выполнялось дренирование верхних мочевых путей.
Средние сроки предстентирования в группе I составили 12,92±1,82 суток. Средний возраст пациентов I группы – 46,38±11,09 л; II группы – 45,6±15,8 л.
Предоперационное обследование включало в себя общеклинические анализы, ультрасонографию верхних мочевых путей, МСКТ мочевыделительной системы с внутривенным контрастированием, ДНСГ.
Показания к операции были определены при наличии одного из следующих факторов или их сочетании: вторичные камни почки, болевой синдром, рецидивирующая инфекция верхних мочевых путей, снижение раздельной функции почки на стороне поражения менее 40% (но не менее 15%) по данным ДНСГ при наличии признаков обструкции при оценке временного параметра T1/2 более 20 минут.
Добавочные сосуды, как причина стриктуры, были диагностированы в I группе в 23,5%, а в 52,9% стриктура сочеталась с ипсилатеральным нефролитиазом; во II группе – 28,6% и 32,1% соответственно. По данным МСКТ с внутривенным контрастированием, на стороне поражения определялось сужение просвета лоханочно-мочеточникового сегмента с задержкой выделительной фазы исследования на данном уровне, а также дилатация полостной системы почки. С целью получения детальных изображений верхних мочевых путей на стороне поражения и определения протяженности зоны стриктуры выполнены отсроченные серии сканирования на 60, 90 и при необходимости 120 минутах исследования. По даннымДНСГ, у всех пациентов на стороне поражения зафиксирован «обструктивный» тип кривой, где T1/2 за время исследования не достигнуто.
Всем пациентам выполнена лапароскопическая расчленяющая пиелопластика по методике Хайнс-Андерсона. Положение троакаров: оптический троакар (12 мм) устанавливали на 4 см выше и на 4 см латеральнее пупочного кольца на стороне операции, в подреберье по среднеключичной линии устанавливали рабочий троакар 5 мм, также рабочий троакар (5 мм) устанавливали в подвздошной области (рис. 1). Операции выполнены с использованием оптики трехмерного изображения с углом обзора 300. При выраженном объеме парапельвикальной клетчатки последнюю фиксировали к передней брюшной стенке нитью, проведенной экстракорпорально (рис. 2).
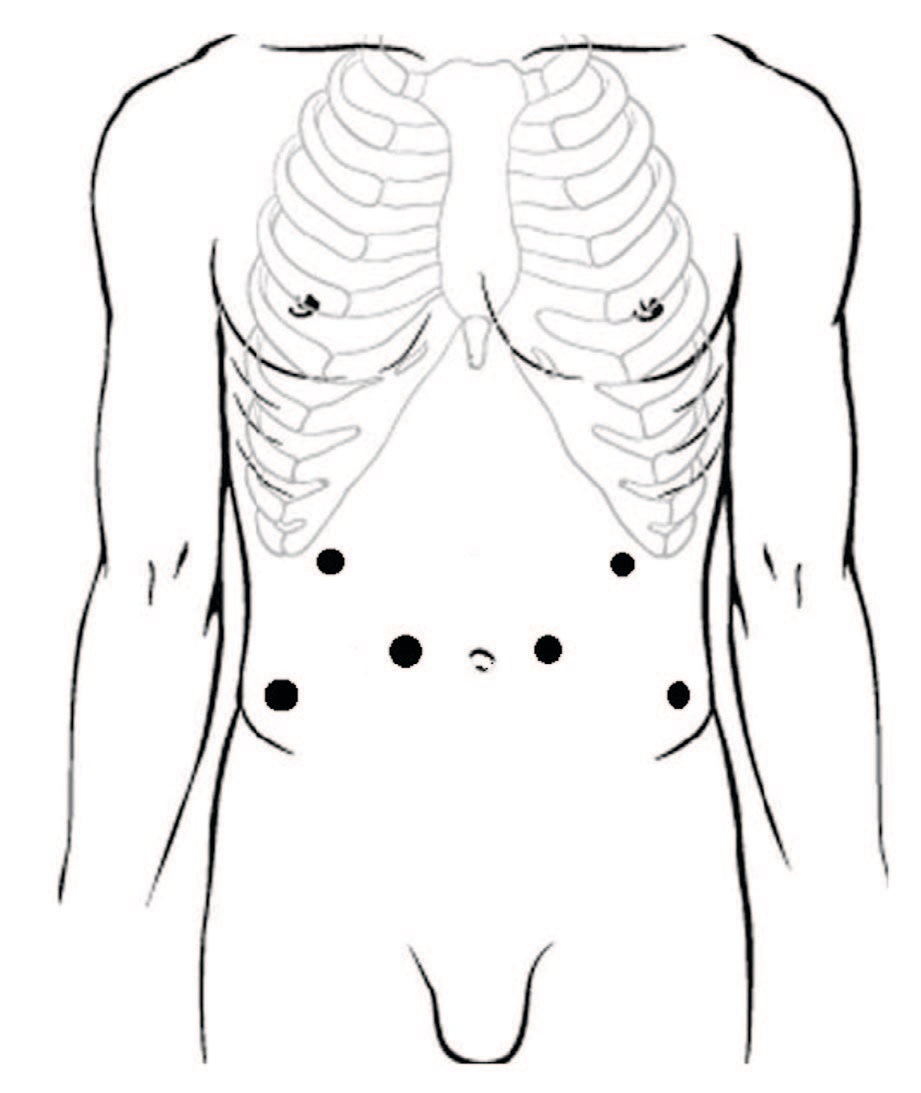
Рис.1 Расстановка троакаров
Fig.1 Location of trocars
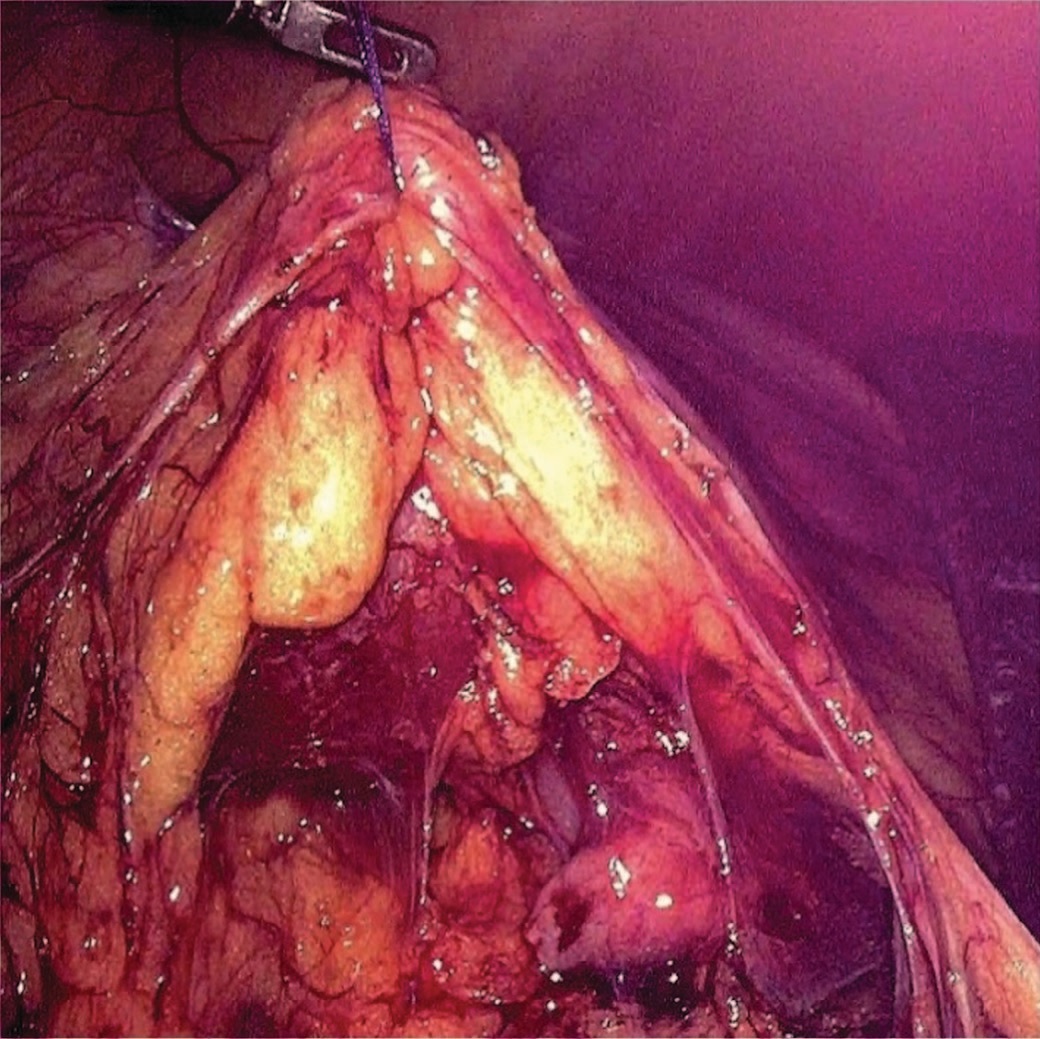
Рис.2 Фиксация паранефральной клетчатки к передней брюшной стенке
Fig.2 Fixation of paranephral fiber to the anterior abdominal wall
При наличии добавочного сосуда анастомоз позиционировали антевазально. При сочетании стеноза с нефролитиазом выполнялась пиелолитоэкстракция, при чашечных камнях для инспекции полостной системы использовали полуригидный уретерореноскоп с доступом через троакар, расположенный в подреберье (рис. 3).
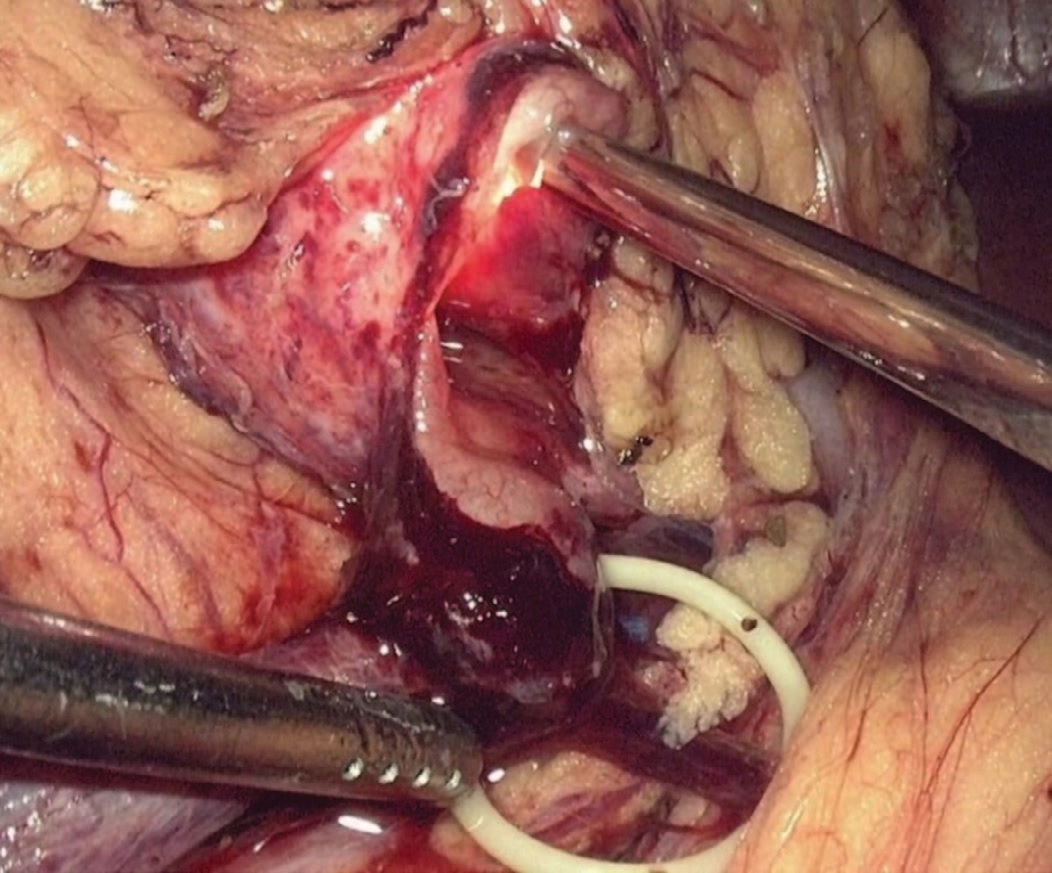
Рис. 3 Инспекция полостной системы почки полуригидным уретерореноскопом
Fig.3 Inspection of the renal cavity system with semi-rigid ureterorenoscope
Уретеропиелоанастомоз выполняли непрерывным швом синтетической рассасывающейся нитью с насечками «Stratofix Spiral Monocryl Plus 4/0», после сопоставления задней губы анастомоза устанавливали мочеточниковый стент-катетер по антеградно проведеной струне-проводнику, после чего выполнялось закрытие передней губы до герметизации мочевых путей. К месту анастомоза устанавливали страховой дренаж. В группе предстентированных пациентов после вскрытия мочевых путей ранее установленный стент удалялся через троакар, расположенный в подреберье, последующие этапы выполнялись по описанной выше технике.
Для оценки осложнений использовали классификцию Clavien-Dindo. Эффективность оперативного лечения оценивали по данным МСКТ мочевых путей с внутривенным контрастированием и ДНСГ через 3 месяца. Потребность в анальгетиках оценивали расчетом средней дозы кеторолока в первые послеоперационные сутки. Оценка выраженности воспалительной реакции осуществлялась мониторингом температуры тела и уровнем лейкоцитоза.
Статистическую обработку выполняли с использованием программного обеспечения Microsoft Excel 2019. Сравнительный анализ проводили с помощью t-критерия Стьюдента, различия между показателями считали статистически достоверными при p<0,05.
РЕЗУЛЬТАТЫ
Группы были сопоставимы по возрасту, уровню коморбидности, функциональному вкладу почки на стороне поражения. Предоперационные данные пациентов представлены в таблице 1.
Таблица 1. Предоперационные данные пациентов
Table 1. Preoperative data of patients
| Показатели Indicators |
I группа Group I |
II группа Group II |
|---|---|---|
| Средний возраст, лет Average age, years |
46,4±11,1 | 45,6±15,8 |
| Распределение по полу, % (n) Gender distribution, % (n) |
♂ - 64,3 (11); ♀ - 35,7 (6) | ♂ - 39,3 (22); ♀ - 60,7 (34) |
| Добавочный сосуд, % (n) Additional vessel, % (n) |
23,5 (4) | 28,6 (16) |
| Ипсилатеральный нефролитиаз, % (n) Ipsilateral nephrolithiasis, % (n) |
52,9 (9) | 32,1 (18) |
| Сторона справа/слева, % (n) Right/left side, % (n) |
58,8 (10)/41,2 (7) | 67,9 (38)/32,1 (18) |
| Раздельная функция почки на стороне поражения по данным ДНСГ, % Differential function renal, % |
36,8±3,2 | 32,1±6,9 |
Среднее время операции в I группе составило – 153,85±42,43мин, во II группе - 116,7±27,29, продолжительность операции в основной группе мы объясняем большей долей пациентов с камнями чашечек, что требовало временных затрат на инспекцию и литоэкстракцию с применением полурегидного уретерореноскопа. В 15 (26,78%) случаях во второй группе с целью сопоставления анастомозируемых краев и снижения натяжения требовалась дополнительная мобилизация и каудальное смещение почки, в группе предстентирования сопоставление осуществлялось без натяжения, и описанный выше прием не потребовался ни в одном случае. Пациентов активизировали в максимально ранние сроки, длительность дренирования забрюшинного пространства зависела от количества и характера отделяемого, при сохранении объема отделяемого более 100 мл/сут определяли уровень креатинина дренажной жидкости, при этом у 3 пациентов II группы длительность дренирования достигала 72 часов в связи с экстравазацией мочи. Средние сроки дренирования в I группе составили – 22,1±3,1 ч, во II группе – 30,8±11,0 ч. Потребность в анальгетиках: I группа – 48,5±17,0 мг/сут, II группа – 56,2±18,7 мг/сут. Температура тела в первые сутки после операции: I группа – 36,9±0,2, II группа – 37,1±0,3; средние уровень лейкоцитов крови: I группа – 7,4±1,1, II группа – 9,5±2,1. Срок госпитализации в I и II группах составил 4,0 и 4,2±0,4 дня соответственно. Средние сроки дренирования полостной системы почек в I группе составили – 26,9±1,8 дней, во II группе – 30,0±3,7 дней (табл. 2).
Таблица 2. Интра- и послеоперационные показатели пациентов
Table 2. Intra- and postoperative patient features
| Показатели / Indicators | I группа / Group I | II группа / Group II | p-value |
|---|---|---|---|
| Среднее время операции, мин Average operation time, min |
153,8±42,4 | 116,7±27,3 | 0,019 |
| Время дренирования забрюшинного пространства, час. Retroperitoneal drainage time, hour |
22,1±3,12 | 30,86±11,0 | 0,0002 |
| Уровень Le крови в 1-е сутки, тыс/мкл Blood Le level on the 1st day, thousand/mcl |
7,4±1,1 | 9,47±2,1 | 0.21 |
| Т тела в 1-е послеоперационные сутки, 0C Body temperature 1st postoperative day, 0C |
36,9±0,2 | 37,1±0,3 | 0,41 |
| Средняя дозировка кеторолака, мг Average dosage of ketorolac, mg |
48,5±17,0 | 56,25±18,7 | 0,11 |
| Срок госпитализации, дни Duration of hospitalization, days |
4,0 | 4,23±0,4 | 0,004 |
| Средние сроки стентирования, дни Average stenting time, days |
26,92±1,8 | 30±3,7 | 0,007 |
Во II группе было зафиксировано 6 случаев (10,7%) осложнений 1 категории – атака пиелонефрита на фоне рефлюкса, купированная дренированием мочевого пузыря в сочетании с антибактериальной терапией; 9 случаев (16,1%) осложнений 3а категории, из них у 2 пациентов развилась гемотампонада лоханки с картиной пиелонефрита, у 2 пациентов сохранялось обильное подтекание мочи по дренажу (более 100 мл/сут) на протяжении 48 часов, без тенденции к снижению объема отделяемого. В одном случае после удаления дренажа в первые послеоперационные сутки были отмечены явления перитонизма с повышением температуры тела до 38,90С, по данным МСКТ с внутривенным контрастированием выявлена экстравазация мочи в зоне анастомоза (рис. 4). Все вышеописанные случаи потребовали дополнительного дренирования путем перкутанной нефростомии. В 4 случаях после удаления мочеточникового стента через 4 недели после лапароскопической пиелопластики у пациентов развился стойкий болевой синдром с отрицательной динамикой гидронефроза по данным УЗИ, что потребовало повторного стентирования сроком на четыре недели.

Рис.4 Экстравазация мочи в зоне анастомоза
Fig.4 Extravasation of urine in the anastomosis
В I группе зафиксировано одно осложнение (5,9%) 1 категории – атака пиелонефрита и один случай осложнений (5,9%) 3а категории – на 20-е сутки после лапароскопической пиелопластики у пациента появился острый болевой синдром, повышение Т тела до 39,20С, в условиях дежурного урологического стационара выявлена уринома размерами 23х15 см, выполнено перкутанное дренирование уриномы, перкутанная нефростомия. Частота осложнений представлена в таблице 3.
Таблица 3. Послеоперационные осложнения по классификации Clavien-Dindo
Table 3. Postoperative complications according to the Clavien-Dindo classification
| Категория осложнений / Complication category | I группа / Group I | II группа / Group II |
|---|---|---|
| I категория,% Category I, % |
5,9 | 10,7 |
| IIIа категория,% Category IIIa,% |
5,9 | 16,1 |
Для сравнения результатов до операции и через 3 месяца после хирургического лечения приводим данные МСКТ мочевых путей пациента без предстентирования (реконструкция серии сканирования на 30 минуте и реконструкция отсроченной серии сканирования на 60 минуте) (рис. 5). А также данные МСКТ пациента из группы предстентирования, до и через 3 мес. после операции (серии сканирования на 60 минуте и реконструкция экскреторной серии сканирования на 15 минуте) (рис. 6). При этом во всех случаях было отмечено восстановление проходимости на уровне лоханочно-мочеточникового сегмента. По данным ДНСГ, во всех случаях зафиксированные кривые имели «необструктивный» тип, при этом отмечено увеличение функционального вклада почки на стороне хирургического вмешательства и уменьшение степени обструкции по данным временного параметра T1/2 (табл. 4).
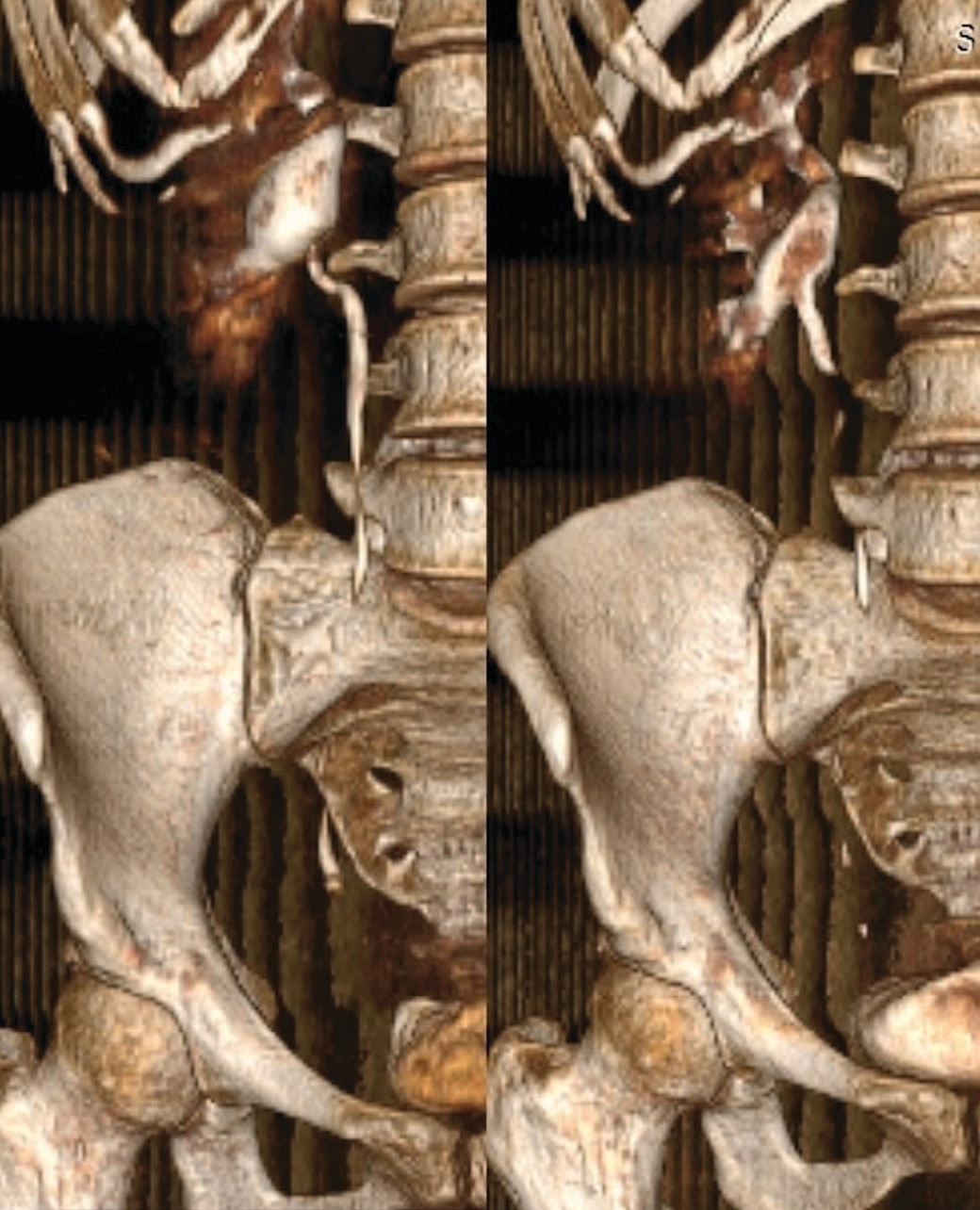
Рис.5 Данные МСКТ пациента без предстентирования (до и через 3 месяца после хирургического лечения)
Fig.5 MSCT data of the patient without prestenting (before and 3 months after surgical treatment)
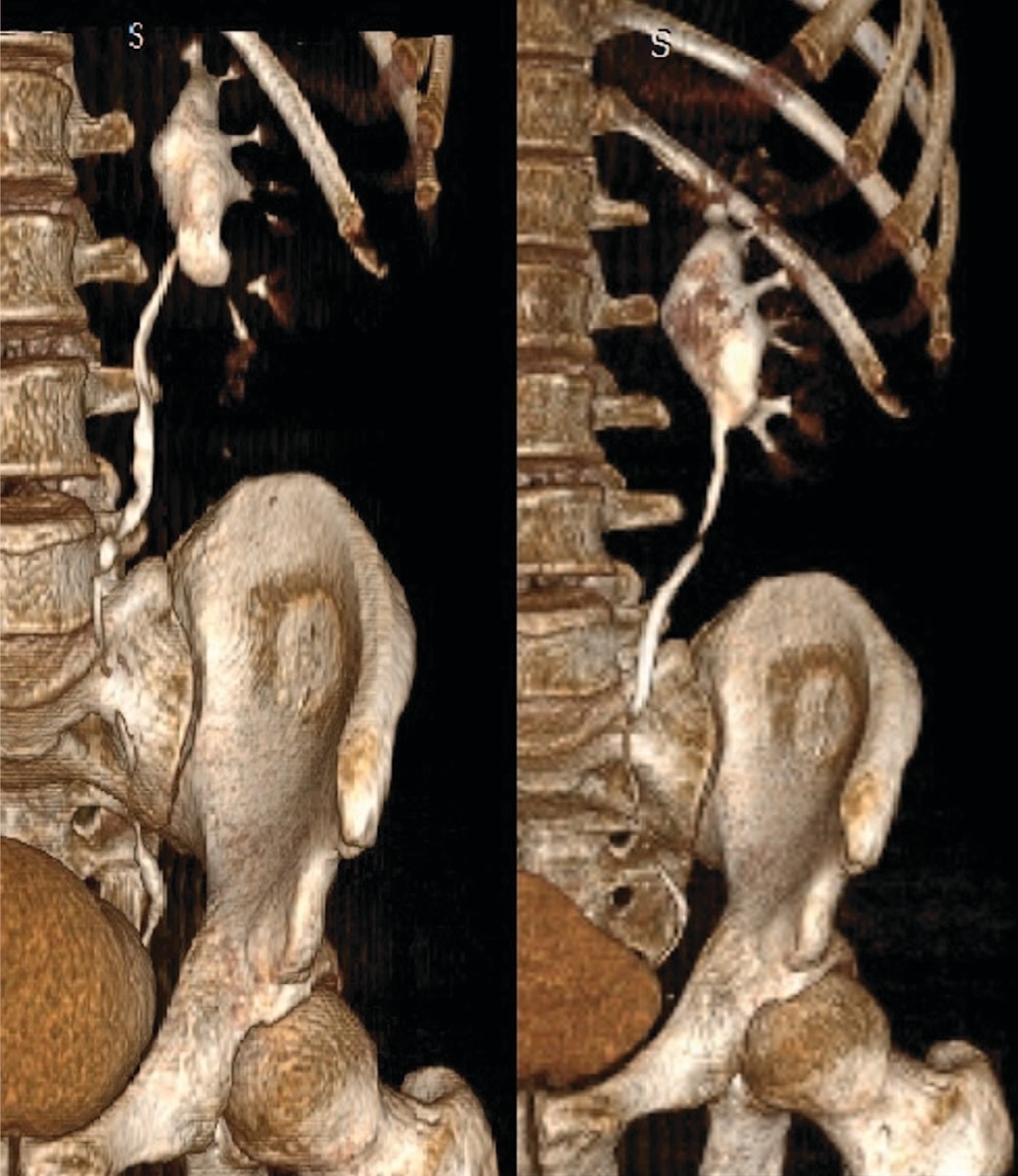
Рис.6 Данные МСКТ пациента из группы предстентирования (до и через 3 месяца после операции)
Fig.6 MSCT data of a patient with prestenting (before and 3 months after surgery)
Таблица 4. Послеоперационные инструментальные данные
Table 4. Postoperative instrumental data
| Показатели / Indicators | I группа / Group I | II группа / Group II |
|---|---|---|
| Оценка проходимости мочеточника по данным МСКТ, % Estimation of the passability of the ureter by MSCT data, % |
100% | 100% |
| Раздельная функция почки на стороне поражения по данным ДНСГ, % Differential function renal, % |
42,8±2,5 | 37,5±5,2 |
| T1/2, по данным ДНСГ, мин. T1/2, according to the DNSG, min. |
22,2±1,2 | 25,5±1,8 |
ОБСУЖДЕНИЕ
Принципы лечения гидронефроза у детей и взрослых схожи и заключаются в восстановлении пассажа мочи по мочеточнику, сохранении почечной функции и направлены на предотвращение атрофии почечной паренхимы и профилактику пиелонефрита [6, 14].
В настоящее время золотым стандартом лечения стриктуры лоханочно-мочеточникового сегмента является лапароскопическая пиелопластика. В отличии от открытой операции она характеризуется меньшей кровопотерей, низкой послеоперационной морбидностью, отсутствием грубых рубцовых изменений. В крупных исследованиях эффективность методики составляет от 85 до 100% [14, 15]. Недостатком лапароскопической пиелопластики можно считать продолжительность операции, связанную с особенностью формирования интракорпорального шва. Одним из возможных осложнений лапароскопической пиелопластики может быть несостоятельность анастомоза с формированием мочевых затеков и инфицированием, что в конечном итоге влияет на эффективность операции в виде развития рестенозов [8, 16, 17]. В данной работе в группе пациентов с предстентированием мы отметили меньший процент (5,9%) несостоятельности анастомоза, где потребовалось дополнительное дренирование полостной системы почки путем перкутанной нефростомии, во второй группе мы наблюдали трех подобных пациентов (16,1%), однако данное осложнение не повлияло на эффективность хирургического лечения, при этом этап формирования анастомоза в группе предстентированных пациентов технически был проще выполним и не требовал дополнительной конвергенции анастомозируемых краев.
Мета-анализ, выполненный L. Li и соавт., демонстрирует связь развития рестенозов после лапароскопической пиелопластики с избыточным натяжением в зоне анастомоза и длительностью дренирования мочеточника стентом [18]. Таким образом, устранение этих двух факторов может привести к повышению эффективности лапароскопической пиелопластики. K.S. Lim и соавт. оценили влияние мочеточникового стента на эластичность верхних мочевых путей на моделях свиней и пришли к выводу, что эластичность мочеточников повышается [19]. P. Jiang и соавт. отметили увеличение диаметра мочеточника через 7 дней на фоне мочеточникового стента на моделях свиней в среднем на 4Ch [20]. По нашему мнению, избыточное натяжение в зоне анастомоза может быть нивелировано путем предстентирования, так как это способствует пассивной дилятации мочеточника.
За счет повышения эластичности было отмечено уменьшения степени натяжения в зоне анастомоза, что способствовало предотвращению формирования зон ишемии и, как следствие, снижению частоты негативных хирургических исходов. В нашей работе мы отметили меньший процент развития осложнений у пациентов в группе предстентирования.
ВЫВОДЫ
Лапароскопическая пиелопластика является высокоэффективным вмешательством в лечении стриктур лоханочно-мочеточникового сегмента. Предстентирование мочеточника позволяет уменьшить частоту послеоперационных осложнений при лапароскопической пиелопластике и устраняет необходимость дополнительной мобилизации почки для формирования уретеропиелоанастомоза с целью сопоставления анастомозируемых краев и снижения натяжения.
ЛИТЕРАТУРА
1. Kausik S, Segura JW. Surgical management of ureteropelvic junction obstruction in adults. Int Braz J Urol 2003;29(1):3-10. https://doi.org/10.1590/s1677-55382003000100002.
2. Поляков Н.В., Кешишев Н.Г., Гурбанов Ш.Ш., Григорьева М.М., Арустамов Л.Д., Казаченко А.В., Алексеев Б.Я. Лапароскопическая пластика при первичных стриктурах лоханочно-мочеточникового сегмента. РМЖ 2017;15(8):515- 7. [Polyakov N.V., Keshishev N.G., Gurbanov Sh.Sh., Grigorieva M.V., Arustamov L.D., Kazachenko A.V., Alekseev B.Ya. Laparoscopic repair of the ureteropelvic junction primary strictures. RMZh = RMJ 2017;15(8):515-7. (In Russian)].
3. Мылтыгашев М.П., Капсаргин Ф.П., Фирсов М.А. Результаты лапароскопической пластики гидронефроза. Уральский медицинский журнал 2016;(5):115-7. [Myltygashev M.P., Kapsargin F.P. Fyrsov M.A., Ershov A.V., Sukhoverkhov A.O. THE Results of laparoscopic hydronephrosis plastics. Ural'skiy Meditsinskiy Zhurnal = Ural Medical Journal 2016;(5):115-7. (In Russian)].
4. Мартов А.Г., Голубев М.Ю., Ергаков Д.В., Голубев П.М., Байков Н.А., Андронов А.С., Абдуллаев Д.А. Трансуретральная эндопиелотомия с помощью тулиевого волоконного лазера. Урология 2020;(3):63-8. [Martov A.G., Golubev M.Yu., Ergakov D.V., Golubev P.M.,Baykov N.A., Andronov A.S., Abdullaev D.A. Transurethral endopyelotomy using thulium fiber laser. Urologiya = Urologiia 2020;(3):63-8. (In Russian)]. https://dx.doi.org/10.18565/urology.2020.3.63-68.
5. Poulakis V, Witzsch U, Schultheiss D, Rathert P, Becht E. Die Geschichte der operativen Behandlung der Harnleiterabgangsstenose (Pyeloplastik). [History of ureteropelvic junction obstruction repair (pyeloplasty). From Trendelenburg (1886) to the present. (In German)] Urologe A 2004;43(12):1544-59. https://doi.org/10.1007/s00120-004-0663-x
6. Schuessler WW, Grune MT, Tecuanhuey LV, Preminger GM. Laparoscopic dismembered pyeloplasty. J Urol 1993;150(6):1795-9. https://doi.org/10.1016/s0022-5347(17)35898-6.
7. Mühlstädt S, Kranz J, Steffens JA, Fornara P. Therapie der ureteropelvinen stenose im erwachsenenalter. [Treatment of ureteropelvic junction obstruction in adult age. (In German)]. Aktuelle Urol 2017;48(6):540-9. https://doi.org/10.1055/s-0043-102802
8. Merder E, Arıman A, Sabuncu K, Altunrende F. Functional, morphological and operative outcome after pyeloplasty in adult patients: Laparoscopic versus open. Urologia 20210;88(3):227-31. https://doi.org/10.1177/0391560320987921.
9. Глыбочко П.В., Аляев Ю.Г., Григорян В.А., Рапопорт Л.М., Еникеев М.Э., Лобанов М.В. Осложнения лапароскопической пиелопластики. Медицинский вестник Башкортостана 2017;12(3):24-9. [Glybochko P.V., Alyaev Yu.G., Grigoryan V.A., Rapoport L.M., Enikeev M.E., Lobanov M.V. Complications after laparoscopic pyeloplasty. Meditsinskiy vestnik Bashkortostana = Bashkortostan medical journal 2017;12(3):24-9. (In Russian)].
10. Гулиев Б.Г., Комяков Б.К., Авазханов Ж.П. Лапароскопическая буккальная пластика проксимального отдела мочеточника. Урология 2021;(3):13-9. [Guliev B.G., Komyakov B.K., Avazkhanov J.P. Laparoscopic substitution of the proximal ureter using buccal mucosa. Urologiya = Urologiia 2021;(3):13-19. (In Russian)]. https://doi.org/10.18565/urology.2021.3.13-19
11. Marien T, Bjurlin MA, Wynia B, Bilbily M, Rao G, Zhao LC, et al. Outcomes of robotic-assisted laparoscopic upper urinary tract reconstruction: 250 consecutive patients. BJU Int 2015;116(4):604-11. https://doi.org/10.1111/bju.13086.
12. Cao H, Zhou H, Yang F, Ma L, Zhou X, Tao T, et al. Laparoscopic appendiceal interposition pyeloplasty for long ureteric strictures in children. J Pediatr Urol 2018;14(6):551.e1-551.e5. https://doi.org/10.1016/j.jpurol.2018.06.017.
13. Al-Kandari A, Ganpule A, Azhar R, Gill I. Difficult Conditions in Laparoscopic Urologic Surgery 2018. https://doi.org/10.1007/978-3-319-52581-5.
14. Еникеев М.Э., Ростовская В.В., Рапопорт Л.М., Григорян В.А., Лобанов М.В., Семенякин И.В. Гидронефроз. Клинические рекомендации. Одобрено Научнопрактическим Советом Минздрава РФ 2023;26-7. [Электронный ресурс]. [Enikeev M.E., Rostovskaya V.V., Rapoport L.M., Grigoryan V.A., Lobanov M.V., Semenyakin I.V. Hydronephrosis. Clinical recommendations. Approved by the Scientific and Practical Council of the Ministry of Health of the Russian Federation 2023;26-7. [Electronic resource]. (In Russian)]. URL: https:// cr.minzdrav.gov.ru/schema/17_2
15. Radmayr C, Bogaert G, Burgu B., Castagnetti MS, Dogan HS, O’Kelly F, et al. Pediatric urology guidelines, European association of urology 2018;49-53. [Electronic resource]. URL: https://uroweb.org/guidelines/paediatric-urology
16. Ekin RG, Celik O, Ilbey YO. An up-to-date overview of minimally invasive treatment methods in ureteropelvic junction obstruction. Cent European J Urol 2015;68:245-51. https://doi.org/10.5173/ceju.2015.543.
17. Fedelini P, Verze P, Meccariello C, Arcaniolo D, Taglialatela D, Mirone VG. Intraoperative and postoperative complications of laparoscopic pyeloplasty: a single surgical team experience with 236 cases. J Endourol 2013;27(10):1224-9. https://doi.org/10.1089/end.2013.0301.
18. Li L, Qiu M, Gong B, Wang Y, Feng Q. Systematic review and meta-analysis of ureteral stent for risk factors of restenosis after laparoscopic pyeloplasty. Ann Palliat Med 2021;10(10):10527-34. https://doi.org/10.21037/apm-21-2228.
19. Lim KS, Lim YW, Yong DZP, Hao Y, Ho HSS, Ng LG, et al. Two weeks too long: optimal duration for ureteral prestenting and its physiologic effects on the ureter in a yorkshire-landrace pig model. J Endourol 2019;33(4):325-30. https://doi.org/10.1089/end.2018.0872.
20. Jiang P, Afyouni A, Brevik A, Peta A, King T, Dinh S, et al. The impact of one week of pre-stenting on porcine ureteral luminal circumference. J Endourol 2022;36(7):885-90. https://doi.org/10.1089/end.2021.0771.
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 2.18 Мб |