Стерилизация одноразовых гибких уретероскопов: мифы и реальность DOI: 10.29188/2222-8543-2023-16-4-180-185
- Горгоцкий И.А. – к.м.н., врач-уролог урологического отделения ФГБОУВО СПбГУ, КВМТ им. Н.И. Пирогова Минздрава России, доцент кафедры госпитальной хирургии СПбГУ; Санкт-Перербург, Росиия; РИНЦ Author ID 1141685, https://orcid.org/0000‑0002‑7860‑0626
- Алоян А.А. – врач-уролог урологического отделения ФГБОУВО СПбГУ, КВМТ им. Н.И. Пирогова Минздрава России; Санкт-Перербург, Росиия; РИНЦ Author ID 1175552, https://orcid.org/0000‑0002‑6273‑4224
- Шкарупа А.А. – студент 2 курса ФГБВОУВО Военно-медицинская академия им. С.М. Кирова; Санкт-Перербург, Росиия
- Мартов А.Г. – д.м.н., профессор, член-корреспондент РАН, заведующий кафедрой урологии и андрологии, Медико-биологический университет инноваций и непрерывного образования ФГБУ им. А.И. Бурназяна ФМБА России; Медицинский научно-образовательный центр МГУ имени М.В. Ломоносова; Москва, Россия; РИНЦ Author ID 788667, https://orcid.org/0000‑0001‑6324‑6110
- Петров А.Д. – врач-уролог, Клиника высоких медицинских технологий им. Н.И. Пирогова ФГБОУ ВО «Санкт-Петербургский государственный университет»; Санкт-Перербург, Росиия
- Конев С.Д. - начальник отдела эпидемиологии, врач-эпидемиолог ФГБОУВО СПбГУ, КВМТ им. Н.И. Пирогова Минздрава России, аспирант кафедры эпидемиологии, паразитологии и дезинфектологии СЗГМУ им. И.И. Мечникова; ; Санкт-Перербург, Росиия; РИНЦ Author ID 7612-8940
- Куляш А.Г. - врач клинической лабораторной диагностики, заведующий лабораторией молекулярно-биологических исследований ФГБОУВО СПбГУ, КВМТ им. Н.И. Пирогова Минздрава России; Санкт-Перербург, Росиия; РИНЦ Author ID 1196609, https://orcid.org/0000‑0002‑9916‑6232
- Шкарупа Д.Д. – д.м.н., врач-уролог, директор ФГБОУВО СПбГУ, КВМТ им. Н.И. Пирогова Минздрава России, профессор кафедры госпитальной хирургии СПбГУ; Санкт-Перербург, Росиия; РИНЦ Author ID 560256, https://orcid.org/0000‑0003‑0489‑3451
- Гаджиев Н.К. – д.м.н., врач-уролог, заместитель директора по медицинской части ФГБОУВО СПбГУ, КВМТ им. Н.И. Пирогова Минздрава России, профессор кафедры госпитальной хирургии СПбГУ; Санкт-Перербург, Росиия; РИНЦ Author ID 819314, https://orcid.org/0000‑0002‑6255‑0193
 963
963 ВВЕДЕНИЕ
Ретроградная гибкая уретеропиелоскопия является наиболее современным и безопасным методом лечения пациентов с мочекаменной болезнью и уротелиальными опухолями чашечно-лоханочной системы [1, 2]. С 2017 года в клиническую практику уверенно вошли одноразовые гибкие уретероскопы (УРС), которые не уступают в визуализации и удобстве использования многоразовым [3-5]. Основным преимуществом одноразовых инструментов по сравнению с многоразовыми является отсутствие необходимости в обслуживании (дорогостоящие ремонты, сложная многоэтапная стерилизация, риски повреждений и т.д.). Поэтому использование одноразовых эндоскопов позволяет снизить трудозатраты, упростить логистику и, в целом, сделать операцию быстрее, дешевле и безопаснее [6, 7]. Несмотря на то, что все доступные на российском рынке инструменты программно ограничены по времени применения (в среднем – 4 часа), технически возможна их стерилизация и повторное использование. Разумеется, исследования по повторному использованию одноразовых гибких УРС отсутствуют, однако при кулуарном общении многие специалисты указывают на способность подобных инструментов сохранять рабочие свойства после 4-10 операций и соответствующего количества циклов стерилизации. Стоит отметить, что остаточная бактериальная контаминация у многоразовых гибких УРС, с предусмотренной ре-стерилизацией, может наблюдаться в 13% случаев [8]. С учетом того, что конструкция и материал одноразового гибкого УРС не предусматривает стерилизацию, может наблюдаться более высокая вероятность остаточной бактериальной контаминации, что может значимо повышать риск послеоперационных инфекционных осложнений при повторном использовании таких эндоскопов. Кроме того, свойства материалов одноразовых инструментов не рассчитаны на многоразовое применение, при этом возникают повреждения после первичного использования и стерилизации [9]. Учитывая вышеперечисленное, мы решили исследовать остаточную бактериальную контаминацию на одноразовых гибких УРС после их стерилизации по стандартному протоколу.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 7 использованных одноразовых гибких УРС после плановых би- и унилатеральных уретеропиелоскопий в отделении урологии Клиники высоких медицинских технологий им. Н.И. Пирогова СПбГУ, простерилизованных по стандарту для многоразовых инструментов сразу после оперативного вмешательства (табл. 1). Среди них пять инструментов после операций у пациентов с отрицательным предоперационным посевом мочи. Два инструмента – после использования у двух пациентов с ранее положительным посевом мочи. У обоих пациентов при обследовании выявлена E. coli (этим пациентам перед операцией проводился курс антибактериальной терапии, согласно результатам чувствительности с целью санации мочевыводящих путей). Все пациенты были предстентированы за 5-14 дней до операции в соответствии с национальными клиническими рекомендации [1]. После проведения гибкого уретероскопа и визуализации, выполнялась, собственно, лазерная фрагментация камня (тулий-волоконный лазер Fiberlase U2, d=220 мкм) и экстракция фрагментов камня. Интраоперационно осуществлялась мануально-контролируемая ирригация стерильным раствором 0,9% NaCl с помощью системы IRRI-FLO (Olympus, Германия). Длительность операции составила от 15 до 50 минут. Интра- и послеоперационных осложнений у прооперированных пациентов отмечено не было. После операции одноразовый УРС подвергался циклу дезинфекции и стерилизации по протоколу обработки многоразовых гибких инструментов.
Таблица 1. Этапы стерилизации гибких уретероскопов
Table 1. Sterilization steps for flexible ureteroscopes
| Этап Phase |
Действие Action |
|---|---|
| 1 | Предварительная очистка: проводится сразу после завершения процедуры и заключается в удалении видимого мусора путем протирания внешней поверхности уретероскопа энзимным раствором ENZYMODEZ 0,5%. Pre-cleaning: carried out immediately after completion of the procedure and consists of removing visible debris by wiping the outer surface of the ureteroscope with ENZYMODEZ 0.5% enzyme solution. |
| 2 | Снятие всех съемных частей. Тест на герметичность. Removing all removable parts. Leak test. |
| 3 | Промывание, чистка щеткой, погружение в раствор ENZYMODEZ 0,5% на 20 минут Rinse, brush, immerse in ENZYMODEZ 0.5% solution for 20 minutes |
| 4 | Промывка эндоскопа, каналов и всех принадлежностей стерильной дистиллированной водой. Рабочие каналы высушиваются воздухом под давлением. В конце сушки для контроля эффективности этапа очистки проводится «Азапирамовый тест». Если он отрицательный, то уретероскоп снова промывают, высушивают и оставляют в вертикальном положении на 24 часа. Rinsing the endoscope, channels and all accessories with sterile distilled water. The working channels are dried with air under pressure. At the end of drying, an «Azapiram test» is carried out to monitor the effectiveness of the cleaning stage. If it is negative, then the ureteroscope is washed again, dried and left in an upright position for 24 hours. |
| 5 | Стерилизация (газо-плазменная стерилизация в перекиси водорода СТЕРРАД) Sterilization (gas-plasma sterilization in hydrogen peroxide STERRAD) |
| 6 | Промывка дистиллированной водой, сушка, упаковка Washing with distilled water, drying, packaging |
Далее стерильный УРС в упаковке перемещался в чистую зону отделения стерилизации. Взятие образцов для бактериологического исследования производилось в стерильных условиях с помощью стандартной пептонной воды для смывов с абиотических поверхностей со стерильными зондами («ГЕМ», Россия) на питательные среды (агар Мюллер-Хинтона с добавлением 5% дефибринированной лошадиной крови, производитель «ГЕМ», Россия). Смывы брались с различных отделов гибкого УРС в следующем порядке:
- торец и вводимая часть эндоскопа;
- блок управления (рычаг);
- рукоятка (шов сборки и ниши с фиксирующими винтами);
- отверстие бокового канала для ирригационной жидкости;
- отверстие вертикального канала (для проведения лазерного зонда или экстракторов);
- смыв с рабочего канала.
Места взятия смывов с гибких УРС схематически обозначены на рисунке 1.

Рис. 1. Схема взятия смывов с одноразового гибкого уретероскопа
Fig.1: Schematic of sampling from a single-use flexible ureteroscope
Образцы 1-5 были получены путем проведения по поверхностям и в отверстия стерильного тампона, смыв с рабочего канала осуществлялся стерильным раствором 0,9% NaCl объемом 5 мл с помощью стерильного одноразового шприца.
Всего было получено 42 образца смывов. Полученные материалы подверглись бактериологическому исследованию для выявления и идентификации микроорганизмов.
РЕЗУЛЬТАТЫ
На всех гибких УРС, участвовавших в исследовании, был выявлен бактериальный рост (табл. 2).
Таблица 2. Результаты исследования. Типы выявленных микроорганизмов
Table 2. Results of the study. Types of microorganisms detected
| Номер иигтпим РИТЛ Instrument number |
Отделы гибкого инструмента, с которых брался смыв и результат бактериологического исследования (штамм бактерии, КОЕ/мл) Sections of the flexible instrument from which the swab was taken and the result of bacteriological examination (bacterial strain, CFU/ml) |
|||||
|---|---|---|---|---|---|---|
| Торец, вводимая часть эндоскопа End, inserted part of the endoscope |
Блок управления (рычаг) Control unit (lever) |
Рукоятка (шов сборки и полости с винтами) Handle (seam of assembly and cavity with screws) |
Отверстие канала для ирриг. жидкости Channel opening for irrig liquid |
Отверстие вертикального канала Opening of the vertical channel |
Смыв с рабочего канала Flushing from the working channel |
|
| 1 | Staphylococcus saprophyticus, 102 | Staphylococcus hominis 102, Micrococcus lylae 102 | Роста нет Аbsence |
Роста нет Аbsence |
Staphylococcus gallinarum,102 | Роста нет Аbsence |
| 2 | Роста нет Аbsence |
Staphylococcus hominis 102 | Роста нет Аbsence |
Роста нет Аbsence |
Роста нет Аbsence |
Staphylococcus saprophyticus, 103 |
| 3 | Роста нет Аbsence |
Роста нет Аbsence |
Staphylococcus saprophyticus, 103 Micrococcus lylae 103 | Роста нет Аbsence |
Роста нет Аbsence |
Роста нет Аbsence |
| 4 | Staphylococcus xylosus, 102 | Роста нет Аbsence |
Staphylococcus saprophyticus, 103 Micrococcus lylae 103 | Micrococcus lylae 102 | Роста нет Аbsence |
Роста нет Аbsence |
| 5 | Роста нет Аbsence |
Роста нет Аbsence |
Staphylococcus saprophyticus, 103 Micrococcus lylae 103 | Роста нет Аbsence |
Роста нет Аbsence |
Роста нет Аbsence |
| 6 | Роста нет Аbsence |
Staphylococcus hominis 104 | Роста нет Аbsence |
Роста нет Аbsence |
Роста нет Аbsence |
Роста нет Аbsence |
| 7 | Роста нет Аbsence |
Роста нет Аbsence |
Staphylococcus saprophyticus, 103 | Роста нет Аbsence |
Роста нет Аbsence |
Роста нет Аbsence |
Инструменты с номерами с 1 по 5 – после операций у пациентов с отрицательным предоперационным посевом мочи, с номерами 6 и 7 – после пациентов с инфицированной мочой (после предварительной санации мочевыводящих путей). Все выявленные штаммы бактерий относились к представителям кожной микрофлоры. Обычных возбудителей инфекций мочевыводящих путей (бактерии группы кишечной палочки и другая кишечная флора, энтерококк, клебсиелла и т.д.) не было выявлено ни в одном случае.
Наименее контаминированными частями эндоскопа, на удивление, оказались рабочий канал (n=1) и отверстия каналов для ирригационной жидкости (n=1) и проведения зондов/экстракторов (n=1). Чаще бактериальный рост выявлялся на рукоятке (n=4), рычаге управления (n=3) и наружной поверхности вводимой части эндоскопа (n=2). Уровень роста микроорганизмов в одном случае составил 104, на остальных локализациях – не превышал 103 КОЕ/мл.
ОБСУЖДЕНИЕ
Ретроградная гибкая уретероскопия является одним из стандартных методов хирургического лечения пациентов с камнями почек до 2-х сантиметров и уротелиальными опухолями верхних мочевыводящих путей [1, 2]. Данный метод позволяет прецизионно не только фрагментировать, но и извлекать конкремент под визуальным контролем [10]. Операция хорошо переносится пациентами, обеспечивая быструю реабилитацию и восстановление трудоспособности [11, 12]. Данные особенности привели к широкому распространению практики гибкой уретероскопией по всему миру. Однако одними из немаловажных ограничений данной хирургии с использованием многоразовых УРС являются высокая стоимость применяемых инструментов, необходимость в сложной многошаговой обработке, высокие риски повреждений эндоскопов на каждом этапе использования и довольно низкий рабочий ресурс, составляющий в среднем 15-20 часов работы [13, 14]. С 2017 года в клиническую практику были введены одноразовые гибкие УРС, которые в принципе лишены вышеперечисленных недостатков [4]. Несмотря на развитие этой технологии и появление нескольких конкурирующих производителей, стоимость одноразовых эндоскопов остается сравнительно высокой для клиник, что побуждает многих специалистов к стерилизации устройства и последующему повторному использованию [9]. Разумеется, по этическим причинам публикаций на эту тему нет, однако в «кулуарах» и анонимных опросах специалистов профессиональных сообществ, многие указывают на повторное использование одноразовых УРС. Так, по данным анонимного опроса урологов, занимающихся гибкой уретеропиелоскопией, 94% специалистов (78 из 83 опрошенных) стерилизуют одноразовые гибкие УРС для повторного использования (рис. 2). Опрос проводился в закрытых профессиональных группах урологов в мессенджерах Telegram и Whatsapp.
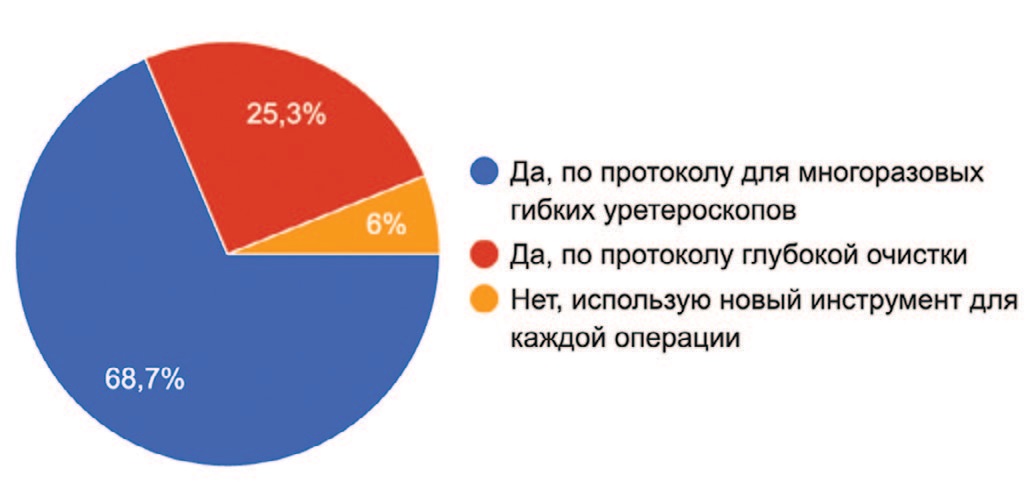
Рис. 2. Диаграмма результатов анонимного опроса специалистов, занимающихся гибкой УРС с использованием одноразовых УРС
Fig.2. Diagram of the results of the anonymous survey of specialists performing flexible URS using single-use ureteroscopes
При этом количество циклов ре-стерилизации и повторного использования одноразового гибкого УРС может доходить до 10 и более раз. Все существующие на российском рынке на момент публикации гибкие УРС имеют программное ограничение времени работы до 4 часов. Данная мера была предусмотрена производителями с целью предупреждения повторного использования [9]. При этом у некоторых одноразовых УРС есть способы обхода программного обеспечения, таким образом, один инструмент можно использовать на 10-12 операций. Необходимо отметить, что имеются данные, касающиеся большей подверженности механическим повреждениям одноразовых гибких УРС (повреждения оплетки, рабочего торца и т.д.) по сравнению с многоразовыми [9]. Подобные изменения структуры, очевидно, приводят к возникновению мелких полостей, которые сложнее подвергаются очистке и стерилизации и как следствие к более выраженной контаминации.
Согласно международным стандартам, цикл стерилизации эндоскопов довольно сложен и состоит из 4-5 стадий процесса, которые включают в себя около 100 этапов, это занимает обычно несколько часов [13- 15]. При этом в 2021 году регулятором FDA (Food and Drug Administration) в США было выпущено предупреждение о потенциальной опасности использования многоразовых гибких уретероскопов вследствие риска их недостаточной стерилизации даже при соблюдении этих мер [16].
Конечно, конструкция одноразовых УРС вообще не предусматривает проведение какой-либо обработки и стерилизации. Например, проверка герметичности технически не может быть выполнена, также в комплектации с инструментом отсутствуют устройства для его мануальной очистки. Некорректное проведение даже одного из этапов нарушает эффективность всего цикла [17]. Поэтому риск остаточной контаминации после стерилизации, предположительно, высокий. Стоит отметить, что даже после стерилизации многоразовых инструментов по конкретному протоколу производителя, каждый из них имел следы загрязнения белком, а в 13% еще и рост различных бактерий [8].
Все составные части используемых в исследовании гибких УРС LithoVue (Boston Scientific, США) оказались подвержены бактериальному загрязнению и каких-либо «безопасных зон» выявить не удалось. При этом обращает на себя внимание, что все выявленные микроорганизмы ассоциированы с кожными покровами, и прямых уропатогенов не выявлено. Вероятнее всего, попадание подобных штаммов на эндоскоп можно объяснить частым контактом рук хирурга прежде всего с кожей промежности и половых органов пациента в начале операции (удержание полового члена, раскрытие половых губ при проведении струны-проводника/кожуха/инструмента и т.д.) Похожая тенденция выявлена и в исследовании, посвященном результатам обработки многоразовых гибких УРС: показано значительное превалирование кожной флоры над кишечной в выявленной бактериальной контаминации – 9,8% против 2,3% соответственно [18]. Кроме того, имеются данные о прямом инфицировании пациентов специфическими уропатогенами (например, Pseudomonas aeruginosa) после применения стерильных многоразовых инструментов [19]. Возможно, смена стерильных перчаток после установки гибкого УРС в рабочем положении поможет в снижении рисков подобных загрязнений.
Наше исследование демонстрирует высокие потенциальные риски переноса бактерий с инструмента в мочевыводящие пути пациента и потенциальную опасность повторного использования одноразового гибкого УРС после стерилизации. И хотя обычных возбудителей инфекции мочевыводящих путей выявлено не было, обнаруженные сапрофитные бактерии – стафиллококки, – также обладают способностью к колонизации урогенитального тракта и могут вызывать воспалительный процесс [20].
Слабой стороной нашего исследования является отсутствие сравнения результатов посевов с образцами с многоразовых инструментов или одноразовых инструментов других производителей. Также в исследовании выявлена некоторая тенденция в локализации более контаминированных областей, возможно, последующие исследования с более крупной выборкой позволят выявить какие-либо закономерности в данном аспекте.
ВЫВОДЫ
Таким образом, каждый из прошедших полноценный цикл стерилизации одноразовых гибких уретероскопов оказался контаминирован бактериями. Несмотря на техническую возможность, повторное использование таких инструментов представляет потенциальную опасность для пациента и может повышать риск инфекционных осложнений при последующих использованиях.
ЛИТЕРАТУРА
1. Мартов А.Г., Харчилава Р.Р., Акопян Г.Н., Гаджиев Н.К., Мазуренко Д.А., Малхасян В.А Российские клинические рекомендации. Мочекаменная болезнь. Одобрено научно-практическим советом Минздрава России. 2021. 73 с. URL: https://cr.minzdrav.gov.ru/schema/7_1. [Martov A.G., Kharchilava R.R., Akopyan G.N., Gadzhiev N.K., Mazurenko D.A., Malkhasyan V.A. Russian clinical guidelines. Urolithiasis disease. Approved by the scientific and practical council of the Russian Ministry of Health. 2021. 73 p. URL: https://cr.minzdrav.gov.ru/schema/7_1. (In Russian)].
2. Skolarikos A, Jung H., Neisius A., Petřík A., Somani B., Tailly T., Gambaro G. EAU guideline on urolithiasis. 2023. 120 p. URL: https://uroweb.org/guidelines/urolithiasis.
3. Гаджиев Н.К., Гаджиева А.Б., Моллаев Р.А., Горелов Д.С., Малхасян В.А., Мазуренко Д.А., Аль-Шукри С.Х., Петров С.Б. Сравнительный обзор одноразовых гибких уретеронефроскопов. Экспериментальная и клиническая урология 2018;2:36-41. [Gadzhiev N.K., Gadzhieva A.B., Mollaev R.A., Gorelov D.S., Malkhasyan V.A., Mazurenko D.A., Al-Shukri S.H., Petrov S.B. Comparative review of disposable flexible ureteronephroscopes. Eksperimental'naya i klinicheskaya urologiya=Experimental and Clinical Urology 2018;2:36-41. (In Russian)].
4. Dale J, Kaplan AG, Radvak D, Shin R, Ackerman A, Chen T, et al. Evaluation of a novel single-use flexible ureteroscope. J Endourol 2021;35(6):903-7. https://doi.org/10.1089/end.2016.0237.
5. Ventimiglia E, Somani BK, Traxer O. Flexible ureteroscopy: reuse? Or is single use the new direction? Curr Opin Urol 2020;30:113-9. https://doi.org/10.1097/MOU.0000000000000700
6. Usawachintachit M, Isaacson DS, Taguchi K, Tzou DT, Hsi RS, Sherer BA, et. al. A prospective case-control study comparing lithovue, a single-use, flexible disposable ureteroscope, with flexible, reusable fiber-optic ureteroscopes. Comparative study. J Endourol 2017;31(5):468-75. https://doi.org/10.1089/end.2017.0027.
7. Martin CJ, McAdams SB, Abdul-Muhsin H, Lim VM, Nunez-Nateras R, Tyson MD, Humphreys MR. The economic implications of a reusable flexible digital ureteroscope: a cost-benefit analysis. J Urol 2017;197(3Pt1):730-5. https://doi.org/10.1016/j.juro.2016.09.085.
8. Ofstead CL, Heymann OL, Mariah RQ, Johnson EA, Eiland E, Wetzler HP. The effectiveness of sterilization for flexible ureteroscopes: A real-world study. Am J Infect Control 2017;45(8):888-95. https://doi.org/10.1016/j.ajic.2017.03.016.
9. Domenech A, Alliende C, Vivaldi B, Pizzi P. Comparison of pre- and post-surgical images of reusable and single use flexible ureteroscopes: a qualitative analysis. Cent European J Urol 2021;74:459-63. https://doi.org/10.5173/ceju.2021.0032.R2.
10. Tseng T Y, Preminger G M. Kidney stones: flexible ureteroscopy. BMJ Clin Evid 2015;2015:2003.
11. Schulz AE, Green BW, Gupta K, Patel RD, Loloi J, Raskolnikov D, et al. Management of large kidney stones in the geriatric population. World J Urol 2023;41(4):981-92. https://doi.org/10.1007/s00345-023-04333-y.
12. Srisubat A, Potisat S, Lojanapiwat B, Setthawong V, Laopaiboon M. Extracorporeal shock wave lithotripsy (ESWL) versus percutaneous nephrolithotomy (PCNL) or retrograde intrarenal surgery (RIRS) for kidney stones. Cochrane Database Syst Rev 2009;(4):CD007044. https://doi.org/10.1002/14651858.CD007044.pub3.
13. Olympus. Instructions for Use: Reprocessing Manual Uretero-Reno Fiberscope Olympus URF-P6, URF-P6R. Tokyo, Japan 2018. https://www.bioclinicalservices.com.au/olympus/clinical/urf-p6r-operation-manual-dec-2012
14. Druskin S, Ziemba J, Cao S, Wang J, Matlaga B. Ureteroscope reprocessing: a time-in-motion study of a lengthy journey. J Urol 2016;195(4S):509–10.
15. Isaacson D, Ahmad T, Metzler I, Tzou DT, Taguchi K, Usawachintachit M, et al. Defining the costs of reusable flexible ureteroscope reprocessing using time-driven activity-based costing. J Endourol 2017;31:1026–31. https://doi.org/10.1089/end.2017.0463
16. Food and Drug Administration. Infections associated with reprocessed urological endoscopes - Letter to health care providers 2021. [Electronic resourse]. URL: https://www.fda.gov/medical-devices/letters-health-care-providers/infections-associated-reprocessed-urological-endoscopes-letter-health-care-providers.
17. Washburn RE, Pietsch JJ. Assessment of test methods for evaluating effectiveness of cleaning flexible endoscopes. Am J Infect Control 2018;46(6):685-8. https://doi.org/10.1016/j.ajic.2017.11.014. Epub 2018 Jan 9.
18. Legemate JD, Kamphuis GM, Freund JE, Baard J, Oussoren HW, Spijkerman JB, et al. Pre-Use Ureteroscope Contamination after High Level Disinfection: Reprocessing Effectiveness and the Relation with Cumulative Ureteroscope Use. J Urol 2019;201(6):1144-51. https://doi.org/10.1097/JU.0000000000000108
19. Kumarage J, Khonyongwa K, Khan A, Desai N, Hoffman P, Taori SK. Transmission of multi-drug resistant Pseudomonas aeruginosa between two flexible ureteroscopes and an outbreak of urinary tract infection: The fragility of endoscope decontamination. J Hosp Infect 2019;102:89–94. https://doi.org/10.1016/j.jhin.2019.02.015
20. Gu J, Chen X, Yang Z, Yao B, Xiaobo Z. Gender differences in the microbial spectrum and antibiotic sensitivity of uropathogens isolated from patients with urinary stones. J Clin Lab Anal 2022;36(1):e24155. https://doi.org/10.1002/jcla.24155.
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 603.36 кб |