Использование внутренних стентов с целью поддержания просвета полого органа приобрело широкое распространение в различных разделах хирургии, в том числе и урологии [1-4]. Наряду с этим имеются и негативные стороны использования внутренних дренажей. Функционирование стентов с антирефлюксными клапанами не всегда стабильно, что приводит к их ограниченному использованию. Рефлюкс, обусловленный наличием внутреннего стента, может осложняться не только стремительным развитием восходящей инфекции и гидродинамической травмой, но и преждевременной активацией ферментов и прогрессией цитолиза [5-7].
Недостижимость полной биоинертрости, прямое механическое воздействие на стенку дренируемого полого органа приводит к тому, что наличие стента даже небольшого диаметра ведет к воспалительному отеку, нарушению микроциркуляции и перистальтики. Последние прогрессируют с увеличением сроков дренирования, что приводит к необратимому склерозу в стенке дренируемого органа [8-10]. Наличие неинфекционных и, особенно, бактериально-ассоцииро-ванных воспалительных изменений в моче ведет к кристаллизации солей и их преципитации на стенках стента [11, 12], что вызывает обструкцию его просвета, и стент, вместо терапевтической функции, приобретает функцию патологического обтуратора [13].
Имеющиеся объективные недостатки внутренних стентов подталкивают как к разработке новых конструктивных вариантов, так и к поиску материалов, удовлетворяющих потребности конкретной хирургической ситуации [14-16].
Цель исследования – оценить в эксперименте биоинертные и адгезивные свойства наноструктурного покрытия на основе аморфного углерода и атомарного серебра.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование биоинертных и адгезивных свойств наноструктурного покрытия на основе аморфного углерода и атомарного серебра (САg) произведено в сравнении с сплавом титана с эффектом памяти формы на основе Ti-Ni-(X) и β-сплавом титана при имплантации в мочевой пузырь белых лабораторных крыс линии Wistar массой 235317 граммов. Каждая группа включала по 20 животных. Материалы в виде фольги размерами 5х2х0,25 мм имплантировали в просвет мочевого пузыря из цистотомического доступа размером 2 мм в области верхушки, мочепузырную рану ушивали непрерывным швом PDS 7-0. На 14-е и 30-е сутки животных выводили из эксперимента, производили общий анализ крови, биохимический анализ крови, морфологическое исследование стенки мочевого пузыря.
Наноструктурное покрытие нанесено методом ионно-плазменного напыления силами «Лабораторией ионно-плазменного напыления» ФГАОУ ВПО «НИУ БелГУ», научный руководитель канд. физмат. наук, профессор А.Я. Колпаков.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При экспериментальном исследовании биоинертности наноструктурного покрытия имплантация фольги из сплава титана с эффектом памяти формы на основе Ti-Ni-(X), ?-сплава и САg в просвет мочевого пузыря крыс не сопровождалась системной лейкоцитарной реакцией на исследуемых сроках наблюдения (р>0,05). Это говорит об отсутствии цитотоксичности и приемлемых показателях биоинертности этих материалов на данной экспериментальной модели. Кроме того, наличие имплантов в мочевом пузыре не вызывало нарушений проходимости пузырно-уретрального сегмента и уродинамики верхних мочевых путей, показатели азотистого обмена не выходили за границы начального референта.
По данным морфометрического исследования микроскопическая картина в группах сплава титана с эффектом памяти формы на основе Ti-Ni-(X) и ?-сплава достоверно не различались (в описательной части объединены в группу «сплавы титана»). Морфологическое исследование стенки мочевого пузыря при внутрипросветном расположении имплантатов группы сплавы титана на 14-е сутки выявило выраженные изменения клеточно-тканевого состава стенки мочевого пузыря, проявившиеся отеком слизистой, гипертрофическими изменениями, десквамацией уротелия и диффузной воспалительной инфильтрацией стенки мочевого пузыря. Изменения уротелия характеризовались увеличением рядности до 914 с образованием псевдополипов (рис. 1 а, b) и полиморфноядерной инфильтрацией, толщина слизистой составила 129,6±26,3 мкм. Клеточная инфильтрация распространялась на все слои мочевого пузыря, в составе инфильтратов преобладали полиморфноядерные лейкоциты 276± 33 кл. в п/з. Гистиоциты представлены в инфильтратах 42±11 кл. в п/з, малые лимфоциты 139±27 кл. в п/з (рис. 1 b, d, табл. 1). В мышечном слое регистрировался отек, гипертрофические изменения и преимущественно очаговая полиморфноядерная воспалительная инфильтрация (рис. 1 с, d), толщина мышечного слоя составила 1352,9±262,4 мкм.
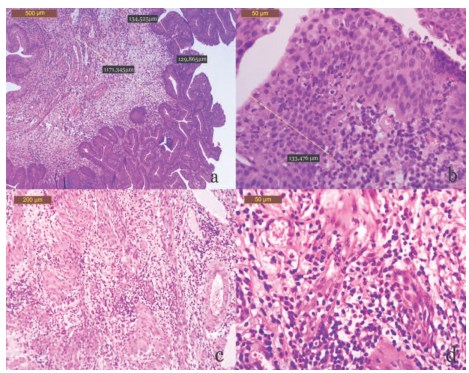
Рис. 1. Морфологические изменения стенки мочевого пузыря на 14-е сутки после внутрипросветного введения пластины из сплава титана: а и b – выраженная диффузная воспалительная полиморфноядерная инфильтрация подслизистого слоя с нарушением целостности базальной мембраны и выходом лейкоцитов в переходноклеточный эпителий; c и d – воспалительный отек и выраженная диффузная и очаговая воспалительная полиморфноядерная инфильтрация мышечного слоя стенки мочевого пузыря. Окр. гематоксилином и эозином. Микрофото. Ув. а – х50, b и d – х400; с – х100.
В группе имплантатов с САg выраженность морфологических изменений оказалась меньшей: гипертрофические изменения слизистой мочевого пузыря носили умеренный характер, что заключалось в усилении складчатости, отсутствии псевдополипоза, лейкоцитарная инфильтрация и увеличение рядности уротелия, толщина которого составила 63,4±10,9 мкм (р<0,05). Воспалительные изменения в данной группе наблюдения были ограничены подслизистой, в которой регистрировали умеренные отек и диффузную воспалительную инфильтрацию (рис. 2), толщина подслизистого слоя составила 253,1±42,4 мкм (р<0,01, рис. 2 а, b, табл. 1). Клеточный состав инфильтратов представлен малыми лимфоцитами 22±9 кл. в п/з и полиморфноядерными лейкоцитами – 35±8 кл. в п/з. Гистиоцитарный компонент – 8±3 кл. в п/з (р<0,05, рис. 2 b, c, табл. 1). Не зарегистрировано гипертрофии мышечного слоя, толщина которого составила 606,2±95,1 мкм (р<0,05, рис. 2 a, табл. 1).
Таблица 1. Морфометрические показатели мочепузырной стенки при имплантации исследуемых материалов
| Исследуемые показатели | Сутки наблюдения | |||
|---|---|---|---|---|
| 14 | 30 | |||
| Группы наблюдения | ||||
| сплавы титана, n=20 | САg, n=10 | сплавы титана, n=20 | САg, n=10 | |
| Cлизистая, мкм | 129,6±26,3 | 63,4±10,9* | 163,3±51,8 | 49,5±9,1* |
| Подслизистая, мкм | 1071,5±206,2 | 253,1±42,4 * | 841,2±174,8 | 8 133,5±26,8* |
| Мышечный слой, мкм | 1352,9±262,4 | 606,2±95,1* | 1488,4±209,1 | 563,9±82,3* |
| Полиморфноядерные лейкоциты, кл. в п/ | 276±33 | 35±8* | 104±19 | 16±4* |
| Малые лимфоциты, кл. в п/з | 139±27 | 22±9* | 164±31 | 37±11* |
| Гистиоциты, кл. в п/з | 42±11 | 8±3* | 57±16 | 13±6* |
| Фибробласты, кл. в п/з | 73±19 | 41±17 | 127±35 | 52±5* |
| Фиброциты, кл. в п/з | 61±14 | 50±12 | 98±23 | 53±9* |
1имели нормальное распределение, приведены в их среднем значении со средней квадратичной ошибкой: М±σ. *имеются статистически достоверные различия в сравнении с группами наблюдения (p<0,05).
На 30-е сутки после имплантации сплавов титана в стенке мочевого пузыря прогрессировал псевдополипоз (рис. 3а) и сохранялись воспалительные изменения, распространяющиеся на всю толщу стенки мочевого пузыря, интенсивность которых несколько снизилась (рис. 3 а-d). Отмечали утолщение и склеротические изменения мочепузырной стенки, большей частью в продслизистом слое и между мышечными пучками детрузора, в которых регистрировали субатрофию мышечных волокон и очаговую смешанную инфильтрацию (рис. 3 а-d). Толщина подслизистого слоя незначительно уменьшилась и составила 841,2±174,8 мкм (р>0,05), аналогичный показатель для мышечного слоя так же статистически незначимо увеличился – 1488,4± 209,1 мкм (р>0,05). Со стороны уротелия сохранились как участки десквамации эпителия, так и псевдополипоз с увеличением рядности и толщины слизистой до 163,3± 51,8 мкм (рис. 3 а, b). Клеточные инфильтраты носили смешанный характер: полиморфноядерные лейкоциты – 74±19 кл. в п/з, малые лимфоциты – 164±31 кл. в п/з и гистиоциты – 57±16 кл. в п/з (рис. 3 b, d, табл. 1).
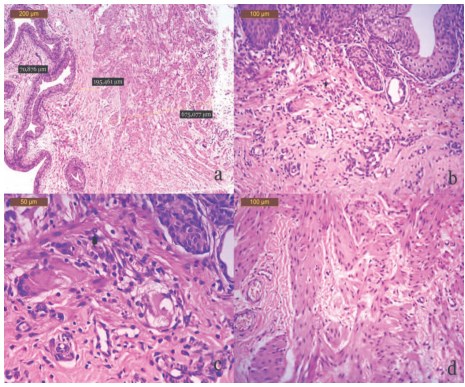
Рис. 2. Морфологические изменения стенки мочевого пузыря на 14-е сутки после внутрипросветного введения пластины с САg: воспалительный отек незначителен, лейкоцитарная инфильтрация имеет диффузный смешанный характер, локализована в подслизистом слое стенки мочевого пузыря. Окр. гематоксилином и эозином. Микрофото. Ув. а – х50; b – х100; с – х400; d – х200
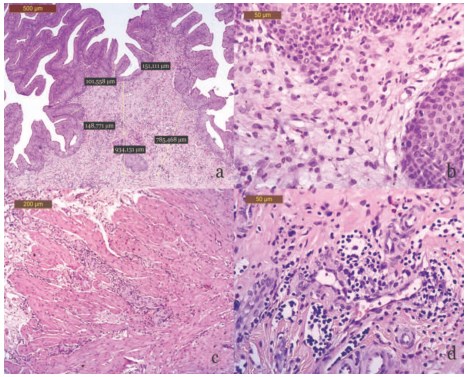
Рис. 3. Морфологические изменения стенки мочевого пузыря на 30-е сутки после внутрипросветного введения пластины из сплава титана: гипертрофические изменения с выраженным псевдополипозом слизистой, воспалительный отек, накопление рыхлой соединительной ткани, умеренная диффузная и очаговая смешанная воспалительная инфильтрация слоев стенки мочевого пузыря. Окр. гематоксилином и эозином. Микрофото. Ув. а – х50; b и d – х400; с– х100
Инфильтративные изменения в стенке мочевого пузыря после имплантации материалов группы с СAg были умеренны. Со стороны слизистой отсутствовало язвенное поражение, морфологическая картина представлена гипертрофическим циститом в области шейки мочевого пузыря. В области дна мочевого пузыря слизистая интактна, полипоз выражен незначительно, по сравнению с группой незащищенных металлов, толщина слизистой составила 49,5±9,1 мкм (р<0,05, рис. 4 а, табл. 1). В исследуемых тканях определялись единичные мелкие очаги воспалительной, главным образом, лимфоидной инфильтрации, ограниченные подслизистой, содержащие малые лимфоциты – 37±11 кл. в п/з и гистиоциты – 13±6 кл. в п/з (р<0,05, рис. 4 b, табл. 1). Число полиморфноядерных лейкоцитов составило 16±4 кл. в п/з (р<0,05, рис. 4 b, табл. 1). На границе с мышечным слоем визуализировали увеличение содержания фибробластов 52±5 кл. в п/з и фиброцитов 53±9 кл. в п/з, что достоверно меньше контроля (р<0,01, табл. 1).
Отек подслизистого слоя достоверно снизился по сравнению с предыдущим временным интервалом и был меньше, чем в группе сплавов титана, его толщина варьировала 133,5±26,8 мкм (p<0,05, табл. 1). Морфометрические характеристики мышечного слоя не изменились и составили 563,9±82,3 мкм, что достоверно меньше группы сравнения (p<0,05, табл. 1). Не отмечено гипертрофических и дистрофических изменений миоцитов
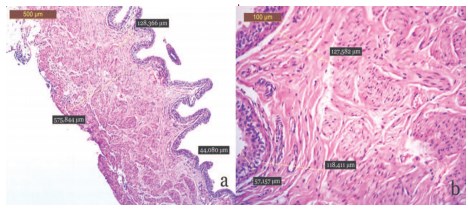
Рис. 4. Морфологические изменения стенки мочевого пузыря на 30-е сутки после внутрипросветного введения пластины с САg: псевдополипы отсутствуют, складчатость умеренно повышена, воспалительный отек не выявляется, лейкоцитарная инфильтрация скудная представлена агранулоцитами, расположенными в подслизистом слое стенки мочевого пузыря. Окр. гематоксилином и эозином. Микрофото. Ув. а – х50; b – х200
В группах сплавов титана отмечены выраженные процессы литогенеза, к 30-м суткам эксперимента в просвете мочевого пузыря животных этих групп обнаруживали конкремент, занимающий весь просвет мочевого пузыря (рис. 5 а). Толщина солевых отложений в 3 – 5 раз превышала толщину импланта, а их масса составила 284,4±41,5% от исходной массы импланта (рис. 5 b-с). В группе САg не зарегистрировано интенсивного камнеобразования. Более 60% поверхности имплантов этой группы были свободны от солевого налета, толщина которого не превышала 100 мкм, масса импланта увеличилась на 15,2±4,9% (р<0,01, рис. 5 d).

Рис. 5. Литогенез на поверхности имплантов мочевого пузыря. а – группа сплавы титана макропрепарат мочевого пузыря (1), конкремент (2), занимающий просвет пузыря; b – группа сплавы титана, электронная микроскопия поверхности конкремента; с – группа сплавы титана, электронная микроскопия края излома (3), визуализируется поверхность импланта (4); d – группа нпСAg№2, единичные участки кристаллизации на поверхности импланта. b-d ув. х200
ОБСУЖДЕНИЕ
На экспериментальной модели нами показано, что реакция со стороны полых органов на введение имплантов гомологична таковой при имплантации в паренхиматозные органы и зависит от показателей биоинертности импланта [17, 18]. У исследованных материалов не зарегистрировано цитотоксичности, отсутствовали некрозы и перфорация стенки мочевого пузыря. Незащищенные металлы (сплав титана с эффектом памяти формы на основе Ti-Ni-(X) и ?-сплав) характеризовались меньшими показателями биоинертности, и их имплантация приводила к выраженному отеку и лейкоцитарной инфильтрации всей стенки органов моделей, регистрируемой с 14-х суток эксперимента. К выходу из эксперимента (30-е сутки) у животных этих групп отмечено развитие склероза стенки мочевого пузыря в области имплантации. Воспалительные изменения стенки мочевого пузыря в группе САg не выходили за пределы подслизистой, гранулоцитарный компонент был не выражен, что позволило избежать выраженной локальной продукции хемокинов и, как следствие, коллагеногенеза к окончанию эксперимента.
Таким образом, нахождение импланта (стента) в просвете полого органа неминуемо сопровождается воспалением с последующим развитием фиброза даже при временной имплантации, а степень данных изменений во многом зависит от биоинертности импланта. Отсутствие различий в результатах морфометрии между сплавами титана (сплав титана с эффектом памяти формы на основе Ti-Ni-(X) и ?-сплав) еще раз подтверждает то, что биоинертность на данных сроках наблюдения определяется титаном, а именно, покрывающей химически инертной пленкой его оксида и не зависит от веществ, входящих в сплав. Однако, наличие пленки из оксида титана не предупредило кристаллизации мочевых солей с ис-ходом в цистолитиаз. Подобное осложнение может быть объяснено с позиций воспалительной теории литогенеза, когда в следствие воспаления и экссудации глобулярной белковой фракции изменяется кислотность и протеазная активность мочи, что приводит к кристаллизации солей на белковом матриксе [19].
ВЫВОДЫ
1. Реакция со стороны полых органов на введение имплантов зависит от показателей биоинертности материала, из которого изготовлен имплант.
2. Незащищенные металлы (сплав титана с эффектом памяти формы на основе Ti-Ni-(X) и ?-сплав) характеризовались меньшими показателями биоинертности, и их имплантация приводила к выраженному отеку и лейкоцитарной инфильтрации всей стенки мочевого пузыря крыс.
3. Воспалительные изменения стенки мочевого пузыря в группе САg не выходили за пределы подслизистой, гранулоцитарный компонент был не выражен, что позволило избежать выраженного фиброза стенки органа к окончанию эксперимента. 4. Окончательные выводы об эффективности применения наноструктурного покрытия будет возможно сделать после проведения всесторонних экспериментальноклинических исследований.
ЛИТЕРАТУРА
1. Naber KG, Cho YH, Matsumoto T, Schaefer AS. Immunoactive prophylaxis of recurrent urinary tract infections: A meta-analysis. Int J Antimicrob 2009;2:111-119.
2. Лоран О.Б., Зайцев A.B., Годунов Б.Н. Особенности диагностики и лечения хронического цистита у женщин. Акушерство и гинекология 2000;(3): 40-43.
3. Франк У. Антибактериальная терапия в амбулаторно-поликлинической практике. М.: ГЭОТАР-Медиа, 2010. 256 с.
4. Перепанова Т.С. Инфекции почек и мочевыводящих путей: современные подходы к терапии. Фарматека. 2004; 82(3-4):16-21.
5. Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Шевелев А.Н., Гринев А.В. и др. Исследовательская группа «ДАРМИС». Современное состояние антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в России: результаты исследования «ДАРМИС» (2010–2011). Клиническая микробиология. антимикробная химиотерапия 2012;14(4): 280-302.
6. Minardi D, d’Anzeo G, Cantoro D. Urinary tract infections in women: etiology and treatment options. Intern J General Med 2011; 4:333–334.
7. Apisarnthanarak A, Buppunharun W, Tiengrim S, Sawanpanyalert P, Aswapokee N. An overview of antimicrobial susceptibility patterns for gram-negative bacteria from the National Antimicrobial Resistance Surveillance Thailand (NARST) program from 2000 to 2005. J Med Assoc Thai 2009;92(Suppl.4): 91-94.
8. Стрельцова О.С., Крупин В.Н. Хронический цистит: новое в диагностике и лечении. Лечащий врач 2008;(7): 18–24.
9. Сидоренко С.В., Тишков В.И. Молекулярные основы резистентности к антибиотикам. Успехи биологической химии 2004; 44(3): 263-306.
10. Мартов А. Г., Гурбанов Ш. Ш., Мудрая И. С. Оценка сократительной функции верхних мочевыводящих путей методом многоканальной импедансной уретерографии до и после эндоуретеропиелотомии. Урология 2009; 4: 25-30.
11. Chatterjee S, Maiti P, Dey R, Kundu A, Dey R. Biofilms on indwelling urologic devices: microbes and antimicrobial management prospect. Ann Med Health Sci Res 2014 4(1):100-104
12. Denstedt JD, Cadieux PA. Eliminating biofilm from ureteral stents: the Holy Grail. Curr. Opin. Urol. 2009; 19(2): 205-210.
13. Modi AP, Ritch CR, Arend D, Walsh RM, Ordonez M, Landman J, Gupta M, Knudsen BE. Multicenter experience with metallic ureteral stents for malignant and chronic benign ureteral obstruction. J Endourol 2010; 24(7): 1189-93.
14. Волова Т.Г. Синтез биорезорбируемых полимеров. Структура и свойства. Известия высших учебных заведений. Физика 2013; 56(12-3): 27-32.
15. Шкуратов С.И., Феофилов И.В., Гюнтер В.Э., Исаенко В.И. Временные и постоянные никелид-титановые стенты при перкутанных операциях по поводу стриктур лоханочно-мочеточникового сегмента. Урология 2007; 4: 31-34.
16. Abizaid A., Costa Jr.J.R. New drug-eluting stents: an overview on biodegradable and polymer-free next-generation stent systems. Circ Cardiovasc Interv 2010; 3(4) 384-393.
17. Шкодкин С.В., Должиков А.А., Жернакова Н.И., Дмитриев В.Н., Идашкин Ю.Б., Фентисов В.В. Исследование биоинертности материалов при имплантации в паренхиму почки в эксперименте. Научные ведомости Белгородского государственного университета. Серия: Медицина Фармация. 2012; 17(4): 207-213.
18. Шкодкин С.В., Иванов С.В., Идашкин Ю.Б., Фентисов В.В. Экспериментальное исследование биоинертности материалов, используемых в производстве хирургических стентов. Курский научно-практический вестник "Человек и его здоровье" 2012; 4: 32-39.
19. Hsu L, Li H, Pucheril D, Hansen M, Littleton R, Peabody J, Sammon J. Use of percutaneous nephrostomy and ureteral stenting in management of ureteral obstruction. World J Nephrol 2016; 6(5-2): 172-81.







