В настоящее время оценка результатов лечения онкоурологических заболеваний складывается из двух параметров: это продолжительность жизни и ее качество. Причем, Американское общество клинической онкологии (ASCO) и Национальный институт рака (NCI) считают, что большой экономической и социальной значимостью обладает именно качество жизни пациента. Успехи хирургов-онкоурологов довольно значительны в последние годы. Освоены эндоскопические и лапароскопические методы, активно внедряются робот-асисстированные технологии. Нервосберегающая простатэктомия привела к значительным функциональным улучшениям результатов лечения рака предстательной железы (РПЖ). С другой стороны, в силу развития скрининговых программ и внедрения в повседневную практику онкомаркеров, опухоли стали выявляться на ранних стадиях развития. Такие опухоли характеризуются компактной локализацией, отсутствием распространения на окружающие ткани, лимфоузлы, не имеют отдаленных метастазов. Это явилось первой предпосылкой для возникновения органосохраняющих методик, где воздействие осуществляется только на патологический очаг.
Второй предпосылкой возникновения новых технологий в онкоурологии явился тот факт, что все-таки и хирурги, и пациенты по-прежнему остаются не удовлетворены результатами лечения РПЖ. Любая хирургическая операция – это агрессия, которая практически всегда приводит к утрате анатомической и функциональной целостности органа, подвергнутого оперативному воздействию. С другой стороны, состояние науки и техники позволяет предложить хирургам арсенал новых методов лечения РПЖ, таких как аблятивные технологии, которые приводят к локальному уничтожению опухоли в организме. С этим связан ряд моментов как предоперационной диагностики, так и интра- и послеоперационного контроля.
Настоящий доклад посвящен опыту НИИ урологии Минздравсоцразвития РФ и наших коллег по лечению рака предстательной железы высокодозным сфокусированным ультразвуком (HIFU).
Малоинвазивные технологии в онкоурологии
HIFU является классическим примером малоинвазивных аблятивных технологий. Механизм абляции опухоли при этом методе складывается из нескольких этапов (рисунок 1):
- повышение температуры до 100о С в точке воздействия сфокусированных ультразвуковых волн;
- возникновение кавитации и «заваривание» сосудов, т. е. прекращение кровотока к органу, где находится опухоль;
- иммунная реакция организма – как местная, так и общая в ответ на травму.
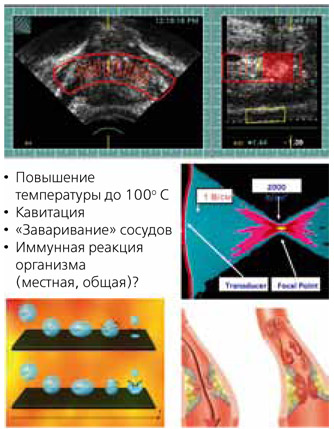
Рисунок 1. Механизм абляции опухоли при HIFU
Клинический опыт применения HIFU, полученный на базе НИИ урологии, получен при использовании аппарата «Sonablate 500» (рисунок 2), который, по нашему мнению, имеет ряд преимуществ по сравнению с другим оборудованием, предназначенным для сфокусированной ультразвуковой терапии:
- мобильность, отсутствует «привязка» к определенному рабочему месту: в нашем случае сеансы HIFU РПЖ выполняются во всех 8 операционных института;
- наличие универсального ультразвукового зонда, позволяющего как визуализировать предстательную железу, так и воздействовать на нее;
- большее фокусное расстояние, дающее возможность подводить ультразвуковую энергию на глубину до 30-40 мм;
- система обратного контроля выполненного лечения, которая определяет результативность проведенной HIFU-терапии и позволяет в этот же сеанс, если необходимо, повторить еще один аблятивный удар в заданной зоне;
- отсутствие дорогостоящих расходных материалов.

Рисунок 2. Оборудование - Sonablate® 500
Сегодня в мире имеется более 100 центров HIFU-терапии «Sonablate», в которых выполнено около 7000 операций.
Под наблюдением японских исследователей (Uchida T., 2007) находились 570 пациентов РПЖ, пролеченных с помощью HIFU- терапии. Общая восьмилетняя выживаемость, свободная от биохимического рецидива, составила 64%, а у пациентов с низкой степенью агрессивности опухоли – до 84%. В 2009 г. эти же ученые представили в Чикаго на Американской ассоциации урологов (Uchida T., 2009) свой 10-летний опыт применения HIFU-терапии на аппаратах «Sonablate» (таблица 1). Они апробировали несколько генераций этой системы и оценили результативность лечения, которая повышалась по мере совершенствования оборудования. Авторы сделали вывод, что использование HIFU-терапии применимо при стадии опухоли T1A, T1B, при отсутствии метастазов, поражения лимфатических узлов, при сумме баллов Глисона 7 и ниже, уровне ПСА до 20 нг/мл и объеме предстательной железы менее 40 см3.
Таблица 1. Sonablate HIFU – 10-летний опыт применения
| SB200 | SB500 | SB500 V4 | |
|---|---|---|---|
| Число пациентов* | 32 | 406 | 224 |
| ВСБР – 8 лет | 56% | 53% | 83% |
| Недержание мочи | 1,5% | ||
| Эректильная дисфункция | - | 40% | 34% |
| Стриктуры уретры** | 20,7% | ||
| * В группу были включены пациенты с раком простаты и низкого и высокого риска ** исследование показало, что частота возникновения стриктур зависит от опыта врача ВСБР – выживаемость, свободная от биохимического рецидива |
В ходе работы 26-ой ежегодной сессии заседаний Европейской ассоциации урологов (EAU) урологи из Франции поделились опытом HIFU- лечения 880 пациентов со стадией заболевания Т1 – 52%, Т2 – 48%, из которых РПЖ низкого риска был у 36% пациентов, среднего – у 48%, высокого – у 16%. Результаты продемонстрировали 7-летнюю общую выживаемость равную 90%, канцерспецифическую – 98%, и семилетнюю выживаемость без метастазов – 96% (Crouzet S., 2011).
Собственный опыт HIFU-терапии
НИИ урологии является пионером внедрения метода HIFU-терапии в России. Еще в 2002 г. мы использовали оборудование версии «Sonablate-200» для лечения доброкачественной гиперплазии предстательной железы (ДГПЖ).Лечение РПЖ методом HIFU на «Sonablate-500», также впервые в России, начато в 2009 г. В других урологических клиниках используется система марки «Ablatherm».
К моменту подготовки этого доклада под нашим наблюдением состоит 56 больных РПЖ, из которых 11 пациентам (20%) HIFU- терапия была выполнена в режиме спасительной (сальважной), после других радикальных методов: простатэктомии, брахитерапии, дистанционной лучевой терапии. Наши промежуточные данные пока не стратифицированы по стадиям заболевания. Период наблюдения составил от 3 до 21 месяца. Однако предварительные результаты свидетельствуют, что общая канцер-специфическая выживаемость за 12 месяцев наблюдения составляет 100%, биохимический рецидив по критериям оценки EAU (ПСА превышает 1 нг/мл) – всего 17,8% (10 пациентов). Полученные результаты сопоставимы с зарубежными данными.
Наша группа – это пожилые мужчины, из 56 пациентов у 23 была сохранена эректильная функция. De novo эректильная дисфункция развилась в 17% случаев (у 4 из 23 пациентов), легкое недержание мочи наблюдалось у 7% (4 пациента из 56). На сегодняшний момент ни один больной не использует прокладки, все они удерживают мочу. Не было отмечено ни одного свища, кровотечения и ни одного летального исхода. Мы встретились с четырьмя случаями (7%) инфравезикальной обструкции, с 2 случаями стриктуры уретры и 2 склерозами шейки мочевого пузы- ря, которые потребовали дополнительного эндоскопического лечения (таблица 2).
Таблица 2. HIFU-терапия (данные НИИ урологии)
| Количество пациентов | 56 пациентов (100%) |
|---|---|
| Средний возраст | 66,6 лет (57- 84) |
| Объем предстатльной железы | 39,5 см3 (7 – 85) |
| ПСА | 9,8 (0,36 – 40,57) |
| Показтель Глисона | 6 (3 – 9) |
| Урофлоуметрия (Qmax) | 16,3 (7 –38) |
| T1-T2 стадия | 96% (54) |
| T3 стадия | 2% (1) |
| M1 стадия | 2% (1) |
| Первичная HIFU | 80% (45 пациентов) |
| Без предшествующей ТУР | 26 пациентов |
| HIFU после ТУР | 33% (19 пациентов) |
| Спасительная HIFU | 20% (11 пациентов) |
| HIFU после простатэктомии | 5% (3 пациента) |
| HIFU после брахитерапии | 5% (3 пациента) |
| HIFU после ДЛТ | 9% (5 пациентов) |
HIFU-терапия с успехом применяется во многих странах Европы и Азии. В России HIFU-терапия разрешена к использованию при лечении заболеваний предстательной железы. Стоит отметить, что совсем недавно FDA выделила значительную сумму для финансирования третьей фазы клинического исследования HIFU-терапии на аппарате «Sonablate» по двум позициям:
- лечение локализованного рака предстательной железы, низкой и средней степени злокачественности;
- спасительная HIFU-терапия при лечении пациентов с рецидивом РПЖ после дистанционной лучевой терапии.
Предварительные данные III фазы мультицентрового исследования, которое проводится под эгидой FDA, показывают многообещающие результаты – средний уровень ПСА на протяжении 18 месяцев равен 0,21 (таблица 3).
Таблица 3. Промежуточные результаты HIFU-лечения РПЖ (данные НИИ урологии)
| Средний период наблюдения | 12 месяцев (3-21 мес) |
|---|---|
| Количество сеансов HIFU | 63 |
| Количество повторов HIFU | 12,5% (7) |
| Дренирование мочевого пузыря | 100% |
| Уретральный катетер | 19% (12) |
| Пункционная цистостома | 81% (51) |
| Среднее время дренирования (дней) | 14 (3-45) |
| Общая и канцерспецифическая выживаемость | 100% |
| Биохимический рецидив (ПСА > 1 нг/мл) | 17,8% (10 пациентов) |
На этапе становления методики всем пациентам с инфравезикальной обструкцией (ИВО) мы выполняли трансуретральную резекцию (ТУР), но сейчас ее применяем крайне редко. Мы считаем, что обструктивный тип мочеиспускания, подтвержденный данными урофлоуметрии, при использовании оборудования «Sonablate» не требует выполнения трансуретральной резекции. И это вполне логично, ведь исторически HIFU-терапия использовалась при лечении доброкачественной гиперплазии предстательной железы. Что же является показанием для ТУР-HIFU? Возможно, только переднезадний размер предстательной железы более 4 см. Большой объем органа не является показанием для ТУР, т. к. уменьшить предстательную железу довольно эффективно можно с помощью гормональной терапии. Если мы используем с этой целью трансуретральную резекцию, то, возможно, получаем некоторые осложнения, которые удлиняют время проведения операции, способствуют риску кровотечения, недержания мочи, склероза шейки мочевого пузыря. Стоит отметить, что у 2 наших пациентов развился склероз шейки мочевого пузыря, и именно после трансуретральной резекции.
HIFU-терапия – это идеальная модель для дистанционного управления процессом лечения рака простаты – от планирования до непосредственно лечения. На базе НИИ урологии имеется уникальный опыт совместной операции по каналам телемедицинской связи – урологов из нашего института и урологов из города Индианаполиса (США), расположенного на расстоянии более 8 тысяч километров. С американской стороны оперировал доктор Дэвид Квигли, у которого большой опыт применения HIFU-терапии РПЖ. Большое преимущество имеет телемедицина на этапе становления метода (наставничество), на этапе контроля качества лечения, а также возможностью привлечения лидеров мировой урологии в лечебный процесс.
Повторимость процедуры – это важный показатель результативности и качества лечения. По данным литературы, повторимость процедуры на одного пациента составляет от 1,44 до 1,17, т. е. в самом лучшем случае 17% пациентов потребует дополнительного повторного лечения с помощью HIFU. Важно, что повторный сеанс HIFU возможно выполнить и в достаточно отдаленные сроки.
Следующим шагом развития аблятивных технологий, и, в частности, HIFU-терапии является фокальная терапия – селективная абляция известного очага опухоли с сохранением функции всего органа, приводящая к минимизации общей заболеваемости без снижения качества жизни. В 2010 г. в Вашингтоне прошел уже III симпозиум по фокальным методам лечения в урологии. Многие из организаторов и участников этого мероприятия присутствуют на конференции у нас в НИИ урологии.
По нашему мнению, идеальным пациентом для выполнения HIFU- терапии является пациент, у которого:
- ПСА составляет 10 и менее нг/мл;
- опухоль имеет сумму баллов Глисона 6 и ниже;
- размер предстательной железы на момент лечения – 40 см3;
- отсутствие кальцинатов предстательной железы размером более 1 см.
Таким образом, исходя из нашего опыта и опыта наших мировых коллег, мы выработали 6 вариантов показаний для лечения с помощью HIFU-терапии:
1 показание – пациент соматически отягощен, ему нельзя выполнить радикальную простатэктомию.
2 показание – при местном рецидиве РПЖ после предшествующих радикальных методов лечения рака предстательной железы, таких как дистанционная лучевая терапия, брахитерапия и радикальная простатэктомия.
3 показание – как альтернатива динамическому наблюдению при клинически незначимом раке предстательной железы.
4 показание – при наличии технических сложностей для выполнения РПЭ – выраженное ожирение до 180 кг (у нас были такие пациенты), пациенты после трансплантации трупной почки и т. д.
5 показание – предшествующая операция на предстательной железе (ТУР или аденомэктомия). Стоит отметить, что у больных этой группы больше осложнений, чем у тех пациентов, которым выполняют простатэктомию. Эти осложнения сопряжены в первую очередь с не- держанием мочи, развитием эректильной дисфункции. Часто у этой группы пациентов выявляются клинически незначимые опухоли.
6 показание – пациенты, которые после ознакомления со всеми вариантами лечения выбрали HIFU-терапию.
Выводы
Хорошая воспроизводимость HIFU и небольшой период обучения могут способствовать быстрому распространению малоинвазивных методов. HIFU может
стать неким переходным мостиком между хирургией и терапией онкоурологических заболеваний. HIFU открывает ряд перспективных направлений развития онкоурологии – это таргетное подведение препаратов к месту абляции; использование системного иммунного ответа на лечение; использование циторедуктивных технологий; применение телемедицинских технологий; оценка возможности создания вакцины и таргетных препаратов. Но одно можно сказать с уверенностью, что новые технологии, и в частности HIFU, не пришли на смену хирургическим методам лечения, а заняли свою нишу в лечении пациентов со злокачественными заболеваниями мочевыводящей системы.
Ключевые слова: рак простаты, HIFU-терапия рака простаты, скрининг рака простаты, радикальная простатэктомия.
Keywords: prostate cancer, HIFU-therapy, scrining of prostate cancer, radical prostatectomy.






