В системе профилактики рака предстательной железы (РПЖ) перспективным направлением является химиопрофилактика – предупреждение РПЖ с помощью длительного применения лекарственных препаратов или природных средств [1, 2]. Для поиска новых химиопрофилактических средств, а также изучения механизмов канцерогенеза и антиканцерогенеза предстательной железы (ПЖ), важная роль принадлежит экспериментальным моделям канцерогенеза на животных. Основная задача, которая стоит перед исследователем, – воспроизвести все этапы канцерогенеза ПЖ, характерные для человека: предраковые изменения (простатическая интраэпителиальная неоплазия, ПИН), локализованный, местно-распространенный и метастатический РПЖ.
По способу моделирования существующие модели канцерогенеза ПЖ на грызунах можно разделить на 5 групп: 1) гетеротрансплантантные (ксенографты) и гомотрансплантантные; 2) трансгенные; 3) гормониндуцированные; 4) индуцированные простат-специфическим канцерогеном; 5) комбинированные (сочетанное введение канцерогена и гормональных средств) [3, 4]. Наиболее близкими к патологии ПЖ у человека являются комбинированные модели с сочетанным введением различных канцерогенов и препаратов тестостерона, который выступает в роли промотора предрака и рака, стимулируя пролиферацию клеток ПЖ [5, 6]. Однако в описанных в литературе моделях не удается одновременно получить достаточную для анализа частоту всех процессов канцерогенеза ПЖ. У животных преобладает только ПИН или только РПЖ, как правило, нет метастазов, к тому же показатели развтия ПИН и РПЖ при комбинированном моделировании весьма вариабельны [7]. В связи с этим, целью нашего исследования стала разработка и количественное описание собственных оригинальных модификаций комбинированных моделей канцерогенеза ПЖ.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент проведен на 86 половозрелых крысах-самцах Вистар с начальной массой 150-170 г, полученных из питомника "Рапполово" РАН (Ленинградская область). Крысы содержались в отдельной комнате в полипропиленовых клетках в условиях автоматически регулируемого искусственного освещения (12 часов - свет, 12 часов - темнота), при температуре воздуха в комнате 20–23°С, относительной влажности воздуха – 54–58%, получали стандартный полнорационный брикетированный комбикорм производства компании "Лабораторкорм" (Москва, Россия) и питьевую водопроводную воду без ограничений.
Перед началом эксперимента животные были рандомизированы и разделены на 3 группы. Первая группа (n=38) – индукция канцерогенеза ПЖ с использованием хирургического метода кастрации. Крысам была выполнена хирургическая кастрация, через 21 день после которой животным ввели однократно внутрибрюшинно пролонгированный препарат смеси эфиров тестостерона (Омнадрен 250, "Jelfa", Польша) в дозе 833 мг/кг массы тела, исходя из расчета – 100 мг/кг тестостерона пропионата – самого "короткоживущего" эфира тестостерона. Спустя 3 дня крысам под эфирным наркозом ввели однократно внутривенно через хвостовую вену N-метил- N-нитрозомочевину (МНМ) (Sigma Aldrich, США, Германия) в дозе 50 мг/кг, растворенную в стерильном физиологическом растворе. Через 7 дней после инъекции МНМ начато введение омнадрена внутрибрюшинно в дозе 16,7 мг/кг, исходя из расчета – 2 мг/кг тестостерона пропионата, который вводили в течение 60 дней с промежутками между инъекциями по 3 дня (всего 15 инъекций). После этого омнадрен вводили внутрибрюшинно в дозе 16,7 мг/кг 1 раз в неделю до конца эксперимента – в течение 42 недель. Вторая группа (n=24) – индукция канцерогенеза ПЖ с использованием фармакологической кастрации ципротерона ацетатом. Крысам вводили ежедневно внутрибрюшинно ципротерона ацетат (Андрокур® Депо, "Schering AG", Германия) в дозе 50 мг/кг массы тела в течение 21 дня. Затем крысам, так же как и в первой группе, вводили омнадрен и МНМ однократно и омнадрен – 15 инъекций, после чего за животными наблюдали до конца эксперимента без дополнительных воздействий. Третья группа (n=24) – интактный контроль: крысы не подвергались никаких воздействий. За крысами 1-й и 2-й групп наблюдали соответственно в течение 55 и 62 недель, после чего оставшихся в живых животных забивали. В интактном контроле половину оставшихся в живых крыс забивали через 55 недель, другую половину – через 62 недели от начала эксперимента. Забой животных осуществляли парами хлороформа.
По окончании эксперимента, а также у забитых в терминальном состоянии и павших до этого крыс, проводилась полная аутопсия. ПЖ у животных забиралась в виде комплекса дорсолатерального отдела и вентральных долей ПЖ, отдельно забирались семенные пузырьки с тесно прилежащими к ним передними долями ПЖ. У всех крыс ПЖ, независимо от макроскопических изменений, брали для гистологического исследования. Фиксацию тканей и их гистологическую обработку проводили стандартными методами. Готовили серийные срезы всех долей ПЖ с шагом микротома 500 мкм. Диагноз РПЖ ставился с учетом степени дифференцировки по индексу Глисона. Диагноз ПИН ставился в том случае, если в препаратах обнаруживали распространенные структурные изменения: множественные или хотя бы единичные очаги (скопления) ацинусов с наличием ПИН. В группах рассчитывали показатели частоты и множественности РПЖ и ПИН. В случае выявления метастазов диагноз подтверждали гистологически. Расчет всех статистических показателей производился по отношению к эффективному числу крыс, то есть дожившим до выявления первого случая ПИН или РПЖ. Результаты экспериментов подвергали статистической обработке на персональном компьютере с помощью программ EXCEL и STATISTICA. Для статистического анализа показателей частоты ПИН и РПЖ использовали тест χ2 и точный метод Фишера, множественности – критерий t (Стьюдента).
РЕЗУЛЬТАТЫ
В группе интактного контроля (3-я группа) из 24 животных 2 (8,3%) погибли от пневмонии, остальные дожили до окончания эксперимента. У всех крыс на аутопсии ПЖ выглядела нормально без видимых макроскопических изменений. В отличие от человека, ПЖ крысы состоит не только из отдела, охватывающего уретру и называемого дорсолатеральным, но имеет еще две вентральных и две передних доли (рис. 1). При морфологическом анализе у крыс из группы интактного контроля дорсолатеральный отдел, вентральные и передние доли ПЖ соответствовали норме (рис. 2), описанной в литературе [8]; не было выявлено ни одного случая ПИН или РПЖ; это согласуется с данными о том, что большинство линий крыс, в том числе крысы-самцы линии Вистар, отличается низкой частотой спонтанных опухолей ПЖ [9].
В 1-й и 2-й группах погибли или были забиты в терминальном состоянии до окончания эксперимента соответственно 22 (64,7%) из 34 крыс и 11 (55%) из 20 крыс. Большинство причин смерти животных было связано с развитием у них злокачественных новообразований. При этом из-за неспецифического действия канцерогена МНМ у крыс развивались не только опухоли ПЖ, но и опухоли других локализаций, наиболее часто выявляли злокачественные лимфомы.
Показатели частоты и множественности ПИН и РПЖ в группах крыс, подвергнутых воздействию кастрации, МНМ и тестостерона, приведены в таблице 1. ПИН обнаружена у большинства крыс, общая частота ПИН в 1-й и 2-й группах составила соответственно 76,5 и 75%, ПИН обнаруживалась во всех трех отделах ПЖ, но чаще – в дорсолатеральном отделе, причем частота крыс с ПИН более чем в 1 отделе ПЖ составила в обеих группах около 60% (табл. 1). В большинстве случаев у крыс с диагнозом ПИН наблюдали распространенные структурные изменения ткани отделов ПЖ, скопления ацинусов с ПИН в очаги, чаще всего – множественные, в нескольких отделах ПЖ. Как правило, при выявлении распространенной ПИН у крыс в отделах ПЖ была одновременно ПИН тяжелой и легкой степени. Наиболее часто ПИН была представлена пучкообразной формой, реже – микрососочковой и крибриформной формами; при выявлении единичных очагов ПИН была обычно плоской и пучкообразной; при обширном поражении ткани ПЖ ПИН наблюдали все ее формы: плоскую, пучкообразную, микрососочковую и крибриформную (рис. 3). Показатели частоты и множественности ПИН в 1-й группе были несколько меньше, чем во 2-й группе, однако статистически достоверной разницы между группами ни по одному параметру не было (таблица). Однако в 1-й группе, по сравнению со 2-й группой, участки ПИН в ткани всех отделов ПЖ были более обширными, преобладала ПИН тяжелой степени, чаще была микрососочковая и крибриформная формы ПИН.
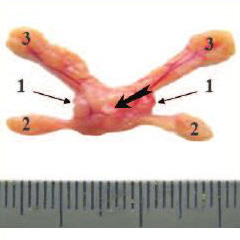
Рис. 1. Макроскопический вид нормальной ПЖ крысы. 1 – дорсолатеральный отдел, 2 – вентральный отдел в виде двух вентральных долей, 3 – передний отдел в виде двух передних долей, прилежащих к семенным пузырькам. Белой стрелкой обозначена простатическая часть уретры
Таблица 1. Показатели развития ПИН и РПЖ в группах крыс, подвергнутых воздействию хирургической или фармакологической кастрации, МНМ и омнадрена
| ПОКАЗАТЕЛЬ | 1-я группа: хирургическая кастрация → омнадрен →МНМ → омнадрен до конца опыта |
2-я группа: фармакологическая кастрация → омнадрен →МНМ → омнадрен 60 дней |
| Число эффективных крыс | 34 | 20 |
| День выявления первого случая ПИН / РПЖ | 244 / 302 | 134/435 |
| Общая частота ПИН / РПЖ | 26 (76,5%)/22 (64,7%) | 15 (75%)/8 (40%)∗ |
| Частота ПИН / РПЖ в дорсолатеральном отделе | 24 (70,6%)/20 (58,8%) | 13 (65%)/8 (40%) |
| Частота ПИН / РПЖ в вентральном отделе | 16 (47,1%)/2 (5,9%) | 12 (60%)/1 (5%) |
| Частота ПИН / РПЖ в переднем отделе | 12 (35,3%)/10 (29,4%) | 11 (55%)/0∗∗ |
| Частота метастатического РПЖ | 11 (32,4%) | 1 (5%)∗ |
| Количество выявленных случаев ПИН / РПЖ | 52/38 | 36 / 9 |
| Частота ПИН / РПЖ в 2 или 3 отделах ПЖ | 19 (55,9%)/11 (32,4%) | 12 (60%)/1 (5%)∗ |
| Множественность ПИН / РПЖ на крысу из группы | 1,53 ± 0,19/1,12 ± 0,18 | 1,80 ± 0,29/0,45 ± 0,14∗∗ |
| Множественность ПИН / РПЖ на крысу-носителя ПИН или РПЖ | 2,0 ± 0,15/1,73 ± 0,18 | 2,4 ± 0,21/1,12 ± 0,12∗∗ |
Частота ПИН / РПЖ – абсолютное количество крыс с патологией (%)
Множественность ПИН / РПЖ рассчитывалась по отношению ко всем крысам в группе и по отношению к
носителям, у которых была выявлена данная патология, М ± m
Разница со 1-й группой статистически достоверна: ∗ – p < 0,05; ∗∗ – p < 0,01
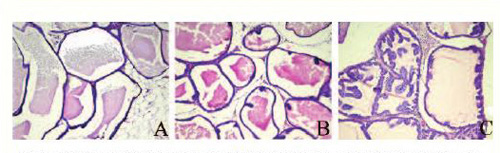
Рис. 2. Нормальная гистологическая структура ПЖ крысы: А – вентральная доля; В – дорсолатеральный отдел; С – передняя доля. Гематоксилин/эозин, ×270
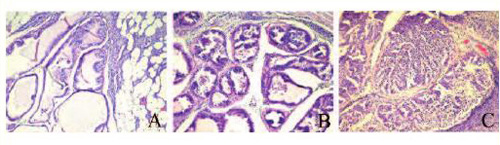
Рис. 3. ПИН: А – ПИН плоская, пучкообразная и микрососочковая вентральной доли; В – ПИН пучкообразная и микрососочковая дорсолатерального отдела; С – ПИН крибриформная передней доли. Гематоксилин/эозин, ×270
Если первые случаи ПИН в 1-й и 2-й группах были обнаружены через 244 и 134 дня от начала эксперимента, то первые случаи РПЖ – существенно позже: через 302 и 435 дней, соответственно. С наибольшей частотой и множественностью РПЖ были диагностированы в 1-й группе: общая частота РПЖ составила 64,7%, причем в большинстве случаев опухоли выявлялись уже при макроскопическом обследовании в виде локализованных или местно- распространенных новообразований, чаще всего рак развивался в дорсолатеральном отделе, реже – в передних долях, в единичных случаях – в вентральных долях, иногда рак, исходящий из дорсолатерального отдела, прорастал в вентральные доли и семенные пузырьки с передними долями (рис. 4); у 32,4% крыс рак диагностирован одновременно в 2-х или 3-х отделах ПЖ; у 32,4% – рак ПЖ был метастатическим (табл. 1). В 1-й группе многие крысы с РПЖ имели выраженные симптомы нижних мочевых путей. Таких крыс забивали в терминальном состоянии. Наиболее частым при аутопсии крыс с симптомами нижних мочевых путей было опухолевое поражение дорсолатерального отдела ПЖ с прорастанием в другие доли ПЖ и семенные пузырьки, мочевой пузырь был растянут и переполнен, с признаками гематурии (рис. 5). По гистологическому типу все выявленные случаи РПЖ были аденокарциномами, в основном, низкой степени дифференцировки с высоким индексом по шкале Глисона: 7–10 баллов (рис. 6).
При метастатическом РПЖ наиболее характерными были метастазы в висцеральную брюшину, сальник, брыжейку кишечника (рис. 5). РПЖ также метастазировал в почки, печень, селезенку, легкие, различные группы лимфоузлов: парааортальные, параректальные, лимфоузлы ворот печени, почек, селезенки, желудка. Наиболее часто метастазировал РПЖ дорсолатерального отдела, в более редких случаях – РПЖ переднего отдела. При морфологическом исследовании все метастазы имели гистологическую структуру аденокарциномы ПЖ с индексом Глисона 7–10 баллов (рисунок 7).
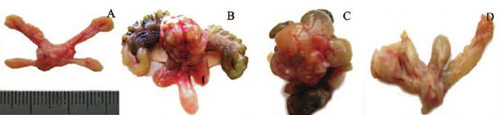
Рис. 4. Рак простаты, макроскопический вид. А – нормальная ПЖ; В – рак дорсолатерального отдела; С – рак, поражающий все отделы; D – рак передней доли
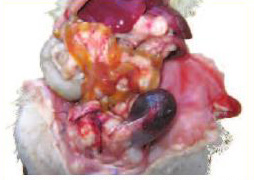
Рис. 5. Макроскопический вид крысы на вскрытии. Рак дорсолатерального отдела простаты с прорастанием всех долей ПЖ и семенных пузырьков, прорастанием и сдавлением уретры; переполненный кровью мочевой пузырь, множественные метастазы висцеральной брюшины, сальника, брыжейки кишечника
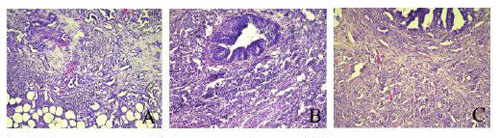
Рис. 6. Аденокарцинома ПЖ: А –вентральной доли ПЖ; В –дорсолатерального отдела;С –передней доли. Гематоксилин/эозин, ×270
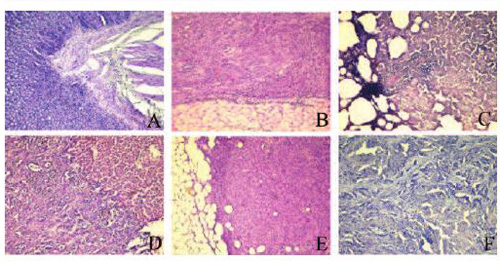
Рис. 7 . Метастазы аденокарциномы ПЖ: А – в брыжейке кишечника; В –в висцеральной брюшине и брюшной стенке; С – в легком; D – в печени; Е – в сальнике; в парааортальном лимфоузле. Гематоксилин/эозин, ×270
Во 2-й группе общая частота РПЖ составила лишь 40%, большинство показателей частоты и множественности РПЖ было статистически достоверно меньше, чем в 1- й группе (табл. 1). Макроскопически при аутопсии РПЖ был обнаружен у единичных крыс, метастатический РПЖ – лишь у 1 крысы. Большинство случаев РПЖ было обнаружено у забитых по окончании экспериментов животных при морфологическом анализе серийных срезов ПЖ. По гистологическому типу все выявленные случаи РПЖ были аденокарциномами различной степени дифференцировки по индексу Глисона. РПЖ, видимый при макроскопическом исследовании, был низкодифференцированным; РПЖ, обнаруженный только при микроскопическом исследовании в виде микроочагов был более дифференцированным.
ОБСУЖДЕНИЕ
Нами разработаны две новые модификации комбинированной двухстадийной модели канцерогенеза ПЖ, основанные на следующих принципах: у крыс вызывается атрофия ПЖ путем хирургической кастрации (1-я группа) или временной фармакологической кастрации с помощью ципротерона ацетата (2-я группа), через 3 недели вводится препарат тестостерона в высокой дозе, который стимулирует пролиферацию клеток ПЖ [10], в период интенсивной пролиферации клеток вводится канцероген МНМ в качестве инициатора, повреждающего ДНК клеток ПЖ, а затем дается тестостерон в меньшей дозе, который, как известно, промотирует канцерогенез ПЖ [10], в течение длительного времени до конца жизни животных (1-я группа) или в течение 60 дней, после чего восстановившиеся к этому времени собственные семенники вырабатывают тестостерон (2-я группа). В отличие от описанных в литературе комбинированных моделей канцерогенеза ПЖ, мы впервые использовали пролонгированную форму тестостерона – препарат омнадрен, который представляет собой смесь эфиров тестостерона: пропионата, фенилпропионата, изокапроната и капроната.
В результате в 1-й группе удалось с высокой частотой и множественностью смоделировать одновременно все этапы канцерогенеза ПЖ: ПИН, локализованный, местно-распространенный и метастатический РПЖ. По гистологической структуре ПИН и РПЖ были близки к данной патологии ПЖ у человека [10]. Во 2-й группе с высокой частотой и множественностью развивались только очаги ПИН, частота и множественность РПЖ были невысокими, причем в большинстве случаев РПЖ был микроинвазивным и диагностировался только при морфологическом анализе серийных срезов ткани ПЖ. В 1-й группе, по сравнению со 2-й группой, чаще выявляли микрососочковую и крибри формную ПИН, а РПЖ был менее дифференцированным (больший индекс Глисона), что свидетельствует о более быстром и агрессивном развитии экспериментальной патологии, переходе предрака в РПЖ и его метастатическую форму. Несколько меньшая частота и множественность ПИН в 1-й группе связаны с тем, что у части крыс опухоль поражала всю ткань ПЖ, и очаги ПИН уже были не видны. Примененная нами методика оценки частоты и множественности ПИН и РПЖ позволяет количественно оценить выраженность предрака и рака ПЖ
С учетом использования в качестве промотора канцерогенеза ПЖ тестостерона, вероятно, индуцированный РПЖ был гормонозависимым, но не исключено, что метастатический РПЖ становился гормононезависимым. Этот вопрос требует специального изучения.
ЗАКЛЮЧЕНИЕ
Разработанные модификации комбинированной двухстадийной модели канцерогенеза ПЖ с использованием различных методов кастрации, канцерогена МНМ и промоции пролонгированным препаратом тестостерона позволяют смоделировать предрак (ПИН) и РПЖ. Хирургическая кастрация, введение МНМ и длительная промоция тестостероном дают возможность одновременно индуцировать с большой частотой и множественностью весь комплекс предраковых изменений и РПЖ, характерный для человека: ПИН тяжелой и легкой степени плоской, пучкообразной, микрососочковой и крибриформной формы; локализованный, местнораспространенный и метастатический РПЖ с высоким индексом Глисона. Фармакологическая кастрация, введение МНМ и кратковременная промоция тестостероном позволяют с высокой частотой и множественностью получить лишь предраковые изменения ПЖ – ПИН. Разработанные модификации комбинированной модели канцерогенеза ПЖ и предложенная методика количественной оценки развития ПИН и РПЖ могут быть использованы с целью изучения процессов канцерогенеза ПЖ, доклинического изучения эффективности новых и существующих препаратов, потенциально применимых для первичной и вторичной химиопрофилактики РПЖ.
ЛИТЕРАТУРА
1. Беспалов В.Г., Муразов Я.Г., Панченко А.В. Химиопрофилактика рака предстательной железы: обзор клинических и доклинических данных // Экспериментальная и клиническая урология. 2011. № 4. С. 80–85.
2. Сивков А.В., Жернов А.А., Кешишев Н.Г., Шкабко О.В. Место ингибиторов 5αредуктазы в химиопрофилактике рака предстательной железы // Экспериментальная и клиническая урология. 2012. № 2. С. 52–57.
3. Fizazi K., Navone N.M. Modèles précliniques de cancer de la prostate // Bull Cancer. 2005. Vol. 92. P. 129–141.
4. Lamb D.J., Zhang L. Challenges in prostate cancer research: animal models for nutritional studies of chemoprevention and disease progression // J Nutr. 2005. Vol. 135. 12 Suppl. P. 3009S–3015S.
5. Bosland M.C., Prinsen M.K. Induction of dorsolateral prostate adenocarcinomas and other accessory sex gland lesions in male Wistar rats by a single administration of N-methyl-N-nitrosourea, 7,12- dimethylbenz(a)anthracene, and 3,2’-dimethyl-4-aminobiphenyl aer sequential treatment with cyproterone acetate and testosterone propionate // Cancer Res. 1990. Vol. 50. P. 691–699.
6. McCormick D.L., Rao K.V., Johnson W.D., Bosland M.C., Lubet R.A., Steele V.E. / Null activity of selenium and vitamin E as cancer chemopreventive agents in the rat prostate // Cancer Prev. Res. (Phila). 2010. Vol. 3. P. 381–392.
7. Bosland M.C. Use of animal models in defining efficacy of chemoprevention agents against prostate cancer // Eur Urol. 1999. Vol. 35. P. 459–463.
8. Ito N., Shiray T. Tumours of accessory male sex organs // In: Pathology of Tumours in Laboratory Animals, Second Edition, Vol. 1, Tumours of the Rat / Ed. by V.S., U. Mohr. IARC Sci. Publ. No. 99. Lyon: France: International Agency for Research on Cancer, 1990. P. 421–443.
9. Scolnik M.D., Servadio C., Abramovici A. Comparative study of experimentally induced benign and atypical hyperplasia in the ventral prostate of different rat strains // J Androl. 1994. Vol. 15. P. 287–297.
10. Клиническая онкоурология / Под редакцией Матвеева Б.П. Москва: Российское общество онкоурологов, 2011. С. 495–560.






