В настоящее время можно считать доказанным факт наличия взаимосвязи между нефролитиазом и ренальной остедистрофией [1, 2]. Однако особый интерес представляет исследования причинно-следственных связей между нефролитиазом, метаболическими поражениями костного скелета и заболеваниями других органов, не являющихся осложнениями первых двух патологических процессов. Данный вопрос сравнительно малоизучен. Результаты проведенных исследований нередко сложны в оценке, но все они достойны внимания вследствие своей актуальности, причем не только для урологии, но и для смежных специальностей.
N.A. Incel et al. представили данные о связи нефролитиаза, остеопороза и анкилозирующего спондилоартрита (болезни Бехтерева) [3]. На сегодняшний день доказана причинно-следственная связь между болезнью Бехтерева и снижением минеральной плотности костной ткани [4, 5]. Однако авторским коллективом данной публикации выявлен достоверно больший риск развития остеопороза и переломов шейки бедра при сочетании анкилозирующего спондилита и нефролитиаза по сравнению с отсутствием последнего. Кроме того установлен повышенный риск самого нефролитиаза у больных, страдающим анкилозирующим спондилоартритом [3].
Можно предположить, что выявленная авторами закономерность окажется актуальной и в отношении других тяжелых и распространенных артропатий. Таких исследований пока нет, тем не менее, в реальной клинической практике прослеживается четкая связь между повышенным риском уратного нефролитиаза и наличием у пациента тяжелого псориаза, особенно суставного.
P. Wong et al. изучали взаимосвязи между талассемией, костными нарушениями и нефролитиазом. Хронические гемолитические анемии, в том числе и талассемии, считаются одним из факторов, предрасполагающих к развитию вторичного остеопороза. В ретроспективное исследование вошли 166 больных талассемией, «часто подвергающихся гемотрасфузиям», что является критерием тяжести этого заболевания. Частота нефролитиаза составила 18,1%, причем у мужчин камнеобразование отмечалось в 3 раза чаще, чем у женщин (28,7% и 9,7% соответственно). Снижение минеральной плотности костной ткани различной степени выраженности было отмечено у всех пациентов [6]. Выявленная авторами частота нефролитиаза и его гендерное распределение, наводит на мысль о симптоматическом характере почечных конкрементов. Можно предположить, что вторичные по отношению в тяжелой гемолитической анемии и многочисленным гемотрансфузиям конкременты должны состоять из уратов. Тогда поднимается вопрос о необходимости медикаментозной профилактики аллопуринолом – если не всем пациентам, то хотя бы мужчинам, имеющим более высокую частоту данного осложнения. Однако состояние пуринового обмена, не являлись предметом исследования. Вполне понятно, что поражение костного скелета вторично по отношению к талассемии и вряд ли имеет причинно-следственную связь с нефролитиазом.
В клинике урологии и нефрологии университета Нагоя (Япония) проведено изучение влияния лечебной физкультуры и бисфосфонатов на повышенный риск камнеобразования у больных, длительно соблюдающих постельный режим. В настоящее время считается доказанным факт снижения минеральной плотности костной ткани и увеличения риска образования почечных конкрементов у подобных больных [5]. В ходе исследования установлено, что почечные конкременты у таких больных состоят из оксалата или фосфата кальция. В качестве лекарственной терапии был назначен памидронат – препарат из группы бисфосфонатов. Лечебная физкультура и памидронат как вместе, так по отдельности снижали прогрессирование остеопении и остеопороза, а также уменьшали риск камнеобразования [7].
Также представляет интерес взаимосвязь хронических заболеваний органов желудочно-кишечного тракта, нефролитиаза и поражения костного скелета. Болезнь Крона, целиакия, неспецифический язвенный колит давно расцениваются как фоновые заболевания по отношению к вторичному остеопорозу [4,5]. Однако в литературе имеются отдельные публикации о возможной связи заболеваний органов пищеварения и нефролитазом. По оценке Reynolds T.M. у пациентов с болезнью Крона и неспецифическим язвенным колитом гиперкальциурия, сопровождаемая нефролитиазом встречается на 8,6% чаще по сравнению с общей популяцией, что, по мнению автора, может быть объяснено повышением абсорбции кальция в кишечнике [8].
Настоящее исследование продолжает актуальную в условиях старения населения тематику коморбидности.
Целью работы было изучение механизмов патогенеза костных поражений у больных страдающих нефролитиазом на фоне сопутствующего андрогенного дефицита, ишемической болезни сердца и сахарного диабета II типа.
МАТЕРИАЛЫ И МЕТОДЫ
Настоящее исследование выполнено на 193 пациентах, прошедших обследование и лечение в ФГБУ «НИИ урологии» Минздрава России и ГКУБ № 47 Департамента здравоохранения г. Москвы за период с 2006 по 2013 гг. Среди них было 86 мужчин и 107 женщин, при этом 69,7% мужчин и 74,8% женщин имели возраст старше 40 лет.
В исследование включались пациенты, страдающие уратным (40 чел), оксалатным (101 чел.) или фосфатным нефролитиазом (52 чел.) и одним из вышеперечисленных заболеваний. Сопутствующий андрогенный дефицит имело 45 пациентов, ишемическую болезнь сердца, осложненную недостаточностью кровообращения – 43 человека, сахарный диабет II типа в стадии компенсации – 27 больных. Оставшиеся 78 пациентов составили контрольную группу.
Из исследования исключались пациенты, страдающие нефролитиазом вследствие первичного гиперпаратиреоза, канальцевых дисфункций и наследственных дефектов минерального обмена, а также имеющие выраженную почечную недостаточность (ХПН II-III стадии, ХБП III-V стадии), другие сопутствующие заболевания, а также их комбинации.
Для количественной оценки минеральной плотности костной ткани применялась остеоденситометрия пяточной кости на аппарате DXL Calscan фирмы Lund (Швеция). По мнению ряда исследователей, определение минеральной плотности костной ткани пяточного бугра по диагностической значимости соизмеримо с результатами комбинированного исследования минеральной плотности тела позвонков и зоны Варда бедра [9-12].
Диагностика остеопороза осуществлялась на основании Методических указаний Международного общества клинической денситометрии. Диагноз устанавливался по Ткритерию, то есть в стандартных отклонениях от нормативных показателей пиковой костной массы. При этом Т критерий выше –1 рассматривался как норма, меньше –1, но больше –2,5 как остеопения, -2,5 и ниже как остеопороз.
Анализ мочевых камней осуществлялся методом спектрального анализа на анализаторе NICOLETiS10 ermoscientific, США.
Определение уровня гормонов в крови, влияющих на метаболизм кальция (паратиреоидный гормон, остеокальцин), а также маркера деградации коллагена 1 типа костной ткани Cross laps производилось иммунохемолюминесцентным методом с применением фирменных наборов реактивов на аппарате ЭЛЕКСИС2010 Roche (Швейцария).
Статистическая обработка цифровых данных проводилась с помощью программы Statistica 6.0 с использованием t-критерия Стьюдента, U-критерия Вилкоксона-Мана и коэффициента корреляции Спирмана. Статистически значимыми различия между группами признавались при p < 0,05.
ВЗАИМОСВЯЗЬ МИНЕРАЛЬНОЙ ПЛОТНОСТИ КОСТНОЙ ТКАНИ С УРОВНЕМ ТЕСТОСТЕРОНА У МУЖЧИН, С НЕФРОЛИТИАЗОМ
Физиологические эффекты тестостерона разнообразны. Наряду с влиянием на половую функцию, андрогены оказывают существенное влияние и на костный обмен, выступая в качестве стимуляторов костеобразования. По сути, здесь имеет место характерный для всех андро-генов анаболический эффект. В 2002 году Mash B. et al доказали наличие рецепторов к андрогенам на остеобластах [13].
Кроме прямого воздействия на остеобласты, андрогены могут оказывать и опосредованное влияние, например, через стимуляцию выработки соматотропного гормона (гормона роста), который также является стимулятором костеобразования, через воздействия на рецепторы к эстрогенам после превращения тестостерона в эстроген с участием фермента ароматазы [5]. В настоящее время дефицит тестостерона расценивается не только как одна из основных причин вторичного остеопороза у мужчин, но и как фактор риска развития нефролитиаза [14].
Наибольшие значения уровня тестостерона крови получены у больных с рецидивирующим оксалатным нефролитиазом (5,72±0,68 нг/мл), несколько меньшие значения выявлены у мужчин с фосфатными камнями (4,03±0,49 нг/мл), достоверно более низкие значения выявлены при уратном уролитиазе (2,43±0,29 нг/мл) (р=0,00027 по сравнению группой пациентов с оксалатным нефролитиазом, р=0,048 по сравнению группой пациентов с фосфатным нефролитиазом). Различия между группами мужчин с оксалатным и фосфатным уролитиазом по среднему сывороточному уровню тестостерона оказались статистически недостоверными (р=0,320). (рис. 1).

Рис. 1. Соотношение уровня тестостерона в крови больных мочекаменной болезнью (МКБ) с различным составом мочевых камней. А – сравнение больных с оксалатными и фосфатными камнями, Б – сравнение больных с оксалатными и уратными камнями, В – сравнение больных с фосфатными и уратными камнями
Различия по уровню тестостерона в анализируемых группах могли быть связаны и с возрастом пациентов, в среднем составившем 46,9±2,7 50,8±2,4 56,1±2,7 лет соответственно при оксалатном, фосфатном и уратном нефролитиазе. Хотя статистически достоверной разницы между возрастом больных разных групп, выделенных согласно химической структуре конкрементов, не было (p > 0,05), тем не менее, наблюдалась явная тенденция к увеличению доли мужчин старшего возраста в группе пациентов, страдающих рецидивирующим уратным уролитиазом.
По современным представлениям именно уратный уролитиаз является характерным спутником метаболического синдрома у мужчин, важным компонентом которого является андрогенная недостаточность [14, 15]. Полученные результаты подтверждают и в некоторой степени дополняют полученные другими исследователями результаты.
Попытка сопоставить значения минеральной плотности костной ткани с уровнем тестостерона в группах с мужчин с различным химическим составом почечных конкрементов не привела к выявлению достоверных закономерностей. У всех больных с оксалатными и фосфатными камнями уровень тестостерона был в пределах нормы (5,72±0,68 нг/мл и 4,03±0,49 нг/мл соответственно), тогда как у большинства больных с уратным уролитиазом он был на нижней границе нормы (2,43±0,29 нг/мл). Однако, при сопоставлении частоты остеопении и остеопороза во всей выборке пациентов с рецидивирующим уратным нефролитиазом и в подгруппе мужчин с этой формой уролитиаза в сочетании с андрогенной недостаточностью было отмечено более частое выявление остеопороза и остеопении при андрогеном дефиците. Нормальная минеральная плотность костной ткани выявлена лишь у 44% больных этой подгруппы, что достоверно нижем, чем в общей выборке мужчин, страдающих рецидивирующим уратным нефролитиазом (67%) (p< 0,05). При этом частота выявления остеопении и остеопороза при сопутствующем андрогенном дефиците возрастала по сравнению с общей выборкой 1,7-1,8 раза (p< 0,05).
Следующим этапом был выполнен корреляционный анализ между сывороточными концентрациями тестостерона и паратиреоидного гормона в тех же группах мужчин, выделенных согласно химической структуре почечных конкрементов. В гуморальной регуляции фосфорно-кальциевого обмена паратиреоидный гормон играет ключевую роль. Физиологические эффекты этого гормона разнообразны. Однако основным можно признать увеличение интенсивности костного метаболизма с преимущественным усилением активности остеокластов, в результате чего доминируют процессы костной резорбции [5].
В группе мужчин, страдающих рецидивирующим нефролитиазом (без уточнения формы) выявлена слабая корреляция между сывороточными концентрациями паратиреоидного гормона и тестостерона (r=-0,276), не достигающая статистической значимости (р=0,113) (рис. 2).
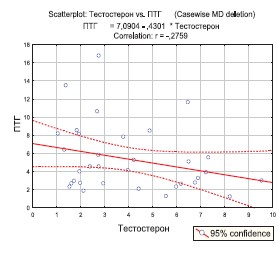
Рис. 2. Результаты корреляционного анализа взаимосвязи индивидуальных значений сывороточного уровня тестостерона и паратиреоидного гормона у мужчин, страдающих рецидивирующим нефролитиазом
У мужчин с рецидивирующим оксалатным нефролитиазом средний уровень паратиреоидного гормона оказался достоверно ниже, чем у мужчин с фосфатными и уратными конкрементами (соответственно 3,32±0,29, 6,98±0,93 и 7,44±0,87 пг/мл; р=0,0053 при сравнении групп пациентов, страдающих рецидивирующим оксалатным и фосфатным нефролитиазом; р=0,011 при сравнении групп пациентов, страдающих рецидивирующим оксалатным и уратным нефролитиазом). Различия по среднему уровню паратиреоидного гормона между группами мужчин, страдающих рецидивирующим фосфатным и уратным уролитиазом не достигли статистической значимости (р=0,385) (рис. 3).
Обращает на себя внимание обратная зависимость между уровнями тестостерона и паратиреоидного гормона в группах больных, страдающих различными формами рецидивирующего нефролитиаза. У мужчин с оксалатными камнями выявляли наибольшие значения тестостерона (5,72±0,68 нг/мл) и наименьшие значения паратиреоидного гормона (3,32±0,29 пг/мл), тогда как при уратном уролитиазе наблюдалась обратная картина: наименьший уровень тестостерона (2,43±0,29 нг/мл) и наивысшие значения уровня паратиреоидного гормона (7,44±0,87 пг/мл).

Рис. 3. Соотношение уровней паратиреоидного гормона и тестостерона у мужчин, страдающих различными формами нефролитиаза. А – сравнение мужчин с оксалатным и фосфатным нефролитиазом, Б – сравнение мужчин с оксалатным и уратным литиазом, В – сравнение мужчин с фосфатным и уратным нефролитиазом
В группе мужчин с фосфатными камнями значения обоих показателей были промежуточными (тестостерон – 4,03±0,49 нг/мл, паратиреоидный гормон – 6,98±0,93 пг/мл).
При раздельном корреляционном анализе взаимосвязи сывороточных уровней паратиреоидного гормона и тестостерона отмечено отсутствие значимой корреляции между этими показателями в группах мужчин, страдающих рецидивирующим оксалатным и уратным нефролитиазом (r=0,041 и r=-0,116 соответственно, p>0,05), в то время как у мужчин с рецидивирующим фосфатным нефролитиазом выявлена статистически значимая корреляция между этими показателями (r=0,354, р=0,041) (рис. 4).
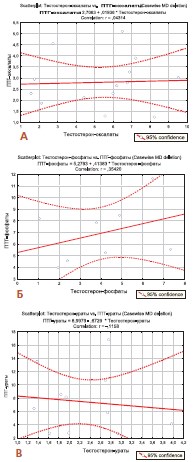
Рис. 4. Результаты корреляционного анализа взаимосвязи уровней тестостерона и паратиреоидного гормона у мужчин с оксалатным (А), фосфатным (Б) и уратным (В) уролитиазом
Таким образом, можно отметить выраженное негативное влияние пониженного уровня тестостерона на состояние костного скелета пациентов, страдающих рецидивирующим нефролитиазом вне зависимости от его формы.
Наблюдаемое повышение уровня паратиреоидного гормона, закономерно приводящее к активизации остеокластов, усиливает костные эффекты андрогенного дефицита.
СЕРДЕЧНО-СОСУДИСТЫЕ ЗАБОЛЕВАНИЯ, МИНЕРАЛЬНЫЙ СОСТАВ КОСТНОЙ ТКАНИ И КОСТНЫЙ МЕТАБОЛИЗМ
Выявленное влияние уровня половых гормонов на состояние костного скелета у больных, страдающих рецидивирующих нефролитиазом, создает предпосылки для оценки значимости сопутствующих заболеваний. Не вызывает сомнений негативное влияние на минеральную плотность костной ткани дефицита женских половых гормонов, гипои гиперфункции щитовидной железы, системных ревматических заболеваний, тяжелой хронической почечной недостаточности, почечного канальцевого ацидоза, тяжелые поражения желудочно-кишечного тракта, приведшие к мальабсорбции [16]. Однако роль сердечно-сосудистых заболева-ний в патогенезе остеопороза исследована все еще недостаточно. Между тем, сердечно-сосудистые заболевания являются одним из важнейших компонентов метаболического синдрома, при котором часто развиваются нарушения минерального обмена, в том числе уратный уролитиаз. Поэтому представляется целесообразным оценить влияние тяжелых сопутствующих сердечно-сосудистых заболеваний, в частности, ишемической болезни сердца, осложненной недостаточностью кровообращения, на состояние костного скелета у пациентов, страдающих различными формами рецидивирующего нефролитиаза.
Средние значения T-критерия у больных, страдающих рецидивирующим нефролитиазом и не имеющих сопутствующих сердечно-сосудистых заболеваний, оказались достоверно выше, чем у аналогичных пациентов, имеющих сопутствующую ишемическую болезнь сердца, осложненной недостаточностью кровообращения (соответственно – 0,736±0,106 и -1,282±0,084, р=0,0002).
У мужчин, имеющих сопутствующую ишемическую болезнь сердца, осложненной недостаточностью кровообращения, средний уровень тестостерона крови составил 2,80±0,29 нг/мл), что достоверно ниже, чем у пациентов, страдающих рецидивирующим нефролитиазом и имеющих сохранную сердечно-сосудистую систему (6,74±0,48нг/мл) (p< 0,05). Такая зависимость сохранялась во всех группах больных с разным составом камней. При этом у больных с оксалатным и уратным уролитиазом и сопутствующей ишемической болезнью сердца, осложненной недостаточностью кровообращения уровень тестостерона был близок к нижней границе нормы (2,98±0,31 и 3,53±0,33 нг/мл соответственно), тогда как у больных без сопутствующих сердечно-сосудистых заболеваний (8,15±0,83 и 6,73±0,71 нг/мл соответственно), а у пациентов с фосфатными камнями был ниже нормы (0,98±0,11 и 5,33±0,51 нг/мл соответственно) (рис. 5).
Анализ распределения пациентов, страдающих рецидивирующим нефролитиазом, по степени снижения минеральной плотности костной ткани также выявил достоверное негативное влияние сопутствующих сердечно-сосудистых заболеваний. Нормальная минеральная плотность костной ткани (>-1 по T-критерию) в группе пациентов, страдающих рецидивирующим нефролитиазом на фоне сопутствующей ишемической болезни сердца, осложненной недостаточностью кровообращения, отмечена у 33,9% больных, что достоверно меньше по сравнению по сравнению с аналогичной группой пациентов с сохранной сердечно-сосудистой системой (59,7%, p< 0,05). Умеренное уменьшение минеральной плотности костной ткани (остеопения) в указанных группах выявлено соответственно в 55,9% и 36,1% случаев (p< 0,05); выраженное снижение минеральной плотности костной ткани (остеопороз) – соответственно в 10,2% и 4,2% случаев (p< 0,05).
При анализе влияния сердечнососудистых заболеваний на состояние костного скелета у больных, страдающих различными формами нефролитиаза, выявилась та же тенденция, что и в общей выборке пациентов. У больных, страдающих оксалатным и фосфатным уролитиазом, различия оказались статистически достоверными и значения этого показателя смещались от нормальных или близких к нижней границы нормы значений до патологических (-1,29 и -1,69 соответственно, p< 0,05), то у больных с уратным нефролитиазом ухудшение состояния костной ткани оказалось статистически недостоверным (p>0,05), а средние значения не выходили за пределы нормы (-0,70).
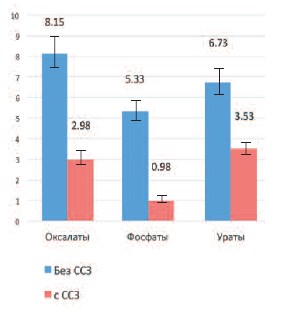
Рис. 5. Уровень тестостерона у мужчин, страдающих различными формами рецидивирующего нефролитиаза, имеющих сопутствующую ишемическую болезнь сердца и не имеющих сердечно-сосудистой патологии. Достоверность различий ** p<0,01, *** p< 0,001.
Также было исследовано влияние сопутствующей ишемической болезни сердца, осложненной недостаточностью кровообращения, на уровни паратиреоидного гормона, остеокальцина, а также маркера деградации костного коллагена I типа Cross laps. Сопутствующая ишемическая болезни сердца, осложненная недостаточностью кровообращения, достоверно не влияла на уровень паратиреоидного гормона у пациентов, страдающих рецидивирующим оксалатным (4,96±0,87 и 5,71± 0,71 пг/мл соответственно (p>0,05)) и фосфатным нефролитиазом 7,83± 1,09 и 6,96±1,01 пг/мл соответственно (p>0,05)), тогда как при рецидивирующем уратном нефролитиазе сывороточная концентрация этого гормона была достоверно выше при наличии ишемической болезни сердца, осложненной недостаточностью кровообращения (7,13±0,98 и 3,16±0,41 пг/мл соответственно, p<0,01).
По уровню остеокальцина достоверных различий в группах пациентов, разделенных по химическому составу почечных конкрементов и состоянию сердечно-сосудистой системы, выявлено не было. У больных с оксалатным уролитиазом, имеющих или не имеющих сердечно-сосудистые заболевания, уровень остеокальцина составил 4,56±0,41 и 4,04±0,46 нг/мл соответственно, при фосфатном уролитиазе – 3,01±0,32 и 3,88±0,37 нг/мл соответственно, а в при уратных камнях – 3,08±0,24 и 3,14±0,37 нг/мл соответственно (во всех группах p>0,05).
Значения маркера деградации коллагена I типа костной ткани Cross laps достоверно повышались в группе больным с фосфатным уролитиазом и сопутствующей ишемической болезнью сердца, осложненной недостаточностью кровообращения (0,56±0,02 мкг/л и 0,47±0,02 мкг/л при наличии или отсутствии сердечно-сосудистых заболеваний, p< 0,05), тогда как у пациентов с оксалатным и уратным нефролитиазом влияния сердечно-сосудистой патологии на уровень Cross laps не было обнаружено (0,52±0,35 и 0,56±0,42 мкг/л при оксалатных камнях и 0,48±0,36 и 0,49±0,43 мкг/л при уратных камнях соответственно, p>0,05).
Таким образом, сопутствующая ишемической болезни сердца, осложненная недостаточностью кровообращения, являются существенным фактором риска снижения минеральной плотности костной ткани у больных страдающих рецидивирующим нефролитиазом. Вероятность развития вторичных изменений костной системы выше у больных с фосфатным уролитиазом по сравнению с пациентами, имеющими почечные конкременты другого химического состава.
В основе патогенеза снижения минеральной плотности костной ткани лежит активизация процессов костной резорбции.
САХАРНЫЙ ДИАБЕТ II ТИПА, СОСТАВ КОСТНОЙ ТКАНИ И КОСТНЫЙ МЕТАБОЛИЗМ
Остеопороз и остеопения считаются одним из поздних осложнений сахарного диабета. Выраженность дефицита минеральной плотности костной ткани коррелирует с длительностью заболевания и возрастом его начала, степенью компенсации нарушений углеводного обмена, а также наличием других осложнений, прежде всего диабетической нефропатии [17].
Доминирующим механизмом снижения минеральной плотности костной ткани при сахарном диабете является уменьшение активности остеобластов, то есть уменьшение интенсивности костеобразования. Отдельные исследователи отмечают и некоторое усиление костной резорбции [18].
Была исследована минеральная плотность костной ткани и состояние костного метаболизма у пациентов, страдающих различными формами нефролитиаза и имеющих сопутствующий компенсированный сахарный диабет II типа.
У больных, имеющих сопутствующий компенсированный сахарный диабет II типа, по минеральной плотности костной ткани, по уровню паратиреоидного гормона и маркера деградации костного коллагена Cross laps не было достоверных различий по сравнению с пациентами с сохранным углеводным обменом. Средние значения Т-критерия у пациентов без диабета и с диабетом составили -1,04±0,01 и – 1,013±0,01 соответственно, концентрация паратиреиодного гормона – 5,33±0,52 и 4,55±0,48 пг/мл соответственно, Cross laps – 0,54±0,06 и 0,38±0,05 мкг/л соответственно (p>0,05). В то же время уровень остеокальцина у пациентов, страдающих рецидивирующим нефролитиазом и имеющих сопутствующий компенсированный сахарный диабет II типа был достоверно ниже, чем у аналогичных больных, не имющих нарушений углеводного обмена (1,58±0,18 и 4,42±0,49 нг/мл соответственно, p< 0,05) (рис. 6).
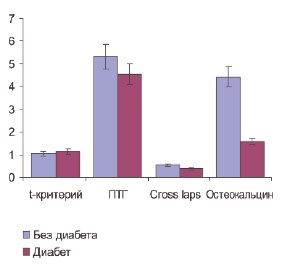
Рис. 6. Влияния сопутствующего сахарного диабета II типа на минеральную плотность костной ткани и маркеры костного метаболизма у пациентов, страдающих рецидивирующим нефролитиазом
Таким образом, сопутствующий сахарный диабет II типа, даже находящийся в стадии компенсации, у больных страдающих рецидивирующим нефролитиазом сопровождается снижением активности остеобластов и некоторым уменьшением активности костеобразования. Активизации процессов костной резорбции не наблюдалось. Доминирование процессов костной резорбции при сахарном диабете закономерно при развитии остеолитических процессов в условиях тяжелой нейропатии (сустава Шарко).
Несмотря на отсутствие достоверного снижения минеральной плотности костной ткани, у этих пациентов можно ожидать развития клинически значимого остеопороза с ростом выраженности нарушений углеводного обмена, длительности заболевания и, особенно, при присоединении почечной недостаточности.
ЛИТЕРАТУРА
- Tsuji H., Umekawa T., Kurita T., Uemura H., Iguchi M., Kin K., Kushida K. Analysis of bone mineral density in urolithiasis patients. // Int J Urol. 2005. Vol. 12. N. 4. P. 335-339.
- Яровой С.К., Сивков А.В. Почечная остеодистрофия на фоне рецидивирующего нефролитиаза: выбор лекарственной терапии. // Экспериментальная и клиническая урология. 2010. №1. С.65-68.
- Incel N.A., Gökoğlu F., Nacir B., Incel N. Bone and stone in ankylosing spondylitis: osteoporosis and urolithiasis. // ClinRheumatol. 2006. Vol. 25. N. 9. P. 667-670.
- Дедов И.И., Марова Е.И., Рожинская Л.Я.. Остеопороз. Патогенез, диагностика, принципы профилактики и лечения. Методическое пособие для врачей. М., 1999.
- Руководство по остеопорозу. Под редакцией Л.И. Беневоленской. М., БИНОМ. Лаборатория знаний. 2003. 532с.
- Wong P., Fuller P.J., Gillespie M.T., Kartsogiannis V., Strauss B.J., Bowden D., Milat F. Thalassemia bone disease: the association between nephrolithiasis, bone mineral density and fractures. // Osteoporos Int., 2013. Vol. 24. N. 7. P. 1965-1971.
- Okada A., Ohshima H., Itoh Y., Yasui T., Tozawa K., Kohri K. Risk of renal stone formation induced by long-term bed rest could be decreased by premedication with bisphosphonate and increased by resistive exercise. // Int J Urol. 2008. Vol. 15. N. 7. P. 630-635.
- Reynolds T.M. Chemical pathology clinical investigation and management of nephrolithiasis. // J ClinPathol., 2005. Vol. 58. P. 134–140.
- Родионова С.С., Морозов А.К. Возможности и ошибки неинвазивной количественной оценки массы костной ткани для диагностики остеопороза.// Остеопороз и остеопатии.2005.№1.С4145.
- Hakulien M., Saarakkala S., Toyras J., Kroger H., Jurvelin J.S. Dual energy X-ray & laser measurement of calcaneal bone mineral density. // Physics in Medicine and Biology. 2003. Vol. 48. pp 1741-1752.
- Kullenberg R. A new accurate technology for the determination of bone mineral areal density Dual X-ray & Laser (DXL). // Proceed. Fifth Symposium on Clinical Advances in Osteoporosis. National Osteoporosis Foundation. USA. Hawaii. 2002.
- Kullenberg R., Faich J. The prevalence of osteoporosis using bone mineral measurements at the Calcauneus by Dual X-ray & Laser (DXL). // Osteoporosis Int. 2003. Vol.14. pp 823-827.
- Mash B., Bheekie A., Jones P.W. Inhaled versus oral steroids for adults with bronchial asthma. // Cochrane Library, 2002;3: CD002161.
- Аполихин О.И., Калинченко С.Ю., Камалов А.А., Гусакова Д.А., Ефремов Е.А. Мочекаменная болезнь как новый компонент метаболического синдрома. // Саратовский научно-медицинский журнал. 2011. Т.7. №2. C.117.
- Яненко Э.К., Меринов Д.С., Константинова О.В., Епишов В.А., Калиниченко Д.Н. Современные тенденции в эпидемиологии, диагностике и лечении мочекаменной болезни. // Экспериментальная и клиническая урология. 2012. № 3. С. 19-24.
- Шварц Г.Я. Фармакотерапия остеопороза. М., Медицинское информационное агентство, 2002, 410с.
- Мкртумян А.М. Особенности минерального обмена и костной системы при некоторых эндокринных заболеваниях. // Автореферат дисс. докт. мед. наук. Москва. 2000. 44с.
- Gough A., Abraha H., Zi F. Measurement of markers of osteoclast and osteoblast activity in patients with acute and Charcot neuroarthropathy. // Diabet. Med. 1997; Vol. 14 N7. P. 527-531.







