Уротелий – высокоспецифическая эпителиальная оболочка мочевого тракта, которая покрывает почечную лоханку, мочеточники, мочевой пузырь и мочеиспускательный канал. Злокачественная трансформация уротелия приводит к развитию уротелиальной карциномы [1]. Уротелиальный рак занимает 4 место по распространенности злокачественных опухолей после рака предстательной железы (или молочных желез), легкого и колоректального рака [2]. Данный вид опухоли может возникать как в нижних мочевыводящих путях (мочевой пузырь или уретра), так и в верхних (чашечно-лоханочная система почки или мочеточник). Рак мочевого пузыря (РМП) составляет 90-95% среди всех случаев уротелиального рака. Уротелиальный рак верхних мочевыводящих путей (УРВМП) встречается довольно редко и составляет 5-10% от всех случаев уротелиального рака [3].
Современная концепция факторов риска развития уротелиального рака пересмотрена по сравнению с прошлыми годами. Пол больного больше не считается независимым прогностическим фактором, влияющим на смертность. Пожилой возраст после хирургического лечения является независимым фактором снижения опухолево-специфической выживаемости. Несмотря на связь с выживаемостью, возраст не должен препятствовать потенциально радикальному подходу в лечении [4].
Исходное расположение уротелиальной карциномы мочеточников является прогностическим фактором в некоторых исследованиях. Пациенты с опухолями мочеточника и/или мультифокальными опухолями мочевого пузыря обладают худшим прогнозом, чем при единичных опухолях мочевого пузыря [5,6]. Курение при раке мочеточника увеличивает риск рецидива заболевания и смертности после нефуретерэктомии, а также частоту рецидивов в мочевом пузыре [7].
Уротелиальная карцинома представляет собой злокачественное заболевание, возникающее в различных органах мочевыводящего тракта, имеющих подобную выстилку. Исследования L. Izquierdo с соавт., показали, что у 2-4% пациентов с РМП также диагностируется рак УРВМП [8].
Вследствие значительно более частой встречаемости РМП патогенез его развития изучен более тщательно. Процесс злокачественной трансформации уротелия происходит при нарушении молекулярных взаимодействий, регулирующих клеточный гомеостаз. В настоящее время выделено несколько ключевых молекул и путей, которые вовлечены в регуляцию важнейших клеточных процессов, а также в онкогенез и прогрессирование РМП. К таковым относятся регуляция клеточного цикла, апоптоз, рост клеток, опухолевый ангиогенез и инвазия. Ключевые молекулярные маркеры являются важными показателями исхода заболевания и чувствительности к проводимому лечению [9-11].
Следует отметить, что авторы, изучающие патогенез развития уротелиального рака различной локализации, пришли к выводу, что, хотя опухоли мочевого пузыря и верхних мочевыводящих путей исходят из одной ткани уротелия, однако они имеют различные биологические и поведенческие особенности [12,13]. Существует несоответствие и в течении заболевания – так, 55-85% опухолей мочевого пузыря неинвазивны при выявлении, а более 60% опухолей верхних мочевыводящих путей являются инвазивными [3,14-17].
Сходства этих опухолей позволяют использовать при их диагностике одни и те же методы исследования. А различия делают необходимым отдельно рассматривать методы лечения и прогноз заболевания [18-20].
Представляем редкое клиническое наблюдение диагностики и лечения на протяжении 4-х лет метахронного уротелиального рака мочевого пузыря и обоих мочеточников.
Клиническое наблюдение
Пациентка Г., 45 лет, проходила лечение в отделении урологии ФГБУ «Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского» Минздрава России в период с 2013 по 2017 гг. с диагнозом: Первично-множественный метахронный рак: Рак мочевого пузыря I ст. рТ1N0М0. ТУР мочевого пузыря (2) 2011-13 гг. Внутрипузырная химиотерапия Митомицином С 40 мг 4 курса. Резекция мочевого пузыря 2013 г. Вторичносморщенный мочевой пузырь. Рецидив. Рак правого мочеточника I ст. рТ1N0М0. Рак левого мочеточника I ст. рТ1N0М0.
Анамнез. В 2011 г. пациентка стала отмечать примесь крови в моче. Обратилась к урологу по месту жительства, произведена цистоскопия. При ревизии выявлены папиллярные экзофитные опухоли задней стенки мочевого пузыря. В отделении урологии Липецкого Онкологического диспансера неоднократно выполнялись трансуретральные резекции (ТУР) мочевого пузыря (август 2011 г., март 2012 г.), проводили внутрипузырную химиотерапию Митомицином (4 курса по 40 мг). В апреле 2013 г., по поводу рецидива произведена открытая резекция мочевого пузыря. Послеоперационный период осложнился формированием мочевого свища передней брюшной стенки. 08.04.2013 г. произведена ревизия мочевого пузыря, биопсия мочевого пузыря, иссечение свища.
В июне 2013 г. пациентка обратилась за консультацией в ФГБУ «НМИЦ хирургии им. А.В. Вишневского». Пациентка была госпитализирована для дообследования и лечения.
По данным мультиспиральной компьютерной томографии (МСКТ) органов брюшной полости и малого таза (05.06.13): изменения стенки мочевого пузыря (в области дна мочевого пузыря два мягкотканых образования размером 8-9 мм, окруженные зоной инфильтрации), нельзя исключить продолженный рост, папиллярные опухоли средней трети правого мочеточника (просвет мочеточника на краниальных сканах 8,4 мм, далее просвет постепенно суживается и на протяжении дистальных 3 см просвет мочеточника не прослеживается), пиелоэктазия с обеих сторон (рис. 1).
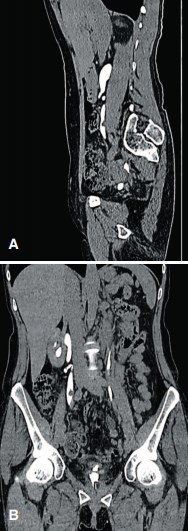
Рис. 1. МСКТ-изображения органов брюшной полости и малого таза (А – сагиттальный срез; Б - фронтальный срез). Опухоль средней трети правого мочеточника, мочевого пузыря
29.08.13 г. больной выполнена следующая операция: радикальная цистэктомия, резекция правого мочеточника, резекция левого мочеточника, экстирпация матки с придатками с резекцией передней стенки влагалища, расширенная тазовая лимфаденэктомия, пластика мочевого пузыря изолированным сегментом подвздошной кишки с формированием уростомы на передней брюшной стенке по Бриккеру, дренирование полости малого таза.
Интраоперационно: выделены наружные подвздошные артерия и вена справа и слева, развилка подвздошных сосудов удалены клетчатка и лимфоузлы окружающие данные сосуды. Выделены, поочередно пересечены между зажимами и лигированы правые и левые маточные сосуды. Выделены правый и левый мочеточники из забрюшинной клетчатки на протяжении 10 см (до терминальной линии таза) (рис. 2). Рассечена задняя стенка влагалища. Произведена ампутация матки с придатками, а также резекция передней стенки влагалища (рис. 3). Частично острым, частично тупым путем произведена мобилизация мочевого пузыря. Пересечены и стентированы правый и левый мочеточники на уровне перехода тазовых отделов их в интрамуральные (рис. 4). Отмечается выраженная дилатация обоих мочеточников. При осмотре правого мочеточника определено, что опухолевый узел располагается на уровне перехода верхней трети мочеточника в среднюю, что исключает возможность двусторонней уретерокутанеостомии (рис. 5). Принято решение о налаживании деривации мочи путем формирования кишечного кондуита (рис. 6). Произведено анастомозирование кондуита с правым мочеточником. При ревизии левого мочеточника пальпаторно определен опухолевый узел на расстоянии 1 см от его дистального конца. Произведена резекция левого мочеточника. Произведено анастомозирование кондуита с левым мочеточником.
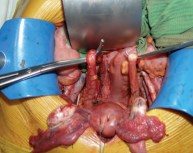
Рис. 2. Интраоперационное фото, область двухсторонней подвздошно-обтураторной лимфаденэктомии, диссекция мочеточников
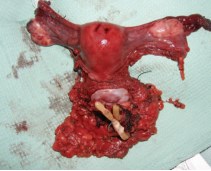
Рис. 3. Макропрепарат, мочевой пузырь, матка с придатками
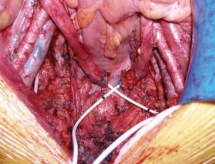
Рис. 4. Интраоперационное фото, стентированы правый и левый мочеточники
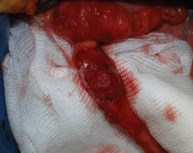
Рис. 5. Интраоперационное фото, опухоль средней трети правого мочеточника
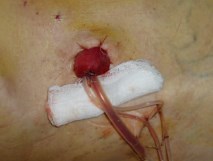
Рис. 6. Интраоперационное фото, уростома на передней брюшной стенке
Данные гистологического заключения: в стенке мочевого пузыря гнойно-некротическое воспаление, обильные микрогрануляции, среди которых множественные комплексы поверхностной уротелиальной карциномы G2 (рТ1N0M0). В области прилежания мочевого пузыря к стенке влагалища – рубцовые изменения, хроническая воспалительная инфильтрация, неинвазивные сосочковые карциномы обоих мочеточников. В регионарных лимфатических узлах – реактивная гиперплазия фолликулов.
В послеоперационном периоде проведено 4 курса адъювантной полихимиотерапии по схеме GP. Переносимость цитотоксической терапии удовлетворительная.
До декабря 2015 года больная не наблюдалась. При визите в НМИЦ хирургии выявлена обструкция обоих мочеточников в дистальных отделах с явлениями азотемии, в связи с чем больной установлены нефростомы с двух сторон. По данным дообследования проводилась дифференциальная диагностика между стриктурами уретерорезервуарных анастомозов и многофокусными опухолевыми рецидивами мочеточников.
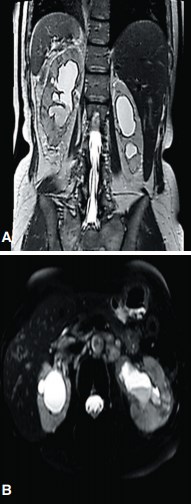
Рис. 7. МРТ-изображения органов брюшной полости и забрюшиннного пространства (А - фронтальный срез, Б - поперечный срез). Продолженный рост по правому и левому мочеточникам
В апреле 2016 г. по данным магнитно-резонансной томографии (МРТ) и МСКТ определено прогрессирование заболевания в форме продолженного роста по мочеточникам (стенки мочеточников практически на всем протяжении муфтообразно утолщены вплоть до лоханочно-мочеточниковых сегментов (ЛМС)), а также развития лимфаденопатии (множественные ретроперитонеальные лимфатические узлы размером до 11 мм) (рис. 7).
Пациентка была третий раз госпитализирована и 11.04.2016 г. произведена операция в объеме: резекция лоханок обеих почек, экстирпация обоих мочеточников, илеумкондуита, расширенная аортокавальная лимфаденэктомия, двухсторонняя ре-нефростомия.
Интраоперационно: мобилизован илеум-кондуит с дистальными отрезками обоих мочеточников. Мочеточники на всем протяжении резко расширены до 2 см. Просвет их от лоханок до уретеро-неоцистоанастомозов заполнен рыхлыми массами множественных экзофитных уротелиальных опухолей. Мочеточники пересечены и перевязаны на уровне анастомозов. Мобилизован илеум-кондуит. Дистальный отдел отсечен от кожи и мягких тканей передней брюшной стенки, выведен полностью в рану брюшной полости. Питающая ножка (брыжейка терминального отдела подвздошной кишки) пересечена, перевязана. Гетеротопический резервуар удален, отправлен на морфологическое исследование (рис. 8). Мочеточник справа мобилизован с парауретеральной клетчаткой до лоханки почки. Произведена экстирпация правого мочеточника (рис. 9).
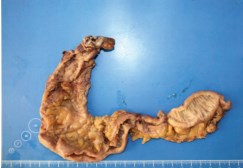
Рис. 8. Макропрепарат, резецированный гетеротопический резервуар
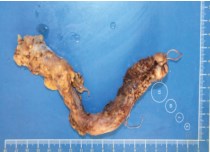
Рис. 9. Макропрепарат, резецированный правый мочеточник
Выполнена резекция лоханки правой почки. В области ЛМС выполнена резекция двух экзофитных образований на широком основании до 3-4 см в диаметре. В полости резецированной лоханки дистальный конец нефростомической трубки. Слизистая лоханки отечна, инфильтрирована с множеством грануляционных разрастаний. Визуально: в полости лоханки множественные мелкие стелющиеся экзофитные разрастания. Лоханка справа ушита наглухо двухрядным моносиновым швом 4/0. Дренаж в правое забрюшинное пространство. Аналогичная манипуляция проведена в левом забрюшинном пространстве. Выполнена аортокавальная лимфаденэктомия. С левой стороны ситуация более драматична: лоханка с множественными стелющимися поверхностными экзофитными опухолями размерами от 5 до 15 мм в диаметре. Согласия на выполнение нефрэктомии в настоящее время у больной получено не было. Выполнено удаление рецидивов. После ушивания двухрядным швом лоханки левой почки зона шва дополнительно укрыта прядью паранефральной клетчатки.
По данным гистологического исследования определяется синхронный уротелиальный рак обоих мочеточников (G 2). Метастазов в 23 аортокавальных лимфоузлах не выявлено.
В декабре 2016 г. по данным МСКТ органов брюшной полости и забрюшинного пространства отмечена отрицательная динамика заболевания в лоханках обеих почек (правая почка: в лоханке определяется множественные мягкотканные гиперваскулярные образования, размерами от 5 мм до 15 мм в диаметре, также утолщение стенки лоханки до 5 мм; левая почка: в лоханке определяется мягкотканное гиперваскулярное образование, размерами 20х15 мм), выраженное ухудшение перфузии паренхимы обеих почек, нарастание степени расширения чашечек средней и нижней группы (рис. 10).
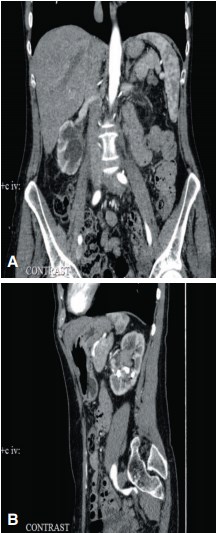
Рис. 10. МСКТ-изображения органов брюшной полости и забрюшинного пространства (А - фронтальный срез; Б - сагиттальный срез). Продолженный рост в правой почке, нарастание степени расширения чашечек средней и нижней группы
Учитывая рецидив заболевания, при четвертой госпитализации 13.02.2017 г. в НМИЦ хирургии им. А.В. Вишневского произведено хирургическое лечение в объёме: правосторонняя нефрэктомия, экстракорпоральная резекция левой почки с доудалением левой почки, формирование артериовенозной фистулы между левой плечевой артерией и левой медиальной подкожной веной.
При ревизии: правая почка увеличена в размерах до 20 см за счет гидронефротической трансформации. Из массивного инфильтрата выделена правая почечная вена и три почечных артерии. Произведена нефрэктомия справа с сохранением правого надпочечника (рис. 11). С учетом абсолютных показаний произведена попытка органосохраняющего лечения: левая почка на пересеченных сосудах перемещена в лоток со льдом, где произведена перфузия ее раствором кустодиола. После вскрытия паренхимы и собирательной системы очевидно, что функционально состоятельны не более 15% паренхимы почки. Остальные участки паренхимы вовлечены в опухолевый и рубцовый процесс. Культи сосудов почки лигированы. Левая почка удалена на морфологическое исследование.
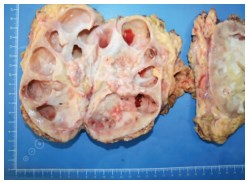
Рис. 11. Макропрепарат, удаленная правая почка
По данным гистологического исследования: синхронный многофокусный уротелиальный рак чашечно-лоханочной системы обеих почек (G-2): папиллярная уротелиальная карцинома с инвазией в основу слизистой оболочки лоханки правой почки и участком начала инвазии в ткань левой почки.
На фоне благополучного послеоперационного периода на 4-е сутки в процессе сеанса программного гемодиализа развилось внутрибрюшное кровотечение. В экстренном порядке была выполнена операция: релапаротомия, ревизия брюшной полости, забрюшинного пространства, гемостаз, дренирование брюшной полости, забрюшинного пространства. Интраоперационно источником кровотечения являлись мягкие ткани обоих забрюшинных пространств. Возможно присутствовал факт гепарин-индуцированной коагулопатии. В дальнейшем гладкое течение послеоперационного периода. Также в послеоперационном периоде было проведено 2 сеанса гемодиализа: на седьмые и девятые сутки. В удовлетворительном состоянии пациентка выписана из отделения под наблюдение нефролога.
В сентябре 2017 года при контрольном обследовании не выявлено признаков метастатического прогрессирования, пациентка в настоящее время получает программный гемодиализ. С больной обсуждаются сроки проведения трансплантации донорской почки.
ОБСУЖДЕНИЕ
Представлено клиническое наблюдение лечения пациентки метахронного уротелиального рака мочевого пузыря и обоих мочеточников. Несмотря на динамическое наблюдение за состоянием пациентки в соответствии с клиническими рекомендациями [3], опухоли последующих локализаций выявляли с достаточно большим объемом поражения. Однако при всех оперативных вмешательствах отсутствовал инвазивный рост уротелиальной карциномы как в мочевом пузыре, так и в верхних мочевыводящих путях. А также при таком длительном течении заболевания отсутствовала генерализация заболевания. Уротелиальная карцинома поражала весь уротелий в организме больной, но в пределах слизистой оболочки. Данное клиническое наблюдение представляет торпидное течение уротелиальной карциномы, которое на протяжение многих лет не привело к генерализации опухолевого процесса.
В настоящее время МСКТ урография с серией изображений в экскреторной фазе (10-15 мин) после введения контрастной среды является стандартным методом визуализации для обнаружения уротелиального рака [20]. Большие сложности возникают при верификации поражения верхних мочевыводящих путей. Сообщалось, что чувствительность МСКТ к выявлению УРВМП составляет 67-100%, в то время как ее специфичность 93% – 99% [21, 22]. Однако точность МСКТ при вери-фикации УРВМП ниже 59% – 88% [23, 24]. Магнитнорезонансная урография демонстрирует широкую изменчивость в отношении ее точности в постановке диагноза УРВМП, поэтому рекомендуется для тех пациентов, у которых имеются противопоказания к проведению МСКТ [18,20]. Непрерывно улучшающиеся методы визуализации обладают потенциалом для преодоления ограничений в диагностике и дифференциальной диагностике уротелиального рака, все большее применение находят такие методы, как эндолюминальное ультразвуковое исследование [25], оптическая когерентная томография [26], конфокальная лазерная эндомикроскопия [27], многопараметрическая МРТ [28], 11C choline PET/CT [29]. Однако, к сожалению, в настоящее время для клинического применения нет методов, которые могут обнаружить раннее системное распространение опухолевых клеток уротелия.
ЗАКЛЮЧЕНИЕ
При поставке диагноза РМП, а при постоянном его рецидивировании особенно, необходимо быть онконастороженным по отношению к верхним мочевыводящим путям. Своевременное выявление мышечно-инвазивного и/или распространенного поверхностного уротелиального рака имеет решающее значение, поскольку задержка в диагностике и терапии может быть опасной для жизни больного. При рецидивирующем РМП надо проявлять онконастороженность в отношении верхних мочевыводящих путей.
ЛИТЕРАТУРА
- Munoz JJ, Ellison LM. Upper tract urothelial neoplasms: incidence and survival during the last 2 decades. J Urol 2000;164(5):1523-5. doi: 10.1016/S0022-5347(05)67019-X
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin 2015;65(1): 5-29. doi: 10.3322/caac.21254.
- Волкова М.И., Матвеев В.Б., Медведев С.В., Носов Д.А., Хмелевский Е.В., Черняев В.А.Клинические рекомендации по диагностике и лечению больных с опухолями верхних мочевыводящих путей. М., 2014; 13 с.
- Клинические рекомендации Уротелиальный рак верхних мочевыводящих путей. М.: Министерство здравоохранения Российской Федерации, 2017; 22 с.
- Shariat SF, Godoy G, Lotan Y, Droller M, Karakiewicz PI, Raman JD, et al. Advanced patient age is associated with inferior cancer-specific survival after radical nephroureterectomy. BJU Int 2010;105(12):1672-1677. doi: 10.1111/j.1464-410X.2009.09072.x.
- Chromecki TF, Ehdaie B, Novara G, Pummer K, Zigeuner R, Seitz C, et al. Chronological age is not an independent predictor of clinical outcomes after radical nephroureterectomy. World J Urol 2011;29(4):473-480. doi: 10.1007/s00345-011-0677-0.
- Xylinas E, Kluth LA, Rieken M, Lee RK, Elghouayel M, Ficarra V, et al. Impact of smoking status and cumulative exposure on intravesical recurrence of upper tract urothelial carcinoma after radical nephroureterectomy. BJU Int 2014; 114: 56–61. doi: 10.1111/bju.12400
- Izquierdo L, Truán D, Alvarez-Vijande R, Alcaraz A. Large series of 114 cases with long term follow-up of upper urinary tract urothelial tumors. Actas Urol Esp 2010;34: 232–237. doi: 10.1016/j.acuro.2009.11.004.
- Ouzzane A, Colin P, Xylinas E, Pignot G, Ariane MM, Saint F, et al. Ureteral and multifocal tumours have worse prognosis than renal pelvic tumours in urothelial carcinoma of the upper urinary tract treated by nephroureterectomy. Eur Urol 2011;60(6):1258-65. doi: 10.1016/j.eururo.2011.05.049.
- Yafi FA, Novara G, Shariat SF, Gupta A, Matsumoto K, Walton TJ, et al. Impact of tumour location versus multifocality in patients with upper tract urothelial carcinoma treated with nephroureterectomy and bladder cuff excision: a homogeneous series without perioperative chemotherapy. BJU Int 2012;110(2 Pt 2):E7-13. doi: 10.1111/j.1464-410X.2011.10792.x.
- Simsir A, Sarsik B, CureklibatirI, Sen S, Gunaydin G, Cal C. Prognostic factors for upper urinary tract urothelial carcinomas: stage, grade, and smoking status. Int Urol Nephrol 2011;43(4):1039-1045. doi: 10.1007/s11255-011-9915-z
- Hanahan D, Weinberg R.A. e hallmarks of cancer. Cell 2000;100: 57-70.
- Mitra AP, Lin H, Cote RJ, Datar RH. Biomarker profiling for cancer diagnosis. Prognosis and thera peutic management. Nat Med J India 2005;18(6):304-312.
- Roupret M, Catto J, Coulet F, Azzouzi A-R, Amira N, Karmouni T, et al. Microsatellite instability as indicator of MSH2 gene mutation in patients with upper urinary tract transitional cell carcinoma. J Med Genet 2004;41:e91. doi: 10.1136/jmg.2003.017871
- Catto JW, Yates DR, Rehman I, Azzouzi AR, Patterson J, Sibony M, et al. Behavior of urothelial carcinoma with respect to anatomical location. J Urol 2007;177:1715-1720. doi: 10.1016/j.juro.2007.01.030
- Foresman WH, Messing EM. Bladder cancer: natural history, tumor markers, and early detection strategies. Semin Surg Oncol 1997; 13: 299-306.
- Baylin S.B., Ohm J.E. Epigenetic gene silencing in cancer – a mechanism for early oncogenic pathway addiction Nat Rev Cancer 2006; 6: 107–116. doi: 10.1038/nrc1799
- Jacobs LB, Lee TC, Montie JE. Bladder cancer in 2010: how far have we come? CA Cancer J Clin 2010;60:244–272. doi: 10.3322/caac.20077.
- Szarvas T, Módos O, Horváth A, Nyirády P. Why are upper tract urothelial carcinoma two different diseases? Transl Androl Urol 2016;5(5): 636–647. doi: 10.21037/tau.2016.03.23
- Rouprêt M, Babjuk M, Compérat E, Zigeuner R, Sylvester RJ, Burger M, et al. European Association of Urology guidelines on upper urinary tract urothelial cell carcinoma: 2015 update. Eur Urol 2015; 68: 868-879. doi: 10.1016/j.eururo.2015.06.044
- Wang LJ, Wong YC, Huang CC, Wu CH, Hung SC, Chen HW. Multidetector computerized tomography urography is more accurate than excretory urography for diagnosing transitional cell carcinoma of the upper urinary tract in adults with hematuria. J Urol 2010;183:48-55. doi: 10.1016/j.juro.2009.08.144
- Jinzaki M, Matsumoto K, Kikuchi E, Sato K, Horiguchi Y, Nishiwaki Y, et al. Comparison of CT urography and excretory urography in the detection and localization of urothelial carcinoma of the upper urinary tract. Am J Roentgenol 2011;196:1102-1109. doi: 10.2214/AJR.10.5249
- Scolieri MJ, Paik ML, Brown SL, Resnick M.I. Limitations of computed tomography in the preoperative staging of upper tract urothelial carcinoma. Urology 2000;56:930-934.
- Fritz GA, Schoellnast H, Deutschmann HA, Quehenberger F, Tillich M. Multiphasic multidetector-row CT (MDCT) in detection and staging of transitional cell carcinomas of the upper urinary tract. Eur Radiol 2006;16:1244-1252. doi: 10.1007/s00330-005-0078-0
- Matin SF,KamatAM, Grossman HB. High-frequency endoluminal ultrasonography as an aid to the staging of uppertract urothelial carcinoma: imaging findings and pathologic correlation. J Ultrasound Med 2010;29:1277-1284.
- Bus MT, de Bruin DM, Faber DJ, Kamphuis GM, Zondervan PJ, Laguna Pes MP, et al. Optical diagnostics for upper urinary tract urothelial cancer: technology, thresholds, and clinical applications. J Endourol 2015;29:113-123. doi: 10.1089/end.2014.0551
- Bui D, Mach KE, Zlatev DV, Rouse RV, Leppert JT, Liao JC. A pilot study of in vivo confocal laser endomicroscopy of upper tract urothelial carcinoma. J Endourol 2015;29:1418-1423. doi: 10.1089/end.2015.0523
- Yoshida S, Kobayashi S, Koga F, Ishioka J, Ishii C, Tanaka H, et al. Apparent diffusion coefficient as a prognostic biomarker of upper urinary tract cancer: a preliminary report. Eur Radiol 2013;23:2206-2214. doi: 10.1007/s00330-013-2805-2
- Sassa N, Kato K, Abe S, Iwano S, Ito S, Ikeda M, et al. Evaluation of 11C-choline PET/CT for primary diagnosis and staging of urothelial carcinoma of the upper urinary tract: a pilot study. Eur J Nucl Med Mol Imaging 2014;41:2232-2241. doi: 10.1007/s00259-014-2871-y







