Несмотря на улучшение ранней диагностики и прогресс в технике хирургического лечения заболеваний почек, количество органоуносящих операций (нефрэктомий) в настоящее время в урологической практике не имеет четкой тенденции к снижению [1]. При этом пациент с оставшейся единственной почкой, по мнению большинства исследователей и клиницистов, не может считаться абсолютно здоровым человеком, поскольку единственная почка принимает на себя весь функциональный удар на протяжении дальнейшей жизни человека, что предопределяет высокую частоту различных заболеваний единственной почки, достигающую 80% [2-4]. Таким образом, органоуносящая операция (нефрэктомия) должна не только преследовать цели избавления пациента от какого-либо хирургического заболевания почки, по и обеспечить хорошее качество жизни в дальнейшем, которое основано на максимально ранней профилактике повреждений единственной почки. Согласно имеющимся данным, самые начальные (доклинические) стадии повреждения единственной почки могут развиваться уже в раннем послеоперационном периоде после нефрэктомии. Адекватное ведение больного в послеоперационном периоде во многом предопределяет исход нефрэктомии и дальнейшую судьбу пациента [58]. Для профилактики повреждений единственной почки после нефрэктомии предлагаются различные подходы, в частности, интегративный комплексный подход в оценке нарушений адаптационной реактивности организма, оказывающих существенное влияние на анатомофункциональное состояние единственной почки [9-12].
Цель исследования: изучить взаимосвязь нарушений общей адаптационной реактивности организма и функционального состояния единственной почки в раннем послеоперационном периоде после нефрэктомии
МАТЕРИАЛЫ И МЕТОДЫ
Общий объем исследования составил 120 пациентов, из которых 90 человек перенесли нефрэктомию и наблюдались в течение 14 суток раннего послеоперационного периода (основная группа), 30 человек с единственной почкой, перенесшие нефрэктомию 6-12 месяцев назад, составили контрольную группу («условно здоровый контроль»). Средний возраст больных контрольной группы составил 44,8 года (доверительный интервал 0,95; 28-56), основной группы – 43,8 (доверительный интервал 0,95; 25-53).
Распределение пациентов по полу в основной и контрольной группах представлено в таблице 1.
Таблица 1. Распределение пациентов в группах исследования по полу (n=120)
| Группы исследования | Мужчины | Женщины | ||
|---|---|---|---|---|
| Абс. (чел.) | % | Абс. (чел.) | % | |
| Контрольная группа (n=30) | 19 | 63,3 | 11 | 36,7 |
| Основная группа (n=90) | 60 | 66,7 | 30 | 33,3 |
| ВСЕГО | 79 | 100,0 | 41 | 100,0 |
Среди заболеваний, приведших к нефрэктомии у больных основной группы, фигурировали опухоли почки (48,9%), травмыпочки (16,7%) и коралловидный нефролитиаз (13,3%) (табл. 2). Полученные данные свидетельствуют о том, что рак почки попрежнему остается основной причиной нефрэктомии, несколько преобладая в мужской популяции. Травматические повреждения почки, потребовавшие нефрэктомии, достоверно чаще наблюдались у мужчин по сравнению с женщинами (соотношение мужчины: женщины составило 4:1), а факт высокой частоты коралловидного нефролитиаза в структуре показаний к нефрэктомии у представителей обоих полов объясняется известной эндемичностью Ярославской области по мочекаменной болезни в целом.
Результаты исследований, выполненные у больных основной группы до операции и на 1, 7 и 14 сутки после нефрэктомии, сравнивались с показателями контрольной группы.
Для оценки степени выраженности стресса использовали лабораторные методы определения некоторых стрессовых биогенных аминов (адреналина, гистамина, серотонина) в плазме крови. Совместное определение показателей гистамина и серотонина в крови проводилось методом, основанном на измерении флюоресценции продуктов конденсации гистамина с ортофталевым альдегидом, а изолированного серотонина – с нингидрином по методике Л.Я. Прошиной [13]. Ориентируясь на интенсивность свечения стандартных проб, производился расчет показателей в мкг/мл. Для приготовления стандартных проб использовали гистамин дигидрохлорид фирмы «Fluka» (Швейцария) и серотонин-креатинин сульфат фирмы «Reanal» (Венгрия). Уровень адреналина определялся дифференциально-флюориметрическим методом В.О. Осинской [14]. Расчет проводился по калибровочным графикам. Концентрация катехоламинов в крови выражалась в мкг/мл. В качестве нормальных значений в крови адреналина, гистамина и серотонина принимались значения указанных биогенных аминов в крови у больных контрольной группы. У всех пациентов до и в течение 14 суток после нефрэктомии проводился общеклинический осмотр, сбор жалоб на момент исследования. Для выявления нарушений психо-эмоционального статуса все пациенты проходили анкетирование по шкале тревоги Цунга [15]. Шкала содержит 20 утверждений, по каждому из которых исследуемый дает ответ по частоте возникновения у него того или иного признака, ранжированной в четырех градациях: «редко», «иногда», «часто» и «очень часто». На основании ответов рассчитывался суммарный балл тревоги (СБТ), максимальное значение которого по данной шкале составляет 80. Индекс тревоги (ИТ) рассчитывался делением полученного при обследовании пациента суммарного балла на максимально возможный суммарный балл (80) [15]. Для оценки состояния центральной гемодинамики использовались традиционные методы диагностики: пальпаторные измерения частоты сердечных сокращений (ЧСС, уд/мин) и аппаратные измерения уровней систолического артериального давления (САД, мм рт.ст.) и диастолического артериального давления (ДАД, мм рт. ст.). На основании измерений показателей ЧСС и ДАД для выявления гемодинамических вегетативных нарушений всем больным выполняли определение расчетного вегетативного индекса Кердо (ВИК), который традиционно используется в соматической медицине для экспресс-диагностики вегетативных сердечно-сосудистых нарушений [16]. Расчет ВИК достаточно прост и быстр, что важно при оценке вегетативной дисфункции в экстремальных условиях (в том числе, в послеоперационном периоде). ВИК вычисляется по формуле:
ВИК = (1ДАД/ЧСС) х 100,
где ВИК – вегетативный индекс Кердо (баллы); ДАД – диастолическое артериальное давление (мм рт.ст.); ЧСС – частота сердечных сокращений (уд/мин).
Усредненный показатель ВИК в норме располагается в области нулевых значений, диапазон колебаний у мужчин в норме составляет от минус 2 до плюс 2 баллов, а у женщин – от минус 5 до плюс 1 балла. В условиях любого психо-эмоционального вегетативного стресса ВИК существенно возрастает и чем он выше, тем более выражена стрессовая реакция [16]. Для оценки функциональной способности единственной почки производили определение в утренней пробе из кубитальной вены, взятой натощак, уровня эндогенного креатинина с применением унифицированного метода Поппера, основанного на реакции Яффе. За нормальное значение уровня креатинина крови принимали значение 70-115 мкмоль/л для мужчин и 35-90 мкмоль/л – для женщин [14]. Измеренный плазменный уровень эндогенного креатинина использовали для расчета у каждого пациента скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI (2009, модификация 2011) [17].
Статистическая обработка выполнялась в программе Microsoft Excel-2007 и Statistica 6.0. (StatSoft, USA). Обработку данных проводили с использованием стандартных методов описательной и сравнительной статистики [18].
Таблица 2. Распределение больных основной группы по причинам нефрэктомии (показаниям к нефрэктомии) (n=90)
| Заболевания почки, которые явились показанием к нефрэктомии | Абс. (чел.) | % от общего числа больных |
|---|---|---|
| Опухоль почки | 44 | 48,9 |
| Травма почки 5-6 степени | 15 | 16,7 |
| Коралловидный нефролитиаз | 12 | 13,3 |
| Острый тотальный гнойно-деструктивный пиелонефрит | 7 | 7,8 |
| Гидронефроз III-IV степени | 7 | 7,8 |
| Пионефроз | 9 | 5,5 |
| ВСЕГО | 50 | 100 |
РЕЗУЛЬТАТЫ
Динамика плазменных уровней изучаемых биогенных аминов до и после нефрэктомии представлена на рисунке 1.
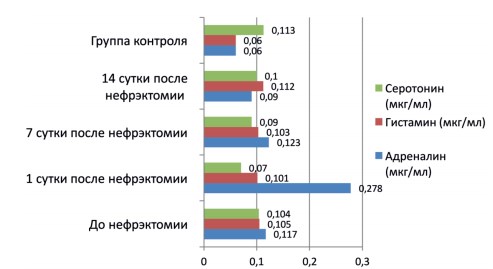
Рис. 1. Показатели плазменных уровней биогенных аминов у пациентов основной группы до и после нефрэктомии и у пациентов контрольной группы
У больных основной группы еще до нефрэктомии отмечалось повышение в 1,9 раза плазменного уровня адреналина (гиперадреналинемия), который оставался повышенным относительно контрольной группы в течение всех 14 суток после операции на фоне умеренной гипергистаминемии и дефицита плазменного серотонина (р<0,05). Пациенты с болевым синдромом перед нефрэктомией, как и пациенты, которым предстояла экстренная нефрэктомия (в отличие от плановой операции) демонстрировали статистически более выраженную гиперадреналинемию как в до, так и в послеоперационном периоде (р<0,05). Нарушения обмена адреналина и гистамина не имели тенденции к полной нормализации даже к 14 суткам послеоперационного периода, в то время как плазменный дефицит серотонина при естественном течении раннего послеоперационного периода к указанному времени уже не выявлялся.
Выявленные нарушения баланса биогенных стрессовых аминов у пациентов после нефрэктомии в клинике сопровождались выраженными психо-эмоциональными и вегетативно-сосудистыми расстройствами. Еще до нефрэктомии и в течение 14 суток после перенесенной нефрэктомии у пациентов имели место выраженные психо-эмоциональные расстройства (достоверно более высокий уровень тревожности, оцененной по показателям СБТ и ИТ по сравнению с группой контроля), которые сохранялись в течение всего периода наблюдения (табл. 3).
Таблица 3. Динамика показателей тревожности в контрольной группе и у больных до и после нефрэктомии (n=120)
| Группа | Показатели | До операции | 1 сутки после нефрэктомии | 7 сутки после нефрэктомии | 14 сутки после нефрэктомии |
|---|---|---|---|---|---|
| Суммарный балл тревоги (СБТ) (баллы) |
контроль (n=30) |
33,2±2,4 | |||
| Нефрэктомия (n=90) |
72,3±3,8* | 64,8±1,2*/** | 57,6±1,8*/** | 52,7±2,2*/ | |
| Индекс тревоги (ИТ) (у.е.) |
контроль (n=30) |
0,41±0,9 | |||
| Нефрэктомия (n=90) |
0,81±0,4 | 0,83±0,6 | 0,72±0,3*/** | 0,56±0,5* | |
* – достоверная разница между группой контроля и больными до и после нефрэктомии при p<0,05. ** – достоверная разница между уровнем до операции и в соответствующие дни послеоперационного периода, но не между собой в группе нефрэктомии при р<0,05.
Нефрэктомия практически у всех 100% больных сопровождалась психо-эмоциональными нарушениями, которые у 26,7 % пациентов (т.е., практически у каждого четвертого) протекали как тревожно-депрессивный синдром (р<0,05). На этом фоне одновременно отмечалась высокая частота вегетативно-сосудистых нарушений, оцененных по суммарному вегетативному индексу Кердо (табл. 4).
Таблица 4. Динамика ВИК в контрольной группе и у больных до и после нефрэктомии
| Группа | До операции | 1 сутки | 7 сутки | 14 сутки |
|---|---|---|---|---|
| Контроль (n=30) | 3,2±0,3 | |||
| Нефрэктомия (n=90) | 4,8±0,6 | 12,3±0,5*/** | 10,3±0,4*/** | 6,5±0,7*/** |
* – достоверная разница между группой контроля и больными до и после нефрэктомии при p<0,05. ** – достоверная разница между уровнем до операции и в соответствующие дни послеоперационного периода в группе нефрэктомии при р<0,05.
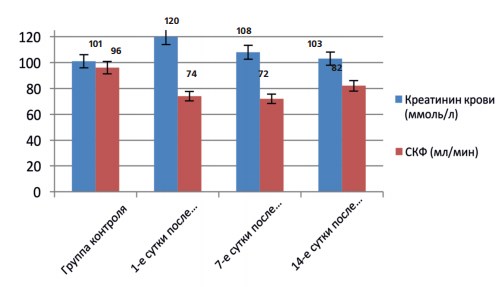
Рис. 2. Показатели плазменного уровня креатинина (ммоль/л) и расчетной СКФ (мл/мин) у пациентов основной группы после нефрэктомии и у пациентов контрольной группы
Как видно из таблицы 4 еще до нефрэктомии и в течение 14 суток после нее у пациентов сохранялся достоверно более высокий показатель вегетативного индекса Кердо по сравнению с группой контроля с пиком в 1-7 сутки, и его уровень не нормализовался к 14 суткам (р<0,05), что свидетельствовало о повышенной нагрузке на сердечно-сосудистую систему в течение всего раннего послеоперационного периода нефрэктомии.
О наличии патогенетической связи между выявленными нарушениями обмена биогенных аминов, психо-эмоциональными и вегетативно-сосудистыми расстройствами в раннем послеоперационном периоде после нефрэктомии свидетельствовали установленные в ходе исследования достоверные положительные связи между плазменным уровнем адреналина и индексом тревоги (ИТ) (r=0,502; n=75; р=0,001), а также между суммарным баллом тревоги (СБТ) и расчетным показателем вегетативного индекса Кердо (ВИК) (r=0,217; n=75; p=0,001).
При оценке динамики функционального состояния единственной почки после нефрэктомии были получены следующие данные: уровень эндогенного креатинина в 1-е сутки после нефрэктомии был достоверно выше (на 19%) показателя группы условно здорового контроля, однако, начиная с 7-х суток происходит его снижение на 12% от исходного, и к 14-м суткам послеоперационного периода уровень креатинина крови у оперированных пациентов достоверно не отличается от аналогичных показателей в группе контроля (р<0,1). Эти данные позволяли сделать вывод о том, что азотовыделительная функция единственной почки в раннем послеоперационном периоде после нефрэктомии нарушается незначительно, а возникающие ее изменения носят временный (транзиторный) характер.
В отличие от уровня эндогенного креатинина, расчетная СКФ единственной почки в течение всех 14 суток после нефрэктомии была достоверно ниже показателя условно здорового контроля (в 1-е сутки – на 23%, на 7-е сутки – на 25%, на 14-е сутки – на 17%, р<0,05). Следовательно, фильтрационная функция единственной почки, оцененная по расчетной СКФ, под влиянием операционного стресса нарушается в большей степени, чем азотвыделительная функция (рис. 2).
Полученные лабораторные данные позволяют рекомендовать для клинической практики расчет СКФ как простой и достоверный диагностико-прогностический критерий, отражающий стресс-индуцированные дезадаптационные нарушения функции единственной почки, поскольку в ходе исследования была выявлена достоверная обратная связь между расчетным показателем вегетативного индекса Кердо и средним показателем СКФ единственной почки (r=0,346; n=75; p=0,001).
ОБСУЖДЕНИЕ
Клиническое исследование показало, что нефрэктомия может рассматриваться как мощный этиологический фактор острого дезадаптационного послеоперационного стресса, приводящего к существенной перестройке как системных, так и локальных (почечных) механизмов адаптационной реактивности. Наиболее ранним признаком индуцированного нефрэктомией дистресссиндрома следует считать развитие дисбаланса биогенных аминов (гиперадреналинемия, гипергистаминемия, дефицит серотонина), регулирующих ответ организма на любые стрессорные влияния, который клинически проявляется выраженными психо-эмоциональными (повышенный уровень тревоги и тревожно-депрессивный синдром) расстройствами и вегетативно-сосудистыми нарушениями (неустойчивость центральной гемодинамики), не имеющими тенденции к самостоятельной нормализации в течение 14 суток после нефрэктомии. В этих неблагоприятных условиях происходит транзиторное нарушение азотовыделительной функции оставшейся единственной почки, а именно: нарушается фильтрационная способность единственной почки, оцененная по расчетной скорости клубочковой фильтрации. Нарушения СКФ после нефрэктомии персистируют на протяжении не менее 14 суток раннего послеоперационного периода и самостоятельно не нормализуются к указанному времени. По данным выполненного исследования, именно расчетная СКФ представляется наиболее информативным и критическим показателем, отражающим адекватность адаптационной реактивности и функциональной перестройки единственной почки в условиях послеоперационного дезадаптационного стресса после нефрэктомии. Величину СКФ следует более широко использовать в качестве прогностического и диагностического критерия в урологической практике, в том числе, после нефрэктомии.
ЗАКЛЮЧЕНИЕ
Проведенное исследование достоверно доказало этиологическую роль нефрэктомии в развитии острого послеоперационного дезадаптационного стресса, который оказывает неблагоприятное влияние не только на психо-эмоциональный и вегетативно-сосудистый статус пациентов, но и на функциональное состояние единственной почки после нефрэктомии. Это может ухудшать конечные результаты нефрэктомии, влиять на клиническое течение раннего послеоперационного периода и в конечном итоге создавать условия для развития повреждений единственной почки впоследствии. Полученные результаты исследования позволяют сделать вывод о том, что адекватное эффективное фармакологическое сопровождение раннего послеоперационного периода после нефрэктомии, направленное на нивелирование или полную коррекцию выявленных стресс-индуцированных нарушений адаптационной реактивности организма и единственной почки является насущной потребностью клинической урологии для улучшения ранних и отдаленных результатов нефрэктомии.
ЛИТЕРАТУРА
1. Атдуев В.А. Органосохраняющая хирургия опухолей паренхимы почки: Дисс…д-ра мед.наук. Н.Новгород, 2002. 316 с.
2. Пытель А.Я., Голигорский С.Д. О показаниях к нефрэктомии и о судьбе лиц, оставшихся с единственной почкой. // Урология и нефрология. 1970. N 2. С. 14-19.
3. Пытель А.Я., Гришин М.А. Заболевания единственной почки. М.: Медицина, 1973. 184 с.
4. Иванов А.П. Клинико-экспериментальное обоснование органо-сохраняющих операций при раке почки: Дисс…д-ра мед.наук. М., 2012. 333 с.
5. Иванов А.П., Тюзиков И.А. Нефрэктомия в современных условиях: причины и дальнейшая судьба больных с единственной почкой. // Фундаментальные исследования. 2011. N 7. С. 64-66.
6. ИвановА.П., Тюзиков И.А. Влияние заболеваний единственной почки на еефункциональное состояние в отдаленномпериоде после нефрэктомии. // Российский медицинский журнал. 2012. N 1. С. 24-26.
7. SharmaA, Mucino MJ,RoncoC.Renal functionalreserve and renalrecovery aer acute kidney injury.// NephronClin Pract. 2014, Vol. 127, N 1, Р. 94-100.
8. Тюзиков И.А., Греков Е.А., Мартов А.Г. Заболевания единственной почки: научная история и эволюция проблемы. // Урология. 2013. N 6. С. 103-110.
9.ЛапшаеваТ.В.Факторырисканеблагоприятногопрогноза у больных с единственной почкой. // Сибирский медицинский журнал. 2006. N 3. С. 47-49.
10. Интегративная урология. Руководство. [Под ред. П.В., Глыбочко Ю.Г. Аляева]. М.: Медфорум, 2014. 432 с.
11. Тюзиков И.А., Мартов А.Г. Системные метаболические факторы патогенеза заболеваний единственной почки у мужчин (пилотное исследование). // Урология. 2012. N 3. С. 11-14.
12. Тюзиков И.А., Калинченко С.Ю., Иванов А.П. Клинико-экспериментальное обоснование патогенеза заболеваний единственной почки как междисциплинарной проблемы. // Вестник Российского Научного Центра Рентгенорадиологии (электронный журнал). 2012, Т. 2, N 21. URL. http://vestnik.rncrr.ru/vestnik/v12/papers/tuzikov_v12.htm (дата обращения 29.06.2012).
13. Прошина Л.Я. Исследования серотонина и гистамина в одной пробе крови. // Лабораторное дело. 1981. N 2. С. 90-93.
14. Горячковский А. Клиническая биохимия в лабораторной диагностике. Одесса: Экология, 2005. 616 с.
15. Zung WWK. A rating instrument for anxiety disorders. // Psychosomatics. 1971, N 12, Р. 371—379.
16. Kérdö I. Ein aus Daten der Blutzirkulation kalkulierter Index zur Beurteilung der vegetativen Tonuslage. // Acta neurovegetativa. 1966, Vol. 29, N 2, Р. 250—268.
17. Смирнов А.В., Шилов Е.М., Добронравов В.А., Каюков И.Г., Бобкова И.Н., Швецов М.Ю., Цыгин А.Н., Шутов А.М. Хроническая болезнь почек: основные принципы скрининга, диагностики, профилактики и подходы к лечению. // Клиническая нефрология. 2012. № 4. С. 4-26.
18. Гланц С. Медико-биологическая статистика. [Пер. с англ.]. М.: Практика, 1999. 459 с.







