Одним из наиболее эффективных подходов для быстрого и точного определения характеристик клеток, их органелл, состояния цитоплазматической оболочки, оценки мембранных антигенов и многих других клеточных параметров является проточная цитофлуориметрия. Данная технология базируется на современных цитохимических флуоресцентных методах исследования и отличается высокой производительностью, позволяющей оперировать большими выборками, гарантирующими статистическую достоверность результатов. Флуоресцентные красители, проникающие в клетки, также можно использовать для дифференциации живых и мертвых клеток. Одним из подобных красителей, который принято использовать для данных целей, является иодид пропидия [1-3].
ЦЕЛЬ РАБОТЫ
Целью работы было изучение возможности применения проточной цитометрии для оценки состояния сперматозоидов и ее сопоставление с результатами общепринятых методов, используемых в андрологии, в частности с методом микроскопии.
Как известно, часть сперматозоидов в процессе дифференцировки подвергается апоптозу, который на ранних стадиях характеризуется активацией эндонуклеаз, расщеплением ДНК, протеолитической деградацией ядерной оболочки, а на завершающей стадии процесса наблюдается нарушение проницаемости клеточной мембраны с последующей деструкцией клетки [4-6].
Одним из критериев оценки качества эякулята, рекомендованных ВОЗ, является подсчет процента жизнеспособных сперматозоидов, точнее, тех из них, клеточная мембрана которых непроницаема для витальных красителей, в частности для эозина. Краситель, добавленный к сперматозоидам, проникает в клетки с поврежденной мембраной и окрашивает их, затем производится подсчет окрашенных клеток в общей популяции сперматозоидов с помощью световой микроскопии.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании были использованы эякуляты 43 человек: 12 - здоровых мужчин, 20 - больных с варикоцеле и 11 - с хроническим простатитом. Возраст пациентов колебался от 18 до 45 лет. Получение и исследование эякулята, а также проницаемость мембраны сперматозоидов для эозина осуществляли по рекомендациям ВОЗ 4-го издания [7]. Использовали 1%-й водный раствор эозина (ЭО) с дальнейшей оценкой процента окрашенных сперматозоидов под световым микроскопом с увеличением 400 х, а также подсчетом не менее 200 клеток.
Для исследования жизнеспособности половых клеток с помощью проточного цитометра Cоulter Epics XL (USA, Florida) применяли метод, разработанный фирмой Molecular Probes, предполагающий использование двух флуорохромов: пропидия иодид (ПИ) и сибра-14 (СИ-14), испускающих свет в различных областях спектра и регистрируемых разными каналами. ПИ проникает только в клетки с поврежденной мембраной и окрашивает их ДНК (красная флуоресценция). СИ-14 способен проникать также и через неповрежденную мембрану, окрашивая нуклеиновые кислоты всех сперматозоидов (зеленая флюоресценция). При инкубации эякулята с обоими красителями жизнеспособные клетки красятся только СИ-14, а мертвые сперматозоиды с поврежденной мембраной - обоими красителями - ПИ и СИ-14.
Образец эякулята разводили солевым буфером HEPES (1:100) и последовательно окрашивали: вначале СИ-14 в концентрации 0,02 мМ с последующей инкубацией в течение 10 минут при температуре 37°С, затем вносили ПИ в концентрации 2,4 мМ с дальнейшей десятиминутной инкубацией при той же температуре. Далее на проточном цитометре подсчитывали результаты каждого образца - 10 - 15 тысяч клеток. Для примера на рисунке 1 приведена гистограмма анализа эякулята пациента П.
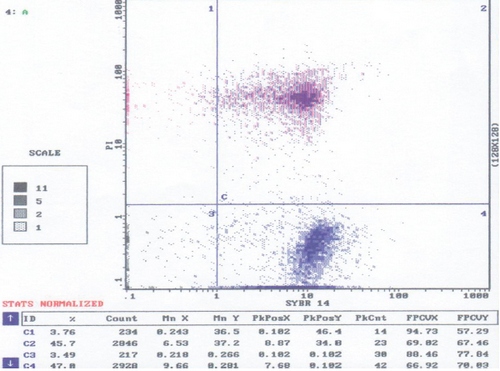
Рис.1. Двухпараметрическая гистограмма распределения сперматазоидов окрашенных сибром- 14 и пробидием иодидом.
Ось абсцисс - Си 14. Ось ординат - ПИ.
2-й и 4-й квадраты - это области окрашенных сперматозоидов Си 14.
2-й квадрат Си 14+ ПИ+ - мёртвые сперматозоиды;
4-й квадрат Си 14+ ПИ- - живые сперматозоиды.
1-й и 3-й квадраты - области неокрашиваемых Си 14 сперматазоидов, предположительно включает клеточный детрит.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После разжижения эякулята проводили регламентированный анализ с определением параметров подвижности, морфологии и жизнеспособности сперматозоидов.
Результаты двух методов окрашивания свежевыделенного эякулята для выявления жизнеспособности клеток (ПИ и ЭО) были близки, процент определения нежизнеспособных сперматозоидов был равен 35,1 ± 11,75 % и 35,6 ± 9,5 % соответственно. Это позволяет рекомендовать данные методы в рутинную практику клинической андрологической лаборатории (табл. 1).
| Методы оценки жизнеспособности сперматозоидов |
% нежизнеспособных сперматозоидов (M ± m) | |||
| Свежевыделенный эякулят (n = 43) |
Эякулят через 24 часа (N = 13) |
Эякулят после криоконсервации (n= 10) |
Эякулят при воздействии 1,5%-м и 3%-м раствором перекиси водорода (n = 13) |
|
| Проточная цитометрия | 35,1 ± 11,7 | 52,4 ± 12,5 | 69,7 ± 4,2 | 86,1 ± 7,5 |
| Световая микроскопия | 35,6 ± 9,5 * | 43,6 ± 7,5* | 58,8 ± 10,2* | 48,7 ± 9,2* |
| Достоверность | p = 0,64 | p = 0,017 | p = 0,004 | p = 0,001 |
Важной проблемой андрологии и репродукции является определение жизнеспособности сперматозоидов после криоконсервации, применяемой для длительного сохранения спермы человека и животных. В связи с этим было предпринято изучение жизнеспособности сперматозоидов человека после криоконсервации вышеописанными методами. В качестве криоконсервантов применяли стерильную среду для замораживания (Sperm Freeze, Belgium), которую используют в практике вспомогательных репродуктивных технологий (ВРТ).
Замораживание/размораживание проводили по стандартной схеме. Определение живых/мертвых сперматозоидов осуществляли сразу после размораживания. Полученные результаты достоверно показывают более высокую выявляемость поврежденных клеток при обработке эякулята ПИ, уровень которых в два раза превосходил исходный. С целью изучения влияния оксидативного стресса, создаваемого в клетке активными формами кислорода (АФК), включая перекись водорода, на жизнеспособность сперматозоидов и повреждающее действие на мембрану клетки, были предприняты опыты с добавлением разных концентраций перекиси водорода (1,5% и 3%) в среду со сперматозоидами. Уровень повреждения мембраны сперматозоидов определяли обоими методами. Так как результаты воздействия двух концентраций перекиси водорода на сперматозоиды были сопоставимы, мы объединили их в одну группу. Как следует из полученных результатов, окрашивание сперматозоидов ПИ выявляет существенно более высокий процент поврежденных клеток, а ЭО в этих случаях менее пригоден для выявления жизнеспособности сперматозоидов.
Возможной причиной расхождения результатов оценки проницаемости клеточной мембраны, окрашенной ПИ или ЭО, могло, по нашему мнению, явиться преобладание разных форм клеточной гибели: в свежевыделенном эякуляте нежизнеспособные клетки - это, в первую очередь, сперматозоиды на поздней стадии апоптоза, а криоконсервация и воздействие перекиси водорода приводит к появлению значительного количества сперматозоидов, претерпевающих некротическую стадию гибели клетки. В этом случае, по-видимому, более чувствительным и предпочтительным является флуоресцентный метод.
ВЫВОДЫ
- Проведённое исследование показало, что оба изучаемых метода оценки жизнеспособности сперматазоидов (проточная цитофлуориметрия и световая микроскопия с окраской эозином) дают аналогичные результаты и являются взаимозаменяемыми.
- Окраске эозином недостаточно адекватно отражает уровень повреждения мембраны сперматозоидов при различных воздействиях на эякулят.
- После определенных воздействий на эякулят in vitro (длительное хранение, криоконсервация, обработка перекисью водорода) цитофлуориметрический метод выявляет достоверно более высокий процент сперматозоидов с поврежденной мембраной.
Ключевые слова: проточная цитометрия, микроскопия, методы окрашивания сперматозоидов, иодид пропидия, эозин, оценка жизнеспособности сперматозоидов.
Keywords: flow cytometry, microscopy, staining methods of sperm, iodit propidium, eozin, assessment of sperm viability.
ЛИТЕРАТУРА
- Абубакиров А.Н. Повреждение ДНК сперматозоидов и мужское бесплодие. // Урология - 2009. - № 3. - C. 86 - 90.
- Долгов В.В., Луговская С.А., Фанченко Н.Д., Миронова И.И., Назарова Е.К., Ракова Н.Г., Раков С.С., Селиванов Т.О., Щелоков А.М.. Лабораторная диагностика мужского бесплодия. М., 2006. 144 с.
- Falzone N., Huyser C., Franken D.R. Comprason between
propidium iodide and 7-amino-actinomicyn-D for viability
assessment during flow cytometric analyses of the human
sperm acrosome. // Andrologia, 2010. Vol. 42, № 1. P. 20-26. 10.
Tarozzi N., Bizzaro D., Flamigni C., Borini A. Clinical relevance
of sperm DNA damage. // Reprod Biomed, 2007. Vol. 14, N 6.
P. 746 - 757. - Комарова М.В. Характеристика эякулята в оценке репродуктивных возможностей человека: Автореф. канд. биол. наук. Уфа, 2000. 19 с.
- Шеина Ю.И., Еремеев А.В., Зайцева Т.А. и др. Анализ фрагментации ДНК сперматозоидов у пациентов с бесплодием. // Тез. докладов XXI межд. конф. РАРЧ. СПб., 2012. - C. 134.
- Darzynkiewicz Z., Juan G., Li X., Gorczyca W., Murakami T., Traganos F. Cytometry in cell necrobiology: analysis of apoptosis and accidental cell death ( necrosis ). // Cytometry, 1997. Vol. 27, N 1. P. 1 - 20.
- Руководство ВОЗ по лабораторному исследованию эякулята человека и взаимодействия сперматозоидов с цервикальной слизью. 4-е изд. М., 2001. 144 c.






