ВВЕДЕНИЕ
Почечно-клеточный рак (ПКР) занимает восьмое место среди наиболее распространенных видов рака в мире с пожизненным риском 1,7% и заболеваемостью примерно 76 000 случаев и 13 800 смертей в 2021 году [1].
Заболеваемость населения Республики Узбекистан злокачественными новообразованиями почек растет и на 2019 г. составила 2,4 на 100 000 населения, в 2015-2016 гг. этот показатель был 1,9, в 2017 г. – 2,1, а в 2018 г. – 2,2. Это может быть связано и с тем, что удельный вес больных раком почки, выявленных активно, от числа больных с впервые в жизни установленным диагнозом этого злокачественного новообразования, значительно повышался. В 2015 г. таких больных было 8,1%, в 2016 г. – 8,9%, в 2017 г. – 10,0%, в 2018 г. – 12,4%, а в 2019 г. – 18,2%. При этом доля больных с опухолями почек, наблюдавшихся 5 лет и более с момента установления диагноза, от общего числа состоящих на учете с этим диагнозом, на 2019 г. составила 37,1% [2].
Рост этого заболевания обостряет проблему повышения эффективности лечения метастатического ПКР. За последние годы в стандарты лечения метастатического ПКР в Узбекистане внедрено использование современных таргетных препаратов из классов ингибиторов тирозинкиназы, однако опыт применения терапии на основе этих лекарственных средств выявил необходимость определения патологического фенотипа для выбора варианта фармакологического воздействия [3–5].
Чтобы оптимизировать подход к лечению метастатического ПКР, очень важно понимать структуру микроокружения опухоли, которая будет определять влияние каждого вида терапии. Транскриптомный анализ иммунного инфильтрата ПКР из базы данных Атласа генома рака (TCGA) идентифицировал ПКР как имеющий самую высокую степень тотальной иммунной инфильтрации и Т-клеточной инфильтрации из 19 типов рака, в то же время при иммунологически «холодном» ПКР инвазии лимфоидными клетками наблюдается редко [6-8]. При этом, CD8 T-лимфоциты и Th1-дифференцированные CD4 T-лимфоциты способствуют противоопухолевому иммунитету, в то время как Treg и Th2 T-лимфоциты связаны с уклонением опухолевых клеток от иммунитета [9, 10].
Целью настоящего исследования является разработка критериев выбора терапевтического воздействия при метастатическом ПКР с учетом факторов микроокружения опухоли.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 110 пациентов с верифицированным диагнозом почечно-клеточного рака с и без метастатического процесса, проходивших лечение в Республиканском специализированном научно-практическом центре онкологии и радиологии Министерства здравоохранения Республики Узбекистан за период с 2018 по 2022 гг. Пятидесяти пяти больным с диагнозом рак почки без метастатического процесса проведен стандартный хирургический метод лечения, включавший радикальную нефрэктомию. Из 55 пациентов с подтверждением наличия метастазов, которые получали иммуно-таргетную терапию, 42 выполнена паллиативная нефрэктомия, у остальных 13 пациентов верификация диагноза проведена при гистологическом исследовании биопсийного материала. Данной группе пациентов, в связи с тяжелым соматическим состоянием на момент обращения, не представлялось возможным выполнить удаление пораженной почки.
Все исследованные пациенты (n=110) были разделены на 3 группы в соответствии с проведенным лечением: 1 группа – больные с метастатическим ПКР, получавшие таргетную терапию препаратами группы ингибиторов тирозинкиназы (ИТК) Пазопаниб или Сунитиниб в качестве монотерапии (n=25); 2 группа – больные с метастатическим ПКР, получавшие комбинированную терапию – Бевацизумаб+Реоферон–альфа (n=30); 3 группа – контрольная, больные ПКР без метастатического процесса, которым был проведен только хирургический метод лечения (n=55).
Для определения лимфоидного спектра в микроокружении опухоли использовали метод цитометрии, который проводили на цитометре CytoFLEX (Beckman Coulter, США). Для окрашивания клеток использовали следующую панель моноклональных антител, меченных FITC и PE (фикоэритрин): CD3, CD4, CD8, CD14, CD16, CD19, CD25, CD38, CD45, CD56 производства Beckman Coulter, США. Для удаления эритроцитов подготовку проб проводили по безотмывочной технологии с использованием следующих лизирующих растворов: OptiLyse C, OptiLyse B, ImmunoPrep и Whole Blood Lysing Reagents производства Beckman Coulter, США. Для анализа результатов использовали встроенное программное обеспечение цитометра CytoFLEX (Beckman Coulter, США).
Иммуногистохимическое исследование осуществляли на срезах с парафиновых блоков толщиной 3-4 мкм авидин-биотин-пероксидазным методом по стандартной методике с использованием первичных антител («Dako», Novocastra™): Bcl 2, Ki 67, р53 и VEGF. В качестве вторичных антител использовали биотинилированные антитела к иммуноглобулинам мыши и кролика («Dako», Novocastra™). Оценивали удельное количество позитивно окрашенных опухолевых клеток, экспрессирующих следующие маркеры: Bcl 2, Ki 67, р53 и VEGF. Положительным результатом являлось наличие специфического окрашивания цитоплазматической мембраны и ядер клеток.
РЕЗУЛЬТАТЫ
Нами были проведены исследования субпопуляционного спектра лимфоидных клеток в опухолевой ткани при метастатическом ПКР (рис. 1).
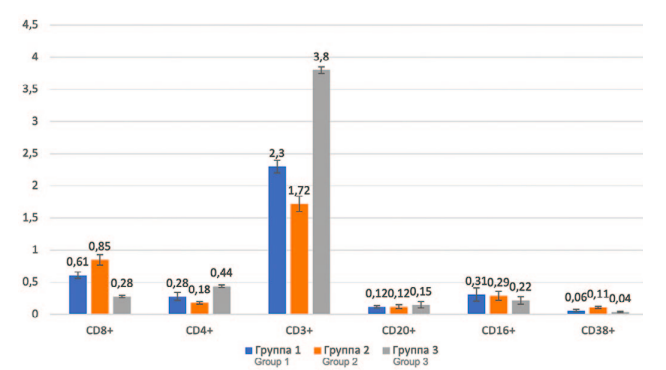
Рис. 1. Субпопуляционный спектр лимфоидных клеток (тыс/мкл) в опухолевой
ткани при метастатическом почечно-клеточный рак
Fig. 1. Subpopulation spectrum of lymphoid cells (thousand/μl) in tumor tissue in
metastatic renal cell carcinoma
Методом проточной цитофлуориметрии были определены ключевые протеины класса CD, относящиеся к различным типам иммунокомпетентных клеток: CD4+ – мономерный трансмембранный гликопротеин надсемейства Ig, является маркером T-хелперов; CD8+ – трансмембранный гликопротеин, служащий корецептором Т-клеточных рецепторов (TCR), является маркером T-супрессоров; CD3+ – маркер, который позволяет идентифицировать зрелые покоящиеся (интактные) Т-клетки и подсчитать общее количество Т-лимфоцитов; CD20+ – белок, ко-рецептор, расположенный на поверхности B-лимфоцитов; CD16+ – мембранный белок суперсемейства иммуноглобулинов, низкоаффинный рецептор для Fc-фрагмента иммуноглобулинов G (IgG), который экспрессирован на поверхности естественных киллеров, нейтрофилов, моноцитов, макрофагов; CD38+ – экпрессируется на поверхности активированных Т- и В-лимфоцитов, NK-клеток, моноцитов, плазматических клеток и медуллярных тимоцитов.
В группе 3 (контроль, больные ПКР без метастатического процесса) количество Т-хелперов значительно превалировало над числом Т-супрессоров (0,44±0,08 тыс/мкл против 0,28±0,08 тыс/мкл), что говорит об активном развитии иммунореактивности организма на канцерогенез. Концентрация субпопуляции зрелых Т-клеток CD3+ составляла 3,8±0,05 тыс/мкл, В-лимфоцитов было 0,15±0,05 тыс/мкл, а Т-киллерных клеток – 0,22±0,06 тыс/мкл. Активированных Т- и В-лимфоцитов, NK-клеток, моноцитов, плазматических клеток и медуллярных тимоцитов, несущих на своей поверхности антиген CD38+ обнаруживалось 0,04±0,02 тыс/мкл. Данная картина микроокружения опухоли демонстрирует активность иммунной защиты в отношении канцерогенеза, но, несмотря на значительное количество CD4+ лимфоцитов, число активированных иммунокомпетентных клеток незначительное. Это можно объяснить гиперантигенизацией организма опухолевыми белками.
В группе 1 наблюдались значительные изменения в субпопуляционном спектре микроокружения опухоли, в сравнении с группой 3 (контроль). Субпопуляция Т-супрессоров превалировала над Т-хелперами (0,61±0,05 тыс/мкл против 0,28±0,06 тыс/мкл), что говорит о подавлении иммунореактивности организма в ответ на канцерогенез. Концентрация субпопуляции зрелых Т-клеток CD3+ составляла 2,3±0,1 тыс/мкл, В-лимфоцитов было 0,12±0,02 тыс/мкл, а Т-киллерных клеток – 0,31±0,1 тыс/мкл. Клеток, несущих на своей поверхности антиген CD38+, обнаруживалось 0,06±0,02 тыс/мкл. Отмечено, что общее количество иммунокомпетентных клеток значительно меньше, чем в группе 3, а киллерных лимфоцитов, наоборот, больше, что говорит в пользу активации тканевого иммунитета.
В группе 2 также наблюдались значительные изменения в субпопуляционном спектре микроокружения опухоли, в сравнении с группой 3 (контроль). Субпопуляция Т-супрессоров превалировала над Т-хелперами (0,85±0,08 тыс/мкл против 0,18±0,02 тыс/мкл), что также демонстрирует, как и в случае группы 1, подавление иммунореактивности организма в ответ на канцерогенез, но здесь степень такого ингибирования значительно выше. Концентрация субпопуляции зрелых Т-клеток CD3+ составляла 1,72±0,12 тыс/мкл, В-лимфоцитов было 0,12±0,03 тыс/мкл, а Т-киллерных клеток –0,29±0,07 тыс/мкл. Клеток, несущих на своей поверхности антиген CD38+ обнаруживалось 0,11±0,02 тыс/мкл. В этой группе зафиксирован наибольший уровень из всех исследованных групп активированных иммунокомпетентных клеток (CD38+), что говорит в пользу увеличения эффективности иммунной защиты самого организма против канцерогенеза.
Другим важным прогностическим фактором при назначении таргетной терапии больным метастатическим ПКР является статус опухолевых клеток по ряду важных пролиферативных биомаркеров [11, 12]. Состав этого комплекса диагностических биомаркеров у разных исследователей различается [13, 15]. Нами было предложено определение диагностического фенотипа, состоящего из онкомаркеров VEGF, Bcl 2, Ki 67, р53. Все они являются составляющими пролиферативных сигнальных путей, и их комплексное определение позволяет получать адекватную картину митотической и апоптотической активности опухолевых клеток [16, 17].
В таблице 1 приведены результаты определения экспрессии VEGF, Bcl 2, Ki 67, р53 у больных метастатическим ПКР, что позволило назначать пациентам, в зависимости от полученных данных, ту или иную таргетную терапию: больные с метастатическим ПКР из группы 1 получали таргетную терапию препаратами группы ингибиторов тирозинкиназы (ИТК) Пазопаниб или Сунитиниб (монотерапия); больные с метастатическим ПКР из группы 2 получали комбинированную терапию (Бевацизумаб+Реоферон–альфа).
Таблица 1. Определение экспрессии VEGF, Bcl 2, Ki 67, р53 у больных метастатическим ПКР (%) в зависимости от проведенного лечения
Table 2. Determination of VEGF, Bcl 2, Ki 67, p53 expression in patients with metastatic RCC (%) depending on the treatment given
|
Определяемый маркер и степень его экспрессирования в опухолевых клетках |
Гpynna 1 (n = 25) / Group 1 (n = 25) |
Гpynna 2 (n = 30) / Group 2 (n = 30) |
||
|---|---|---|---|---|
|
абс. |
% |
абс. |
% |
|
|
VEGF |
||||
|
Высокая / high |
3 |
12,0±2,65 |
28 |
93,33±2,04 |
|
Низкая / low |
22 |
88,0±2,65 |
2 |
6,67±2,04 |
|
Bel 2 |
||||
|
Высокая / high |
9 |
36,0±3,92 |
6 |
20,0±3,27 |
|
Низкая / low |
16 |
64,0+3,92 |
24 |
80,0±3,27 |
|
Ki 67 |
||||
|
Высокая / high |
15 |
60,0±4,0 |
13 |
43,3±4,05 |
|
Низкая / low |
10 |
40,0±4,0 |
17 |
56,7±4,05 |
|
p53 |
||||
|
Высокая / high |
15 |
60,0±4,0 |
23 |
76,7±3,45 |
|
Низкая / low |
10 |
40,0±4,0 |
7 |
23,3±3,45 |
Критериями отбора для назначения комбинированной терапии (Бевацизумаб+Реоферон–альфа) служили: высокая экспрессия VEGF, средняя экспрессия Ki-67, высокая экспрессия маркера апоптоза p53 и низкая экспрессия его антагониста bcl-2. Диагностический фенотип опухолевых клеток при назначении препаратов группы ингибиторов тирозинкиназы (ИТК) выглядел иначе: низкая экспрессия у большинства пациентов VEGF, высокая экспрессия маркера пролиферации Ki-67, сбалансированная экспрессия маркеров апоптоза bcl-2 и p53.
Выбор таргетного препарата для терапии метастатического ПКР в соответствии с разработанным комплексом биомаркеров был обусловлен его фармакологической направленностью в отношении мишеней в опухолевых клетках. Бевацизумаб представляет собой рекомбинантные гуманизированные моноклональные антитела, которые избирательно связываются и нейтрализуют биологическую активность человеческого фактора роста сосудистого эндотелия (VEGF), что обуславливает наличие в диагностическом фенотипе высокой экспрессии маркера VEGF [18-20]. Комбинированное воздействие совместно с таргетным препаратом иммуномодулятора Реоферон–альфа эффективно в отношение высокопролиферирующих клеток (высокая экспрессия маркера Ki-67) [21]. Синергизм этих лекарственных средств, относящихся к разным классам цитостатиков, позволяет преодолевать развившуюся в результате метастатического канцерогенеза резистентность опухолевых клеток к химиотерапии, выражающуюся в примерно равном соотношении экспрессии маркеров bcl-2 и p53, т.е. в пониженной апоптотической активности раковых клеток [22, 23].
Наличие другого диагностического фенотипа опухолевых клеток при метастатическом ПКР, выражающегося в низкой экспрессии у большинства пациентов фактора VEGF, высокой экспрессии маркера Ki-67 и сбалансированной экспрессии маркеров апоптоза bcl-2 и p53, обусловил выбор таргетной терапии ингибиторами тирозинкиназы (ИТК) – препаратами Пазопаниб или Сунитиниб (группа 1) [24]. Эти таргетные препараты могут селективно связываться не только рецепторами эндотелиальных факторов роста-1, 2, 3 (VEGFR-1, VEGFR-2, VEGFR-3), но и с рецепторами фактора роста тромбоцитов альфа и бета (PDGFR-α и PDGFR-β), рецепторами фактора роста фибробластов-1 и -3 (FGFR-1, -3), рецепторами цитокина (Kit), рецепторами интерлейкина-2, индуцируемого киназой Т-клеток (Itk) [25]. В условиях низкой экспрессии VEGF и высокой инфильтрации опухолевой ткани лимфоидными клетками выбор данных таргетных препаратов при обозначенном диагностическом фенотипе является наиболее предпочтительным.
ОБСУЖДЕНИЕ
Результаты проведенных нами исследований показали, что экстраопухолевая гетерогенность клетками различного генеза, в большинстве иммунокомпетентными, является значительным прогностическим маркером выбора терапевтического воздействия и последующего мониторинга результатов проведенного лечения. По результатам проведенного анализа нам удалось установить патологический фенотип, основанный на критериях экстраопухолевой гетерогенности при метастатическом ПКР.
В таблице 2 приведены выделенные нами прогностические критерии, характерные для выбора терапевтического воздействия с учетом гистоморфологической картины экстраопухолевой гетерогенности при ПКР.
Таблица 2. Степень лимфоидной инвазии, наблюдаемые у пациентов с ПКР, по результатам гистоморфологического анализа образцов опухолевой ткани
Table 2. The lymphoid invasion degree observed in patients with RCC, according to the results of histomorphological analysis of tumor tissue samples
|
Симптом |
Гpynna 1 (n = 25) |
Группа 2 (n = 30) |
Гpynna 3 (n = 55) |
|---|---|---|---|
|
Низкая степень лимфоидной инвазии |
8,0±2,22 |
6,67±2,04 |
90,91±2,35 |
|
Высокая степень лимфоидной инвазии |
92,0±2,22 |
93,33±2,04 |
9,09±2,35 |
|
Преимущественно незрелые Т-лимфобласты |
88,0±2,65 |
93,33±2,04 |
7,27±2,12 |
|
Преимущественно зрелые Т-лимфоциты |
12,0±2,65 |
6,67±2,04 |
92,73±2,12 |
|
Лимфоидная инвазия распределена по всей опухолевой ткани |
8,0±2,22 |
3,33±1,47 |
98,18±1,09 |
|
Лимфоидная инвазия распределена в области ангиогенеза |
92,0±2,22 |
96,67±1,47 |
1,82±1,09 |
Мы предлагаем оценивать следующие параметры микроокружения опухоли для выбора варианта лечения метастатического ПКР: низкая или высокая степень лимфоидной инвазии, обнаружение преимущественно незрелых Т-лимфобластов или зрелых Т-лимфоцитов, характер распределения лимфоидных клеток – по всей опухолевой ткани или в области развития ангиогенеза. Для назначения таргетной терапии препаратами группы ингибиторов тирозинкиназы (ИТК) Пазопаниб или Сунитиниб (группа 1) или же комбинированной терапии (Бевацизумаб+Реоферон–альфа) (группа 2) патологический морфотип опухолевой ткани должен быть следующим: высокая степень лимфоидной инвазии, обнаружение преимущественно незрелых Т-лимфобластов, лимфоидная инвазия распределена в области ангиогенеза. В случае обнаружения другого патологического морфотипа опухолевой ткани, а именно: высокая степень лимфоидной инвазии, обнаружение преимущественно зрелых Т-лимфоцитов, лимфоидная инвазия распределена по всей опухолевой ткани – следует скорректировать терапевтическую тактику в сторону выбора других терапевтических методов.
ЗАКЛЮЧЕНИЕ
Предлагаемый нами новый патологический фенотип с учетом картины лимфоидной инвазии в опухолевой ткани при метастатическом ПКР, позволяет, при условии учета экспрессии VEGF, Bcl 2, Ki 67, р53 у больных, облегчить выбор терапевтического воздействия таргетными и иммуномодулирующими препаратами и, таким образом, повысить эффективность лечения данного заболевания.
ЛИТЕРАТУРА
1. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2021. CA Cancer J Clin 2021;71(1):7–33. https://doi.org/10.3322/caac.21654.
2. Тилляшайхов М.Н., Ибрагимов Ш.Н., Джанклич С.М. Состояние онкологической помощи населению Республики Узбекистан в 2019 году. Ташкент 2020;124 с. [Tillyashaykhov M.N., Ibragimov Sh.N., Dzhanklich S.M. The state of oncological care to the population of the Republic of Uzbekistan in 2019. Tashkent 2020;124 p. (In Russian)].
3. Тилляшайхов М.Н., Пендхаркар Д., Юсупбеков А.А., Абдихакимов А.Н., Хакимов Г.А. и др. Практические рекомендации по лечению рака почки. В Стандарты диагностики и лечения онкологических заболеваний. Под ред. Тилляшайхова М.Н., Ташкент 2021;368-374 с. [Tillyashaykhov M.N., Pendharkar D., Yusupbekov A.A., Abdikhakimov A.N., Khakimov G.A., et al. Practical recommendations for the treatment of kidney cancer. In Standards for the diagnosis and treatment of oncological diseases. Edit. Tillyashaykhov M.N. Tashkent 2021;368-374 p. (In Russian)].
4. Аксель Е.М., Матвеев В.Б. Статистика злокачественных новообразований мочевых и мужских половых органов в России и странах бывшего СССР. Онкоурология 2019;15 (2):15-24. [Axel E.M., Matveev V.B. Statistics of malignant neoplasms of the urinary and male genitalia in Russia and the countries of the former USSR. Oncourologiya = Cancer Urology 2019;15(2):15-24. (In Russian)].
5. Atkins MB, Jegede O, Haas NB, McDermott DF, Bilen MA, Drake CG, et al. Phase II study of Nivolumab and Salvage Nivolumab + Ipilimumab in treatment-naïve patients (Pts) with advanced renal cell carcinoma (RCC) (HCRN GU16-260). J Clin Oncol 2022;40(25):2913-2923. https://doi.org/10.1200/JCO.21.02938.
6. Braun DA, Hou Y, Bakouny, Z, Ficial M, Sant’Angelo M, Forman J, et al. Interplay of somatic alterations and immune infiltration modulates response to PD-1 blockade in advanced clear cell renal cell carcinoma. Nat Med 2020;26(6):909–18. https://doi.org/10.1038/s41591-020-0839-y.
7. Bedke J, Albiges L, Capitanio U, Giles RH, Hora M, Lam TB, et al. The 2021 updated European Association of Urology guidelines on renal cell carcinoma: immune checkpoint inhibitorbased combination therapies for treatment-naive metastatic clear-cell renal cell carcinoma are standard of care. Eur Urol 2021;80(4):393-397. https://doi.org/10.1016/j.eururo.2021.04.042.
8. Braun DA, Hou Y, Bakouny, Z, Ficial M, Sant’Angelo M, Forman J, et al. Interplay of somatic alterations and immune infiltration modulates response to PD-1 blockade in advanced clear cell renal cell carcinoma. Nat Med 2020;26(6):909–18. https://doi.org/10.1038/s41591-020-0839-y.
9. Makhov P, Joshi S, Ghatalia P, Kutikov A, Uzzo RG, Kolenko VM. Resistance to systemic therapies in clear cell renal cell carcinoma: mechanisms and management strategies. Mol Cancer Ther 2018;17(7):1355–64. https://doi.org/10.1158/1535-7163.
10. Carretero-González A, Lora D, Martín Sobrino I, Sáez Sanz I, Bourlon MT, Anido Herranz U, et al. The Value of PD-L1 expression as predictive biomarker in metastatic renal cell carcinoma patients: a meta-analysis of randomized clinical trials. Cancers (Basel) 2020;12(7):1945. https://doi.org/10.3390/cancers12071945
11. Choueiri TK, Albiges L, Powles T, Scheffold C, Wang F, Motzer RJ. A phase III study (COSMIC-313) of Cabozantinib (C) in combination with Nivolumab (N) and Ipilimumab (I) in patients (Pts) with previously untreated advanced renal cell carcinoma (ARCC) of intermediate or poor risk. J Clin Oncol 2020;(38):15.. https://doi.org/10.1200/JCO.2020.38.15_suppl.TPS5102.
12. Choueiri TK, Tomczak P, Park SH, Venugopal B, Ferguson T, Chang Y-H, et al. Adjuvant Pembrolizumab after nephrectomy in renal-cell carcinoma. N Engl J Med 2021;385(8):683-694. https://doi.org/10.1056/NEJMoa2106391.
13. Deleuze A, Saout J, Dugay F, Peyronnet B, Mathieu R, Verhoest G, et al.. Immunotherapy in renal cell carcinoma: the future is now. Int J Mol Sci 2020;21(7):2532. https://doi.org/10.3390/ijms21072532.
14. Doroshow DB, Bhalla S, Beasley MB, Sholl LM, Kerr KM, Gnjatic S et al. PD-L1 as a biomarker of response to immune-checkpoint inhibitors. Nat Rev Clin Oncol 2021;18(6):345-362. https://doi.org/10.1038/s41571-021-00473-5.
15. Escudier B, Motzer RJ, Tannir NM, Porta C, Tomita Y, Maurer MA, et al. Efficacy of Nivolumab plus Ipilimumab according to number of IMDC risk factors in CheckMate 214. Eur Urol 2020;77(4):449-453. https://doi.org/10.1016/j.eururo.2019.10.025.
16. Figel A-M, Brech D, Prinz PU, Lettenmeyer UK, Eckl J, Turqueti-Neves A, et al. Human renal cell carcinoma induces a dendritic cell subset that uses T-Cell crosstalk for tumorpermissive milieu alterations. Am J Pathol 2011;179(1):436-51. https://doi.org/10.1016/j.ajpath.2011.03.011.
17. Giraldo NA, Becht E, Pages F, Skliris G, Verkarre V, Vano Y, et al. Orchestration and prognostic significance of immune checkpoints in the microenvironment of primary and metastatic renal cell cancer. Clin Cancer Res 2015;21(13):3031-40. https://doi.org/10.1158/1078-0432.CCR-14-2926.
18. Grimm M-O, Esteban E, Barthélémy P, Schmidinger M, Busch J, Valderrama BP, et al. Efficacy of Nivolumab/Ipilimumab in patients with initial or late progression with Nivolumab: updated analysis of a tailored approach in advanced renal cell carcinoma (TITAN-RCC). J Clin Oncol 2021;39:4576. https://doi.org/10.1200/JCO.2021.39.15_suppl.4576.
19. Hartman TR, Demidova EV, Lesh RW, Hoang L, Richardson M, Forman A, et. Prevalence of pathogenic variants in DNA damage response and repair genes in patients undergoing cancer risk assessment and reporting a personal history of early-onset renal cancer. Sci Rep 2020;10(1):13518. https://doi.org/10.1038/s41598-020-70449-5.
20. Iacovelli R, Ciccarese C, Bria E, Bracarda S, Porta C, Procopio G, et al. Patients with sarcomatoid renal cell carcinoma–re-defining the first-line of treatment: a meta-analysis of randomised clinical trials with immune checkpoint inhibitors. Eur J Cancer 2020;136:195-203. https://doi.org/10.1016/j.ejca.2020.06.008
21. Ko JS, Rayman P, Ireland J, Swaidani S, Li G, Bunting KD, et al. Direct and differential suppression of myeloid-derived suppressor cell subsets by Sunitinib is compartmentally constrained. Cancer Res 2010;70(9):3526-36. https://doi.org/10.1158/0008-5472.CAN-09-3278
22. Lalani A-KA, Xie W, Martini DJ, Steinharter JA, Norton CK, Krajewski KM, et al. Change in neutrophil-to-lymphocyte ratio (NLR) in response to immune checkpoint blockade for metastatic renal cell carcinoma. J Immunother Cancer 2018;6(1):5. https://doi.org/10.1186/s40425-018-0315-0.
23. Li F, Li C, Cai X, Xie Z, Zhou L, Cheng B, et al. The Association between CD8+ tumor-infiltrating lymphocytes and the clinical outcome of cancer immunotherapy: a systematic review and metaanalysis. EClinicalMedicine 2021;41:101134. https://doi.org/10.1016/j.eclinm.2021.101134.
24. Lindskog M, Laurell A, Kjellman A, Melichar B, Niezabitowski J, Maroto P, et al. A randomized phase ii study with ilixadencel, a cell-based immune primer, plus Sunitinib versus Sunitinib alone in synchronous metastatic renal cell carcinoma. J Clin Oncol 2020;38(5 Suppl):11. https://doi.org/10.1200/jco.2020.38.5_suppl.11
25. Motzer R, Alekseev B, Rha S-Y, Porta C, Eto M, Powles T, et al. Lenvatinib plus Pembrolizumab or Everolimus for advanced renal cell carcinoma. N Engl J Med 2018;384(14):1289-1300. https://doi.org/10.1056/NEJMoa2035716..







