Несмотря на успехи в комплексном и комбинированном лечении рака мочевого пузыря (РМП) остаются высокими частота рецидивов и прогрессии. Не удается значительно улучшить показатели выживаемости пациентов с высокими факторами риска, которые имеют рецидивирующее и прогрессирующее течение болезни. Значимо не улучшает показатели выживаемости у этих больных и цистэктомия, выполняемая как операция отчаяния на фоне неэффективной органосохраняющей терапии [1-7]. Актуальность этой проблемы в последние годы связана как с истинным ростом заболеваемости РМП и поздней выявляемостью, так и с неадекватностью проводимой терапии, и несвоевременностью перехода к более агрессивным схемам лечения. Это ведет к неудовлетворенности пациентов и урологов результатами лечения [8-12]. Особенно это касается мышечно-инвазивных и местно-распространенных форм РМП (МИРМП и МРРМП), которые остаются самыми смертельно опасным среди злокачественных образований, лечением которых занимаются урологи [13-15]. Ранняя радикальная цистэктомия (РЦЭ) является излечивающей для большинства пациентов с МИРМП, реже – при МРРМП и значительно реже – для больных с регионарными метастазами. Радикальность обеспечивается соблюдением главных принципов операции: максимально широким иссечением мочевого пузыря и паравезикальной клетчатки с тщательной регионарной лимфодиссекцией. Очевидно, что плохое качество хирургии, независимо от техники, имеет драматические последствия для больных с МИРМП и МРРМП. Частота местного рецидива РМП напрямую связана с наличием положительного хирургического края и практически всегда обусловливает плохой результат. Таким образом, качество хирургии в вопросах лечения пациентов МИРМП и МРРМП должно являться главным принципом при любых модификациях хирургической техники и внедрении новых технологий [16]. К сожалению, органосохраняющее лечение при этих формах РМП часто и неоправданно используется как единственный подход по принципу «до последнего». В большинстве случаев это паллиативное лечение, а цистэктомия в такой ситуации выполняются с опозданием, как операция отчаяния, при поздних, запущенных стадиях и не имеет должной эффективности, дискредитируя метод.
В этой связи важно оценить в сравнительном аспекте роль и достоверность прогностических факторов выживаемости после РЦЭ в зависимости от: стадии РМП – немышечно-инвазивный (НМИРМП), МИРМП и МРРМП; от возраста; у первичных и рецидивных больных; при первичной, спасительной и паллиативной цистэктомиях; времени от установки диагноза РМП до РЦЭ; от наличия гидронефроза, обусловленного РМП; от многофокусности поражения; анемии; коморбидности пациентов; статусов pN и pG; от наличия непереходно-клеточных опухолей и CIS [17-19].
МАТЕРИАЛЫ И МЕТОДЫ
В период с 1995 по 2014 гг. выполнено более 400 цистэктомий (ЦЭ). Показаниями к РЦЭсчитали наличие РМП в стадии сT2-T4aN0-хM0, либо наличие НМИРМП (cN0-хM0) высокой степени риска. Критериями высокого риска прогрессии при НМИРМП считали: cT1G3 – многофокусная и/или большая опухоль (>3 см); cT1G3 – рецидивная опухоль; cT1G3 + CIS; cT1G3 ± CIS в простатической уретре.
Дополнительным показаниям к РЦЭ при НМИРМП считали – cT1N0-хM0G2-3 + верифицированный рак предстательной железы. В данном исследовании ретроспективно оценены результаты ЦЭ при стадиях РМП pTa-pT4b (n=349). Средний возраст составил 58,8±9,2 лет (от 26 до 87 лет): женщин было 30 (8,6%), средний возраст – 58,4±9,3 года (от 42 до 78 лет), мужчин – 319 (91,4%), средний возраст – 58,7±9,6 лет (от 26 до 87 лет). Для достоверности оценки онкологических результатов из общего числа больных (n=349) выделили группы: I – pT1-pT4aN0-3M0 (n=325) – для анализа результатов РЦЭ и II – pT4bN0-3M0 (n=17) + pT2a-pT4bN03M1 (hepar; pulm; oss) (n=7) – для оценки эффективности паллиативной ЦЭ. Анализируемые показатели формализованы и введены в единую базу данных. Использовали методы статистического анализа: проверка нормальности распределения количественных признаков с использованием критерия Колмогорова-Смирнова с поправкой Лиллиефорса и критерия Шапиро-Уилка; проверка равенства генеральных дисперсий с помощью точного критерия Фишера и Кохрэна; анализ таблиц сопряженности. Статистическая обработка выполнена с помощью пакета прикладных программ: Statistica 7.0 (StatSoft, USA); BioStat 2009 (AnalystSoft Inc., USA), Microsoft Excel 2013 и Microsoft Access 2010 (Microsoft Corporation, USA) [20-22].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Общая 3-х летняя и 5-летняя выживаемость больных при стадиях pT1-pT4a (n=324, исключен один пациент в стадии pTa) после РЦЭ, при общей медиане выживаемости – 123,5 месяца, составила 69,2% и 58,1% соответственно. Актуриальная 10летняя и 15-летняя общая выживаемость – 51,7% и 46,3% (рис. 1).
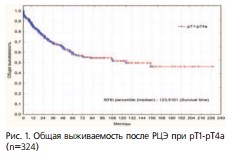
Рис. 1. Общая выживаемость после РЦЭ при pT1-pT4a (n=324)
3-летняя канцерспецифическая выживаемость в той же группе – 80,7%, а ожидаемая 5-летняя – 71,3% (рис. 2).

Рис. 2. Канцерспецифическая выживаемость после РЦЭ при pT1-pT4a (n=324)
Показатели безрецидивной выживаемости в той же группе и в те же сроки послеоперационного наблюдения составили – 73,2% и 65,1% соответственно (рис. 3).

Рис. 3. Безрецидивная выживаемость после РЦЭ при pT1-pT4a (n=324)
Общая выживаемость пациентов достоверно коррелируют со стадиями РМП (рис. 4).
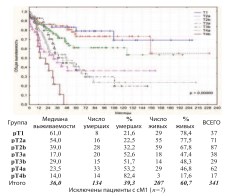
Рис. 4. Общая выживаемость после РЦЭ при pT1-pT4b по стадиям
Выявлена достоверно худшая общая выживаемость при pT4bN0-3M0: актуриальная 3-летнаяя общая выживаемость не превышает 21,9%, а к 44 месяцам послеоперационного наблюдения ожидаемая летальность 100%. Канцерспецифическая и безрецидивная выживаемости пациентов при pT1-pT4а (n=324) по стадиям представлены на графиках (рис. 5-6).
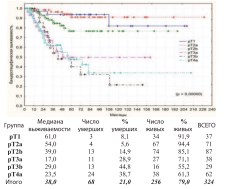
Рис. 5. Канцерспецифическая выживаемость после РЦЭ при pT1-pT4a по стадиям
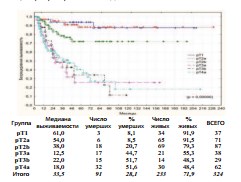
Рис. 6. Безрецидивная выживаемость после РЦЭ при pT1-pT4a по стадиям
Между группами больных при стадиях pT3a, pT3b и pT4a отсутствует достоверная разница в канцерспецифической (p=0,86218) и безрецидивной (p=0,87427) выживаемости: канцерспецифическая 3летняя выживаемость составила – 61,5%, 59,7%, 62,3%, расчетная 5летняя – 49,7%, 48,2% и 47,6%, безрецидивная 3-летняя – 42,6%, 48,9%, 53,6% и расчетная 5-летняя – 25,6%, 34,2% и 40,4% соответственно. Анализ всех видов выживаемости демонстрирует достоверно лучшие показатели выживаемости у пациентов при НМИРМП и МИРМП. При медиане в 46 месяцев, канцерспецифическая выживаемость при pT2a достоверно выше, чем при pT2b: 3-летняя – 96,3% и 88,2% и 5летняя – 91,0% и 76,7% соответственно (p=0,03603). Также достоверна разница в показателях безрецидивной выживаемости: при медиане – 44 месяца 3-летняя – 95,1% и 78,5%, а 5-летняя – 88,2% и 71,9% соответственно (p=0,02472).
В соответствии с рекомендациями ВОЗ по возрастной периодизации жизни человека из когорты пациентов подвергнутых РЦЭ (n=325) выделены группы: зрелый возраст – 21-60 лет (n=180 / средний возраст – 52,36±6,2 года); пожилой возраст – 61-74 года (n=138 / средний возраст – 66,4±3,7 лет); старческий возраст – 75-90 лет (n=7 / средний возраст – 78,3±4,0 лет). Ввиду малочисленности выборки в III группе для достоверного статистического анализа дополнительно выделена группа пациентов старшей возрастной категории – от 70 лет и старше (n=39 / средний возраст – 72,9±3,3 лет).Сравнительный анализ общей и канцерспецифической выживаемости пациентов выделенных групп демонстрирует отсутствие достоверной разницы между ними (рис. 7-8).
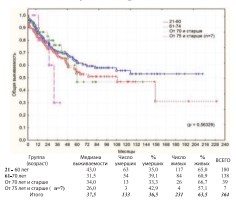
Рис. 7. Общая выживаемость после РЦЭ в зависимости от возраста
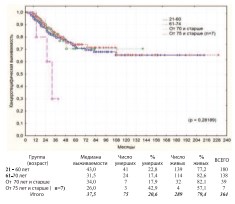
Рис. 8. Канцерспецифическая выживаемость после РЦЭ в зависимости от возраста
3-х летняя и 5-летняя выживаемость в анализируемых группах представлены в таблице 1.
Таблица 1. Общая и канцерспецифическая выживаемость после РЦЭ по возрастам
| Группа | Общая | Канцерспецифическая | р | ||
|---|---|---|---|---|---|
| 3-летняя | 5-летняя | 3-летняя | 5-летняя | ||
| 21-60 лет | 71,5% | 61.7% | 80,9% | 70.9% | р = 0.56329* р =0,28189** |
| 61-70 лет | 67,7% | 54,3% | 82,7% | 73,9% | |
| От 70 лет и старше | 76.0% | 46.7% | 82.4% | 70.5% | |
| От 75 лет и старше (п=7) | 30.0% | 0.0% | 0.0% | 0.0% | р > 0.05 |
Сравнительные результаты общей, канцерспецифической и безрецидивной выживаемости при первичном(n=215) и рецидивном(n=110) РМП представлены на графиках (рис. 9-11).
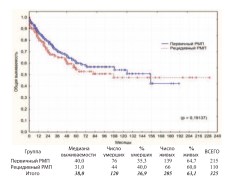
Рис. 9. Общая выживаемость после РЦЭ при первичном и рецидивном РМП
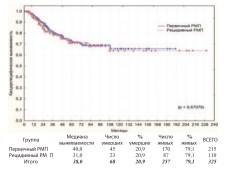
Рис. 10. Канцерспецифическая выживаемость после РЦЭ при первичном и рецидивном РМП
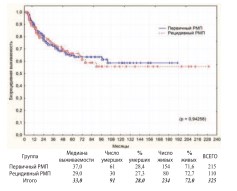
Рис. 11. Безрецидивная выживаемость после РЦЭ при первичном и рецидивном РМП
Достоверная разница между группами по всем видам выживаемости отсутствует. Для выявления такой разницы у первичных и рецидивных пациентов с разной степенью инвазии РМП нами выполнен дополнительный анализ выживаемости в подгруппах НМИРМП, МИРМП и МРРМП. В каждой из подгрупп достоверной разницы в выживаемости между первичными и рецидивными пациентами также не получено (табл. 2).
Таблица 2. Показатели достоверности разницы в выживаемости первичных и рецидивных больных после РЦЭ при НМИРМП, МИРМП и МРРМП
| Группа | Cравниваемые подгруппы | Выживаемость | ||
|---|---|---|---|---|
| Общая | Канцер специфическая | безрецидивная | ||
| НМИРМП | первичный | р = 0.81115 | р = 0.22910 | р = 0.34983 |
| рецидивный | ||||
| МИРМП | первичный | р 0.05870 | р0.89718 | р 0.98585 |
| рецидивный | ||||
| МРРМП | первичный | р = 0,60301 | р = 0.31003 | р = 0.41461 |
| рецидивный | ||||
Первичную РЦЭ выполняли по стандартным вышеуказанными показанияму первичных пациентов, не получавших ранее никакого лечения по поводу РМП. К спасительной РЦЭ прибегали у больных, которые ранее получали лечение РМП, но ответ на него отсутствовал и/или возник рецидив с прогрессией, либо изначально выявлена непереходно-клеточная опухоль. Паллиативная ЦЭ выполнялась при нерезектабельных местнораспространенных (T4b), метастатических (M1) опухолях, имеющих тяжелые и/или жизнеугрожающие осложнения: мочепузырно-кожные, -кишечные, влагалищные свищи, выраженный болевой синдром, неконтролируемые фармакологически и эндоскопически мочепузырные кровотечения, кишечную непроходимость, как осложнение МРРМП и другие. Среди пациентов подвергнутых ЦЭ (n=349) выделеныгруппы: РЦЭ первичная (n=206), РЦЭ спасения (n=119) и ЦЭ паллиативная (n=24). Общая, канцерспецифическая и безрецидивная выживаемость в этих группах представлены на графиках (рис. 12-14).
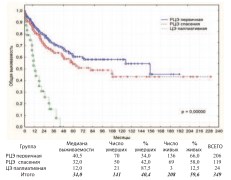
Рис. 12. Общая выживаемость после РЦЭ первичной, РЦЭ спасения и ЦЭ паллиативной
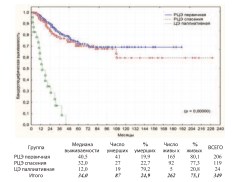
Рис. 13. Канцерспецифическая выживаемость после РЦЭ первичной, РЦЭ спасения и ЦЭ паллиативной
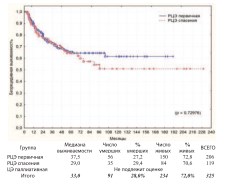
Рис. 14. Безрецидивная выживаемость после РЦЭ первичной и РЦЭ спасения
Достоверно худшие показатели всех видов выживаемости выявлены при паллиативной ЦЭ, что ассоциировано с продолженнымростомопухоли (p=0,00000). Статистически достоверная разница в показателях выживаемости при первичной и спасительной РЦЭ отсутствует. 3-летняя, 5-летняя и актуриальная 10-летняя выживаемость представлены в таблице 3.
Таблица 3. Общая, канцерспецифическая и безрецидивная выживаемость после РЦЭ первичной, спасения и ЦЭ паллиативной
| Общая | Канцерспецифическая | Безрецидивная | Р | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Подгруппа (РЦЭ/ЦЭ) |
3- летняя |
5- летняя |
10- летняя |
3- летняя |
5- летняя |
10- летняя |
3- летняя |
5- летняя |
10- летняя |
|
| Первичная | 71,8% | 60,4% | 58,2% | 82,1% | 72,0% | 69,2% | 73,0% | 65,7% | 61,6% | p=0,14657* |
| Спасения | 64,9% | 54.2% | 43.2% | 78.2% | 70,2% | 59.6% | 73.9% | 64,4% | 51,0% | p=0.40901** p=0.72976*** |
| Паллиативная | 15,4% | 0.0% | 0.0% | 17,1% | 0.0% | 0.0% | Не подлежит оценке | р=0.00000* р=0,000(К)** |
||
Дополнительно выполнен анализ выживаемости пациентов перенесших ЦЭ (n=325) в зависимости от факторов способных потенциально влиять на прогноз и исход заболевания при РМП. Так рядом исследований продемонстрирована лучшая выживаемость пациентов после РЦЭ, у которых сроки от момента первичной диагностики РМП до выполнения РЦЭ не превышали 3 года. При аналогичном анализе у наших пациентов мы не получили достоверной разницыв общей и канцерспецифической выживаемости по этому критерию (рис. 15, 16).
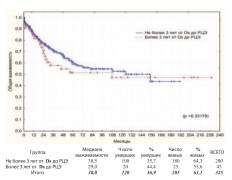
Рис. 15. Общая выживаемость после РЦЭ в зависимости от сроков между диагностикой РМП и выполнением РЦЭ
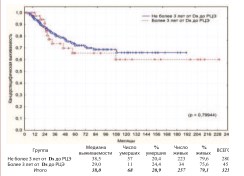
Рис. 16. Канцерспецифическая выживаемость после РЦЭ в зависимости от сроков между диагностикой РМП и выполнением РЦЭ
Другим потенциальным фактором прогноза РМП является наличие гидронефроза до выполнения РЦЭ, обусловленного самой опухолью. Анализ по этому критерию представлен на графиках (рис. 17-18).
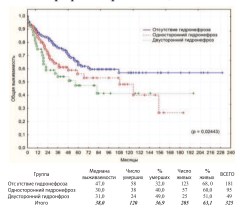
Рис. 17. Общая выживаемость после РЦЭ в зависимости от наличия или отсутствия дооперационного гидронефроза
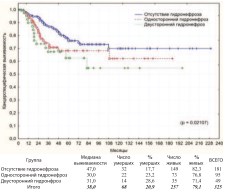
Рис. 18. Канцерспецифическая выживаемость после РЦЭ в зависимости от наличия или отсутствия дооперационного гидронефроза
Результаты сравнительного анализа канцерспецифической выживаемости при монои полифокальном поражении стенки мочевого пузыря опухолью представлены на графике (рис. 19).
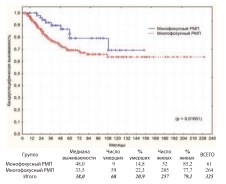
Рис. 19. Канцерспецифическая выживаемость после РЦЭ при монои многофокусном РМП
Для оценки степени анемии пользовались общепринятыми критериями: I степень 100-120 г/л у мужчин и 90 -110 г/л у женщин,II степень – 80100 г/л умужчин и 70-90 г/л у женщин, III степень – ниже 80 г/л у мужчин и ниже 70 г/л у женщин. В результате установлено наличие высоко достоверной разницы в общей и в канцерспецифической выживаемости пациентов после РЦЭ в зависимости от наличия и степени выраженности исходной анемии (рис. 20-21).
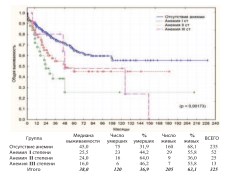
Рис. 20. Общая выживаемость после РЦЭ при отсутствии или наличии анемии
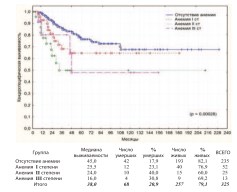
Рис. 21. Канцерспецифическая выживаемость после РЦЭ при отсутствии или наличии анемии
Коморбидность – фактор оказывающий влияние, прежде всего, на общую выживаемость больных после РЦЭ. В нашем исследовании полученная разница, как в общей, так и в канцерспецифической выживаемости по данному показателю оказалась недостоверной (рис. 22-23).
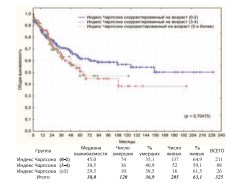
Рис. 22. Общая выживаемость после РЦЭ в зависимости от коморбидности
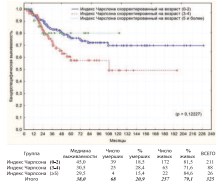
Рис. 23. Канцерспецифическая выживаемость после РЦЭ в зависимости от коморбидности
Важным прогностическим факторомканцерспецифической выживаемости после РЦЭ является наличие регионарных лимфоидных метастазов. Разница в выживаемости по этому прогностическому фактору в наших наблюдениях определяется с высокой степенью статистической достоверности в пользу статуса N(-)(рис. 24).
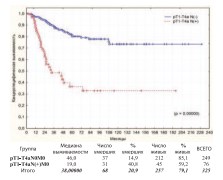
Рис. 24. Канцерспецифическая выживаемость после РЦЭ по статусу pN(±)
Та же закономерность c высокой степенью достоверности прослеживается при раздельном анализе по степени выраженности статуса pN(0-3) (рис. 25).
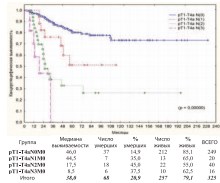
Рис. 25. Канцерспецифическая выживаемость после РЦЭ в зависимости от степени статуса pN(0-3)
Не менее важным и достоверным прогностическим фактором канцерспецифической выживаемости по результатам наших исследований является степень дифференцировки опухоли – статус pG (рис. 26).
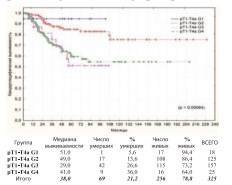
Рис. 26. Канцерспецифическая выживаемость после РЦЭ в зависимости от статуса pG
Достоверным неблагоприятным прогностическимфакторомпо нашим результатам оказалось наличие непереходно-клеточных опухолей мочевого пузыря (НеПКР) (рис. 27).
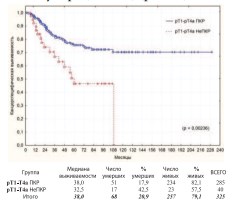
Рис. 27. Канцерспецифическая выживаемость после РЦЭ в зависимости от наличия ПКР и НеПКР мочевого пузыря
Мы не получили достоверной разницы в канцерспецифической выживаемости при наличии, либо отсутствии pCIS (рис. 28).
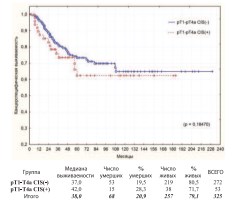
Рис. 28. Канцерспецифическая выживаемость после РЦЭ в зависимости от наличия или отсутствия CIS мочевого пузыря
ОБСУЖДЕНИЕ
ЦЭ при стадии pT4b и/или при наличии определяемых до операции отдаленных метастазов является исключительно паллиативной операцией, которая требует отдельного анализа результатов в сравнении с результатами РЦЭ. У этой категории больных после операции имеет место продолженный рост опухоли, а не ее рецидив. Это ведет к быстрому прогрессированию, развитию метастатической фазы болезни, делает невозможной оценку безрецидивной выживаемости и значительно ухудшает показатели канцерспецифической и общей выживаемости в этой группе. Таким образом, суммарный анализ результатов радикальной и паллиативной ЦЭ ведет к необъективности обобщенных данных и дискредитации эффективности РЦЭ.
Выполненный нами раздельный анализ позволил избежать ошибок многих ранее выполненных исследований и повысить достоверность полученных данных.
Мы не получили достоверной разницы в выживаемости по критерию коморбидности, что связано с ретроспективностью анализа в уже отобранной для РЦЭ когорте пациентов. Это коррелирует и с отсутствием разницы в выживаемости пациентов разных возрастных групп. На практике это означает, что при рациональном отборе больных для РЦЭ с оценкой коморбидности и прогнозируемой выживаемости пациенты демонстрируют идентичную общую и канцерспецифическую выживаемость вне зависимости от возраста.
В нашей когорте пациентов наличие рецидивного РМП не ассоциировано с худшей выживаемостью и худшим онкологическим прогнозом после своевременного выполнения РЦЭ в сравнении с первичными пациентами. Это доказывает важность тщательного мониторинга при органосохраняющем лечении с целью верификации рецидивов и/или прогрессии, с необходимостью своевременного определения показаний к РЦЭ. Полученными данными подтверждено, что используемый нами максимально «агрессивный» подход при прогрессии РМП (либо при отсутствии эффекта от проводимой терапии) со своевременным выполнением спасительной РЦЭ оправдан в полной мере и обеспечивает онкологические результаты аналогичные таковым при первичной РЦЭ. Заблуждением мы считаем применение РЦЭ как резервного метода, оправданного только после использования всего известного альтернативного арсенала с негативным исходом, как запасного варианта «исправления» многочисленных предшествующих неудач в лечении РМП. Запоздалое принятие решения о РЦЭ неминуемо ведет к развитию нерезектабельной и/или метастатической фазы болезни, превращают РЦЭ в паллиативную и тем самым дискредитируют метод. Критически неверным является мнение об эффективности РЦЭ в запущенных ситуациях, в отчаянных попытках выполнить цистэктомию как «последний единственно возможный» вариант лечения! В такой ситуации ЦЭ технически возможна, но часто не эффективна и не оправдана с позиций радикализма. По нашим данным паллиативная цистэктомия демонстрирует ожидаемую общую и канцерспецифическую 3-летнюю выживаемость на уровне 15,4% и 17,1% соответственно, при медиане выживаемости – 12,0 мес. При современном уровне развития уродеривации РЦЭ, при наличии показаний, должна рассматриваться как первичный лечебный подход, как вариант выбора.
Нашими исследованиями не подтверждается прогностическая значимость влияния CIS на выживаемость пациентов после РЦЭ. Это приводит к пониманию того, что CIS, как доказанный фактор риска прогрессии, способна приводить к быстрой инвазии, метастазированию и инкурабельности пациентов с позиций радикализма на этапе органосохраняющего лечения. Но при достоверном стадировании и своевременном выполнении РЦЭ не оказывает последующего негативного влияния на выживаемость пациентов в послеоперационном периоде.
ЗАКЛЮЧЕНИЕ
Достоверными негативными факторами прогноза, влияющими на общую, канцерспецифическую и безрецидивную выживаемость пациентов после РЦЭ являются стадия РМП (pT), состояние регионарных лимфоузлов (pN), степень дифференцировки опухоли (pG), наличие многофокусного поражения МП, наличие непереходно-клеточных опухолей МП, степень исходной анемии и наличие одноили двустороннего гидронефроза, обусловленного РПМ.
ЛИТЕРАТУРА
1. Chen KK, Ho DM, Chen MT, Chang LS. Histological changesin the Kock pouch. // Br J Urol. 1993. Vol. 72, N 4. P. 433-440.
2. Аполихин О.И., Чернышев И.В., Какорина Е.П. Организация помощи больным раком мочевого пузыря в Российской Федерации и пути её улучшения на основе стандартизации лечебно-диагностического процесса. // Урология. 2003. N 4. С. 9 14.
3. Атдуев.А., Березкина Г.А., Абрамов Д.В., Нуждин П.И., СтрогановА.Б.,ЛедяевД.С.,СеничевА.А.,Адеишвили Г.З., БерезинК.В., МамедовХ.М.,Амоев З.В.,ДаниловА.А. Непосредственные результаты радикальной цистэктомии. // Онкоурология. Материалы III конгресса Российского общества онкоурологов. 2008. С. 82-83.
4. Глыбочко П.В., Митряев Ю.И., Понукалин А.Н. и др. Сравнительная оценка органосохраняющего лечения и цистэктомии у больных инвазивным раком мочевого пузыря. // В кн.: Материалы VI Всероссийской научно-практической конференции «Актуальные вопросылечения онкоурологических заболеваний». М., 2005. С. 42.
5. Даренков С.П., Чернышев И.В., Самсонов Ю.В. Качество жизни онкоурологических больных после кишечной деривации мочи. // Избранные лекции по урологии [Под ред. Н.А. Лопаткина, А.Г. Мартова]. М.: ООО «Медицинское информационное агентство», 2008. С. 358-375.
6. Матвеев Б.П.Клиническая онкоурология. М.: Издательский дом «АБВ-пресс», 2011. 934 с.
7. Коган М.И., Перепечай В.А., Васильев О.Н. Радикальная цистэктомия при раке мочевого пузыря: результаты 300 операций в одном центре. // Материалы XII съезд Российского общества урологов. Москва, 2012. С. 246
8. Красный С.А., Суконко О.Г., Поляков С.Л. Радикальная цистэктомия в лечении злокачественных опухолей мочевого пузыря. // Онкологический журнал. 2009. Т.3, N 4. C. 7–15.
9. Матвеев В.Б., Волкова М.И. Рак мочевого пузыря.// Проблемы клинической медицины. 2006. N4. С.10-15.
10. Ситдыков Э.Н., Ситдыкова М.Э. Основы реабилитации больных раком мочевого пузыря. Казань, 1994.Указать количество страниц или др. источник // Казанский медицинский журнал. 1999. № 4. С. 279-282.
11. Урология. Российские клинические рекомендации. [Под ред.Ю. Г.Аляева, П. В. Глыбочко,Д.Ю. Пушкаря]. М.: ГЭОТАР – Медиа. 2015. 480с.
12. Коган М.И., Перепечай В.А. Современная диагностика и хирургия рака мочевого пузыря Ростов-н/Д, 2002. 239 с.
13. Карякин О.Б. Инвазивный и метастатический рак мочевого пузыря. // Онкоурология. 2005. N 1. С. 69-71.
14. Алексеев Б.Я., Русаков И.Г., Франк Г.А., Андреева Ю., Нюшко К.М. Первично-множественный рак мочевого пузыря и предстательной железы у больных, перенесших радикальную цистэктомию. // Онкоурология. 2005. N 2. С.40-44.
15. Комяков Б.К, Новиков А.И., Сергеев А.В., Фадеев В.А. Опыт 300 радикальных цистэктомии. // Материалы Пленума правления Рос. общества урологов, Нижний Новгород, 2009. С. 335-336.
16. Bochner B.H. Oncologic outcomes achieved by radical cystectomy. .// Eur Urol. 2013. Vol. 64, N 2. P. 225 – 226
17. Лапытов В.Р., Дамбаев Г.Ц., Вусик А.Н., Скиданенко В.В., Калиничева О.А. Прогностические критерии и выживаемость больных после радикальной цистэктомии при раке мочевого пузыря. // Онкоурология. Материалы III Конгресса Российского общества онкоурологов. 2008. С. 100.
18. Лоран О.Б., Вишневский А.Е. Варианты хирургического лечения рака мочевого пузыря. // Тезисы докладов пленума Всероссийского общества урологов.. Кемерово. 1995. С. 240-241.
19. Карякин О.Б. Органосохранная тактика при инвазивном раке мочевого пузыря: «за» и «против». // Практическая онкология. 2003. Т. 4, N 4. С. 252-255.
20. Петрова Г.В., Грецова О.В., Старинский В.В. и др. Характеристика и методы расчета статистических показателей применяемых в онкологии. Практическое пособие. М.: ФГУ МНИОИ им. П.А. Герцена Росздрава, 2005. 39 с.
21. Гланц С. Медико-биологическая статистика. [Пер. с англ.] М.: Практика, 1998. 459 с.
22. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA / О.Ю. Реброва. М.: Медиа Сфера, 2002. 312 с.







