С момента выполнения первой чрескожной нефроскопии E. Rupel и R. Brown в 1941 году перкутанная хирургия претерпела серьезные изменения и сегодня является золотым стандартом в лечении крупных и коралловидных камней почек [1]. Наиболее технически сложной частью перкутанной нефролитотомии (ПНЛ), является выполнение перкутанного доступа к почке. Двумя основными визуализационными методами сопровождения операции является рентгентелевизионный и ультразвуковой [2]. При сравнении эффективности обоих методов различий выявлено не было [3,4]. Так, во время операции под рентген-контролем для доступа в оптимальную чашечку хирургу необходимо преобразовывать двухмерные рентгеновские снимки в трехмерные, используя ментальные навыки. Предполагается, что хирург, выполнивший меньше 24 операций, обладает начальным опытом, после выполнения более 60 операций врач является компетентно обученным и при более 100 выполненных операций — является экспертом [5]. Но даже для эксперта в области ПНЛ существуют клинические случаи (большой объем камня, сложная анатомия полостной системы почки), представляющие сложную хирургическую задачу.
В последнее время все чаще используются модифицированные техники получения доступа с применением гибких уретерореноскопов, однако использование последних значительно увеличивает стоимость самой операции из-за дороговизны инструментов, а также не всегда возможно в силу отсутствия свободного пространства в полостной системе для проведения гибкого инструмента [6,7]. Рядом авторов было описано несколько способов, упрощающих получение перкутанного доступа с использованием технологии трекеров [8,9]. Однако, несмотря на полученный положительный эффект, эти техники не имеют широкого распространения ввиду временных и финансовых затрат. Эти работы подтверждают факт того, что необходимо эффективное решение, позволяющее решить проблему доступа в полостную систему почки при ПНЛ.
До тех пор пока новые технологии не станут обыденностью существует острая необходимость обучения и тренировки хирургов перкутанному доступу. В литературе описаны несколько моделей обучения ПНЛ [6,10]. Для этих целей используются специальные виртуальные тренажеры, ex vivo органы животных и небиологические искусственные модели. Однако каждый из вариантов имеет собственные недостатки. Виртуальные тренажеры слишком дороги, животные модели точно не воспроизводят анатомию чашечно-лоханочной системы (ЧЛС) человека, небиологические модели также экономически невыгодны. Вышеуказанные модели объединяет еще один, но очень важный недостаток — они практически бесполезны в предоперационном планировании у оперируемого пациента со сложной формой мочекаменной болезни (МКБ) и не повторяют индивидуальных анатомических особенностей строения ЧЛС почки конкретного больного.
Попытки создать более эффективные и менее затратные модели для тренировки доступа при перкутанной нефролитотомии сложных форм камней почек привели к созданию точных копий ЧЛС почки пациентов. Данные модели имеют ряд преимуществ: дешевизну, быстроту изготовления, и, самое главное, позволяют хирургу на предоперационном этапе подробно изучить анатомию полостной системы почки, совершить тренировку выполнения перкутанного доступа на модели с учетом особенностей конкретного больного и выбрать оптимальную чашечку для пункции до непосредственного момента ПНЛ.
Целью данного проекта была разработка анатомически точной, небиологической модели чашечно-лоханочной системы почки и верхнего сегмента мочеточника пациентов для обучения и тренировки доступа при перкутанной нефролитотомии под рентген-контролем у пациентов со сложными формами мочекаменной болезни.
МАТЕРИАЛЫ И МЕТОДЫ
Создание аутентичной модели ЧЛС почки пациентов для тренировки доступа при перкутанной нефролитотомии (приоритетная заявка на изобретение № 2017105680 (010092) от 20.02.2017) [11] условно можно разделить на следующие этапы:
Этап получения изображений ЧЛС при помощи КТ
Всем пациентам для получения анатомически точной, небиологической модели ЧЛС почки и верхнего сегмента мочеточника выполнялась компьютерная томография с в/в контрастированием на 64-срезовом томографе Somatom Definition AS (Siemens, Germany). Для создания 3D модели ЧЛС почки, поддерживаемой принтерами для 3D печати, полученные снимки при помощи программного обеспечения 3D-DOCTOR (Able Software) преобразовывались из формата DICOM (от англ. Digital Imaging and Communications in Medicine) в формат STL (от англ. Standard Triangulation Language) (рис. 1).
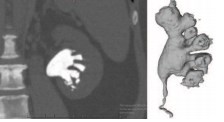
Рис.1. Преобразование формата DICOM в формат STL
Данный этап выполняется врачом и занимает не более 15 минут. В последующем STL файл с моделью ЧЛС почки отправлялся по электронной почте на кафедру оборудования и робототехники переработки пластмасс Санкт-Петербургского Технологического института, где открывался на программном обеспечении 3D принтера (Leapfrog Creatr 2H, Голландия). Все последующие этапы производства модели выполнялись там же.
Этап печати 3D модели
STL файлы распечатывались на 3D принтере (Leapfrog Creatr 2H, Голландия). В качестве полимерного термопластичного материала использовался ABS (акрилонитрил-бутадиенстирольный пластик). Таким образом, создавалась модель полостной системы почки (рис.2)

Рис. 2. Печать 3D модели полостной системы почки
Этап создания аутентичной модели чашечно-лоханочной системы почки пациентов для тренировки перкутанного доступа
Создание промежуточной формы
Напечатанная 3D модель ЧЛС почки помещалась в опалубку и заливалась жидкой композицией (силикон) (рис.3А). После отвердевания силикона промежуточная форма разрезалась с извлечением 3D модели. В дальнейшем части формы повторно совмещались между собой, образуя полость идентичную 3D модели, в которую в последующем осуществлялась заливка расплава быстрорастворимых в воде материалов (сорбит, ксилит, сплав солей и т.д.). Затем из промежуточной формы извлекалась отвердевшая модель ЧЛС почки (рис. 3Б).

Рис. 3. Этапы создания промежуточной и окончательной форм. (А — напечатанная на принтере 3D модель ЧЛС почки в опалубке в процессе заливки силиконом для получения промежуточной формы; Б — отвердевшая модель ЧЛС почки из смеси быстрорастворимых материалов; В — 3D модель ЧЛС почки из затвердевающих и быстрорастворимых материалов в опалубке в процессе заливки силиконом; Г — окончательный вид модели)
Создание окончательной формы
3D модель ЧЛС почки из затвердевающих и быстрорастворимых материалов помещалась в опалубку и заливалась полимерной композицией с твердостью от 15 до 20 ед. по А. Шор (рис. 3В). Для извлечения 3D модели ЧЛС почки из затвердевающих и быстрорастворимых материалов из формы, использовалась обычная теплая вода, вследствие чего получалась полая полостная система абсолютно идентичная полостной системе пациента (рис. 3Г).
В последующем полученная силиконовая форма доставлялась в отделение урологии клиники ВЦЭРМ им А.М. Никифорова. В условиях рентген-кабинета модель почки наполнялась контрастным веществом и оперирующим урологом проводилась отработка навыка по выполнению доступа. Полученный опыт применялся в операционной с конкретным пациентом (рис. 4).
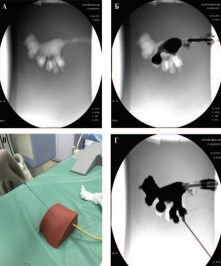
Рис. 4. Тренировка перкутанного доступа перед операцией (А — Рентгеноскопия 3D модели ЧЛС почки; Б — Рентгеноскопия с контрастированием полости 3D модели ЧЛС почки; В — отработка пункции полосной системы под рентгенологическим контролем; Г — пункция нижней чашечки 3D модели ЧЛС почки)
Данная аутентичная силиконовая модель ЧЛС почки и верхнего сегмента мочеточника пациентов позволяет выполнять тренировку перкутанного доступа под рентген-контролем с использованием рутинного в клинической практике оборудования. Экономические затраты на изготовление одной силиконовой модели достаточно низкие и составляют пор яд к а 6 000 рублей, однако в данной цене не учитываются затраты на покупку программного обеспечения и оборудования. Время, затрачиваемое на создание полноценной тренировочной модели, составляет 1-2 рабочих дня. От 2 до 4 часов занимает печать 3D модели, от 4 до 5 часов необходимо для затвердевания силиконовой модели и 3D модели ЧЛС почки из плавких и быстрорастворимых материалов из формы. Растворение наполнителя 3D модели ЧЛС почки при помощи теплой воды не превышает 2 часов.
При обучении и тренировках каждая модель может быть использована много раз, т.к. материал, из которого сделана модель, выдерживает от 20 до 30 попыток пунктирования без вытекания контраста. При использовании данной модели воспроизводится ЧЛС почки, полностью отражающая индивидуальные особенности анатомии оперируемого пациента. Так, в этой модели можно успешно выбрать оптимальную чашечку для доступа и выполнить еe пункцию под рентген-контролем. Данная модель уже использовалась в Российско-американском интенсивном курсе по перкутанной хирургии мочекаменной болезни в Санкт-Петербурге в 2015 и 2016 годах и получила высокие оценки у врачей-урологов.
ОБСУЖДЕНИЕ
Согласно клиническим рекомендациям Европейской и Российской ассоциаций урологов ПНЛ является первой линией лечения конкрементов почек более 2 см [12,13]. Успех ПНЛ в первую очередь зависит от знания анатомии полостной системы почки и точности выполнения перкутанного доступа [8]. Разработанный нами способ получения модели позволяет улучшить результаты ПНЛ.
Возможности быстро конвертировать двухмерные КТ изображения в 3D модель виртуально на мониторе или же распечатать на 3D
принтере, способствуют лучшему восприятию анатомии ЧЛС и ориентации чашечек, чем обычные изображения, полученные при рентгенологическом или ультразвуковом исследовании. Строение ЧЛС почки варьирует у каждого человека и некоторые авторы предполагают, что 3D модель может помочь хирургу в планировании безопасного перкутанного доступа, ускоряя идентификацию расположения задних и передних чашечек по отношению к лоханке [14]. В целом, идея биомоделирования не нова и уже успешно используется в планировании и обучении в других областях медицины, таких как ортопедия и травматология, краниофасцилярная реконструктивная пластическая хирургия и нейрохирургия [9,15,16].
Наше исследование описывает лишь один из немногих путей, применения современных технологий в эндоурологии. Недавний стремительный прогресс в программном обеспечении и производстве 3D принтеров позволяет обеспечивать центры, специализирующиеся на лечении больных мочекаменной болезнью, этими полезными моделями. Но для этого необходимо активное сотрудничество между врачами и специалистами в области компьютерного моделирования, технологического оборудования и полимерного машиностроения. В нашем случае, мы наладили плодотворное научное партнерство с Санкт-Петербургским государственным технологическим институтом, кафедрой оборудования и робототехники переработки пластмасс.
На сегодняшний день известны несколько моделей для обучения и тренировки ПНЛ [5,17,18]. Эти модели можно разделить на три основные категории: виртуальные тренажеры, искусственные модели и ex vivo органы животных. Виртуальные тренажеры очень дороги (в сред-нем цена тренажера составляет ~ $100 000), представленные на рынке искусственные модели также не дешевы и зачастую непригодны после первого использования (цена ~ $1 000). Использование ex vivo органов животных, к сожалению, не дает адекватного представления об анатомии ЧЛС человека.
Главные положительные особенности предложенной аутентичной модели ЧЛС почки пациентов, созданной по нашей технологии, заключаются в том, что учитываются анатомические особенности строения верхних мочевых путей конкретного пациента, модели можно использовать несколько раз, стоимость производства в десятки раз ниже других моделей, а срок изготовления не превышает двух рабочих дней. Вышеуказанные плюсы делают данную модель незаменимой в повседневной практике хирурга, специализирующегося на хирургическом лечении сложных форм МКБ — ведь непрерывный процесс обучения, является залогом его конкурентоспособности и успеха.
Однако пока есть и нерешенные задачи. В будущем мы планируем добавить к данным формам модель ребер и близлежащих органов, сделав процесс обучения еще более реалистичным. Также планируется реализация возможности наработки навыка доступа под ультразвуковым контролем.
ЗАКЛЮЧЕНИЕ
Использование аутентичной модели почки пациента с использованием 3D печати в предоперационном периоде обеспечивает наработку навыка выполнения доступа под рентген-контролем, что в свою очередь может повысить точность, эффективность и безопасность доступа в чашечку при перкутанной нефролитотомии у реального пациента.
ЛИТЕРАТУРА
1. Rupel E, Brown R. Nephroscopy with removal of stone following nephrostomy for obstructive calculous anuria. J Urol 1941;47:177-82.
2. Basiri A, Ziaee AM, Kianian HR, Mehrabi S, Karami H, Moghaddam SM.Ultrasonographic versus fluoroscopic access for percutaneous nephrolithotomy: a randomized clinical trial. J Endourol 2008;22(2):281-84. doi:10.1089/end.2007.0141.
3. Agarwal DK, Khaira HS, Clarke D, Tong R. Modified transurethral technique for the management of distal ureter during laparoscopic assisted nephroureterectomy. Urology 2008;71(4):740-43. doi: 10.1016/j.urology.2007.11.048.
4. Andonian S, Scoffone CM, Louie MK, Gross AJ, Grabe M, Daels FP, et al. 2013. Does imaging modality used for percutaneous renal access make a Ddfference? A matched case analysis. J Endourol 2013;27(1):24-28. doi:10.1089/end.2012.0347.
5. de la Rosette JJ, Laguna MP, Rassweiler JJ, Conort P. Training in percutaneous nephrolithotomy? A critical review. Eur Urol 2008;54(5):994-1003. doi:10.1016/j.eururo.2008.03.052.
6. Valdivia JG, Scarpa RM, Duvdevani M, Gross AJ, Nadler RB, Nutahara K,, et al. Supine versus prone position during Percutaneous nephrolithotomy: a report from the clinical research office of the endourological society percutaneous nephrolithotomy global study. J Endourol 2011;25(10):1619-25. doi:10.1089/end.2011.0110.
7. Atkinson CJ1, Turney BW, Noble JG, Reynard JM, Stoneham MD. Supine vs prone percutaneous nephrolithotomy: an anaesthetist’s view. BJU Int 2011:108(3):306-8. doi:10.1111/j.1464-410X.2011.10488.x.
8. Miiller M, Rassweiler MC, Klein J, Seitel A, Gondan M, Baumhauer M, et al. Mobile augmented reality for computer-assisted percutaneous nephrolithotomy. Int J Comput Assist Radiol Surg 2013;8 (4):663-75. doi:10.1007/s11548-013-0828-4.
9. Rodrigues PL, Vilapa JL, Oliveira C, Cicione A, Rassweiler J, Fonseca J, et al. Collecting sys-
tem percutaneous access using real-time tracking sensors: first pig model in vivo experience. J Urol 12013;90 (5): 1932-37. doi:10.1016/j.juro.2013.05.042.
10. Schout BM, Hendrikx AJ, Scherpbier AJ, Bemelmans BL. Update on training models in endourology: a qualitative systematic review of the literature between January 1980 and April 2008. Eur Urol 2008;54 (6):1247-61. doi:10.1016/j.eururo.2008.06.036.
11. Гаджиев Н.К., Бритов В.П. Петров С.Б., и др. Тренажер урологический. Приоритетная заявка о выдаче патента на полезную модель РФ № 2017105680/ 20.02.2017.
12. Turk C., Petnk A., Sarica K., Seitz C., Skolarikos A., Straub M., Knoll T. EAU Guidelines on Urolithiasis. Eur Assoc Urol. 2015;69:475-82. doi:10.1159/000049803
13. Григорьев Н.А., Семенякин И.В., Малхасян В.А, Гаджиев Н.К., Руденко В.И. Мочекаменная болезнь. Урология 2016;(2S):37-69.
14. Radecka E, Brehmer M, Holmgren K, Palm G, Magnusson P, Magnusson A. Pelvicaliceal biomodeling as an aid to achieving optimal access in percutaneous nephrolithotripsy. J Endourol 2006;20(2):92-101. doi:10.1089/end.2006.20.92.
15. Yau YY, Arvier JF, Barker TM. Technical note: maxillofacial biomodelling--preliminary result. Br J Radiol. 1995 May;68(809):519-23. doi:10.1259/0007-1285-68-809-519.
16. Byram IR, Khanna K, Gardner TR, Ahmad CS. Characterizing bone tunnel placement in medial ulnar collateral ligament reconstruction using patient-specific 3-dimensional computed tomography modeling. Am J Sports Med. 2013;41(4):894-902. doi:10.1177/0363546513477377.
17. Stern J, Zeltser IS, Pearle MS. Percutaneous renal access simulators. J Endourol 2007;1(3):270-73. doi:10.1089/end.2007.9981.
18. Mishra S, Jagtap J, Sabnis RB, Desai MR.«Training in percutaneous nephrolithotomy». Curr Opin Urol 2013;23(2):147-51. doi:10.1097/MOU.0b013e32835d4e37.







