До настоящего времени стандартными хирургическими подходами к удалению простатической ткани при доброкачественной гиперплазии предстательной железы (ДГПЖ) являются открытая аденомэктомия (ОАЭ) и монополярная трансуретральная резекция предстательной железы (ТУРПЖ) [1-4], несмотря на многочисленные альтернативы с превосходными результатами в виде биполярной ТУРПЖ, лазерных и аблятивных технологий [5-7]. Как и любая деструктивная хирургия, ОАЭ и ТУРПЖ имеют свои ранние и поздние осложнения, среди последних на протяжении многих десятилетий продолжают доминировать стриктуры уретры (СУ) (2,2- 9,8%) и стенозы шейки мочевого пузыря (ШМП) (0,3– 9,2%) [8-12]. Рецидив инфравезикальной обструкции может развиваться в любом отделе уретры дистальнее выходного отверстия мочевого пузыря, иметь различную протяженность, включая субтоальное поражение, и степень сужения просвета вплоть до облитерации. И если особенности поздних инфравезикальных обструкций после ТУРПЖ и результаты их хирургического лечения представлены в единичных работах [13,14], то подобных публикаций, касающихся ОАЭ, не удалось найти в современной литературе, и поэтому отсутствуют сравнительные оценки обструктивных осложнений ОАЭ и ТУРПЖ, их хирургической коррекции и эффективности лечения, что и явилось целью настоящего исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Ретроспективное исследование включает в себя анализ хирургического лечения последовательно госпитализированных 68 пациентов со СУ и (или) стенозами ШМП, возникшими вследствие оперативного лечения ДГПЖ, выполненного в клиниках различных регионов страны. Все пациенты были разделены на 2 группы. Первую группу составили 30 пациентов, которым была ранее выполнена ОАЭ. Вторая группа представлена 38 пациентами после ТУРПЖ. Наличие СУ в анамнезе являлось критерием исключения из данного исследования.
Всем больным в составе комплексного урологического обследования проводили ультразвуковое исследование (УЗИ) верхних мочевых путей, предстательной железы и мочевого пузыря, восходящую уретрографию и микционную цистоуретрографию.
Статистическую обработку проводили с использованием пакета прикладных программ специального назначения SPSS 17.0. Определяли средние значения и среднеквадратичную ошибку, Т-критерий Стьюдента. При определении статистической значимости различий руководствовались общепринятымуровнем(р<0,05).
РЕЗУЛЬТАТЫ
Медиана возраста пациентов в I группе составила 67,5 (62-75) лет, во II – 66 (61-72) лет (р>0,05). На момент госпитализации в I группе у 20 (67%), а во II – у 16 (42%) больных деривация мочи осуществлялась посредством цистостомического дренажа. Основными жалобами пациентов с сохраненным мочеиспусканием были: слабая струя мочи и частое болезненное мочеиспускание, чувство неполного опорожнения мочевого пузыря.
Согласно анамнеза, у 13 (43%) пациентов I группы и у 9 (24%) пациентов II группы в послеоперационном периоде после удаления уретрального катетера самостоятельное мочеиспускание не было восстановлено. У больных с восстановленным мочеиспусканием срок возникновения обструктивной симптоматики после хирургии ДГПЖ в I группе составил 6 (3-24) месяцев, во II – 4 (3-5) месяца (р<0,05). Таким образом, трансуретральная хирургия приводит к более раннему развитию обструктивных симптомов, а операция ОАЭ чаще сопровождается развитием ранней и полной обструкции уретры/ШМП, чем ТУРПЖ.
Одиночные поражения в виде СУ или стеноза ШМП являются доминирующими у пациентов I и II групп и составляют 93% и 89%, соответственно, и только 7% пациентов I группы и 11% пациентов II группы имеют сочетание СУ со стенозом ШМП. К моменту госпитализации у 9 (30%) пациентов Iгруппыи у 5 (13%) пациентов II группы отмечены облитерации уретры в бульбозном и перепончато-простатическом отделах.
При анализе взаимосвязи локализации стриктур с видом первичной хирургии установлено, что ОАЭ более чем в 70% случаев сопровождается поражением двух и трех отделов мочеиспускательного канала с преимущественной локализацией в задней уретре (84,6%), тогда как большинство СУ после ТУРП локализуются в спонгиозной уретре, преимущественно в ее бульбозном отделе (80,6%).
Протяженность СУ в зависимости от локализации в обеих группах значимо не отличается (р>0,05) (табл. 1). На долю коротких (<2,0 см) СУ приходится 50% и 58% в I и II группах больных, соответственно. Протяженные стриктуры мочеиспускательного канала в основном локализуются в пенильном и пенильно-бульбозном отделах уретры, а также поражают переднюю и заднюю уретру с локализацией в бульбозно-перепончато-простатическом отделах. Субтотальное поражение пенильного отдела уретры в одном случае у пациента I группы, по всей видимости, не связано с техникой самой хирургии, а обусловлено формированием обширного спонгиофиброза воспалительного генеза вследствие длительного расположения уретрального катетера в послеоперационном периоде.
Таблица 1. Протяженность СУ в связи с локализацией
| Локализация СУ, отдел | Протяженность, см | p | |
|---|---|---|---|
| I группа (n=26) | II группа (n=31) | ||
| Пенильный | 15,0 | 7,0 | 0,66 |
| Пенильно-бульбозный | 6,0 | 4,5 ± 1,2 (3-6) | 0,33 |
| Бульбозный | 1,9 ± 1,2 (0,5-4) | 1,5 ± 0,7 (0,5-3) | 0,67 |
| Бульбозно-перепончатый | 2,1 ± 0,8 (0,5-3) | 1,25 ± 0,8 (0,5-2,5) | 0,07 |
| Перепончато-простатический | 3,2 ± 1,0 (1,5-4,5) | 3,75 ± 0,4 (3,5-4) | 0,35 |
| Бульбозно-перепончато-простатический | 5,8 ± 1,2 (4,5-7) | 5,25 ± 0,6 (4,5-6) | 0,62 |
| Простатический | 0,8 ± 0,5 (0,5-1,5) | 1,9 ± 0,74(1-2,5) | 0,15 |
Ранее 37 (54%) больных были подвержены повторному хирургическому лечению в связи с обструкцией уретры/ШМП в тех клиниках, где были оперированы первично (табл. 2). Большинство пациентов (86%) I группы и треть пациентов (34%) II группы, перенесли одну или несколько внутренних оптических уретротомий (ВОУТ).
Общее количество операций у пациентов I группы составило 30, у II – 51. Средний показатель операций на одного больного в I группе – 2,1, во II – 2,2.
Таблица 2. Характер ранее перенесенных операций
| Характер операций | группа (n=14) | II группа (n=23) |
|---|---|---|
| ВОУТ | 8 (57%) | 1 (4%) |
| ТУР шейки мочевого пузыря | – | 13 (57%) |
| ВОУТ+ТУР шейки мочевого пузыря | 4 (29%) | 7 (31%) |
| Резекция уретры | 2 (14%) | 1 (4%) |
| Наружная уретротомия и перинеостомия | – | 1 (4%) |
Для рецидивного поражения чаще характерно развитие стеноза ШМП и его сочетание со СУ (38%), тогда как первичные поражения в большинстве случаев (97%) являются стриктурами мочеиспускательного канала. Большинство первичных обструкций (73,4%) локализуются в одном отделе уретры – в бульбозном или простатическом, в то время как 70% рецидивных обструкций поражают два и более отделов уретры. Соответственно и протяженность рецидивных СУ была выше по сравнению с первичными, в отдельных случаях более 5,5 см.
Из 68 больных в трех случаях нами было реализовано в качестве лечения программное бужирование уретры в связи с непротяженностью СУ (1,0-1,5 см) и диаметром 16-17 Ch. В других 65 наблюдениях было выполнено оперативное лечение (табл. 3).
Таблица 3. Типы операций
| Тип операции | I группа (n=28) | II группа (n=37) |
|---|---|---|
| Резекция уретры, уретроцистоанастомоз | 7 (25%) | 4 (11%) |
| Резекция уретры с концевым анастомозом | 14(50%) | 16 (43%) |
| Различные виды уретропластик | 2 (7%) | 6 (16%) |
| ВОУТ | – | 1 (3%) |
| ТУР шейки мочевого пузыря | 4 (14%) | 8 (22%) |
| ВОУТ+ТУР шейки мочевого пузыря | 1 (4%) | 2 (5%) |
Наш опыт показывает, что обструкции уретры и ШМП, возникшие после ТУРП, удается значительно чаще (30%) разрешить путем эндоскопической трансуретральной хирургии, чем после ОАЭ (18%). Большая же часть больных обеих групп подвергнута открытой хирургии. При этом резекционно-анастомотическая техника хирургии была применена в 75% случаев после ОАЭ и у 54% больных после ТУРП.
Самостоятельное мочеиспускание восстанавливали на 10-14 сутки. При контрольной восходящей уретрографии во всех случаях в эти сроки отмечена нормальная проходимость уретры без признаков сужения, деформации и затеков. Таким образом, эффективность хирургического лечения достигнута у всех больных. Однако у трех (4,6%) пациентов из 65 после удаления уретрального катетера не удалось восстановить самостоятельное мочеиспускание, что потребовало анализа причин.
Приводим клинические случаи. Больной Ш., 59 лет, в течение 10 лет страдал тяжелой формой депрессивного расстройства, получал лечение антидепрессантами. 3 года назад отмечено появление обструктивной симптоматики, выполнена ТУРПЖ, деривация мочи осуществлялась посредством цистостомы. При восходящей и микционной уретроцистографии выявлена протяженная облитерация бульбозно-перепончато-простатического отделов уретры. Нами выполнена резекция рубцовых тканей и уретроцистоанастомоз. При перикатетерной восходящей уретрографии на 14-е сутки после операции контраст свободно проходит по широкой уретре в мочевой пузырь (рис. 1).
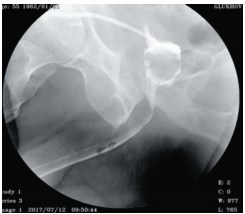
Рис.1. Перикатетерная восходящая уретрограмма больного Ш., 59 лет, на 14-е сутки после уретроцистоанастомоза
Неоднократные попытки в течение 1,5 месяцев восстановить естественное мочеиспускание не удались. Контрольная уретроцистоскопия установила хорошую проходимость уретры и шейки мочевого пузыря. Отказ от антидепрессантов по решению психиатра невозможен. В связи с этим больному предложено осуществлять периодическую катетеризацию (3-4 раза в сутки).
Причина невосстановления мочеиспускания у двух пациентов из I группы объяснена нами нейрогенной дисфункцией нижних мочевых путей, которая не была диагностирована до выполнения операции на предстательной железе.
Пациент М., 77 лет, 7 лет назад выполнена ОАЭ, через год развилось обструктивное мочеиспускание, по месту жительства выполнены многократные ТУР шейки мочевого пузыря, резекция уретры с концевым анастомозом, однако самостоятельное мочеиспускание не было восстановлено. Более 4-х лет деривация мочи по цистостоме. Нами выявлена протяженная (7,0 см) облитерация бульбозно-перепончато-простатического отдела уретры, выполнена резекция уретры и уретроцистоанастомоз. На 14-е сутки удален уретральный катетер, однако самостоятельное мочеиспускание не восстановилось. При восходящей уретроцистографии уретра проходима на всем протяжении, признаков сужения в зоне уретроцистоанастомоза нет (рис. 2).Комплексное уродинамическое исследование выявило дисфункцию нижних мочевых путей: фаза наполнения: низкий комплаенс со сниженной емкостью мочевого пузыря, нормосенсорный, терминально гиперактивный мочевой пузырь, уретральная функция компетентна; фаза выделения: нормоактивный детрузор, детрузорно-сфинктерная диссинергия (уродинамическая классификация) (рис 3). Пациент предпочел сохранение цистостостомического дренажа.
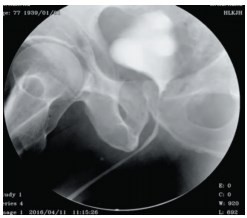
Рис.2. Восходящая уретроцистограмма больного М., 77 лет, на 14-е сутки после уретроцистоанастомоза
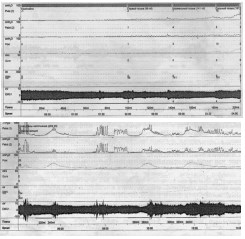
Рис.3. Восходящая уретроцистограмма больного М., 77 лет, на 14-е сутки после уретроцистоанастомоза
Пациент И., 66 лет, 10 лет назад по месту жительства произведена ОАЭ, после удаления уретрального катетера самостоятельное мочеиспускание не восстановилось, сохранена цистостома. По месту жительства выполнены многократные ТУР шейки мочевого пузыря, резекция бульбозного отдела уретры, однако самостоятельное мочеиспускание не восстановлено. Нами при восходящей имикционной уретроцистографии выявлен стеноз шейки мочевого пузыря, нейрогенный мочевой пузырь (рис. 4).
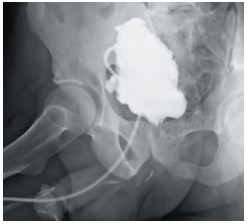
Рис.4. Цистограмма больного И., 66 лет, после множественных операций на простате
Пациенту выполнена ТУР шейки мочевого пузыря, в послеоперационном периоде самостоятельное мочеиспускание не восстановлено, отмечено отсутствие позыва к мочеиспусканию при объеме более 600 мл. Пациенту сохранен цистостомический дренаж.
ОБСУЖДЕНИЕ
Как показывает клинический опыт, инфравезикальные обструкции после ОАЭ и ТУРПЖ в виде СУ и поражения ШМП имеют особенности возникновения и развития. Вопервых, у некоторого числа больных не происходит восстановление мочеиспускания после удаления уретрального катетера. Конечно самым рациональным подходом в этой ситуации является немедленная уретроцистоскопия, которая во всех случаях позволяет выявить причину(ы) острой посткатетерной обструкции и тотчас ликвидировать ее или их. Однако на практике такой подход реализуется редко и, как правило, предпринимаются попытки бужирования, повторной установки уретрального катетера или восстановления надлонного мочепузырного дренажа. Такая тактика не ликвидирует причины обструкции и, более того, способствует процессу хронизации состояния. Безусловно, острая обструкция после ОАЭ и ТУРПЖ в большей части случаев связана с несовершенством хирургической техники уролога при удалении аденоматозной ткани, особенно часто это наблюдается при ОАЭ. Хотя этот же фактор может лежать в основе и в отдаленном периоде инфравезикальных обструкций, но на их развитие влияние оказывают и другие факторы: одни из них связаны с недостатками в работе с резектоскопом и электрическим оборудованием («блуждающие» электрические токи, недостаточная смазка и т.д.), другие – с особенностями предстательной железы и здоровья пациента. Как показали исследования, выполненные в Первом Московском государственном медицинском университете имени И. М. Сеченова, факторами риска развития СУ после ТУРПЖ явля-ются хронический простатит, объем предстательной железы более 70 мл, продолжительность ТУР более 70 минут, диаметр резектоскопа 27 Ch, сахарный диабет 2 типа, повторное введение уретрального катетера [14].
Во-вторых, важно понимать, что своевременная уретроцистоскопия при острой задержке мочи после удаления уретрального катетера может не только устранить причины обструкции, но и предупредить развитие в последующем облитераций уретры и ШМП.
Нами показано, что СУ после ОАЭ и ТУРПЖ различаются рядом характеристик: сроками развития, локализацией, протяженностью, степенью обструкции, а также характером хирургии, предпринятой урологами после ОАЭ или ТУРПЖ для их коррекции, что пришлось учитывать при оперативном лечении госпитализированных пациентов. Совершенно ясно, что изолированные обструкции ШМП и простатической уретры устраняются эффективно путем трансуретральной хирургии. Но подавляющее большинство пациентов с множественными, протяженными, рецидивными, облитеративными поражениями требуют исключительно открытого хирургического подхода.
Причем, по нашему мнению, с целью излечения пациентов следует отдавать предпочтение резекционно-анастомотической хирургии. Конечно, это касается в полной мере случаев поражения бульбарной уретры и проксимальнее ее вплоть до ШМП, и только при пенильных и пенильнобульбарных сужениях (необлитеративных) рационально использовать аугментационную пластику кожным или оральным трансплантатом.
В трех случаях из 68 мы столкнулись после дезоблитерации уретры с невозможностью восстановить естественное мочеиспускание при хорошей анатомической характеристике уретры и ШМП: в одном случае это оказалось связанным с более чем 10-летним приемом антидепрессантов, в двух других – с наличием нейрогенной дисфункции нижних мочевых путей, что в итоге потребовало с учетом коморбидности сохранения пузырной деривации мочи.
ЗАКЛЮЧЕНИЕ
Таким образом, обструкции уретры и ШМП после ОАЭ и ТУРПЖ отличаются своими особенностями возникновения и развития, требуют и своеобразных хирургических подходов к их коррекции. Опыт показывает, что при данного рода поражениях уретры и шейки мочевого пузыря в каждом отдельном случае можно добиться эффективного анатомического хирургического результата и восстановления мочеиспускания. Однако коморбидность в виде психических и неврологических поражений ограничивают функциональный успех при ликвидации уретральной обструкции.
ЛИТЕРАТУРА
- Урология. Российские клинические рекомендации [под ред. Ю. Г. Аляева, П. В. Глыбочко, Д. Ю. Пушкаря]. М.: Медфорум, 2018; 544 с.
- Oelke M, Bachmann A, Descazeaud A, Emberton M, Gravas S, Michel MC, et al. EAU guidelines on the treatment and follow-up of non-neurogenic male lower urinary tract symptoms including benign prostatic obstruction. Eur Urol 2013;64(1):118-140. doi: 10.1016/ j.eururo.2013.03.004.
- Камалов A.A., Гущин Б.Л., Дорофеев С.Д., Комлев Д.Л, Токарев Ф.В., Ефремов Е.А. Современные аспекты оперативного лечения доброкачественной гиперплазии предстательной железы. Урология 2004;1:30-34.
- Мартов А.Г., Андронов А.С., Дутов С.В., Байков Н.А. Эякуляторно-протективная трансуретральная резекция предстательной железы. Урология 2014;4:69–75.
- McVary K, Roehrborn G, Avins A, Barry M, Bruskewitz R, Donnell R, et al. Management of benign prostatic hyperplasia (BPH). American Urological Association guideline. 2014. [Electronic resource]. URL: http://www.auanet.org/guidelines/benign-prostatic-hyperplasia-(2010- reviewed-and-validity-confirmed-2014)
- Gravas S, Bach T, Bachmann A, Drake M, Gacci M, Gratzke C, et al. Management of Non-Neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO). European Association of Urology. 2016. [Electronic resource]. URL: https://uroweb.org/wp-content/uploads/EAU-Guidelines-Management-of-non-neurogenic-male-LUTS-2016-1.pdf.
- McVary KT, Roehrborn CG, Avins AL, Barry MJ, Bruskewitz RC, Donnell RF, et al. Update on AUAguideline on the management of benign prostatic hyperplasia. J Urol 2011;185(5):1793–1803. doi: 10.1016/j.juro.2011.01.074
- Устинов Д.В., Холтобин Д.П., Кульчавеня Е.В., Айзикович Б.И. Применение лазерной вапоризации для лечения аденомы предстательной железы. Урология 2013;4:74–79.
- Zheng W, Vilos G, McCulloch S, Borg P, Denstedt JD. Electrical burn of urethra as cause of stricture aer transurethral resection. J Endourol 2000;14(2):225-228.
- Rassweiler J, Teber D, Kuntz R, Hofmann R. Complications of transurethral resection of the prostate (TURP) – incidence, management and prevention. Eur Urol 2006;50(5):969-980. doi: http://dx.doi.org/10.1016/j.eururo.2005.12.042
- Meeks JJ, Barbagli G, Mehdiratta N, Granieri MA, Gonzalez CM. Distal urethroplasty for isolated fossa navicularis and meatal strictures. BJU Int 2012;109(4):616-619.
- Ramirez D, Simhan J, Hudak SJ, Morey AF. Standardized approach for the treatment of refractory bladder neck contractures. Urol Clin North Am 2013;40(3):371-380. doi: 10.1016/j.ucl.2013.04.012
- Parker D, Simhan J. Manegement оf complications after surgical outlet reduction for benign prostatic obstructions. Can J Urol 2015;22(1):88-92.
- Греченков А.С., Глыбочко П.В., Аляев Ю.Г., Бутнару Д.В., Безруков Е.А., Винаров А.З., Суханов Р.Б. Факторы риска развития стриктуры уретры и/или контрактуры шейки мочевого пузыря после монополярной трансуретральной резекции гиперплазии предстательной железы. Урология 2017;1:5-9. doi: 10/20953/2307-6631-2017-1-5-6







