Существуют различные методы способные оценить функцию почек и их повреждение при различных заболеваниях и стрессовых состояний органа. Проводимые в настоящее время исследования помогают определить место новых маркеров для диагностики острого повреждения почек (ОПП) интраоперационно или же в раннем послеоперационном периоде больным, после хирургической травмы почки. Эти маркеры могут дать оценку состояния почечной паренхимы во время ишемии почки, а также выявляют воздействие фармакологических препаратов на функцию почки.
Быстрое развитие научных исследований привело к внедрению стратегий, основанных на новых маркерах, которые позволяют оценить латентный период заболевания до выявления клинических симптомов фактической почечной недостаточности [1].Ранняя диагностика острой почечной недостаточности (ОПН), связанной с хирургическим вмешательством, с помощью новых почечных биомаркеров дает пространство для терапевтического маневра.
Хирургическое вмешательство приводит к травме внутри нефрона, которая в свою очередь, приводит к потере полярности клетки и последующей ее гибели. Вследствие чего нарушаются функциональные возможности почки (рис. 1). Современные биомаркеры способны выявить нарушение на этапе повреждения нефрона до появления первых функциональных нарушений [2]. Представление об остром повреждении почек (ОПП) в наши дни подверглось существенному пересмотру.
Растет число данных, указывающих на то, что острое, относительно незначительное повреждение почек или нарушение почечной функции, проявляющееся изменениями объема выделяемой мочи и биохимического состава крови, имеет серьезные клинические последствия. Установлено, что у пациентов, имеющих в анамнезе ОПП, риск развития хронической почечной болезни является очень высоким. Исторически сложилось, что мочевина стала первым маркером, который использовался для оценки функции почек.
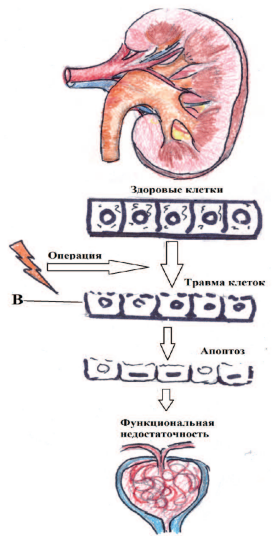
Рис. 1. Схема внутриклеточного повреждения почки, развившегося вследствие хирургического воздействия. (В - почечные биомаркеры)
В 1827 году Richard Bright первым связал накопление мочевины в крови и ее снижение в моче у больных с заболеванием почек. В клиническую практику, как диагностический тест, в начале 1900-х было введено количественное определение азота мочевины. Несмотря на то, что оценка азота мочевины остается широко применяемым тестом при оценке функции почек, в настоящее время признается, что данный тест является субоптимальным маркером для данной цели [3].
Следующим маркером, пришедшим на смену азоту мочевины, стал креатинин. В середине 1900-х он стал широко применяться в лабораторных тестах при оценке скорости клубочковой фильтрации (СКФ) и применяется в повседневной практике по сей день. Креатинин свободно фильтруется клубочками и не реабсорбируется почечными канальцами, но он секретируется с разной скоростью. Такие лекарства, как циметадин и триметоприм, тормозят канальцевую секрецию.
Также сомнительно утверждение о том, что канальцевая секреция относительно пропорциональна его клубочковой фильтрации, так как функция почки снижена, что приводит к неправильной оценке СКФ и, как следствие, увеличение креатинина сыворотки может не наблюдаться до того момента, когда СКФ существенно снизится. Еще один фактор, создающий трудности в диагностике при использовании креатинина сыворотки – это внутрииндивидуальная и межиндивидуальная вариабельность образования креатинина.
Исторически значительная вариабельность, связанная с изменением креатинина в сыворотке, обычно приводит к менее точной оценке СКФ в случаях, когда концентрация креатинина в сыворотке была в пределах референсного значения или несколько ниже [4]. В наши дни ведется поиск диагностических критериев, которые могли бы на ранних этапах указать на формирование ОПП. В качестве диагностических критериев предложены биомаркеры ОПП, которые не зависят от фильтрационной функции почек.
Липокалин, связанный с нейтафильной желатиназой (NGAL) – этот белок принадлежит к суперсемейству липокалина, которые являются секретируемыми или цитозольными белками, переносящими гидрофобные лиганды (такие как жирные кислоты, ретиноиды и феромоны) [5]. Человеческий NGAL существует как мономер или как гомодимер, а также он может существует как гетеродимер, где он конъюгирован с желатиназой и специфичен к нейтрофилам.
Мономер представляет собой продукт гена, который очень быстро выделяется из поврежденных эпителиальных клеток [6]. Функции NGAL обусловлены его способностью связывать железо-сидерофорные комплексы. Он формирует бактериостатическую функцию врожденной иммунной системы путем секвестрации железо-сидерофорных комплексов и тем самым предотвращает поглощение железа бактериями [7].
Эта функция также может быть кооптирована для транспортировки железа в цитоплазму через комплексы «катехолат-железо», где данный комплекс активирует или репрессирует гены, чувствительные к железу. После поглощения сидерофора, связанный NGAL перемещается в эндосому, от комплекса отщепляется железо. Это приводит к регуляции генов, чувствительных к железу (рис. 2А). Не связанный NGAL захватывает сидерофорсвязанное железо и переносит его во внеклеточное пространство.
NGAL связывает бактериальные сидерофоры и, тем самым, ограничивает потребление железа бактериями и регулирует потребление железа клетками организма (рис. 2Б) [8]. Данный белок (NGAL) был открыт в 1993 году и вскоре получил признание у нефрологов в качестве маркера ОПП. Причиной повышенного интереса к данному белку явилось то обстоятельство, что при остром повреждении в моче преобладает «ренальный» пул NGAL, синтезируемый в почках, и не поступающий в систему кровообращения.
Повышение синтеза NGAL в клетках проксимальных канальцев связано с ишемией почечной паренхимы и ее поражениями нефротоксическими соединениями. Плазменный NGAL свободно фильтруется гломерулами, большая его часть эффективно реабсорбируется в проксимальных канальцах мегалинзависимым эндоцитозом, возвращая таким путем железо клеткам.
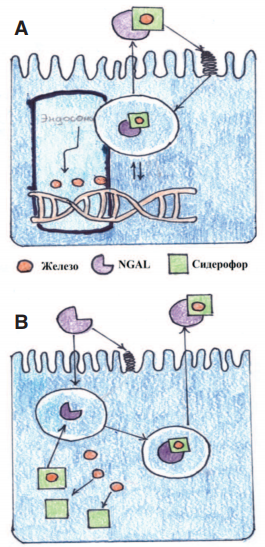
Рис. 2. Схематическая модель транспортной функций NGAL
A - регуляции генов, чувствительных к железу.
В - регуляция потребления железа клетками организма.
В моче NGAL появляется только при повреждении проксимальных канальцев за счет роста синтеза NGAL de novo в дистальных отделах нефрона, что и происходит при ОПП. В ответ на повреждение ренальных канальцев уровень NGAL возрастает в плазме крови в 7-16 раз (уровень сывороточного NGAL (s-NGAL)) и в моче в 25-1000 раз (уровень NGAL в моче (u-NGAL)). Экскреция NGAL с мочой на 24-48 часов опережает повышение концентрации креатинина в сыворотке крови.
Рост концентрации NGAL в моче наблюдается при ОПП, остром тубулярном некрозе или тубулоинтерстициальной нефропатии [9-11]. В 2011 году было проведено исследование, которое поставило своей целью проверить гипотезу о том, что без изменения креатинина сыворотки крови у пациентов с субклинической ОПН повышается уровень NGAL, что может определить дальнейший прогноз таких больных. В исследовании были проанализированы данные 2 322 пациентов с кардиоренальным синдромом из 10 проспективных независимых исследований.
В исследовании использовались NGAL (-) и NGAL (+), для оптимального прогнозирования ОПП и термины Креатинин (−) или Креатинин (+). Априорные исходы включали необходимость применения заместительной почечной терапии, летальные исходы, их сочетание и продолжительность пребывания в реанимации и стационаре. На основе проведенных исследований ученые пришли к выводу, что при отсутствии диагностического повышения уровня креатинина в сыворотке крови повышение уровня NGAL выявляется у пациентов с вероятной субклинической ОПП [12].
В 2015 году в Мельбурне проведено исследование, которое оценивало способность NGAL прогнозировать у кардиохирургических больных ОПН, а также влияние искусственного кровообращения на уровень NGAL. В исследование было включено 288 кардиохирургических больных старше 18 лет. NGAL измерялся в начале исследования, сразу после операции и в 1, 2 дни послеоперационного периода. Было установлено, что NGAL может использоваться как маркер повреждения при развитии ОПП и его уровень тесно связан с продолжительностью искусственного кровообращения [13].
Таким образом, был сделан вывод о пограничных уровнях NGAL, позволяющих с оптимальной чувствительностью и специфичностью предсказывать ОПП. Установленные в разных исследованиях и у пациентов с ОПП разных этиологий, значения NGAL находятся в диапазоне 100 – 270 нг/мл. Для рутинного измерения NGAL с целью диагностики и прогнозирования ОПП рекомендуется пограничный уровень NGAL, разный 150 нг/мл [14]. Цистатин С – хорошо изученный современный маркер ОПП.
В качестве маркера повреждения почек цистатин С оценивают в двух средах: сыворотке крови и в моче. Сывороточный цистатин С – белок, принадлежащий ко 2-й группе генетического семейства цистатинов. Цистатин С содержится в плазме крови человека, функцию выведения белка из организма осуществляют почки [10-11]. Цистатин С представляет собой негликозилированный белок с молекулярной массой 13,4 кДа и изоэлектрической точкой при рН 9,3.
Относится к семейству ингибиторов цистеиновых протеиназ, идентичен пост-гаммаглобулину; впервые идентифицирован у пациентов с почечной недостаточностью как белок спинномозговой жидкости и мочи [15]. Сывороточная концентрация цистатина С, в отличие от креатинина, не зависит от питания, массы тела, пола, возраста. Поэтому как эндогенный биомаркер почечной функции он близок к идеальному и показывает лучшие результаты по сравнению с креатинином [10,11].
Исходно высокие при рождении уровни цистатина С в первый год жизни снижаются и остаются стабильными до 50 лет, а затем повышаются. В большинстве исследований обнаружено, что референтный интервал значений концентрации цистатина С в сыворотке составляет для женщин 0,52 – 0,90 мг/л со средним значением 0,71 мг/л и 0,56 – 0,98 мг/л – для мужчин, среднее значение – 0,77 мг/л [16]. Цистатин С мочи в настоящее время являться индикатором количественной оценки тяжести канальцевых нарушений [11].
Цистатин С является одним из самых точный эндогенных маркеров и по своим диагностическим возможностям значительно превосходит креатинин, также высокочувствительный маркер при кардиохирургичеких вмешательствах, независимый от каких-либо кардиомаркеров (кардиальные тропонины, натрийуретические пептиды, С-реактивный белок) [17-22]. Впервые уровень цистатина C мочи был определен в 1979 г. и составил 0,095± 0,057 мг/л [23].
На данный момент установлена связь между уровнем цистатина C мочи и концентрацией креатинина в моче, что было выявлено у пациентов с персистирующей протеинурией. Установлена также связь уровня креатинина с возрастом и количеством мышечной массы (средний уровень креатинина мочи возрастает с возрастом и увеличением мышечной массы). В то же время уровень цистатина С не зависит ни от одного из этих факторов. Уровень цистатина С мочи четко отражает эффективность реабсорбции цистатина С в проксимальных канальцах.
В том случае, если соотношение цистатина С мочи и креатинина мочи находится в нормальном диапазоне, то цистатин С более точно отражает фильтрационную способность клубочков [24]. Молекула-1 поражения почек (KIM-1) – трансмембранный гликопротеин 1-го типа, который в норме присутствует в почечной ткани в минимальном количестве. В результате ишемического или нефротоксического ОПП происходит его значительное увеличение в клетках проксимальных почечных канальцев.
KIM-1 является ранним неинвазивным биомаркером для ОПП, связанного с повреждением проксимальных почечных канальцев [9-11]. KIM-1 действует как фосфатидилсериновый рецептор, связывающий апоптотические тельца. KIM-1 связывается с альфа-субъединицей гетеротримерного белка G12, тем самым опосредуя фагоцитоз апоптотических телец (рис. 3). Внеклеточный домен KIM-1 выводится с поверхности клетки металлопротеиназой [8].
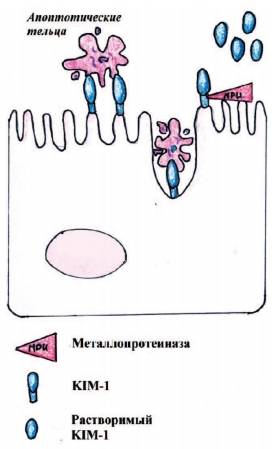
Рис. 3. Схема действия KIM-1 при фагоцитозе апоптотических телец
Имеются исследования, подтверждающие экспрессию KIM-1 в клубочках, в ходе очагового клубочкового некроза почек, нефропатии IgA или мембранно-пролиферативной гломерулопатии. У пациентов с высокой степенью протеинурии в результате хронического повреждения клубочков чаще развивается ОПП. На этом основании можно утверждать, что KIM-1 может является маркером повреждения почек [25- 26].
Особая значимость KIM-1 была обнаружена при остром повреждении канальцев, которые могут быть следствием гипоксии (шок, обширное хирургическое вмешательство, трансплантация почки), септического или токсического повреждения почек, повреждения индуцированного контрастными, антибактериальными, противогрибковыми и цитотоксическими препаратами. Появляется KIM-1 в моче в первый день после токсического или ишемического повреждения канальцев почек, в то время как креатинин плазмы увеличивается только на третий день.
Более того, было отмечено увеличение концентрации KIМ-1 через час после хирургического вмешательства [27-28]. Экспериментальные испытания, проведенные на животных и генетическом материале, полученном из проксимального канальца, позволили обнаружить гены, которые индуцируются в начале и после повреждения почки. Белковые продукты этих генов можно рассматривать как полезные маркеры для диагностики почечной недостаточности.
Индукция гена KIM-1 (называемая молекулярной патологией почек-1) приводит к образованию белка, который можно рассматривать как диагностический маркер. Также КИМ-1 является еще и маркером почечно-клеточного рака (ПКР) до проявления клинических признаков. Группой ученых нескольких европейских стран было проведено исследование, в ходе которого удалось доказать значимость КИМ-1 при ранней диагностике ПКР.
Так, повышение концентрации в плазме крови КИМ-1 может предсказать развитие ПКР за 5 лет до установления диагноза и, как следствие этого, может повлиять на выживаемость больных [29]. Интерлейкин-18 (ИЛ-18) – провоспалительный цитокин, принадлежащий к семейству интерлейкина 1. Синтезируется макрофагами и другими клетками организма. Был впервые открыт в 1995 году в качестве интерферон-гамма-индуцирующего фактора, который увеличивал активность клеток естественных киллеров в селезенке, причем его активность выше, чем у интерлейкина 12 [30].
ИЛ-18 является провоспалительным цитокином, продуцируемым в проксимальных канальцах, и определятся в моче у больных с ишемическим ОПП. Кроме того, было обнаружено, что увеличение концентрации ИЛ-18 мочи в раннем послеоперационном периоде позволяет предсказать развитие ОПП в течение ближайших 24 часов с вероятностью 73%. Установлено, что повышение концентрации ИЛ-18 опережает повышение концентрации креатинина сыворотки крови на 48- 72 часа.
Повышение концентрации ИЛ-18 в моче более 100 пг/мл указывает на ОПП [10-11]. ИЛ-18 играет активную роль в различных процессах почечных заболеваний, включая апоптоз, ишемию/реперфузию, отторжение аллотрансплантата, инфекцию, аутоиммунные состояния и злокачественность. Белок, связывающий печеночные жирные кислоты (L-FABP) представляет собой протеин, который в норме проявляется в проксимальных извитых и прямых канальцах почек.
В случае ОПП повышение L-FABP определяется в первые 24 часа, в то время как повышение креатинина отмечается только через 72 часа [9-11]. L-FABP представляет собой белок из большого надсемейства липидсвязывающих белков [31]. Общей функцией всех членов этого семейства является внутриклеточный транспорт. L-FABP переносит альбумин в митохондрии и пероксисомы, в которых белок метаболизируется. В почках L-FABP преимущественно располагается в проксимальных канальцах и выводится вместе со связанными токсичными продуктами окисления, в случае травмы почек данные продукты накапливаются в клетках почки [32].
L-FABP является новым потенциальным биомаркером почечной дисфункции. В Дании провели диагностическое исследование, представлявшее собой анализ информативности экскреторного мочевого L-FABP в отношении установленных маркеров риска, таких как артериальное давление, экскреция альбумина и СКФ, относительно прогрессирования хронической почечной недостаточности (ХПН). Было установлено, что уровень экскреторного мочевого L-FABР постоянно повышается у пациентов с ХПН, но коррелирует только со снижением СКФ у пациентов без альбуминурии [33].
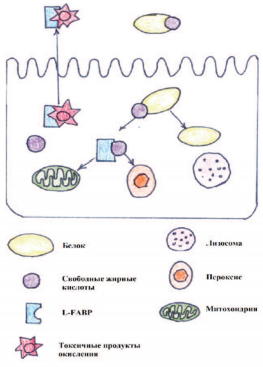
Рис. 4. Схематическая модель транспортной функции L-FABP.
L-FABP транспортирует свободные жирные кислоты в митохондрии и пероксисомы,
а затем L-FABP выводится из клетки вместе с токсичными продуктами окисления.
В настоящее время проведенные исследования показали возможность применения новых биомаркеров с целью диагностики поражения почек на ранних этапах, когда еще не наступила развернутая клиническая картина ОПП. Это является важным диагностическим фактором, особенно во время проведения хирургического вмешательства на почке. В мировой практике широко применяются различные маркеры почечного повреждения. Так, с 2012 по 2014 г. в Университетской больнице Гента проводилось когортное исследование кардиохирургических пациентов.
В исследование было включено 211 пациентов, в предоперационном периоде не имевших ОПП. Целью исследования являлось установить, может ли хитиназа-3- подобный белок мочи быть использован в прогностических целях для предсказания развития острой почечной недостаточности у взрослых больных, перенесших кардиохирургическое вмешательство и сравнить таковую способность указанного белка с NGAL и креатинином сыворотки.
По результатам данного исследования установлено, что в раннем послеоперационном периоде хитиназа-3-подобный белок сыворотки, в сочетании либо с хитиназа-3-подобный белком мочи (ОР 0,773, 95% ДИ 0,708-0,829), либо с NGAL (ОР 0,774; 95% ДИ 0,710- 0,830), является хорошим предиктором стадии ОПН ≥2 в течение 12 часов после завершения операции [34]. В России же подобные работу проводились в контексте оценке функции почки после органосохраняющих операций при ПКР.
Изучалось влияние эпидуральной блокады на функциональное состояние почки во время резекции в условиях тепловой ишемии. В исследование было включено 35 больных локализованным раком почки, которым проводилась эпидуральная блокада при резекции почки и имелась контрольная группа из 37 пациентов с локализованным раком без проведения эпидуральной блокады. Маркеры оценивались в крови и моче до вмешательства и через 40 мин после начала операции, а также на 1-е и 3-и сутки послеоперационного периода.
Методом иммуноферментного анализа были исследованы 5 маркеров острого повреждения почек: цистатин С, интерлейкин 18, NGAL, L-FABP и КIМ-1. По фоновому уровню цистатина С в сыворотке крови все больные были разделены на 2 группы: с уровнем показателя ≤1000 нг/мл и >1000 нг/мл. По результатам исследования было установлено, что применение эпидуральной блокады в периоперационном периоде у больных локализованным ПКР при резекции почки в условиях тепловой ишемии оказывает нефропротективный эффект, позволяя сохранить функциональные показатели почек на исходном уровне в отличие от стандартного ведения больных [35].
Таким образом, поиск идеального биомаркера повреждения почки продолжается до сих пор. Для клинициста биомаркер должен быть неинвазивным, обнаруживаемым на ранних стадиях заболевания и прогностически эффективным, но он также должен быть специфичным для типа ткани и иметь тесное патофизиологическое отношение к болезни. Установленные в настоящее время биомаркеры имеют свои преимущества и недостатки. Однако применение данных биомаркеров в клинической практике помогает своевременно выявлять ОПП, что в свою очередь способствует снижению частоты серьезных осложнений.
Литература:
- Gaião SM, Paiva JAOC. Biomarkers of renal recovery after acute kidney injury. Rev Bras Ter Intensiva 2017;29(3):373-381. doi: 10.5935/0103-507X.20170051.
- Ronco C, McCullough P, Anker SD, Anand I, Aspromonte N, Bagshaw SM, et al. Cardio-renal syndromes: report from the consensus conference of the аcute dialysis quality initiative. Eur Heart J 2010;31(6):703-11. doi: 10.1093/eurheartj/ehp507.
- Steensma DP, Kyle RA. A history of the kidney in plasma cell disorders. Contrib Nephrol 2007;153:5-24. doi: 10.1159/000096757
- Pasala S, Carmody JB. How to use… serum creatinine, cystatin C and GFR. Arch Dis Child Educ Pract Ed 2017;102(1):37-43. doi: 10.1136/ archdischild-2016-311062.
- Schiefner A, Skerra A. The menagerie of human lipocalins: a natural protein scaffold for molecular recognition of physiological compounds Acc Chem Res 2015;48(4):976-85. doi: 10.1021/ar5003973
- Cai L, Rubin J, Han W, Venge P, Xu S. The origin of multiple molecular forms in urine of HNL/NGAL. Clin J Am Soc Nephrol 2010;5(12):2229-35. doi: 10.2215/CJN.00980110.
- Bao GH, Ho CT, Barasch J. The Ligands of Neutrophil Gelatinase-Associated Lipocalin. RSC Adv 2015;5(126):104363-104374.
- Schrezenmeier EV, Barasch J, Budde K, Westhoff T, Schmidt-Ott KM. Biomarkers in acute kidney injury – pathophysiological basis and clinical performance. Acta Physiol 2017;219(3):556–574. doi: 10.1111/apha.12764.
- Смирнов А.В., Каюков И.Г., Добронравов В.А., Кучер А.Г.: Острое повреждение почек – новое понятие в нефрологии. Клиническая нефрология 2009;(1):11 – 15;
- Смирнов А.В., Добронравов В.А., Румянцев А.Ш., Шилов Е.М., Ватазин А.В., Каюков Ю.Г. и др. Национальные рекомендации. Острое повреждение почек: основные принципы диагностики, профилактики и терапии. Часть I. Нефрология 2016;20(1):79 – 104;
- Уразаева Л.И., Максудова А.Н. Биомаркеры раннего повреждения почек: обзор литературы. Практическая медицина 2014;1 (4):125 – 130
- Haase М, Devarajan Р, Haase-Fielitz А, Pharm D, Bellomo R, Wagener G, et al. The Outcome of Neutrophil Gelatinase-Associated Lipocalin (NGAL)-positive subclinical acute kidney injury: a multicenter pooled analysis of prospective studies. J Am Coll Cardiol 2011;7(17):1752–1761. doi: 10.1016/j.jacc.2010.11.051.
- Garcia-Alvarez M, Glassford NJ, Betbese AJ, Ordoñez J, Baños V, Argilaga M, et al. Urinary neutrophil gelatinase-associated lipocalin as predictor of short or long-term outcomes in cardiac surgery patients. Cardiothorac Vasc Anesth 2015;29(6):1480-8. doi: 10.1053/ j.jvca.2015.05.060
- Haase M, Bellomo R, Devarajan P. Accuracy of neutrophil gelatinase-associated lipocalin (NGAL) in diagnosis and prognosis in acute kidney injure: a systematic review and meta-analysis. Am J Kidney Dis 2009;54(6):1012-1024.
- Zhai JL, Ge N, Zhen Y, Zhao Q, Liu C. Corticosteroids Significantly Increase Serum Cystatin C Concentration without Affecting Renal Function in Symptomatic Heart Failure. Clin Lab 2016;62(1-2):203-7.
- Iversen E, Bodilsen AC, Klausen H, Treldal C, Andersen O, Houlind M, Petersen J. Kidney function estimates using cystatin C versus creatinine: Impact on medication prescribing in acutely hospitalized elderly patients. Basic Clin Pharmacol Toxicol 2018 Oct. doi: 10.1111/bcpt.13156.
- Jalalonmuhali M, Elagel SMA, Tan MP, Lim SK, Ng KP. Estimating Renal Function in the Elderly Malaysian Patients Attending Medical Outpatient Clinic: A Comparison between Creatinine Based and Cystatin-C Based Equations. Int J Nephrol 2018;2018:3081518. doi: 10.1155/2018/3081518.
- Khosravi N, Zadkarami M, Chobdar F, Hoseini R, Khalesi N, Panahi P, Karimi A. The value of urinary cystatin C level to predict neonatal kidney injury. Curr Pharm Des 2018 Sep 17. doi: 10.2174/1381612824666180918100819.
- Herget-Rosenthal S, Bökenkamp A. Hofmann W. How to estimate GFR-serum creatinine, serum cystatin C or equations? Clin Biochem 2007;40(3-4):153-61.
- Tidman M, Sjöström P, Jones I. A Comparison of GFR estimating formulae based upon s-cystatin C and screatinine and a combination of the two. Nephrol Dial Transplant 2008;23(1):154-60.
- Stevens LA, Coresh J, Schmid CH. Estimating GFR using serum cystatin C alone and in combination with serum creatinine: a pooled analysis of 3,418 individuals with CKD. Am J Kidney Dis 2008;51(3):395-406.
- Sterner G, Björk J, Carlson J. Validation of a new plasma cystatin Cbased formula and the modification of diet in renal disease creatininebased formula for determination of glomerular filtration rate. Scand J Urol Nephrol 2009;43(3):242-249.
- Lofberg H, Grubb A. Quantitation of gamma-trace in human biological fluids: indications for production in the central nervous system. Scand J Clin Lab Invest 1979; 39: 619–626;
- Herget-Rosenthal S, Feldkamp T, Volbracht L. Measurement of urinary cystain C by particle enhanced nephelometric immunoassay: precision, interferences, stability, and reference range. Ann Clin Biochem 2004;41 (Part 2):111–118.
- Comnick M, Ishani A. Renal biomarkers of kidney injury in cardiorenal syndrome. Curr Heart Fail Rep 2011;8(2):99-105. doi: 10.1007/s11897-011-0052-x.
- Nijboer WN, Schuurs TA, Damman J, van Goor H., Vaidya VS, van der Heide JJ, et al. Kidney injury molecule-1 is an early noninvasive indicator for donor brain death-induced injury prior to kidney transplantation. Am J Transplant 2009;9(8):1752-9. doi: 10.1111/ j.1600-6143.2009.02713.x.
- Liang XL, Liu SX, Chen YH, Yan LJ, Li H, Xuan HJ, et al. Combination of urinary kidney injury molecule-1 and interleukin-18 as early biomarker for the diagnosis and progressive assessment of acute kidney injury following cardiopulmonary bypass surgery: a prospective nested case-control study. Biomarkers 2010;15(4):332-9. doi: 10.3109/13547501003706558.
- Liang XL, Shi W. Beyond early diagnosis: prognostic biomarkers for monitoring acute kidney injury. Hong Kong J Nephrol. 2010;12(2):45-49.;
- Bagshaw SM. Novel biomarkers for early diagnosis of acute kidney injury. Expert Opin Med Diagn 2008;2(9):1041-54. doi: 10.1517/17530059.2.9.1041.
- Appenrodt B, Lammert F. Renal Failure in Patients with Liver Cirrhosis: Novel Classifications, Biomarkers, Treatment. Visc Med 2018;34(4):246-252. doi: 10.1159/000492587.
- Gohda T, Nishizaki Y, Murakoshi M, Nojiri S, Yanagisawa N, Shibata T, et al. Clinical predictive biomarkers for normoalbuminuric diabetic kidney disease. Diabetes Res Clin Pract 2018;141:62-68. doi: 10.1016/ j.diabres.2018.04.026.
- Moriyama T, Hagihara S, Shiramomo T, Nagaoka M, Iwakawa S, Kanmura Y. The protective effect of human atrial natriuretic peptide on renal damage during cardiac surgery. J Anesth 2017;31(2):163-169. |doi:10.1007/s00540-016-2284-0.
- Khatir DS, Bendtsen MD, Birn H, Nørregaard R, Ivarsen P, Jespersen B, et al. Urine liver fatty acid binding protein and chronic kidney disease progression. Scand J Clin Lab Invest 2017;77(7):549-554. doi: 10.1080/00365513.2017.1355561;
- De Loor J, Ingrid H, Francois K, Van Wesemael A, Nuytinck L, Meyer E, et al. Diagnosis of cardiac surgery-associated acute kidney injury: differential roles of creatinine, chitinase 3-like protein 1 and neutrophil gelatinase-associated lipocalin: a prospective cohort study. Ann Intensive Care 2017; 7(1):24. doi: 10.1186/s13613-017-0251-z.
- Кит О.И., Франциянц Е.М., Розенко Д. А., Ушакова Н.Д., Димитриади С.Н., Погорелова Ю.А., и др. Динамика маркеров острого повреждения почек при использовании эпидуральной блокад во время резекции в условиях тепловой ишемии. Онкоурология 2017;13(4): 25-33. DOI: 10.17650/1726-9776-2017-13-4-25-33







