В России в структуре онкологической заболеваемости опухоли мочеполовых органов различной локализации занимают с 4-го по 9-е места. Диагностику этих заболеваний нельзя признать удовлетворительной, так как при первичном обследовании в 25-30% случаев обнаруживаются метастазы, смертность на первом году жизни с момента установления диагноза регистрируется в 8-15% и продолжается рост больных на поздних стадиях [1,2,3]. Применение в онкоурологии инновационных методов прогноза агрессивности опухоли, основанных на исследование онкомаркеров, позволяет проводить неинвазивный контроль течения опухолевой процесса при лечении, выбирать персонализированную тактику терапии, повышать качество и продолжительность жизни больных.
Как известно, злокачественная трансформация клеточных структур происходит на этапе накопления в геноме определенного числа повреждений генов, нарушение нормального синтеза белков, качественного и количественного изменения профиля белковых молекул, вовлеченных в канцерогенез. К их числу относят активацию синтеза эндотелиального фактора роста (vascular endothelial growth factor, VEGF-A) [4-8]. За последние годы установлено, что нарастание уровня VEGF сыворотки крови снижает пролиферацию Т-лимфоцитов, приводит к накоплению иммунных клеток супрессивного фенотипа [9] и экспрессии контрольных точек – чекпоинтов (PD-L1) на миелоидных клетках супрессорах, дендритных и опухолевых клетках. Результатом исследований, подтвердивших, что изменение концентрации VEGF сыворотки крови связано с модификацией опухолевого микроокружения и снижением защитных свойств иммунной системы [10-12], стало одно из направлений терапии онкозаболеваний, основанной на применении комбинации антиангиогенных препаратов с ингибиторами иммунных контрольных точек (антиPD/ L-1 антител) [13].
Вместе с тем исследование уровня VEGF в сыворотке пока не получило широкого распространения в клинической практике, что прежде всего связано с биологической вариабельностью показателя [14-15]. В периферическом кровотоке VEGF содержится в количестве, необходимом для немедленной реакции на повреждение [16,17,18]. Источником незначительной части фактора являются эндотелиальные прогенеторные клетки, большая часть данного белка высвобождается из альфа-гранул тромбоцитов при свертывании крови [19]. Кроме того определение концентрации VEGF в биологических жидкостях не стандартизированы, выполняются с использованием биологического материала, полученного разными методами и наборами реагентов. Результаты анализа VEGF сыворотки и плазмы крови в группах практически здоровых людей, как правило, не сопоставимы и не дополняют друг друга [20-23]. Отсутствие результатов исследования биологической вариации величин VEGF у практически здоровых лиц вносит существенные ограничения в клиническую практику применения данного маркера [24-32]. Необходимость разработки референтных значений для содержания VEGF в биологических жидкостях, прежде всего в сыворотке крови, с учетом возрастной вариации очевидна. Целью настоящей работы явились обоснование клинико-диагностического значения изменения уровня VEGF в сыворотке крови у практически здоровых лиц в зависимости от возраста и при опухолевых заболеваний мочеполовых органов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
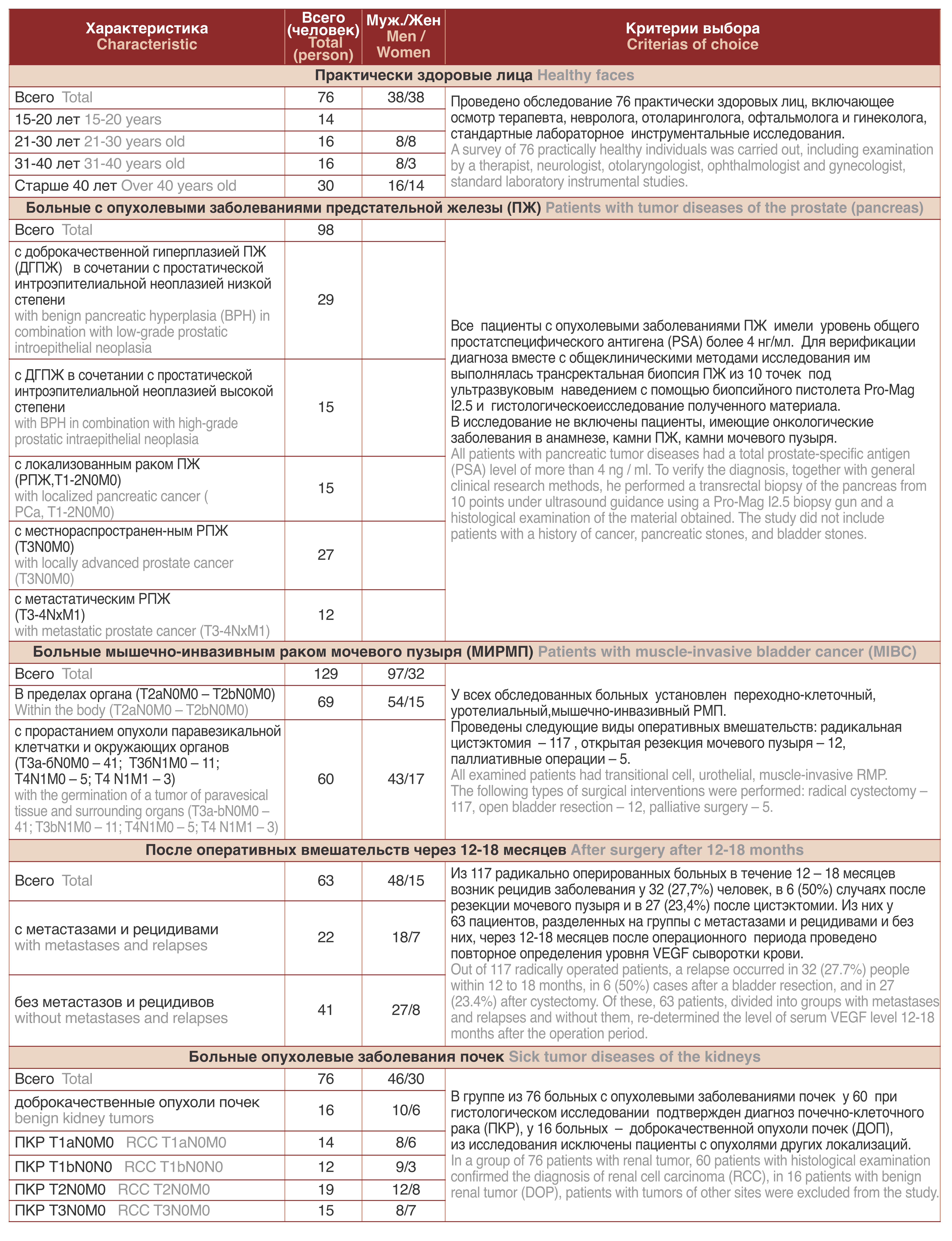
Всего обследовано 76 практически здоровых лиц и 303 пациента с онкоурологическими заболеваниями, проходивших лечение в НИИ фундаментальной и клинической уронефрологии ФГБОУ ВО Саратовский ГМУ им. В. И. Разумовского Минздрава России. Характеристика групп практически здоровых лиц и больных с опухолями ПЖ, мочевого пузыря, почек представлена в таблице 1.
Таблица 1. Характеристика групп практически здоровых лиц и больных с опухолями ПЖ, мочевого пузыря, почек
Table 1. Characterization of groups of practically healthy individuals and patients with tumors of the pancreas, bladder, kidney
Методы исследования. Для определения концентрации VEGF в сыворотке и плазме крови использовали наборы реактивов для твердофазного иммуноферментного анализа «VEGF – ИФА – БЕСТ» (ЗАО «Вектор-Бест», Новосибирск). Для описания количественных данных рассчитывали медиану, интерквартильный размах. Для определения различий между двумя независимыми группами по количественным признакам использовали непараметрический двусторонний критерий Манна-Уитни. Во всех случаях различия признавали статистически достоверными при уровне значимости p<0,05. Статистическую обработку данных выполняли с использованием статистического пакета программ Statistica v. 6.0 («StatSoftInc»). Для выявления взаимосвязи между возрастом практически здоровых лиц и концентрацией VEGF в сыворотке крови использовали ранговый корреляционный анализ Спирмена. Для оценки диагностической чувствительности и специфичности VEGF применяли ROC-анализ.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Содержание VEGF сыворотки крови у здоровых лиц. Медиана сывороточной концентрации VEGF в возрастной группе 21– 30 лет повышается на 78%, по сравнению с группой лиц в возрасте от 16 до 20 лет, и достигает в группах 31– 40 лет и старше 41 года – 468 и 855% соответственно (табл.2). Между возрастом практически здоровых лиц и концентрацией VEGF в сыворотке крови выявлена сильная положительная корреляционная взаимосвязь (r = 0,769). Возрастное нарастание концентрации VEGF в сыворотке крови у практически здоровых лиц VEGF можно считать следствием нарушения эндотелиального гомеостаза и системы ангиогенеза и развития системного низкоградуированного воспаления. Смещение баланса ангиогенных и антиангиогенных факторов в сторону активации ангиогенеза и подъем уровня VEGF в сыворотке крови наиболее значительным становится в возрасте 41год и старше. В связи с этим, при анализе результатов исследования у больных с опухолевыми заболеваниями использовано содержание VEGF сыворотки крови группы практически здоровых лиц старше 41 года, предложены возрастные референтные интервалы концентрации ПСА.
Содержание VEGF сыворотки крови у больных с опухолевыми заболеваниями ПЖ, мочевого пузыря, почек. Результаты исследования уровня VEGF сыворотки крови у обследованных пациентов с онкоурологическими заболеваниями представлены в таблице 3. Как видно при доброкачественных новообразованиях ПЖ и почек изменения концентрации VEGF сыворотки крови незначительно отличались от величин возрастной нормы. В группах больных с ПИН высокой степени и локализованным РПЖ содержание VEGF в сыворотке крови возрастало всего в 1,1-1,2 раза соответственно по сравнению с группой практически здоровых лиц. У пациентов с ДОП концентрация VEGF сыворотки крови снижалась ниже величин в группе практически здоровых лиц (р < 0,05).Высокие уровни VEGF в сыворотке крови выявлены у больных со злокачественными новообразованиями органов мочеполовой системы и высокой прогрессией заболевания.
У больных с местно – распространенным РПЖ уровень VEGF в сыворотке крови превышал величину практически здоровых лиц в 1,7 раза (р<0,05), у пациентов с метастатическим РПЖ – в 2,2 раза (р<0,05). При этом содержание общего PSA сыворотки крови коррелировало с уровнем VEGF (r = 0,7312, р<0,05). Диагностическое значение VEGF сыворотки крови у больных РЖП составил 770 (пг/мл) при диагностической чувствительности равной 72,4% и специфичности -84,9%. Практически у всех обследованных больных МИРМП имело место достоверное повышение уровня VEGF сыворотки крови (в 1,48 раз у больных с МИРМП в пределах органа, в 1,89 раза – у пациентов МИРМП с прорастанием опухоли паравезикальной клетчатки и окружающих органов, р<0,05).
Таблица 2. Концентрация VEGF в сыворотке крови в зависимости от возраста практически здоровых лиц
Table 2. Serum VEGF concentration depending on the age of healthy individuals

* p< 0,05 по сравнению с группой от 16 до 20 лет
* p<0.05 compared with a group of 16 to 20 years
После оперативных вмешательств через 12-18 месяцев в группе больных МИРМП с рецидивами и метастазами содержание VEGF в сыворотке значительно превышало его уровень у практически здоровых лиц в раза. В группе больных без метастазов и рецидивов в сыворотке концентрация VEGF сыворотки крови становилась ниже величин нормы (р<0,05). Уровень VEGF в сыворотке в качестве показателя прогноза риска прогрессирования заболевания у больных МИРМП составил 796,9 (пг/мл), при чувствительности – 71,4% и специфичности – 87,5%. У больных ПКР уровень VEGF сыворотки крови становился выше в 1,34 раза (р <0,05) только у пациентов с Т3 стадией заболевания. У больных ПКР со стадиями Т1а – Т2 содержание VEGF сыворотки крови увеличивалось в 1,47 до 1,97 раз только при сравнению с группой больных ДОП (р < 0,05). Диагностический порог VEGF сыворотки крови, характеризующий стадию развития ПКР, составил для пациентов с рТ1-2 стадиями – 314 -795 пг/мл; с рТ3 стадией – >705 пг/мл.
Таблица 3. Содержание VEGF в сыворотке крови у больных с опухолевыми заболеваниями предстательной железы, мочевого пузыря, почек
Table 3. Serum VEGF in patients with cancer of the prostate, bladder, and kidney
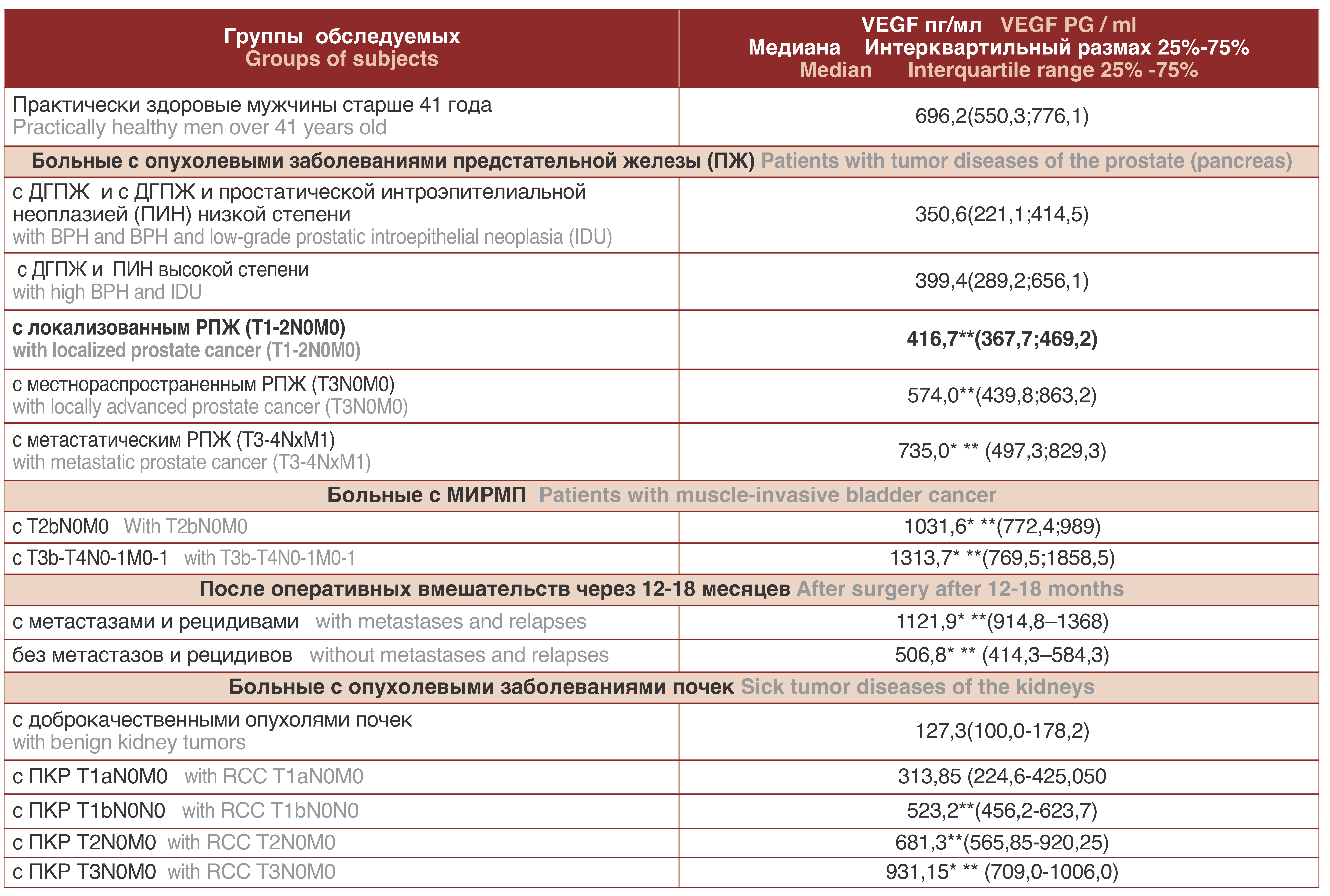
* р≤0,05 в сравнении с группой практически здоровых лиц в возрасте старше 41года
**р≤0,05 в сравнении с группой пациентов с ДГПЖ, ДОП
* p≤0.05 in comparison with a group of healthy individuals over the age of 41 years
** p≤0.05 in comparison with a group of patients with BPH, DOP
ОБСУЖДЕНИЕ
Представленные результаты исследования, полученные при обследовании 309 больных онкоурологическими заболеваниями, показали, что активность роста опухолевых клеток сопровождается подъемом уровня VEGF в периферическом сосудистом русле. Установлена значимая связь между высокими уровнями VEGF сыворотки крови и стадией заболевания или наличием метастазирования. Содержание VEGF сыворотки крови может быть одной из характеристик прогрессии заболевания и развития метастазов у больных злокачественными образованиями ПЖ, мочевого пузыря, почек. Несмотря на то, что до настоящего времени данный биомаркер не вошел в клинические рекомендации, результаты проведенного исследования подтверждают возможность его использования в качестве потенциального маркера распространенности метастатического процесса.
Клинико-диагностическое значение высоких концентраций VEGF сыворотки крови представлено для каждой из групп обследованных больных в таблице 4.
Таблица 4. Клинико-диагностическое значение высоких концентраций VEGF сыворотки крови у больных опухолевыми заболеваниями ПЖ, почек, МИРМП
Table 4. Clinical and diagnostic value of high concentrations of VEGF serum in patients with tumor diseases of the pancreas, kidneys, MIВС

Происходящие в последние годы изменения парадигмы терапии онкоурологических больных с высокими рисками прогрессии и развития метастазов рака ПЖ, мочевого пузыря, почек и проведение рандомизированных крупных исследований позволят установить возможность использовать показатели VEGF сыворотки крови при прогнозировании исходов заболеваний и эффективности терапии.
ВЫВОДЫ
- С возрастом происходит нарастание содержания VEGF сыворотки крови у практически здоровых лиц;
- Диагностическое значение исследование уровня VEGF сыворотки крови при онкоурологических заболеваниях приобретает на этапе прогрессии опухолевого роста, в периоде развития метастазов;
- Определение в ходе клинико-лабораторных исследований с помощью метода иммуно-ферментного анализа такого белкового маркера как VEGF в сыворотке крови может найти применение в качестве прогностического теста при метастатических формах онкоурологических заболеваний в силу невысокой стоимости и наличия производства отечественных наборов реактивов. Отдельного внимания заслуживает возможность с помощью определения уровня VEGF сыворотки крови повышение качества индивидуального мониторирования эффективности методов лечения пациентов с онкоурологическими заболеваниями, прежде всего таких, как таргетная терапия ингибиторами ангиогенеза и иммунных контрольных точек.
ЛИТЕРАТУРА
- Состояние онкологической помощи населению России в 2017 году. [Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой]. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России, 2018. 236 с.
- Каприн А.Д., Аполихин О.И., Сивков А.В., Москалева Н.Г., Солнцева Т.В., Комарова В.А. Анализ уронефрологической заболеваемости и смертности в Российской Федерации за 2003–2013 гг. Экспериментальная и клиническая урология. 2015;2:4–12.
- Клинические рекомендации Европейской ассоциации урологов. 2017, 968 с.
- Капланская И.Б., Гласко Е.Н., Франк Г.А. Ангиогенез, межклеточные контакты и стромально-паренхиматозные взаимоотношения в норме и патологии. Российский онкологический журнал 2005; 4: 53–7.
- van Royen N, Piek JJ, Buschmann I, Hoefer I, Voskuil M, Schaper W. Stimulation of arteriogenesis; a new concept for the treatment of arterial occlusive disease. Cardiovasc Res 2001;49(3):543 –53. doi: 10.1016/S0008-6363 (00)00206-6.
- Harshman LC, Xie W, Bjarnason GA, Knox JJ, MacKenzie M, Wood L, et al. Conditional survival of patients with metastatic renal-cell carcinoma treated with VEGF-targeted therapy: a population-based study. Lancet Oncol 2012;13(9):927-35. doi:10.1016/S1470-2045(12)70285-1.
- Folkman J. Is angiogenesis an organizing principle in biology and medicine? J Pediat Surg 2007;42(1):1–11. doi: 10.1016/j.jpedsurg.2006.09.048.
- Domblides C, Gross-Goupil M, Quivy A, Ravaud A. Emerging antiangiogenics for renal cancer. Expert Opin Emerg Drugs 2013;18(4):495-511. doi: 10.1517/14728214.2013.858697.
- Кушлинский Н.Е., Фридман М.В., Морозов А.А., Герштейн Е.С., Кадагидзе З.Г., Матвеев В.Б. Cовременные подходы к иммунотерапии рака почки. Онкоурология 2018;14(2):54-67. doi: 10.17650/1726-9776-2018-142-54-67.
- Sharpe K, Stewart GD, Mackay A, Van Neste C, Rofe C, Berney D, et al. The effect of VEGF targeted therapy on biomarker expression in sequential tissue from patients with metastatic clear cell renal cancer. Clin Cancer Res 2013;19(24):6924-34. doi: 10.1158 / 1078-0432.CCR-13-1631.
- van der Veldt AA, Vroling L, de Haas RR, Koolwijk P, van den Eertwegh AJ, Haanen JB, et al. Sunitinib-induced changes in circulating endothelial cellrelated proteins in patients with metastatic renal cell. Int J Cancer 2011;131 (4):484-93. doi: 10.1002/ijc.26456.
- Fujita N, Okegawa T, Terado Y, Tambo M, Higashihara E, Nutahara K. Serum level and immunohistochemical expression of vascular endothelial growth factor for the prediction of postoperative recurrence in renal cell carcinoma. BMC Res Notes 2014;7:369. doi: 10.1186/1756-0500-7-369.
- Chen PC, ChengHC,Wang J,Wang SW, Tai HC, Lin CW, Tang CH. Prostate cancer derived CCN3 induces M2 macrophage infiltration and contributes to angiogenesis in prostate cancer microenvironment. Oncotarget 2014;5(6):1595–1608. doi: 10,18632 oncotarget.1570.
- Hormbrey E, Gillespie P, Turner K, Han C, Roberts A, McGrouther D, et al. A critical review of vascular endothelial growth factor (VEGF) analysis in peripheral blood: is the current literature meaningful? Clin Exp Metastasis 2002;19(8):651-663. doi: 10.1023/A:1021379811308.
- Macarthur M, Hold GL, El-Omar EM. Inflammation and cancer: II. Role of chronic inflammation and cytokine gene polymorphisms in the pathogenesis of gastrointestinal malignancy. Am J Physiol Gastrointest Liver Physiol 2004;286(4):515-20. doi: 10.1152/ajpgi.00475.2003.
- Kubisz P, Chudý P, Staško J, Galajda P, Hollý P, Vyšehradský R, et al. Circulating vascular endothelial growth factor in the normoand/or microalbuminuric patients with type 2 diabetes mellitus. Acta Diabetol 2010;47(2):19-24. doi: 10.1007/s00592-009-0127-2.
- Zachary I, Mathur A, Yla-Herttuala S, Martin J. Vascular protection: A novel nonangiogenic cardiovascular rolefor vascular endothelial growth factor. Arterioscler Thromb Vasc Biol 2000; 20(6):1512-1520. doi: 10.1161/01.ATV.20.6.1512.
- Carmeliet P, Jain R. Angiogenesis in cancer and other diseases. Nature Med 2010;407:249-57. doi: 10.1038/35025220.
- Italiano JE, Richardson JL, Patel-Hett S, Battinelli E, Zaslavsky A, Short S, et al. Angiogenesis is regulated by a novel mechanism: pro-and antiangiogenic proteins are organized into separate platelet alpha granules anddifferentially released. Blood 2008;111:1227–1233. doi: 10.1182/blood-2007-09-113837.
- Гавриленко Т.И., Рыжкова Н.А., Пархоменко А.Н. Сосудистый эндотелиальный фактор роста в клинике внутренних заболеваний и его патогенетическое значение. Український кардіологічний журнал 2011;(4):86–95 .
- Захарова Н.Б., Вараксин Н.А., Терешкина Н.Е. Тарасова Ю.В., Шатылко Т.В., Дружинина Ю.В. и др. Концентрация фактора роста эндотелия сосудов в крови практически здоровых лиц зависит от возраста. Новости Вектор-Бест: информационный бюллетень 2014; 71 (1):11–5.
- Zachary I, Mathur A, Yla-Herttuala S, Martin J. Vascular protection: a novel nonangiogenic cardiovascular role for VEGF. Arterioscler Thromb Vasc Biol 2000; 20(6): 12–20.
- Герштейн Е.С., Кушлинский Д.Н., Дегтярь В.Г. Фактор роста эндотелия сосудов как основной регулятор ангиогенеза и клинически значимый показатель при различных злокачественных новообразованиях. Технологии живых систем 2013;10:18-33.
- Глыбочко П.В., Дурнов Д.А., Понукалин А.Н., Захарова Н.Б., Блюмберг Б.И., Россоловский А.Н. Диагностическое значение метаболического онкомаркера TuM2Pk и фактора роста эндотелия сосудов в стадировании опухолевого процесса при раке почки. Медицинский вестник Башкортостана 2011; 6(2):234-239.
- Глыбочко П.В., Шахпазян Н.К., Понукалин А.Н., Захарова Н.Б. Молекулярные маркеры в диагностике мышечно-неинвазивного рака мочевого пузыря. Клиническая лабораторная диагностика 2011;5:16–20.
- Понукалин А.Н., Попков В.М., Захарова Н.Б., Михайлов В.Ю. Онкомаркеры в диагностике стадии инвазии рака мочевого пузыря. Медицинский вестник Башкортостана 2013;8(2):213–7.
- Попков В.М., Понукалин A.H., Захарова Н.Б. Фактор роста эндотелия сосудов в диагностике метастазов мышечно-инвазивного рака мочевого пузыря. Онкоурология 2016;12(2):53-7.
- Попков В.М., Захарова Н.Б., Понукалин А.Н., Тонкошкур А.Н. Диагностическая значимость биомаркеров ангиогенеза и воспаления у пациентов с заболеваниями простаты. Саратовский научно-медицинский журнал. 2016;12(4): 593-9.
- Захарова Н.Б., Понукалин А.Н., Скрипцова С.А. Перспективы применения биомаркера "фактор роста эндотелия сосудов" при прогнозировании исходов лечения рака мочевого пузыря. Саратовский научно-медицинский журнал 2018; 14(2): 268-72.
- Щербаков А.М., Герштейн Е.С., Короткова Е.А., Овчинникова Л.К., Овсий О.Г., Ермилова В.Д., и др. Белки-регуляторы эпителиально-мезенхимального перехода и некоторые компоненты VEGF-сигнального пути в опухолях молочной железы. Бюллетень экспериментальной биологии и медицины 2015;160 (12): 773-8.
- Трапезникова М.Ф., Глыбин П.А., Морозов А.П., Кылычбеков М.Б., Кушлинский Н.Е. Ангиогенные факторы при почечно-клеточном раке. Онкоурология 2008;(4):82-87.
- Shariat SF, Semjonow A, Lilja H, Savage C, Vickers AJ, Bjartell A. Tumor markers in prostate cancer I: blood-based markers. Acta Oncologica 2011;50(Suppl 1): 61–75. doi: 10.3109 / 0284186X.2010.542174.
- Никольский Ю.Е., Москалева А.В. Программа для оценки состояния почки пациента на наличие рака. URL: http://www1.fips.ru/iiss/document. xhtml?faces-redirect=true&id=96bdccaa276ac698e32c6deb47d89a2e







