Эпителий мочевого пузыря представляет собой не просто защиту от инфекции, но также является специализированной тканью, регулирующей ком плексные функции мочевого пузыря и играющий активную роль в патогенезе многих болезней мочевого пузыря [1]. Уротелий имеет две основ ные функции [2]:
- «афферентную функцию», которая информирует центральную нервную систему о местных стимулах и, сле довательно, участвует в контроле рефлекса мочеиспуска ния, боли и модулирования кардиоваскулярного рефлекса;
- «эфферентная» или паракринная функция, кото рая связана с высвобождением медиаторов, таких как субстанция Р и тахикинины, провоцируя сокращение гладких мышц и локальное воспаление.
Наиболее поверхностный слой уротелия состоит из т.н. зонтичных клеток, которые являются высоко специа лизированными. Поверхность зонтичных клеток, обра щенная в просвет мочевого пузыря покрыта уропла кинами, лектинами и гликозаминогликановой (ГАГ) ли нией. Сочетание этих компонентов известно как гликока ликс. Вместе с зонтичными клетками гликокаликс фор мирует протективный барьер. Гликозаминогликановый слой состоит из отрицательно заряженных полисахаридов. ГАГ-слой связывает воду, превращая ее в гель, при помощи процесса, известного как электростатический захват. В ре зультате формируется буфер между токсичными компо нентами мочи и клетками уротелия. Таким образом, ГАГ-слой является передним краем «обороны» уротелия [3,4]. Тонкая линия ГАГ действует как неспецифический антиадгезивный фактор и неспецифический механизм за щиты против инфекции и имеющихся в моче веществ (на пример, мочевины и калия). ГАГ являются длинными, линейными и крайне отрицательно заряженными гетеро генными полисахаридами, состоящими из различного числа повторяющихся дисахаридных единиц [1]. Имеется два главных типа ГАГ: несульфатированных ГАГ – это гиа луроновая кислота (ГК) и сульфатированных ГАГ: гепарин сульфат и гепарин, хондроитин сульфат, дерматан сульфат и кератан сульфат. За исключением гиалуроновой кислоты ГАГ обычно ковалентно прикрепляются к ядру протеина, формируя общую структуру, которая называется протео гликан [5]. Имеются строгие доказательства того, что раз личные хронические воспалительные заболевания моче вого пузыря, такие как рецидивирующая инфекция ниж них мочевых путей, химический или радиационный ци стит, синдром болезненного мочевого пузыря/интерсти циальный цистит (СПМП/ИЦ) могут быть связанными одинаковыми патофизиологическими изменениями. Пер вый шаг в развитии этих заболеваний связан с потерей гли козаминогликанов слизистой оболочки мочевого пузыря [6]. Каскад событий, начинающихся от повреждения ГАГ линии, который не может быть излечен, может вести к хро ническому повреждению эпителия мочевого пузыря и нейрогенному воспалению [7]. К повреждению защитного слоя слизистой оболочки мочевого пузыря и ГАГ-барьера в частности, могут приводить самые различные факторы.
Среди них выделяют [8]:
- аутоиммунные заболевания;
- нейрогенное воспаление;
- дисфункцию мышц тазового дна;
- хронические бактериальные инфекции;
- химические факторы;
- некоторые лекарственных препараты (например, внутрипузырное введение вакцины БЦЖ);
- ионизирующее излучение;
- радиация;
- травмы.
Основными причинами повреждения ГАГ-слоя при хроническом бактериальном цистите являются: разруше ние гиалуронидазой, токсинами, продуцируемыми уропа тогенными штаммами микроорганизмов (E.Coli, Klebsiella pneumonia, E.faecalis и др.); генетическая предрасположен ность и снижение уровня эстрогенов у женщин в постме нопаузе.
Потеря водонепроницаемой функции уротелия поз воляет как нормальным, так и аномальным (т.е. метаболи там цитотоксических препаратов или токсическим субстанциям, экскретирующимся с мочой) компонентам приходить в прямой контакт с субэпителиальной линией, вызывая воспаление и замедленное заживление повреж денной уротелиальной и ГАГ-линии. Активация пептид содержащих волокон в субуроэпителии, которые являются ответственными за нейрональную гиперчувствительность, ведут к аллодинии с увеличением частоты мочеиспуска ния, ноктурии, неотложности позывов и боли во время мо чеиспускания. В соответствии с этой теорией раннее восстановление ГАГ линии либо препаратами гиалуроно вой кислоты, либо хондроитин сульфата поможет избе жать хронической эволюции воспаления в мочевом пузыре. Восстановление ГАГ линии становится необходи мым видом лечения при хроническом цистите и болезнен ном мочевом пузыре/интерстициальном цистите.
РЕЦИДИВИРУЮЩАЯ ИНФЕКЦИЯ МОЧЕВЫХ ПУТЕЙ (РИМП)
РИМП определяется, если отмечено 2 случая ИМП в течение 6 мес. или 3 случая цистита в течение года [9]. Ча стота рецидивирующего цистита оценивается как 20% от всех случаев ИМП [10].
Патогенез хронической, рецидивирующей инфекции мочевых путей, вызванной уропатогенной кишечной па лочкой (UPEC) – основного возбудителя ИМП, включает [11]:
- колонизацию UPEC периуретральной и вагиналь ной областей с колонизацией уретры;
- восхождение в просвет мочевого пузыря и рост в виде планктонных клеток в моче;
- адгезию к поверхности и взаимодействие с за щитной системой эпителия мочевого пузыря;
- формирование биопленок;
- инвазию и репликацию путем формирования внутриклеточных бактериальных сообществ (ВБС) в сли зистой мочевого пузыря, где создаются покоящиеся внут риклеточные резервуары (ПВР) – живут в подлежащих слоях уротелия;
- колонизацию почки и повреждение ткани хо зяина с увеличением риска бактериемии/сепсиса (≤1%).
В настоящее время применяются различные ме тоды ведения пациентов с РИМП: это и поведенческие меры (уменьшение сексуальной активности; уменьше ние применения спермицидов; мочеиспускание и под мывание после коитуса; подмывание «спереди-назад»; обильное питье) и длительная низкодозовая антимик робная терапия (но она способствует селекции анти биотикорезистентных штаммов возбудителей мочевой инфекции и нежелательным побочным действиям ан тимикробных препаратов); посткоитальная антимик робная профилактика и интермиттирующие курсы самолечения. В настоящее время, в связи с быстрым ро стом антибиотикорезистентных штаммов возбуди телей мочевой инфекции предпочтение отдается не микробным методам профилактики рецидивов инфек ции [12]:
- местное применение эстрогенов;
- фитопрепараты: золототысячник, любисток, роз марин;
- препараты клюквы (проантоцианидины);
- пробиотики (L. rhamnosus, L. reuteri, L. crispatus);
- иммунопрофилактика (иммунопрепараты: лио филизированный бактериальный лизат 18 штаммов ки шечной палочки);
- внутрипузырные инстилляции препаратов гиа луроновой кислоты, хондроитин сульфата.
Повреждение ГАГ линии уротелия может способ ствовать бактериальной адгезии и развитию инфек ционно-воспалительного процесса [13]. Введение в мочевой пузырь препаратов гиалуроновой кислоты и хондроитин сульфата оказывает значительное положи тельное влияние на частоту эпизодов инфекции нижних мочевых путей у женщин с рецидивирующей инфекцией. Инстилляция гиалуроновой кислоты является приемле мой и перспективной терапевтической альтернативой у пациентов с РИМП.
ХОНДРОИТИН СУЛЬФАТ
Хондроитин сульфат (ХС), является веществом, которое естественно возникает в слое ГАГ мочевого пу зыря. Лечение хондроитин сульфатом, как полагают, по полняет дефицит хондроитина сульфата в ГАГ и помогает предотвратить проникновение раздражителей из мочи в стенку мочевого пузыря. Исследования показали, что хондроитин сульфат эффективен и хорошо пе реносится. Его применяют не только при интерстици альном цистите, но также при радиационном цистите, химически индуцированном цистите, гиперактивном мочевом пузыре и хроническом бактериальном цистите [14]. Эффективность внутрипузырных инстилляций хондроитин сульфата доказана при введении один раз в неделю на протяжении 4-х недель и далее один раз в месяц на протяжении 12 месяцев. Положительные ре зультаты получены у 73,1% пациентов, максимальный эффект отличен после 4-6 месяцев инстилляций. Под держивающие инстилляции 2% раствором были более эффективны, чем 0,2% [15]. H. Madersbacher и соавт., проведя обзор 27 клинических исследований по воспол нению GAG линии при внутрипузырных введениях хондроитин сульфата пациентам с разной этиологией цистита, отметил, что 2 плацебо контролируемых иссле дования с гиалуроновой кислотой показавшие неудачу в лечении не были опубликованы [16]. В одном опубли кованном рандомизированном клиническом исследова нии было показано, что хондроитин сульфат 0,2% имел очевидную пользу для пациентов с гиперактивным мочевым пузырем. Тогда как в другом исследовании с 2,0% хондроитин сульфатом не получено статистически значимых доказательств. Таким образом, более пред почтителен 0,2% раствор хондроитин сульфата для внутрипузырных инстилляций.
ГИАЛУРОНОВАЯ КИСЛОТА (ГИАЛУРОНАТ НАТРИЯ)
Гиалуроновая кислота (ГК) это высокополимер ный неразветвленный (линейный) гликозамингликан, состоящий из N-ацетил-β-D-глюкозамина и β-D-глю куроновой кислоты, соединенных между собой 1→3 и 1→4 О-гликозидными связями соответственно [17,18].
Гиалуроновая кислота член семейства гликоза мингликанов, в которое также входит хондроитин сульфат, дерматин сульфат и гепарин сульфат, но в от личие от других гликозамингликанов гиалуроновая кислота не содержит сульфатной группы и не связана ковалентно с белками. В лечебных целях, как правило используют не саму гиалуроновую кислоту, а получае мую после ее щелочной экстракции соль, чаще всего гиалуронат натрия.
Биологические функции ГК зависят от ее молеку лярного веса. Молекулярная масса гиалуроновой кис лоты зависит от количества повторов дисахаридного фрагмента и может составлять от 2 кДа до 10000 кДа. Как правило, разделяют низкомолекулярную (<500 кДа) и высокомолекулярную (>500 кДа) ГК. Классифи кация эта весьма условна и основана на том факте, что в организме человека молекулярная масса ГК в основ ном более 1000 кДа. [19]. Высокомолекулярная ГК (>500 кДа) заполняет пространство, обладает антиангиогенными и иммуносупрессивными свойствами. ГК средней молекулярной массы (20–500 кДа) участвует в регуля ции овуляции, эмбриогенеза и способствует заживле нию ран. Низкомолекулярная ГК (6-20 кДа), напротив, оказывает ангиогенное и провоспалительное действие. ГК с очень малым весом (0,4-4 кДа) обладает антиапоп тотическими свойствами и стимулирует синтез белков теплового шока.
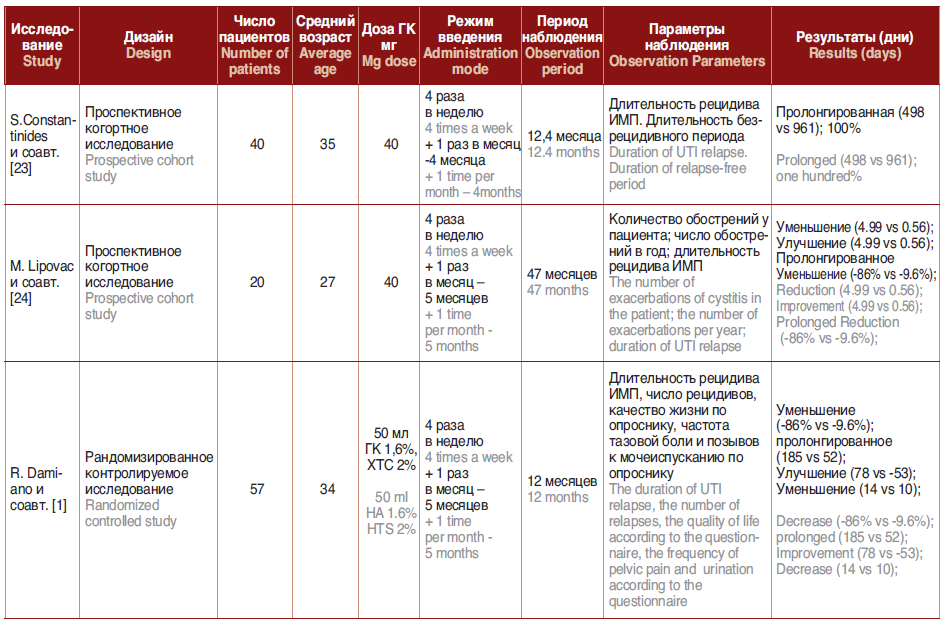
Исходно ГК выделяли из органов и тканей живот ных, однако в последнее время все большее распростра нение получают генно-инженерные методы [20]. Наибо лее широко используемым методом является получение ГК в результате культивации патогенного микроорга низма Streptococcus zooepider. ГК, также называемая гиа луронатом натрия, одно из естественно встречающихся веществ в слое гликозаминогликана или ГАГ, стенки мочевого пузыря и всей соединительной ткани [21]. ГК пополняет основу ГАГ, связывая молекулы ГАГ слоя, об разуя непроницаемый барьер. Также улучшает синтез ГАГ и снижает уровень воспалительных цитокинов. Гиалуронат натрия является природным протеоглика ном, восстанавливающим дефекты ГАГ-слоя мочевого пузыря. О положительных результатах инстилляций гиалуроната натрия на 4-й неделе терапии сообщали 56% пациентов и 71% – на 7-й неделе [22]. Имеется не сколько последних исследований, доказывающих эф фективность внутрипузырной инстилляции препаратов ГК и ХС при профилактике рецидивов цистита (табл. 1).
C. Constantinides и соавт. подтвердили уменьшение уровня рецидивов ИМП за счет восполнения ГАГ линии. Они показали значительное уменьшение в уровне ИМП у пациентов, как в количестве обострений в год (с 4,3 до 0,3; р<0,001), так и увеличении среднего времени до рецидива ( с 96 до 498 дней; р<0,001) после внутрипузырных инстилляций ГК у 40 женщин с РИМП [23]. M. Lipovac и соавт. оценили эффективность 9 внут рипузырных инстилляций ГК в течение 6 месяцев у 20 женщин с РИМП. Их состояние оценивали проспек тивно, но сравнивали с ретроспективным обзором ам булаторных карт пациентов. Количество обострений инфекции в год на 1 пациента значительно уменьшилось (с 4,99± 0,92 до 0,56±0,82; р<0,001) и значительно увели чился безрецидивный период ( с 76,7± 24,6 до 178,3± 25,5 дней; р>0,001). Около 65% пациентов до конца исследо вания не испытывали обострений (47,6 недель). В про тивовес традиционной антибактериальной терапии,целью которой является эрадикация патогенов, лечение ГК, ХС ставит целью уменьшение бактериальной адге зии к слизистой мочевого пузыря, предполагая, что по врежденная ГАГ линия облегчает бактериальную адге зию и рецидив ИМП, а восстановление ГАГ-линии спо собно предотвратить адгезию [24].
Таблица 1. Сравнительный анализ исследований, доказывающих эффективность внутрипузырной инстилляции препаратов гиалуроновой кислоты и хондроитин сульфата при профилактике рецидивов цистита
Table 1. Comparative analysis of studies proving the effectiveness of intravesical instillation of hyaluronic acid and chondroitin sulfate preparations in the prevention of relapse of cystitis
В диссертации П.Л. Хазана показано, что у пациен ток с тремя нозологическими формами хронического ци стита (рецидивирующий бактериальный цистит, ИЦ и хронический цистит у пациенток в постменопаузе) име ется несостоятельность ГАГ слоя мочевого пузыря, что приводит к нарушению антиадгезивных и барьерных свойств уротелия. В эксперименте доказана безопасность и высокая эффективность гиалуроната цинка как агента способного восполнить дефицит ГАГ в стенке мочевого пузыря при бактериальном и интерстициальном цистите. Доказана высокая (83,3%) клинико-морфологическая эф фективность и безопасность внутрипузырного примене ния гиалуроната цинка при лечении пациенток с хроническим рецидивирующим бактериальным цисти том, пациенток с рецидивирующим циститом в постме нопаузе и у больных с интерстициальным циститом [25].
ИНТЕРСТИЦИАЛЬНЫЙ ЦИСТИТ
Одна из теорий возникновения хронического ин терстициального цистита – это разрушение защитного мукополисахаридного слоя мочевого пузыря. В эпите лии мочевого пузыря при ИЦ обнаруживается много макрофагов, а в моче – веществ, которые выделяют туч ные клетки и которые вызывают воспаление и боль (IL 6, NGF, гистамин). Также известно, что макрофаги могут выделять гиалуронидазу и глюкуронидазу – фер менты, которые разрушают ГК. Этот процесс называ ется дегрануляцией тучных клеток [26].
Разрушение защитного слоя влияет на проницае мость клеток эпителия и делает их уязвимыми к воздей ствию веществ и токсинов, которые присутствуют в моче. В результате возникает воспаление субэпителиального слоя, которое препятствует восстановлению молекул ГАГ и защитных свойств. Кроме того, происходит постоянное воздействие на нервные волокна, которые отвечают за ре гуляцию рефлексов мочеиспускания, обеспечивают боле вую чувствительность, а также иннервируют гладкие мышцы мочевого пузыря и стимулируют выброс гиста мина тучными клетками. Гиперчувствительность нерв ных окончаний способствует развитию нейрогенного воспаления и дополнительно воздействует на централь ную нервную систему, приводит в действие механизмы, которые способствуют закреплению и усилению описан ных эффектов. Все эти изменения приводят к развитию специфических симптомов, например, никтурии, посто янной боли, увеличению частоты мочеиспускания и др. По мнению ряда авторов, эффективно устранить данные проявления можно лишь в том случае, если обеспечить раннее восстановление защитного слоя при помощи эн догенных препаратов, вводимых внутрь мочевого пузыря [27,28]. Преимуществом внутрипузырного введения пре паратов является создание более высокой концентрации действующего вещества в очаге поражения, чем в случае перорального приема, при минимуме побочных эффек тов. Недостатками являются необходимость катетериза ции, которая при интерстициальном цистите может быть болезненной и есть риск развития инфекционных ослож нений. Препараты, используемые для внутрипузырной инстилляции, могут применяться как отдельно, так и в сочетании с другими активными веществами. При ин стилляциях используют стероиды, антибиотики, диме тилсульфоксид (ДМСО), гепарин, болеутоляющие средства, гиалуроновую кислоту или ХС [29]. В Руковод стве Европейской урологической ассоциации (ЕАУ) 2019 года отмечается, что ГК и ХС восстанавливают дефекты ГАГ-линии у больных с болезненным мочевым пузырем, но исследования, доказывающие это, были неконтроли руемые и с малым количество пациентов [30]. Имеются разногласия в составе компонентов препаратов, дозах, концентрациях. Недавний мета-анализ подтвердил полез ность восстановления ГАГ-линии, однако большинство найденных работ были нерандомизированными и с недо статочным количеством пациентов [31]. У пациентов с ре цидивирующим циститом, ИЦ, гиперактивным мочевым пузырем, лучевым циститом проведено 27 исследований, однако никаких заключений ЕАУ не делает, отмечая не обходимость широкомасштабных исследований [1,16]. E.B. Kallestrup и соавт. опубликовали результаты 3-х лет него наблюдения за пациентами с ИЦ, которые получали инстилляции гиалуроната натрия в течение 3-х месяцев. Положительный долговременный эффект демонстриро вали 2/3 пациентов. ГК была эффективна в снижении ча стоты мочеиспускания и боли [32]. Еще одно исследова ние показало аналогичные результаты инстилляций ГК. Участники получали еженедельные инстилляции 40 мг гиалуроната натрия (50 мл 0,08% раствора) в течение 10 недель. 50% респондентов сообщили о полной ремиссии без дополнительной терапии, а 41,7% – об улучшении после повторного курса лечения [30]. Своевременные ин стилляции ГК могут привести к уменьшению или полной ремиссии симптомов у части пациентов с СБМП/ИЦ, в то время как некоторым респондентам необходима непре рывная внутрипузырная терапия [33]. Различные авторы пришли к выводу, что еженедельные инстилляции моче вого пузыря защищали мочевой пузырь, уменьшали ра диационную токсичность и риск заражения, а также сокращает задержки в плановой лучевой терапии и хи миотерапии [34,35]. Внутрипузырные инстилляции с ГК являются эффективным вариантом лечения пациентов с геморрагическим циститом, вызванных лучевой тера пией. В результате использования этих препаратов кро вотечение из стенки мочевого пузыря значительно уменьшилось, интенсивность тазовой боли и частота срочного мочеиспускания уменьшились, при отсутствии побочных реакций. Положительный эффект терапии со хранялся в течение, как минимум, 12 месяцев [36]. В ран домизированном исследовании 2014 года применение натрия гиалуроната 120 мг/50 мл оказывается столь же эф фективным, как и комбинированное лечение для сниже ния симптомов у пациентов с СБМП/ИЦ [37]. Другие исследования также показали положительные результаты при применении препарата с ГК 120 мг на 50 мл [38]. Од новременное применение ГК и ХС показало многообе щающие результаты [38]. Внутрипузырная инстилляция ГК и ХС более эффективна, чем долгосрочная антибиоти копрофилактика для предотвращения рецидивирующего бактериального цистита [39,40]. Защита уротелия или бы строе восстановление ГАГ-слоя является показанием для клинического использования внутрипузырных инстилля ций гиалуроната натрия с ХС. Использование эндогенных гликозаминогликанов для лечения пациентов с постлуче вым циститом также оказалось оправданным. Результаты исследований говорят о том, что данный метод способ ствует снижению частоты мочеиспускания, устранению никтурии и улучшению качества жизни. Всего к настоя щему времени проведено несколько десятков исследова ний, в которых принимало участие более 1000 пациентов с различными хроническими заболеваниями мочевыво дящих путей. Подавляющее большинство авторов под твердили эффективность и безопасность терапии препаратами ГК и ХС [41]. Существенным недостатком всех существующих внутрипузырных инстилляций яв ляется недостаточная продолжительность действия – после первого, максимум второго мочеиспускания пре парат выводится из мочевого пузыря. В связи с этим, ве дется поиск способов пролонгации действия внутри пузырных инстилляций ГК и ХС. Последние несколько лет велись работы над технологией продления действия ГК при помощи термопластичного полимера (поллокса мера). Поллоксамер Kolliphor P 480 имеет жидкую кон систенцию при температуре до 8°С, при нагреве становится более вязким. В мочевом пузыре темпера тура около 38°С и при такой температуре поллоксамер демонстрирует максимальную вязкость и адгезию к уро телию. Комбинация гиалуроната натрия и Kolliphor P480 для внутрипузырного применения получила торговое наименование «Уролайф». Разумеется, пролонгирован ное действие препарата in vitro вовсе не означает более высокую эффективность in vivo [42]. В.В. Протощак про вел сравнительную оценку проникающей способности лекарственных средств в ткани изолированной стенки мочевого пузыря свиньи и человека при использовании пассивной диффузии и эффектов постоянного тока – электрофореза, электроосмоса и электропорации. Опре делены эффекты совместного использования в одном растворе веществ-пенетрантов и лекарственных препа ратов. Им сконструированы, испытаны и предложены к применению в клинике не имеющие аналогов ориги нальные внутренние (уретральный катетер) и наружные электроды для электрофоретического введения лекарст венных препаратов непосредственно в слизистую моче вого пузыря со стороны его полости. Анатомически обусловленное использование разработанных изделий позволило сократить путь движения молекул лекарств, миновав кожу, подкожно-жировую клетчатку, мышцы и фасции при введении с прокладок наружных электродов и создать большую, клинически эффективную концент рацию препарата в пораженных патологическим процес сом тканях органа, по сравнению с пассивной диф фузией при внутрипузырной инстилляции. Разработана методика проведения процедуры внутрипузырного ле карственного электрофореза в лечении хронических воспалительных, нейрогенных и неопластических забо леваний мочевого пузыря [43].
ЗАКЛЮЧЕНИЕ
На сегодняшний день получены убедительные на учные данные, свидетельствующие о том, что поврежде ние уротелиального барьера лежит в основе развития некоторых хронических заболеваний мочевого пузыря, среди которых СБМП/ИЦ, инфекционные поражения, а также химический и радиационный цистит. Данные на рушения в прошлом рассматривались как обособленные нозологические формы. Однако в настоящее время они могут расцениваться как следствие нарушения защит ного слоя слизистой мочевого пузыря, образованного гликозаминогликанами. Применение нового подхода к изучению заболеваний, вызванных нарушением ГАГ барьера, позволит разработать более эффективные ме тоды лечения хронических заболеваний мочевого пузыря. В настоящее время продолжается активный на учный поиск оптимальных субстанций для внутрипу зырной терапии разных форм хронического цистита, а также перспективных способов их доставки, обеспечи вающих стойкий и длительный терапевтический эф фект.
ЛИТЕРАТУРА
- Damiano R, Cicione A. The role of sodium hyaluronate and sodium chondroitin sulphate in the management of bladder disease. er Adv Urol 2011;3(5):223–232. doi: 10.1177/1756287211418723.
- Arms L, Vizzard MA. Neuropeptides in lower urinary tract function. Handb Exp Pharmacol 2011;(202):395-423. doi: 10.1007/978-3-642-16499-6_19.
- Раствор «Уролайф». URL: http://urolife.info/flacon/[«Urolife» solution. URL: http://urolife.info/flacon/. (In Russian)].
- Сравнительная эффективность восстановления гликозаминогликанового слоя мочевого пузыря внутрипузырная терапия гиалуронатом натрия («уролайф») и комбинация внутрипузырной тера пии гиалуронатом натрия с пероральным приемом хондроитинсульфата. URL: http://urolife.info/ for_doctors/sravnitelnaya-effektivnost-vosstanovleniya-glikozaminoglikanovogo-sloya-mochevogopuzyrya vnutripuzy. [Comparative efficacy of the recovery of the glycosaminoglycan layer of the bladder intravesical therapy with sodium hyaluronate (“urolife”) and the combination of intravesical therapy with sodium hyaluronate with oral chondroitin sulfate]. URL: http://urolife.info/for_doctors/sravnitelnaya-effektivnost vosstanovleniya-glikozaminoglikanovogo-sloya-mochevogo-puzyrya-vnutripuzy. (In Russian)].
- Lilly JD, Parsons CL. Bladder surface glycosaminoglycans is a human epithelial permeability barrier. Surg Gynecol Obstet 1990;171(6):493-496.
- Apodaca G. The Uroepithelium: Not just a passive barrier. Тraffic 2004;5:117–128. doi: 10.1046/ j.1600-0854.2003.00156.x.
- Geppetti P, Nassini R, Materazzi S. Benemei S. The concept of neurogenic inflammation. BJU Int 2008;101(Suppl. 3):2-6. doi: 10.1111/j.1464-410X.2008.07493.x.
- Эффективность комбинированной терапии хронического цистита внутрипузырными инстилля циями гиалуроната натрия и пероральным приемом хондроитинсульфата. URL: http://urolife.info/articles/ effectivnost-terapii/. [The effectiveness of combination therapy of chronic cystitis by intravesical instillation of sodium hyaluronate and oral chondroitin sulfate. URL: http://urolife.info/articles/effectivnostterapii/. (In Russian)].
- Prevention of recurrent urogenital tract infections in adult women // in the book: “Urogenital Infections [Ed. Naber K, Shaeffer A, Heyns C, Matsumoto T, Shoskes D, Bjerlund Johansen T]. International Consultation on Urogenital Infections, Stockholm, Sweden, March, 2009, EAU, p. 235-288. doi: 10.5680/lhuii000005.
- Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Am J Med 2002;113(Suppl. 1A):5S-13S.
- Terlizzi M, Gribaudo G, Maffei M. UroPathogenic Escherichia coli (UPEC) infections: virulence factors, bladder responses, antibiotic, and non-antibiotic antimicrobial strategies. Front Microbiol 2017;8:1566. doi: 10.3389/fmicb.2017.01566. eCollection 2017.
- Перепанова ТС, Козлов РС, Руднов ВА, Синякова ЛА Федеральные клинические рекомендации «Антимик робная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов», Москва, 2017, 70 с. [Perepanova TS, Kozlov RS, Rudnov VA, Sinyakova LA Federal clinical guidelines "Antimicrobial therapy and prevention of infections of the kidneys, urinary tract and male genital organs". M.: 2017, 70 p. (In Russian)].
- Parsons CL Тhe therapeutic role of sulfated polysaccharides in urinary bladder. Urol Clin North Am 1994;21:93-100.
- Инфекции и воспаления в урологии [под ред. П.В.Глыбочко, М.И. Когана, Ю.Л. Набока] М.: 2019, C. 424-430. [Infections and inflammations in urology. Edit. P.V.Glybochko, M.I. Kogan, YU.L. Naboka. M.: 2019, P. 424-430. (In Russian)].
- Интерстициальный цистит: консервативное лечение. URL: http://urolife.info/for_doctors/interstitsialnyy tsistit-konservativnoe-lechenie/. [Interstitial cystitis: conservative treatment]. URL: http://urolife.info/ for_doctors/interstitsialnyy-tsistit-konservativnoe-lechenie/. (In Russian)].
- Madersbacher H, van Ophoven A, van Kerrebroeck PE. GAG layer replenishment therapy for chronic forms of cystitis with intravesical glycosaminoglycans--a review. Neurourol Urodyn 2013;32(1):9-18. doi: 10.1002/nau.22256.
- Федорищев И.А. Гиалуроновая кислота: монография. Книга 1. Тула: ТулГУ, 2011. 237 с. [Fedorishchev I.A. Hyaluronic acid: a monograph]. Kniga 1. Tula: TulGU, 2011. 237 p. (In Russian)].
- Saranraj P, Naidu MA. Hyaluronic Acid Production and its Applications – A Review. IJPBA 2013;4(5):853-859.
- Maharjan AS, Pilling D, Gomer RH. High and low molecular weight hyaluronic acid differentially regulate human fibrocyte differentiation. PLoS One 2011;6(10):e26078. doi: 10.1371/journal.pone.0026078.
- Boeriu CG, Springer J, Kooy FK, Lambertus AM van den Broek, Eggink G. Production methods for hyaluronan. J Carbohyd Chem 2013;2013(Article ID 624967): 14 p. URL:http://dx.doi.org/10.1155/2013/624967.
- International Painful Bladder Foundation. Interstitial cystitis and the painful bladder. URL: http://www.painful-bladder.org/pdf/IPBF; 20Publ; 2004; 20UK.pdf.
- Morales A, Emerson L, Nickel JC. Intravesical hyaluronic acid in the treatment of refractory interstitial cystitis. J Urololy 1997;49(5A Suppl):111-3.
- Constantinides C, Manousakas T, Nikolopoulos P, Stanitsas A, Haritopoulos K, Giannopoulos A. Prevention of recurrent bacterial cystitis by intravesical administration of hyaluronic acid: a pilot study. BJU Int 2004; 93: 1262-1266.
- Lipovac M, Kurz C, Reithmayr F, Verhoeven HC, Huber JC, Imhof M. Prevention of recurrent bacterial urinary tract infections by intravesical instillation of hyaluronic acid. Int J Gynaecol Obstet 2007;96(3):192-195. doi: 10.1016/j.ijgo.2006.11.025.
- Хазан П.Л. Современный подход к медикаментозной терапии хронического цистита: дис. … канд. мед. наук, М., 2010, 207 с. [Khazan P.L. Modern approach to drug therapy for chronic cystitis]. Cand.Med.Sci [dissertation. М.: 2010, 207 p. (In Russian)].
- Arms L, Vizzard MA. Neuropeptides in lower urinary tract function. Handb Exp Pharmacol, 2011;(202):395-423. doi: 10.1007/978-3-642-16499-6_19.
- Применение экзогенных гликозаминогликанов при хронических заболеваниях мочевого пузыря. URL: http://urolife.info/for_doctors/primenenie-ekzogennykh-glikozaminoglikanov-pri-khronicheskikhzabolevaniyakh mochevogo-puzyrya/. [The use of exogenous glycosaminoglycans in chronic diseases of the bladder. URL: http://urolife.info/for_doctors/primenenie-ekzogennykh-glikozaminoglikanov-prikhronicheskikh zabolevaniyakh-mochevogo-puzyrya/. (In Russian)].
- Marshall K. Interstitial cystitis: understanding the syndrome. Altern Med Rev 2003; 8)4):426-437.
- Интерстициальный цистит: консервативное лечение. URL: http://urolife.info/for_doctors/interstitsialnyy tsistit-konservativnoe-lechenie/. [Interstitial cystitis: conservative treatment. URL: http://urolife.info/ for_doctors/interstitsialnyy-tsistit-konservativnoe-lechenie/. (In Russian)].
- European Association of Urology. Urological Infections. Guidelines, 2019 edition. URL: https://uroweb.org/guideline/urological-infections/.
- Pyo JS, Cho WJ. Systematic review and meta-analysis of intravesical hyaluronic acid and hyaluronic acid/chondroitin sulfate instillation for interstitial cystitis/painful bladder syndrome. Cell Physiol Biochem 2016;39(4):1618-25. doi: 10.1159/00044786.
- Kallestrup EB, Jorgensen SS, Nordling J, Hald T. Treatment of interstitial cystitis with Cystistat®:a hyaluronic acid product. Scand J Urol Nephrol 2005;39(2):143-7.
- Riedl CR, Engelhardt PF, Daha KL, Morakis N, Pflüger H. Hyaluronan treatment of interstitial cystitis/painful bladder syndrome. Int Urogynecol J Pelvic Floor Dysfunct. 2008 May;19(5):717-21.
- Delgado JM, Samper P, Rivière M. Hyaluronic acid in the prevention of radiation-inducedcystitis. Presented 41st Annual Meeting of Infectious Diseases Society of America, 2003; October 9-12 San Diego, California: Poster #03-AB 242-IDSA.
- Sommariva ML, Sandri SD, Ceriani V. Efficacy of sodium hyaluronate in the management of chemical and radiation cystitis. Minerva Urol Nefrol 2010;62(2):145-150.
- Пасечников С.П., Шило В.Н. Применение гиалуроновой кислоты – эффективная опция лечения лучевого геморрагического цистита. Mедицинские аспекты здоровья мужчин 2016;20(1):42-45. [Pasechnikov S.P., Shilo V.N.. The use of hyaluronic acid is an effective treatment option for radiation hemorrhagic cystitis. Meditsinskiye aspekty zdorovya muzhchin=Medical aspects of man health 2016;20(1):42 45. (In Russian)].
- Hyacyst® (sodium hyaluronate). URL: https://www.syner-med.com/product/hyacyst.
- International Painful Bladder Foundation. Interstitial cystitis and the painful bladder. URL: http://www.painful-bladder.org/pdf/IPB.
- Cervigni M, Natale F, Nasta L, Padoa A, Voi RL, Porru D. A combined intravesical therapy with hyaluronic acid and chondroitin for refractory painful bladder syndrome/ interstitial cystitis. Int Urogynecol J Pelvic Floor Dysfunct. 2008 Jul;19(7):943-7. doi: 10.1007/s00192-008-0572-4.
- Gugliotta G, Calagna G, Adile G. Is intravesical instillation of hyaluronic acid and chondroitin sulfate useful in preventing recurrent bacterial cystitis? A multicenter case control analysis. Taiwan J Obstet Gynecol. 2015;54(5):537-40. doi: 10.1016/j.tjog.2015.03.005.
- Эффективность комбинированной терапии хронического цистита внутрипузырными инстилля циями гиалуроната натрия и пероральным приемом хондроитинсульфата. URL: http://urolife.info/articles/ effectivnost-terapii/. [The effectiveness of the combination therapy of chronic cystitis by intravesical instillation of sodium hyaluronate and oral chondroitin sulfate]. URL: http://urolife.info/articles/effectivnostterapii/. (In Russian)].
- Эйзенах И.А., Помешкин Е.В., Миркин Я.Б. Хронический бактериальный рецидивирующий ци стит, как результат уротелиальной дисфункции: сравнительная оценка эффективности внутрипу зырной терапии. Урогинекология 2015;(2), C.5-8. [Eyzenakh I.A., Pomeshkin Ye.V., Mirkin YA.B.. [Chronic bacterial recurrent cystitis, as a result of urothelial dysfunction: a comparative assessment of the effectiveness of intravesical therapy. Uroginekologiya=Uroginecology 2015;(2):5-8. (In Russian)].
- Протощак В.В. Внутрипузырная фармакотерапия воспалительных, нейрогенных и неопласти ческих заболеваний мочевого пузыря: автореф. дисс. … д-ра мед. наук, Санкт-Петербург, 2012, 48 с. [Protoshchak V.V. [Intravesical pharmacotherapy of inflammatory, neurogenic and neoplastic diseases of the bladder. Dr. Med. Sci [thesis]. Sankt-Peterburg: 2012, 48 p. (In Russian)].







