ВВЕДЕНИЕ
Термин искусственный интеллект (ИИ) относят к вычислительным технологиям, которые имитируют такие интеллектуальные процессы человека, как рассуждение, обучение, запоминание, решение проблем. ИИ – это ответвление от компьютерных наук и часть междисциплинарного подхода, объединяющий принципы математики, логики, вычислений и биологии, направленный на создание интеллектуальной машины для выполнения интеллектуальных задач человека.
В ближайшее время можно ожидать симбиоза и синергии искусственного интеллекта и телемедицинских технологий из-за того, что телемедицина будет пополнять программные алгоритмы уникальными медицинскими данными, полученными с приборов и при общении пациента с врачом. В свою очередь применение искусственного интеллекта будет способствовать более широкому внедрению в практику телемедицинских технологий, укрепляя позиции последней и среди пациентов, и среди врачебного сообщества [1, 2].
МАТЕРИАЛЫ И МЕТОДЫ
Были проанализированы публикации в базе данных PubMed и Электронной научной библиотеке России по ключевым словам «онкология», «урология», «онкоурология», «искусственный интеллект», «oncology», «urology», «cancer urology», «artificial intelligence». В PubMed из 127 статей, отвечающих запросам, было отобрано 32 публикации. В Электронной научной библиотеке по запросу «искусственный интеллект» было найдено 155968 публикаций, из них – 20464 по запросу «искусственный интеллект в медицине», по запросу «искусственный интеллект в онкологии» найдено 18 публикаций, «искусственный интеллект в урологии» – 1, «искусственный интеллект в онкоурологии» не было найдено ни одной публикации. Из русскоязычных публикаций были отобраны 3 статьи по применению ИИ в медицине.
В настоящее время описаны различные методы ИИ, включающие в себя обучение на основе существующих данных и составление прогнозов на основе невидимых:
- Метод опорных векторов (Support vector machines, SVM) – это математический метод получения функции, решающей задачу классификации. Если в пространстве разместить множество точек и разделить их плоскостью (или прямой), то в таких плоскостей будет бесконечное множество. Те точки, которые располагаются ближе к плоскости (прямой) на одинаковом расстоянии, будут считаться точками-векторами или опорными (рис. 1).
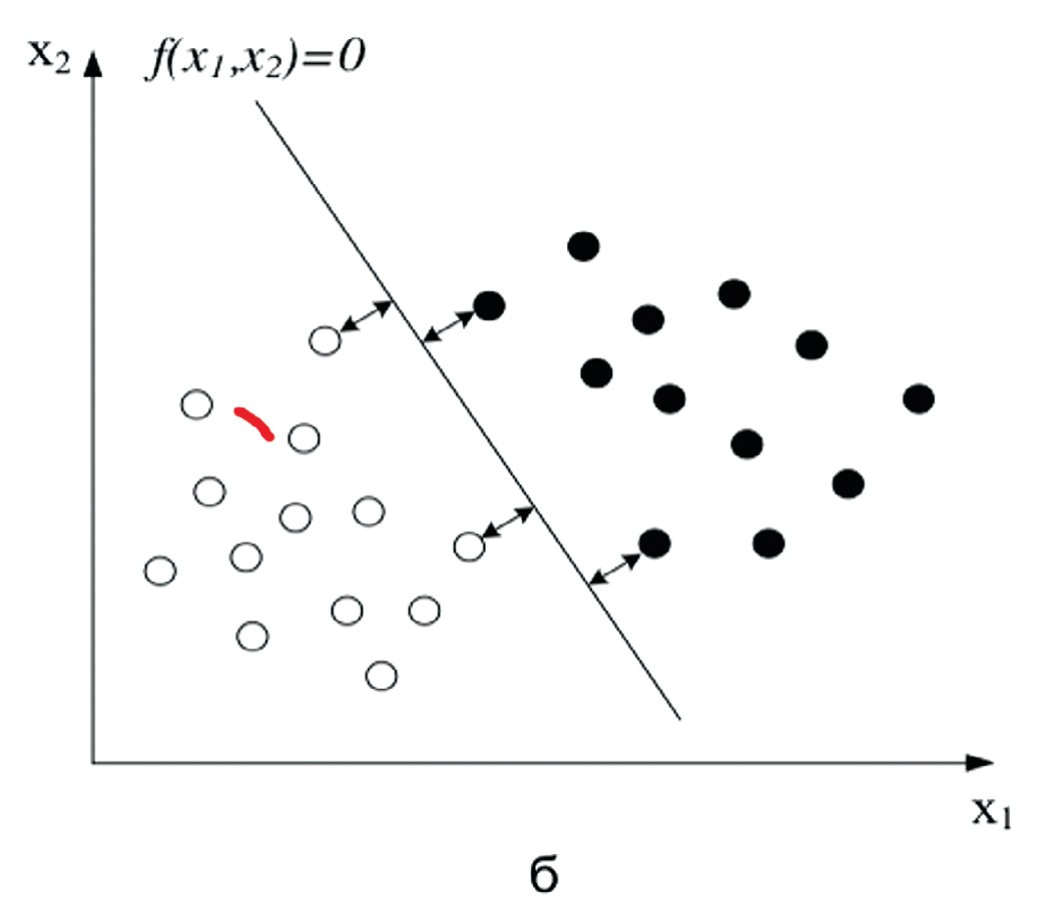
Рис. 1. Деление пространства на плоскости. Точки-векторы (опорные точки)
Fig. 1. Division of space on a plane. Points-vectors (control points)
Математики разработали эффективные алгоритмы поиска оптимальной плоскости, объединение нелинейных случаев и т.д. Данный метод оправдал себя в распознавании рукописного текста, текстовой классификации, а также разрабатываются пути его применения в сфере сетевой безопасности. В медицине эта методика применяется в диагностике опухолевых заболеваний щитовидной железы, камней почек [3].
- Текстурный анализ КТ-изображений – метод исследования, который позволяет оценивать изменение интенсивностей шкал градаций серого и положение пикселей внутри изображения;
- Алгоритм рекурсивного извлечения переменных – в программировании рекурсия – вызов функции (процедуры) из нее же самой, непосредственно (простая рекурсия) или через другие функции (сложная или косвенная рекурсия), например, функция A вызывает функцию B, а функция В – функцию A. Количество вложенных вызовов функции или процедуры называется глубиной рекурсии. Рекурсивная программа позволяет описать повторяющееся или даже потенциально бесконечное вычисление, причем без явных повторений частей программы и использования циклов;
- Байесовские сети доверия – модель, представляющая собой множество переменных и их вероятностных зависимостей;
- Нейронные сети – математическая модель, процессор, накапливающий экспериментальные знания и предоставляющий их для последующей обработки. Построены по типу биологических нейронных сетей. Представляет собой частный случай распознавания образов, дискриминантного анализа, методов кластеризации. Возможность обучения – главное преимущество нейронных сетей перед традиционными алгоритмами [4];
- Сверточная нейронная сеть – отдельная архитектура нейронных сетей, направленная на эффективное распознавание образов, входит в состав технологий глубокого машинного обучения;
- Случайный лес (Random forest) – алгоритм машинного обучения, способный обрабатывать данные с большим числом признаков и классов, нечувствительный к маштабированию, хорошо обрабатывает как непрерывные, так и дискретные признаки;
- Радиомика – в области медицины представляет собой метод, который извлекает большое количество признаков из рентгенологических медицинских изображений с использованием алгоритмов характеристики данных. Эти признаки, называемые радиомными признаками, могут раскрыть признаки заболевания, которые не могут быть оценены невооруженным глазом. Радиомика вышла из медицинской области онкологии и является наиболее продвинутым методом ИИ в этой области. Однако этот метод можно применить к любому медицинскому исследованию, в котором можно визуализировать заболевание или состояние.
ВОЗМОЖНОСТИ ИИ ПРИ ДИАГНОСТИКЕ РАКА ПОЧКИ
Заболеваемость почечно-клеточным раком (ПКР) на протяжении последних десятилетий неуклонно растет в результате случайного выявления малой ренальной массы (small renal masses, SRM) с помощью методов поперечно-срезовой визуализации [5]. В настоящее время нет клинических или рентгенологических признаков, которые точно предсказывали бы гистологию новообразования. Недавно стали использоваться алгоритмы машинного обучения для изучения сложных взаимодействий клинических и визуализационных данных для обеспечения диагностики, прогнозиро-вания, планирования лечения. В связи с ограниченностью традиционной медицинской визуализации растет интерес к радиомике, которая предполагает автоматическое извлечение количественных признаков из медицинских изображений. Радиомика может обеспечить новый подход к разработке прогностических инструментов путем корреляции признаков визуализации с такими характеристиками опухоли, как гистология, стратификация опухоли по степени злокачественности, генетические паттерны и молекулярные фенотипы [6]. Текстурный анализ, основанный на распределении пикселей в паттернах, возник как количественный метод для обнаружения некоторых различий в тканях, которые не могут быть оценены субъективно и визуально [7]. Сообщается, что особенности текстуры каким-то образом значительно связаны с лежащими в основе патологическими изменениями, такими, как гетерогенность опухоли [8]. В исследовании G. Kanapuli и соавт. определялась эффективность алгоритмов статистического реляционного машинного обучения на основе радиомных признаков, полученных при выполнении компьютерной томографии (КТ) до оперативного вмешательства, в идентификации злокачественности почечных образований. Модель показала точность 0,82, что было выше, чем при визуальном исследовании экспертами [9].
Преимущество КТ-текстурного анализа с методом опорных векторов (SVM) в диагностике почечно-клеточного рака показали H. Yu и соавт. При дифференцировке светлоклеточного рака почки с онкоцитомой AUC составила 0,93, при дифференцировке папиллярного рака почки с онкоцитомой AUC – 0,99, при дифференцировке онкоцитомы с другими опухолями AUC – 0,92. Выявлена эффективная возможность алгоритма различать светлоклеточный и папиллярный варианты рака от других опухолей с AUC 0,91 и 0,92 соответственно [10]. С помощью текстурного анализа КТ-изображений и искусственной нейронной сети L. Yan и соавт. дифференцировали ангимиолипому, светлоклеточный и папиллярный рак почки с ошибкой 0-9,3% [11]. Используя метод опорных векторов, обученный на основе текстурных особенностей, Z. Feng и соавт. получили высокую точность в дифференциальной диагностике ангиомиолипомы и почечно-клеточного рака (точность – 93,9%, чувствительность – 87,8%, специфичность – 100%, AUC – 0,955) [12].
Большое значение в диагностике почечно-клеточного рака имеет ядерная градация по Фурману, которая определяет агрессивность опухоли. На практике градация осуществляется посредством исследования материала, полученного при перкутанной биопсии почки, что ограничивает точность метода. Есть исследования, которые показывают высокую точность ядерной градации при использовании классификаторов машинного обучения. На основе текстурных особенностей на усиленных КТ-изображениях алгоритмы машинного обучения демонстрируют высокую точность (85,1%), чувствительность (91,3%), специфичность (80,6%) в выявлении светлоклеточного рака почки высокого ядерного грейда по Фурману [13].
Выделяют 16 генов, нарушения которых играют значительную роль в канцерогенезе светлоклеточного рака почки. Одним из частых генетических нарушений является ген PBRM1, который мутирует в 40-50% случаев светлоклеточного рака почки [14]. B.Kocak и соавт. используя искусственную нейронную сеть (ИНС) и алгоритмы машинного обучения, оценили потенциал текстурного анализа КТизображений для прогнозирования наличия мутаций PBRM1. ИНС в 88,2% случаев светлоклеточного рака почки правильно классифицировала мутационный статус в отношении PBRM1, а случайный лес – в 95% случаев [15].
Вышеописанные методы показали хороший результат, что требует дальнейшего развития диагностики с использованием неинвазивных визуализируемых маркеров, свидетельствующих о гистопатологическом подтипе, прогнозе и об ответе на терапию [6].
ВОЗМОЖНОСТИ ИИ ПРИ ДИАГНОСТИКЕ УРОТЕЛИАЛЬНОГО РАКА
Были рассмотрены возможности ИИ в диагностике уротелиального рака. На сегодняшний день определение степени инвазии опухоли (Т) в стенку мочевого пузыря обычно осуществляется в ходе трансуретральной биопсии мочевого пузыря. Из-за вариабельности выполнения данной операции могут быть пропущены мышечно-инвазивные опухоли мочевого пузыря. Повторные цистоскопии и биопсии мочевого пузыря в 9-49% случаев исправляют допущенные в стадировании ошибки, но данные методы ограничены своей инвазивностью, высокой стоимостью [16].
В связи с этим исследуются неинвазивные методы Т-стадирования, включая использование возможностей искусственного интеллекта. Так, Х. Xu и соавт. используя Т2-взвешенные магнитно-резонансные изображения органов малого таза 62-х пациентов с патологически подтвержденным раком мочевого пузыря, с помощью машинного обучения, а именно метода опорных векторов c использованием алгоритма рекурсивного извлечения переменных, выявили значимые 3D-текстурные признаки опухоли, на основе которых возможно определение степени инвазии опухоли в стенку мочевого пузыря. На основе выявленных признаков классификатор машинного обучения показал 87,9% точность в Т-стадировании рака мочевого пузыря [17]. S.S. Garapati и соват. на основе 76 КТ-урографий, выполненных пациентам с раком мочевого пузыря (≥ T2,
Также авторы предлагают в будущем исследовать в алгоритмах машинного обучения комбинацию визуализируемых признаков с невизуализируемыми [18]. Использование последних в алгоритмах машинного обучения в целях диагностики рака мочевого пузыря продемонстрировал C.H. Shao и соавт. на основе 87 образцов мочи, полученных от пациентов с раком мочевого пузыря, с помощью жидкостной хроматографии с масс-спектрометрией были получены профили метаболитов, которые в дальнейшем использовались для построения алгоритма машинного обучения (дерева решений). Точность данного диагностического метода в независимом тесте составила 76,6%, чувствительность – 71,9%, специфичность – 86,7% [19].
Применение искусственного интеллекта с целью прогнозирования рецидива рака мочевого пузыря показало свою целесообразность. N. Sapre и соавт. использовали алгоритм машинного обучения (метод опорных векторов) для идентификации рецидива рака мочевого пузыря посредством выявления микро-РНК мочи. Чувствительность метода составила 88%, специфичность 48%. Эффективность классификатора была наилучшей при наличии заболевания стадии Т1 (AUC=0,92) и опухоли большого объема (AUC=0,81). По мнению авторов, при использовании подобного метода частота цистоскопии в когорте была бы снижена на 30% [20]. В будущем возможно снижение затрат, связанных с цистоскопическим наблюдением, при развитии алгоритма, обученного на основе панелей микроРНК, способного профилировать мочу и выявлять рецидив рака мочевого пузыря. Машинное обучение на основе профилей экспрессии генов использовалось также при прогнозировании риска рецидива немышечно-инвазивного рака после трансуретральной резекции мочевого пузыря. В тренировочных сетах чувствительность достигала 80%, специфичность 90%, в тестовых – 71%, 67% соответственно [21].
Применение алгоритмов машинного обучения исследовалось на возможность дифференцирования высокого и низкого грейда рака мочевого пузыря. X. Zhang и соавт. на основе текстурных особенностей, полученных в результате анализа МР-изображений, обучили классификатор машинного обучения различать между собой высокий и низкий грейд рака мочевого пузыря с точностью 0,83 [22].
Имеются данные, что помимо текстурных особенностей, полученных при КТ и МРТ, с помощью методов искусственного интеллекта исследовались цистоскопические изображения. Для классификации цистоскопических находок использовалась глубокая сверточная нейронная сеть (convolutional neural network), которая обеспечивала точность в классификации свыше 99% [23]. Алгоритмы машинного обучения были использованы для создания прогностической модели рецидива и выживаемости через 1, 3, 5 лет после цистэктомии. Задаваемыми параметрами были предоперационные, операционные данные. Рецидив и выживаемость были предсказаны с чувствительностью и специфичностью более 70% [24].
Важным в лечении рака мочевого пузыря является ранняя оценка эффективности химиотерапии. E. Wu и соавт. показали эффективность в прогнозировании ответа опухоли на химиотерапию с использованием прогностических моделей на базе глубокого обучения сверточной нейронной сети с входными данными из КТсканов, полученных до лечения и после (AUC – 0,79, что выше, чем при исследовании радиолога) [25].
ВОЗМОЖНОСТИ ИИ ПРИ ДИАГНОСТИКЕ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
С целью снизить количество ненужных биопсий на основе клинических характеристик T. Takeuchi и соавт. разработали ИНС, осуществляющую прогноз наличия рака предстательной железы (РПЖ). ИНС предотвратила проведение биопсии у 48% пациентов без РПЖ, было пропущено 16% случаев РПЖ, 6% – с суммой баллов по шкале Глисона ≥7, прогностическая ценность отрицательного результата – 76% для любого РПЖ и 94% для РПЖ с суммой баллов по шкале Глисона ≥7 [26].
Методы машинного обучения также могут использоваться для прогнозирования местно-распространенного РПЖ. J. Kim и соавт. задались целью изучить ряд методов машинного обучения в точности прогнозирования стадии РПЖ и сравнить точность этого метода с номограммой Партина. Использовалась база данных 944 пациентов, методом лечения которых была радикальная простатэктомия (РПЭ), в качестве переменных для классификаторов машинного обучения были использованы: уровень простат-специфического антигена (ПСА), сумма баллов по шкале Глисона, клиническая T, количество позитивных столбиков при биопсии. Между собой сравнивались такие классификаторы, как метод обратного распространения ошибки, метод опорных векторов, наивный байесовский метод, байесовская сеть, дерево классификации и регрессии, случайный лес. В итоге точность прогнозирования при использовании таблицы Партина оказалась самой низкой – 65,68%. Классификаторы машинного обучения показали точность от 68,75% до 75%. Наибольшую точность показал метод опорных векторов [27].
Методы машинного обучения могут использоваться в анализе цифровых изображений, например, при обработке данных МРТ, что показало исследование А. Algohary и соавт. в котором первым этапом были выделены радиомные признаки, характерные для клинически значимого РПЖ. В дальнейшем их использовали в качестве переменных для классификаторов машинного обучения. В качестве классификаторов использовалось три метода: квадратичный дискриминантный анализ, случайный лес, метод опорных векторов. Вторым этапом авторы сравнили точность машинного обучения с системой оценки PI-RADS. В группе с ложноотрицательной МРТ (PIRADS 1-2 при положительной биопсии) машинное обучение продемонстрировало выявление клинически значимого РПЖ в 80% случаев. В группе с ложноположительной МРТ (PIRADS 4-5, при отрицательной биопсии) машинное обучение с 60% точностью определило отсутствие клинически значимого рака. Наиболее точным оказался метод квадратичного дискриминантного анализа. Использование подобной методики в будущем может улучшить определение группы риска, а также позволит осуществлять неинвазивный мониторинг степени злокачественности (грейд) и стадии РПЖ [28].
Анализируя МР-изображения, D. Fehr и соавт. представили алгоритм машинного обучения, способного по найденным структурным особенностям T2-взвешенных и диффузно-взвешенных МР-изображений автоматически с высокой точностью (до 93%) различать высоко дифференцированный РПЖ (сумма баллов по шкале Глисона 6) от умеренно дифференцированного РПЖ (сумма Глисона 7), а также отличать грейд 2 (сумма Глисона 7 (3+4), от грейд 3 (сумма Глисона 7 (4+3) с точностью до 92%. Наибольшую точность показал метод опорных векторов c использованием алгоритма рекурсивного извлечения переменных [29].
J. Kwak и соавт. использовали 5 тканевых микропанелей, которые были получены при помощи сканирования окрашенных гематоксилином и эозином образцов тканей. Каждая тканевая панель содержала определенное количество как доброкачественных, так и злокачественных образцов ткани. С помощью морфологических особенностей, выявленных на оцифрованных образцах тканей разного расширения, производилось машинное обучение по алгоритму мультиклассового бустинга. В результате получения и объединения характеристик тканей, полученных из нескольких разрешений, выполнялась автоматическая идентификации РПЖ с AUC 98% [30]. Эти же авторы, используя особенности ядерной архитектоники эпителиальных клеток предстательной железы (ПЖ), обучили сверточную нейронную сеть идентифицировать РПЖ с AUC 97% [31].
Т. Nguyen и соавт. разработали автоматический метод анализа ткани ПЖ, основанный на количественной фазовой визуализации и алгоритмах машинного обучения. В результате им удалось продемонстрировать способность обученного алгоритма автоматически дифференцировать грейд Глисона 3 с грейд Глисона 4 с общей точностью 82% в материале после простатэктомии. В будущем авторы планируют повысить точность алгоритма, применение которого позволит избегать расхождения между патоморфологами [32]. Автоматизированный вычислительный метод на основе данных из оцифрованных образцов, применяемый для определения суммы баллов по шкале Глисона, разработали Е. Arvanati и соавт., обучив сверточную нейронную сеть. В итоге распределение пациентов в группы низкого, среднего и высокого прогностичекого риска по сумме баллов по шкале Глисона достигло такого же уровня, как при патологоанатомической оценке экспертом [33].
M.J. Donovan и соавт. представили инновационную платформу машинного обучения и микроскопического анализа паттернов, которая с высокой точностью различает РПЖ низкого, среднего и высокого риска и предсказывает вероятность значимой клинической неудачи в течение 8 лет (при обучении модель предсказывала значимую клиническую неудачу с С-индексом 0,82 и HR 6,7) [34].
В недавнем исследовании N.C. Wong и соавт. использовали три алгоритма машинного обучения для прогнозирования раннего биохимического рецидива после робот-ассистированной простатэктомии. При всех алгоритмах AUC составил >0,95, что превосходит традиционные статистические регрессионные модели [35].
ВЫВОДЫ
- Методы искусственного интеллекта постоянно развиваются, расширяется спектр их применения в области онкоурологии.
- В ближайшем будущем не идет речь о замене традиционных методов, но в дополнение к ним искусственный интеллект может давать больше информации о пациенте.
- Развитие и активное применение методов ИИ в онкоурологии будет способствовать активному применению телемедицинских технологий.
- Для широкого внедрения данных методов должны быть разработаны механизмы надзора за безопасностью и эффективностью алгоритмов искусственного интеллекта.
- Нужны дополнительные исследования по клиническому и статистическому сравнению результатов, полученных с помощью ИИ, с результатами, полученными традиционными методами.
ЛИТЕРАТУРА
- Шадеркин И.А. Роль искусственного интеллекта в телемедицине России. Журнал телемедицины и электронного здравоохранения 2019(5),1:38-40, https://doi.org/10.29188/2542-2413-2019-5-1-38-40. [Shaderkin I.A. Rol iskusstvennogo intellekta v telemeditsine Rossii. Zhurnal telemeditsinyi i elektronnogo zdravoohraneniya = Journal of Telemedicine and E-Health 2019(5)1:38-40,
https://doi.org/10.29188/2542-2413-2019-5-1-38-40. (In Russian)]. - Харитонов С.В., Лямина Н.П., Зайцев В.П., Самсонова Г.О., Голубев М.В. Применение искусственного интеллекта в прогнозировании удовлетворенности больных медицинской помощью в условиях специализированной клиники восстановительного лечения. Журнал телемедицины и электронного здравоохранения 2020(3):15-23. https://doi.org/10.29188/2542-2413-2020-6-3-15-23. [Haritonov S.V., Lyamina N.P., Zaytsev V.P., Samsonova G.O., Golubev M.V. Primenenie iskusstvennogo intellekta v prognozirovanii udovletvorennosti bolnyih meditsinskoy pomoschyu v usloviyah spetsializirovannoy kliniki vosstanovitelnogo lecheniya. Zhurnal telemeditsinyi i elektronnogo zdravoohraneniya = Journal of Telemedicine and E-Health 2020(3):15-23. https://doi.org/10.29188/2542-2413-2020-6-3-15-23. (In Russian)].
- Лебедев Г.С., Маслюков А.П.., Шадеркин И.А., Шадеркина А.И. Глубокое машинное обучение (искусственный интеллект) в ультразвуковой диагностике. Журнал телемедицины и электронного здравоохранения 2020;(2):22-29. [Lebedev G.S., Maslyukov A.P.., Shaderkin I.A., Shaderkina A.I. Glubokoe mashinnoe obuchenie (iskusstvennyiy intellekt) v ultrazvukovoy diagnostike. Zhurnal telemeditsinyi i elektronnogo zdravoohraneniya = Journal of Telemedicine and EHealth 2020;(2):22-29. (In Russian)].
- Chen J, Remulla D, Nguyen JH, Aastha D, Liu Y, Dasgupta P, et al. Current status of artificial intelligence applications in urology and their potential to influence clinical practice. BJU International 2019;124(4):567-577. https://doi.org/10.1111/bju.14852.
- Richard PO, Jewett MAS, Bhatt JR, Kachura JR, Evans AJ, Zlottaet AR, et al. Renal Tumor Biopsy for Small Renal Masses: A Single-center 13-year Experience. Euro Urol 2015;68(6):1007-1013. https://doi.org/10.1016/j.eururo.2015.04.004.
- Suarez-Ibarrola R, Hein S, Reis G, Gratzke C, Miernik A. Current and future applications of machine and deep learning in urology: a review of the literature on urolithiasis, renal cell carcinoma, and bladder and prostate cancer. World J Urol 2020;38(10):2329-2347. https://doi.org/10.1007/s00345-019-03000-5.
- Bektas CT, Kocak B, Yardimci AH, Turkcanoglu MH, Yucetas U, Koca SB, et al. Clear Cell Renal Cell Carcinoma: Machine Learning-Based Quantitative Computed Tomography Texture Analysis for Prediction of Fuhrman Nuclear Grade. Euro Radiol 2019;29(3):1153-1163. https://doi.org/10.1007/s00330-018-5698-2.
- Schieda N, Lim RS, Krishna S, McInnes MDF, Flood TA, Thornhill RE. Diagnostic accuracy of unenhanced CT analysis to differentiate low-grade from high-grade chromophobe renal cell carcinoma. Amer J Roentgenol 2018;210(5):1079-1087. https://doi.org/10.2214/AJR.17.18874.
- Kunapuli G, Varghese BA, Ganapathy P, Desai B, Cen S, Aron M, et al. A Decision-Support Tool for Renal Mass Classification. J Digital Imaging 2018;31(6):929-939. https://doi.org/10.1007/s10278-018-0100-0.
- Yu HS, Scalera J, Khalid M, Touret AS, Bloch N, Li B, et al. Texture analysis as a radiomic marker for differentiating renal tumors. Abdominal Radiology 2017;42(10):2470-2478. https://doi.org/10.1007/ s00261-017-1144-1.
- Yan L, Liu Z, Wang G, Huang Y, Liu Y, Yu Y, et al. Angiomyolipoma with Minimal Fat: Differentiation From Clear Cell Renal Cell Carcinoma and Papillary Renal Cell Carcinoma by Texture Analysis on CT Images. Academic Radiology 2015;22(9):1115-1121. https://doi.org/10.1016/j.acra.2015.04.004.
- Feng Z, Rong P, Cao P, Zhou Q, Zhu W, Yan Z, et al. Machine learning-based quantitative texture analysis of CT images of small renal masses: Differentiation of angiomyolipoma without visible fat from renal cell carcinoma. Euro Radiol 2018;28(4):1625-1633. https://doi.org/10.1007/s00330-017-5118-z.
- Bektas CT, Kocak B, Yardimci AH, Turkcanoglu MH, Yucetas U, Koca SB, et al. Clear Cell Renal Cell Carcinoma: Machine Learning-Based Quantitative Computed Tomography Texture Analysis for Prediction of Fuhrman Nuclear Grade. Euro Radiol 2019;29(3):1153-1163. https://doi.org/10.1007/s00330-018-5698-2.
- Zaridze DG, Mazurenko NN, Bezhanova SD, Maksimovich DM, Shangina OV, DraudinKrylenko VA, et al. Prognostic role of PBRM1 marker expression in clear-cell renal-cell carcinoma. Onkourologiya 2019;15(1):23-31. https://doi.org/10.17650/1726-9776-2019-15-1-23-31.
- Kocak B, Durmaz ES, Ates E, Ulusan MB. Radiogenomics in clear cell renal cell carcinoma: Machine learning–based high-dimensional quantitative CT texture analysis in predicting PBRM1 mutation status. Amer J Roentgenol 2019;212(3):W55-W63. https://doi.org/10.2214/AJR.18.20443.
- Miladi M, Peyromaure M, Zerbib M, Saıghi D, Debré B. The Value of a Second Transurethral ̈ Resection in Evaluating Patients with Bladder Tumours. Euro Urol 2003;43(3):241-245. https://doi.org/10.1016/S0302-2838(03)00040-X.
- Xu X, Zhang X, Tian Q, Zhang G, Liu Y, Cui G, et al. Three-dimensional texture features from intensity and high-order derivative maps for the discrimination between bladder tumors and wall tissues via MRI. International Journal of Computer Assisted Radiology and Surgery 2017;12(4):645-656. https://doi.org/10.1007/s11548-017-1522-8.
- Garapati SS, Hadjiiski L, Cha KH, Chan HP, Caoili EM, Cohan RH, et al. Urinary bladder cancer staging in CT urography using machine learning. Medical Physics 2017;44(11):5814-5823. https://doi.org/10.1002/mp.12510.
- Shao CH, Chen CL, Lin JY, Chen CJ, Fu SH, Chen YT, et al. Metabolite marker discovery for the detection of bladder cancer by comparative metabolomics. Oncotarget 2017;8(24):38802-38810. https://doi.org/10.18632/oncotarget.16393.
- Sapre N, Macintyre G, Clarkson M, Naeem H, Cmero M, Kowalczyk A, et al. A urinary microRNA signature can predict the presence of bladder urothelial carcinoma in patients undergoing surveillance. British J Cancer 2016;114(4):454-462. https://doi.org/10.1038/bjc.2015.472.
- Bartsch G, Mitra AP, Mitra SA, Almal AA, Steven KE, Skinner DG, et al. Use of Artificial Intelligence and Machine Learning Algorithms with Gene Expression Profiling to Predict Recurrent Nonmuscle Invasive Urothelial Carcinoma of the Bladder. J Urol 2016;195(2):493-498. https://doi.org/10.1016/j.juro.2015.09.090.
- Zhang X, Xu X, Tian Q, Li B, Wu Y, Yan Z, et al. Radiomics assessment of bladder cancer grade using texture features from diffusion-weighted imaging. Journal of Magnetic Resonance Imaging 2017;46(5):1281-1288. https://doi.org/10.1002/jmri.25669.
- Eminaga O, Eminaga N, Semjonow A, Breil B. Diagnostic Classification of Cystoscopic Images Using Deep Convolutional Neural Networks. JCO Clinical Cancer Informatics 2018;(2):1-8. https://doi.org/10.1200/cci.17.00126.
- Hasnain Z, Mason J, Gill K, Miranda G, Gill IS, Kuhn P, et al. Machine learning models for predicting post-cystectomy recurrence and survival in bladder cancer patients. Katoh M, ed. PLOS ONE 2019;14(2):e0210976. https://doi.org/10.1371/journal.pone.0210976.
- Wu E, Hadjiiski LM, Samala RK, Chan HP, Cha KH, Richter C, et al. Deep Learning Approach for Assessment of Bladder Cancer Treatment Response. Tomography (Ann Arbor, Mich) 2019;5(1):201-208. https://doi.org/10.18383/j.tom.2018.00036.
- Takeuchi T, Hattori-Kato M, Okuno Y, Iwai S, Mikami K. Prediction of prostate cancer by deep learning with multilayer artificial neural network. Canad Urol Association J 2019;13(5):E145-E150. https://doi.org/10.5489/cuaj.5526.
- Kim J, Yook I, Choi M, Lee J. YP-S in health, 2017 undefined. A Performance Comparison on the Machine Learning Classifiers in Predictive Pathology Staging of Prostate Cancer. europepmc.org. Accessed October 29, 2020. https://sci-hub.do/https://europepmc.org/article/med/29295358.
- Algohary A, Viswanath S, Shiradkar R, Ghose S, Pahwa S, Moses D, et al. Radiomic features on MRI enable risk categorization of prostate cancer patients on active surveillance: Preliminary findings. Journal of Magnetic Resonance Imaging 2018;48(3):818-828. https://doi.org/10.1002/jmri.25983.
- Fehr D, Veeraraghavan H, Wibmer A, Gondo T, Matsumoto K, Vargas HA, et al. Automatic classification of prostate cancer Gleason scores from multiparametric magnetic resonance images. Proceedings of the National Academy of Sciences of the United States of America 2015;112(46):E6265-E6273. https://doi.org/10.1073/pnas.1505935112.
- Kwak JT, Hewitt SM. Multiview boosting digital pathology analysis of prostate cancer. Computer Methods and Programs in Biomedicine 2017(142):91-99. https://doi.org/10.1016/j.cmpb.2017.02.023.
- Kwak JT, Hewitt SM. Nuclear Architecture Analysis of Prostate Cancer via Convolutional Neural Networks. IEEE Access 2017(142):91-99.. https://doi.org/10.1109/ACCESS.2017.2747838.
- Nguyen TH, Sridharan S, Macias V, Kajdacsy-Balla A, Melamed J, Do MN, et al. Automatic Gleason grading of prostate cancer using quantitative phase imaging and machine learning. Journal of Biomedical Optics 2017;22(3):036015. https://doi.org/10.1117/1.jbo.22.3.036015.
- Arvaniti E, Fricker KS, Moret M, et al. Automated Gleason grading of prostate cancer tissue microarrays via deep learning. Scientific Reports 2018;8(1):12054. https://doi.org/10.1038/s41598-018-30535-1.
- Donovan MJ, Fernandez G, Scott R, Rupp N, Hermanns T, Fankhauser C, et al. Development and validation of a novel automated Gleason grade and molecular profile that define a highly predictive prostate cancer progression algorithm-based test. Prostate Cancer and Prostatic Diseases 2018;21(4):594-603. https://doi.org/10.1038/s41391-018-0067-4.
- Wong NC, Lam C, Patterson L, Shayegan B. Use of machine learning to predict early biochemical recurrence after robot-assisted prostatectomy. BJU International 2019;123(1):51. https://doi.org/10.1111/bju.14477.







