ВВЕДЕНИЕ
Сперматогенез представляет собой комплексный процесс деления и дифференцировки сперматогенного эпителия с образованием высокоспециализированных половых клеток – сперматозоидов. По данным ряда исследований сперматогенез в значительной степени подвержен пагубному воздействию окислительного стресса, возникновению которого могут способствовать инфекции половых органов, варикоцеле, токсины окружающей среды, а также прием ряда лекарственных препаратов [1, 2]. Известно, что нарушение фертильности, вплоть до бесплодия, могут вызывать базовые противовоспалительные средства, антибиотики, гормональные контрацептивы, цитостатики и другие противоопухолевые препараты [3].
В последние годы существенное внимание уделяется вопросам бесплодия, вызванного воздействием лучевой и химиотерапии, приводящим как к обратимым, так и необратимым нарушениям мужской фертильности [4, 5]. Активно развиваются исследования, направленные на фармакологическую коррекцию функции сперматогенного эпителия, в том числе с использованием биомедицинских клеточных продуктов [6]. Однако ввиду частого использования полимодальных схем лечения, включающих одновременное применение нескольких химиотерапевтических препаратов, выбор оптимального агента для моделирования нарушения сперматогенеза является нетривиальной задачей [7, 8]. Одним из подходов может являться применение распространенных и доступных химиотерапевтических препаратов, обладающих выраженными токсическими эффектами в отношении сперматогенеза, например, Цисплатина и Доксорубицина. Ключевым механизмом гонадотоксичности данных лекарственных препаратов является развитие дисбаланса про- и антиоксидантных процессов, приводящих к возникновению оксидативного стресса в семенниках и нарушению сперматогенного эпителия и ниши сперматогониальной стволовой клетки. Несмотря на то, что использование гонадотоксичных эффектов Цисплатина и Доксорубицина для моделирования патологии описано в ряде исследований, требуется дальнейшая оптимизация этих моделей для подбора оптимальных доз, режимов введения и контролируемых параметров, релевантных для клинических ситуаций и удобных для использования данных животных моделей в доклинических исследованиях для оценки специфической активности новых препаратов для лечения токсических случаев мужского бесплодия [9, 10].
Таким образом, целью настоящего исследования является оценка возможности использования Цисплатина и Доксорубицина для моделирования токсических нарушений сперматогенеза в экспериментах in vivo.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Работа выполнена на половозрелых самцах крыс породной группы Wistar возраста 3,5-4,0 месяцев со стандартными весовыми характеристиками, полученных из питомника Филиала «Столбовая» ФГБУН НЦБМТ ФМБА России. В исследовании также использовали половозрелых самцов мышей линии C57BL/6 возраста 3 месяца со стандартными весовыми характеристиками, полученных из питомника ИЦиГ СО РАН (Новосибирск).
Животные содержались в виварии лаборатории трансляционной медицины (ФФМ МГУ) в соответствии с ГОСТ 33215-2014 Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур. Исследования на животных проводили в соответствии с Директивой ЕС 201/63/EU.
Моделирование нарушений сперматогенеза
Для моделирования повреждения сперматогенеза Цисплатином были использованы два режима внутрибрюшинного введения препарата. В группу однократного введения Цисплатина (производитель: ФГБУ «РОНЦ им Н.Н. Блохина») в дозах 1 мг/кг, 2 мг/кг, 3 мг/кг и 4 мг/кг было включено 8 крыс: по 2 животных на каждую дозу соответственно. На 28 сутки после введения Цисплатина осуществляли выведение животных из эксперимента и гистологический контроль тестикулярных изменений. В группу многократного введения Цисплатина было включено 8 крыс, получавших Цисплатин в дозе 4 мг/кг в течение 3-5 дней.
Для моделирования повреждения сперматогенеза Доксорубицином были использованы два режима внутрибрюшинного введения препарата: однократное введение Доксорубицина (производитель: ООО ЛЭНС-ФАРМ) в дозе 1,5 мг/кг (низкая доза) и 3 мг/кг (высокая доза). В каждую группу было включено по 5 мышей. На 35 сутки после введения Доксорубицина осуществлялось выведение животных из эксперимента и гистологический контроль тестикулярных изменений.
Гистологический анализ
Семенники, полученные от животных на момент выведения из эксперимента, были зафиксированы в 10% формалине. Далее органы были залиты в парафин, подготовлены срезы толщиной 1 мкм. Для расчета количества атрофичных семенных канальцев на срезах ткани яичка была использована окраска гематоксилиномэозином. Семенные канальцы с тонким слоем сперматогенного эпителия (толщиной в один клеточный слой в среднем) и склерозированием просвета считали атрофичными.
Статистический анализ
Статистический анализ был проведен с использованием программного обеспечения STATISTICA 12. Было рассчитано процентное количество поврежденных канальцев в поле зрения для каждой модели и режима введения. Данные представлены в виде медиан и 25-, 75-го процентилей, максимальных и минимальных значений. Сравнение моделей токсического повреждения сперматогенеза было проведено при помощи Uкритерия Манна-Уитни. Различия считались статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ
В группе однократного введения различных доз Цисплатина все исследуемые животные на 28-е сутки после инъекции были живы, видимых системных нарушений не наблюдалось. При гистологическом исследовании тканей яичка (табл. 1, рис. 1А) атрофированных и повреждеенных канальцев не наблюдали, сперматогенный эпителий и сперматозоиды были сохранны (на рис. 1 представлены данные для максимального режима дозирования – 4 мг/кг). При многократном введении Цисплатина в дозе 4 мг/кг была отмечена выраженная токсичность препарата, в результате которой животные погибали до окончания цикла инъекций. Из 8 крыс выжили 3: 2 после трехкратного и 1 – после четырехкратного введения Цисплатина. При гистологическом исследовании ткани яичек (рис. 1Б) до 9,1% семенных канальцев были повреждены (табл. 1).
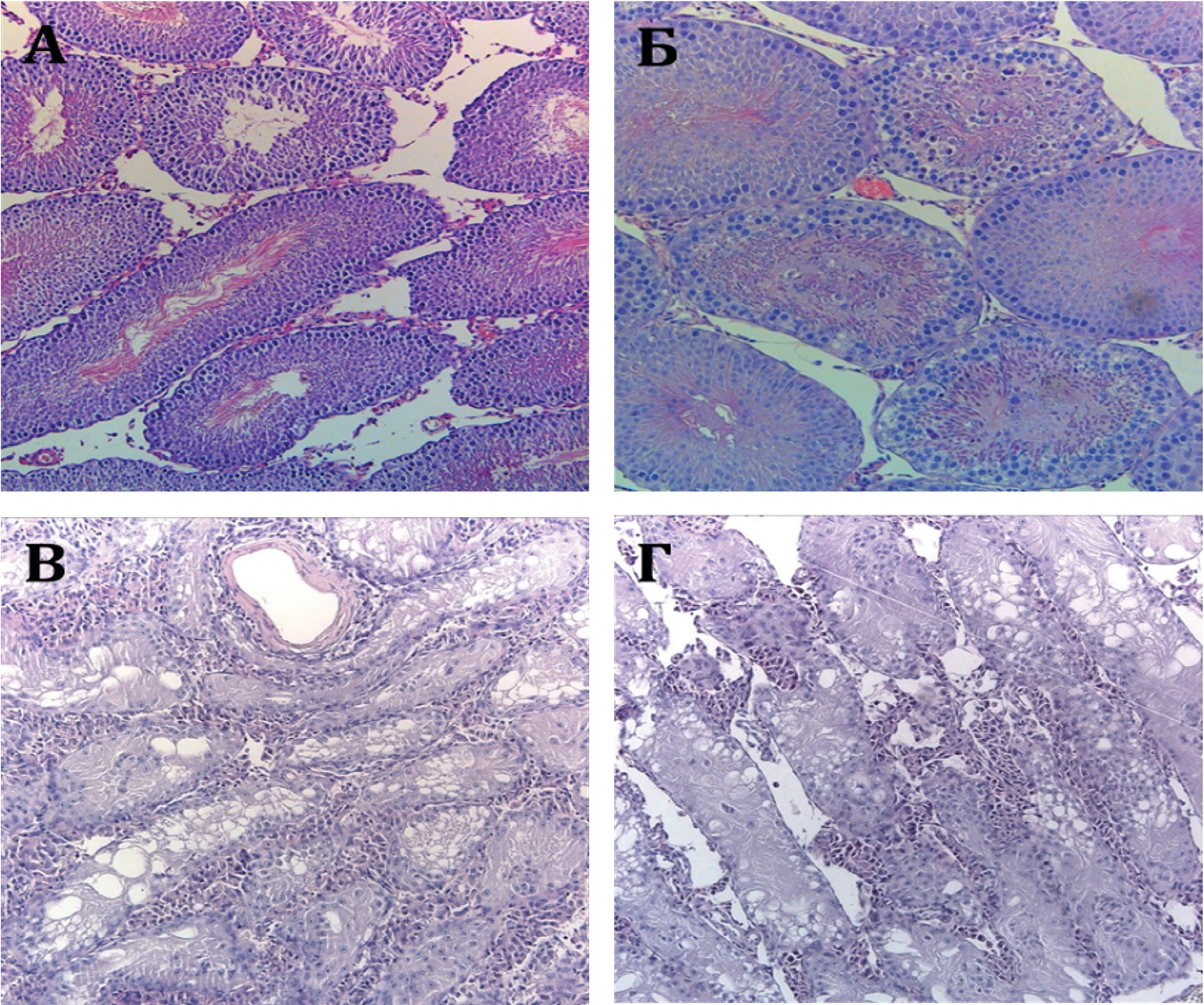
Рис. 1. Гистологическая картина срезов семенников крыс после внутрибрюшинного введения препаратов.
А) Цисплатин однократно в дозе 4 мг/кг; Б) Цисплатин многократно (х4); В) Доксорубицин в дозе 1,5 мг/кг; Г) Доксорубицин в дозе 3 мг/кг. Увеличение 100х. Окраска гематоксилином-эозином.
Fig. 1. Histology of rat testicles after intraperitoneal administration of drugs;
A) cisplatin once at a dose of 4 mg/kg; B) cisplatin repeatedly (x4); C) doxorubicin at a dose of 1.5 mg/kg; D) doxorubicin at a dose of 3 mg/kg, 100x, hematoxylin-eosin.
Учитывая полученные результаты, для второй серии экспериментов был выбран другой химиотерапевтический препарат – Доксорубицин, кроме того, для исключения видоспецифичности реакции на препараты исследование провели на мышах. Доксорубицин как в низких, так и в высоких дозах оказывал тяжелое токсическое влияние на сперматогенез с наличием до 100% поврежденных канальцев (табл. 1). При гистологическом исследовании ткани яичек после введения Доксорубицина (рис. 1 В, Г) было отмечено наличие менее 3-х слоев клеток на базальной мембране большинства канальцев, при этом часть клеток герминогенного эпителия было смещена в просвет канальца. Количество сперматозоидов в просвете канальцев было снижено, а в некоторых канальцах зрелые сперматозоиды отсутствовали, что было сопряжено с появлением многочисленных вакуолярных структур, нарушающих нормальную архитектонику тканей яичка.
Таблица 1. Количество поврежденных канальцев (%) в поле зрения для групп животных, которым вводили Цисплатин однократно (х1), многократно (хN), Доксорубицин в низкой (НД) или высокой (ВД) дозах для оценки гонадотоксичности
Table 1. The number of damaged tubules ( % ) in the field of vision for groups of animals that were administered Сisplatin once (x1), multiple (xN), Doxorubicin in high (HD) or low (LD) doses to assess gonadotoxicity
| Поврежденные канальцы, % Damaged tubules, % |
Цисплатин xl Cisplatin xl n=8 |
Цисплатин xN Cisplatin xN n=8 |
Доксорубицин, НД Doxorubicin, LD n=5 |
Доксорубицин, ВД Doxorubicin, HD n=5 |
|---|---|---|---|---|
| Медиана Median |
0 | 0 | 100 | 99,7 |
| 25% | 0 | 0 | 99,4 | 99,5 |
| 75% | 0 | 7,7 | 100 | 100 |
| Минимум Minimum |
0 | 0 | 97,4 | 98 |
| Максимум Maximum |
0 | 9,1 | 100 | 100 |
При попарном сравнении разных режимов введения и дозировок исследуемых препаратов было установлено, ввиду малого количества наблюдений, отсутствие статистически значимых различий внутри каждой из предложенных моделей. Однако при многократном введении Цисплатина отмечалась тенденция к увеличению процентного содержания поврежденных семенных канальцев, но данное различие было статистически незначимым при сравнении с группой однократного введения препарата (рис. 2Б). При анализе нарушений сперматогенеза при введении Доксорубицина было установлено, что Доксорубицин как в низких, так и в высоких дозах повреждает канальцы и сперматогенный эпителий в большей степени, чем Цисплатин при любом режиме дозирования (рис. 2).
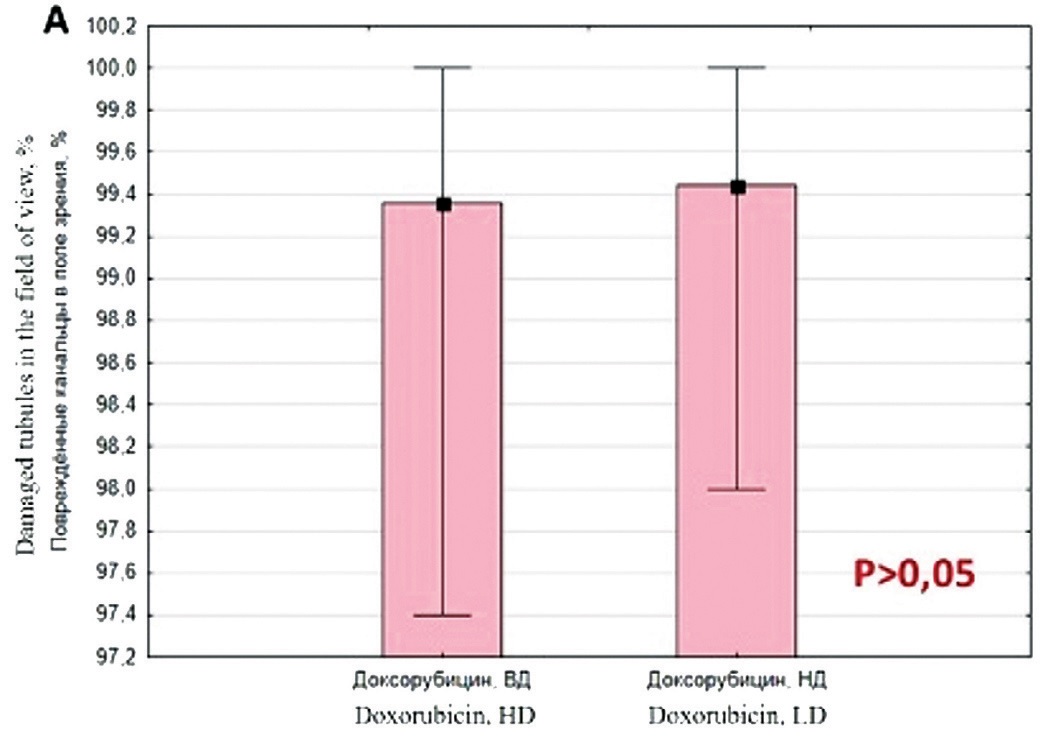
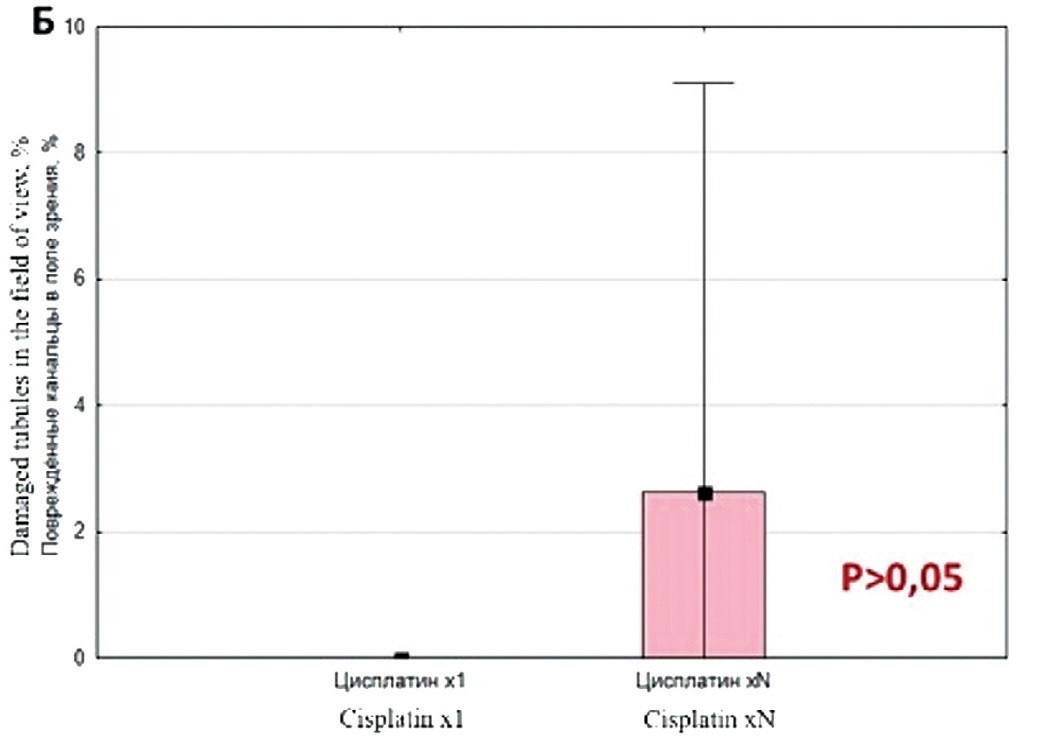
Рис. 2. Сравнительная оценка выраженности нарушений сперматогенеза при использовании Доксорубицина и Цисплатина
Fig. 2. Comparative assessment of the severity of spermatogenesis disorders using Doxorubicin and Сisplatin
ОБСУЖДЕНИЕ
Доксорубицин и Цисплатин являются высокоэффективными противоопухолевыми препаратами, однако их применение, согласно данным литературы, сопряжено с выраженной гонадотоксичностью [11]. Известно, что Цисплатин запускает апоптоз герминогенных клеток яичек дозозависимым образом, а наибольшие изменения в семенниках наблюдаются при единичной внутрибрюшинной инъекции Цисплатина в дозе 10 мг/кг [12]. Согласно E.J. Chow и соавт. высокие дозы Цисплатина, вводимые мужчинам (более 488 мг/м2), ассоциированы со снижением вероятности наступления беременности в паре и рождения живого потомства, в то время как низкие дозы Цисплатина (355-487 мг/м2 ) снижали вероятность рождения живого ребенка при сопоставимой со здоровой популяцией частотой зачатия [13]. В исследовании P. Romerius и соавт. через 10 лет после проведенного курса лечения так называемой «стерилизующей» дозой Цисплатина (более 500 мг/м2) у 67% мужчин в спермограмме наблюдалась азооспермия, в то время как назначение низких доз препарата (менее 500 мг/м2) не вызывало подобных нарушений [14].
Похожие результаты были получены в условиях in vitro в исследовании M.A. Caroline и соавт. Было показано, что плотность герминогенного эпителия и пролиферирующих герминогенных клеток в яичках уменьшается дозозависимым образом до 15% при инкубации в течение суток в среде с Цисплатином [15]. В нашем исследовании наблюдалась тенденция к подобному повреждению канальцев дозозависимым образом при многократном введении препарата, однако системная токсичность оказалась значительно выше гонадотоксичности, в результате чего животные были выведены из эксперимента ранее запланированного срока по причине повышенной гибели.
Исследования, проведенные на животных моделях, указывают на выраженное токсическое воздействие Цисплатина на морфологию семенников и сперматогенез. Так, по данным A.M. Aboul-Naga и соавт., единичная интраперитонеальная инъекция Цисплатина в дозе 5 мг/кг вызывала деформацию семенных канальцев, выраженное повреждение клеток Сертоли, клеток Лейдига, морфологии и ДНК сперматозоидов [16]. По данным T. Kohsaka и соавт. внутрибрюшинная инъекция Цисплатина в дозе 6 мг/кг приводила к уменьшению диаметра семенных канальцев, дегенерации слоя зародышевых клеток, а также потере нормальных сперматозоидов, что было сопряжено со снижением уровня тестостерона по сравнению с контрольной группой [17]. Введение Цисплатина в дозе 7 мг/кг проявлялось более выраженным нарушением анатомии яичек: канальцы были практически лишены герминогенного эпителия, а базальная мембрана канальцев принимала вид гофрированной бумаги, что приводило к нарушению гематотестикулярного барьера и усугублению имеющихся нарушений [18]. Однако, в нашем исследовании однократная внутрибрюшинная инъекция Цисплатина в дозе 4 мг/кг не приводила к выраженным морфологическим нарушениям семенных канальцев, что может быть связано с различными дозами вводимых препаратов. В то же время доза 4 мг/кг для крыс является эквивалентной используемой в клинической практике дозе Цисплатина для пациентов.
Многократное внутрибрюшинное введение Цисплатина курсами по 5 дней в неделю в течение 3-х недель в дозе 1 мг/кг, по данным A.P.A. Favareto и соавт., оказывало токсическое влияние на сперматогенез без выраженной системной токсичности. По окончании курса терапии Цисплатином в биоптатах яичек было отмечено уменьшение диаметра канальцев. При исследовании показателей спермограммы наблюдалось снижение подвижности сперматозоидов, а также уменьшение их количества по сравнению с контрольной группой, при этом подобные изменения носили обратимый характер [19]. В настоящем исследовании многократное введение Цисплатина в дозе 4 мг/кг приводило к выраженному системному токсическому эффекту, а изменения в семенниках были минимальными. Подобные различия с результатами, полученными в работе A.P.A. Favareto и соавт. могут быть объяснены применением различных доз препарата. Многократное введение в небольших дозах, по всей видимости, способствует накоплению Цисплатина в тканях, в дальнейшем кумулятивный эффект опосредует гонатотоксичность [20]. В то же время необходимость в длительном режиме введения препарата для развития нарушений сперматогенеза может снижать удобство применения подобной модели в доклинических исследованиях.
Таким образом, полученные данные свидетельствуют о том, что для создания токсической модели сперматогенеза на основе Цисплатина необходимы более высокие дозы препарата. Однако в настоящем исследовании назначение высоких доз Цисплатина приводило к выраженной полиорганной недостаточности с дальнейшим выведением особей из эксперимента по причине их гибели.
Данные литературы по применению Доксорубицина для повреждения сперматогенеза не отличаются выраженной вариабельностью. Различные дозы вводимого препарата сопряжены с выраженной гонадотоксичностью. В исследовании S. Kaur и соавт. внутрибрюшинное трехкратное введение Доксорубицина в дозе 3 мг/кг вызывало уменьшение плотности и истончение герминогенного эпителия, нарушение нормальной структуры базальной мембраны и, как следствие, нарушение гематотестикулярного барьера. В биоптатах яичек было обнаружено большое количество атрофированных семенных канальцев, для которых было характерно включение многочисленных вакуолярных структур, также являющихся своеобразным маркером токсического повреждения [1]. Аналогичные данные были получены в работе H.M. Khani и соавт. при четырехкратном внутрибрюшинном введении Доксорубицина [21]. При повышении дозы Доксорубицина до 5 мг/кг при однократном введении в спермограмме исследуемых животных было отмечено снижение общего количества сперматозоидов, а также нарушение их морфологии с появлением атипичных форм с микроцефалией, двумя головками, короткой хвостовой частью. Гистологическое исследование яичек выявило снижение плотности герминогенного эпителия с его отделением от базальной мембраны, вакуоляризацией и выходом в просвет канальцев [22]. Внутривенное введение 7 мг/кг Доксорубицина вызывало похожую гистологическую картину [23]. Полученные нами данные по индуцированному Доксорубицином повреждению сперматогенеза полностью согласуются с литературными данными. Как относительно небольшие (1,5 мг/кг), так и высокие дозы Доксорубицина (3 мг/кг) при многократном введении вызывают выраженные морфологические изменения ткани яичек с повреждением более 95% семенных канальцев, что делает индуцированные Доксорубицином повреждения сперматогенеза наиболее удобной моделью для изучения гонадотоксичности, вызываемой противоопухолевыми препаратами.
ВЫВОДЫ
Согласно результатам проведенного исследования, использование Цисплатина в выбранном дизайне непригодно для получения стойких нарушений функции сперматогенного эпителия, так как однократное введение не приводит к существенным нарушениям сперматогенеза, а курсовое введение препарата вызывает гибель экспериментальных животных за счет развития полиорганной недостаточности, при которой гонадотоксичный эффект клинически незначим. Индуцированное Доксорубицином повреждение сперматогенеза, по сравнению с применением Цисплатина, является более удобной моделью изучения гонадотоксичности, так как изменения функции сперматогенного эпителия наступают в течение первого же цикла сперматогенеза. При этом в семенных канальцах морфологически отмечаются выраженный отек и нарушение структуры и функции сперматоцитов, а также повреждение клеток Сертоли.
Согласно полученным экспериментальным данным, выбор токсической модели повреждения сперматогенеза представляет собой непростую задачу, несмотря на достаточно многочисленные опубликованные результаты исследований. Наш опыт показывает, что ожидаемые клинические эффекты могут не наступать в ранние сроки после инъекций, а однократные введения токсиканта не оказывают влияния на функцию «забарьерного» органа, которым является яичко, как это было выявлено при анализе результатов, полученных с использованием Цисплатина. В то же время мы показали, что Доксорубицин может быть рекомендован для моделирования стойких, быстро развивающихся нарушений сперматогенеза, что позволяет рекомендовать эту модель для доклинических исследований специфической активности препаратов для лечения мужского бесплодия, вызванного химиотерапевтическими препаратами.
Данная работа проведена в рамках Госзадания МНОЦ МГУ имени М.В. Ломоносова, № гос. регистрации НИОКТР АААА-А19-119120690094-8 от 6 декабря 2019 года.
ЛИТЕРАТУРА
1. Kaur S, Maan KS, Sadwal S, Aniqa A. Studies on the ameliorative potential of dietary supplemented selenium on doxorubicin-induced testicular damage in mice. Andrologia 2020;52(11):e13855.
2. Uygur R, Aktas C, Tulubas F, Uygur E, Kanter M, Erboga M, et al. Protective effects of fish omega-3 fatty acids on doxorubicin-induced testicular apoptosis and oxidative damage in rats. Andrologia 2014;46(8):917–26.
3. Камалов А.А., Охоботов Д.А., Ефименко А.Ю., Сагарадзе Г.Д., Чалый М.Е., Низов А.Н. и др. Выбор химического соединения, обладающего комбинированным сперматотоксическим эффектом, для создания модели управляемого токсического повреждения сперматогенеза. Технологии живых систем 2019;16(3):5–20. [Kamalov A.A., Ohobotov D.A., Efimenko A.Yu., Sagaradze G.D., Chaliy M.E., Nizov A.N. et al. Options of a chemical compound with a combined spermatotoxic effect to create a model of controlled toxic damage of spermatogenesis. Tehnologii zhivyih system =Living systems technologies 2019;16(3):5–20.]
4. David S, Orwig KE. Spermatogonial Stem Cell Culture in Oncofertility. Urol Clin North Am 2020;47(2):227–44.
5. Poorvu PD, Frazier AL, Feraco AM, Manley PE, Ginsburg ES, Laufer MR, et al. Cancer Treatment-Related Infertility: A Critical Review of the Evidence. JNCI cancer Spectr 2019;3(1):pkz008.
6. Sagaradze GD, Basalova NA, Kirpatovsky VI, Ohobotov DA, Grigorieva OA, Balabanyan VY, et al. Application of rat cryptorchidism model for the evaluation of mesenchymal stromal cell secretome regenerative potential. Biomed Pharmacother 2019;109:1428–36.
7. Douedi S, Carson MP. Anthracycline Medications (Doxorubicin). In Treasure Island (FL) 2020: Stat Pearls Publishing, 2021, jan, aug 16.
8. Gold JM, Raja A. Cisplatin. In Treasure Island (FL) 2020: Stat Pearls Publishing, 2021, jan, jul 25.
9. Koster R, van Vugt MATM, Timmer-Bosscha H, Gietema JA, de Jong S. Unravelling mechanisms of cisplatin sensitivity and resistance in testicular cancer. Expert Rev Mol Med 2013;15:e12.
10. Amin A, Abraham C, Hamza AA, Abdalla ZA, Al-Shamsi SB, Harethi SS, et al. A standardized extract of Ginkgo biloba neutralizes cisplatin-mediated reproductive toxicity in rats. J Biomed Biotechnol 2012;2012:362049.
11. Fouad AA, Refaie MMM, Abdelghany MI. Naringenin palliates cisplatin and doxorubicin gonadal toxicity in male rats. Toxicol Mech Methods 2019;29(1):67–73.
12. Zhang X, Yamamoto N, Soramoto S, Takenaka I. Cisplatin-induced germ cell apoptosis in mouse testes. Arch Androl 2001;46(1):43–9.
13. Chow EJ, Stratton KL, Leisenring WM, Oeffinger KC, Sklar CA, Donaldson SS et al. Pregnancy after chemotherapy in male and female survivors of childhood cancer treated between 1970 and 1999: a report from the Childhood Cancer Survivor Study cohort. The Lancet Oncology 2016;17(5):567–76.
14. Romerius P, Ståhl O, Moëll C, Relander T, Cavallin-Ståhl E, Wiebe T et al. High risk of azoospermia in men treated for childhood cancer. International journal of andrology 2011;34(1):69–76.
15. Allen CM, Lopes F, Mitchell RT, Spears N. Comparative gonadotoxicity of the chemotherapy drugs cisplatin and carboplatin on prepubertal mouse gonads. Mol Hum Reprod 2020;26(3):129–40.
16. Aboul-Naga AM, Hamam ET, Awadalla A, Shokeir AA. The protective role of l-carnitine on spermatogenesis after cisplatin treatment during prepubertal period in rats: A pathophysiological study. Life Sci 2020;258:118242.
17. Kohsaka T, Minagawa I, Morimoto M, Yoshida T, Sasanami T, Yoneda Y, et al. Efficacy of relaxin for cisplatin-induced testicular dysfunction and epididymal spermatotoxicity. Basic Clin Androl 2020;30:3.
18. Fekry E, Rahman AA, Awny MM, Makary S. Protective effect of mirtazapine versus ginger against cisplatin-induced testicular damage in adult male albino rats. Ultrastruct Pathol 2019;43(1):66–79.
19. Favareto APA, Fernandez CDB, da Silva DAF, Anselmo-Franci JA, Kempinas WDG. Persistent impairment of testicular histology and sperm motility in adult rats treated with Cisplatin at peri-puberty. Basic Clin Pharmacol Toxicol 2011;109(2):85–96.
20. Whirledge SD, Garcia JM, Smith RG, Lamb DJ. Ghrelin partially protects against cisplatin-induced male murine gonadal toxicity in a GHSR-1a-dependent manner. Biol Reprod 2015;92(3):76.
21. Khani HM, Shariati M, Forouzanfar M, Hosseini SE. Protective effects of Ceratonia siliqua extract on protamine gene expression, testicular function, and testicular histology in doxorubicin-treated adult rats: An experimental study. Int J Reprod Biomed 2020;18(8):667–82.
22. Abdelaziz MH, Salah El-Din EY, El-Dakdoky MH, Ahmed TA. The impact of mesenchymal stem cells on doxorubicin-induced testicular toxicity and progeny outcome of male prepubertal rats. Birth defects Res 2019;111(13):906–19.
23. Silva RC, Britto DMC, de Fátima Pereira W, Brito-Melo GEA, Machado CT, Pedreira MM. Effect of short- and medium-term toxicity of doxorubicin







