ВВЕДЕНИЕ
Гипергонадотропный гипогонадизм встречается у 0,1% пациентов с задержкой пубертата, является многогранной проблемой, находящейся на стыке нескольких медицинских областей [1]. Данная патология ставит ряд серьезных вопросов перед представителями различных врачебных специальностей и, в первую очередь, перед урологом и эндокринологом [2]. Урологу необходимо провести адекватную коррекцию внешнего вида половых органов, выбрав для этого наиболее рациональные сроки; эндокринологу – решить вопрос своевременного начала и последующей адекватной коррекции заместительной гормональной терапией, обеспечив максимально выгодное достижение показателей физического развития, фенотипического и гормонального баланса [3]. Каждое из этих решений не имеет однозначного общепринятого стандарта, оставляя и сегодня почву для дискуссии, что подчеркивает чрезвычайную актуальность проблемы.
МАТЕРИАЛЫ И МЕТОДЫ
В результате проведенного поиска обнаружен недостаток описания случаев комплексного лечения гипогонадизма в подростковом возрасте.
В статье приведены данные собственного опыта обследования и лечения пациента, страдающего гипергонадотропным гипогонадизмом, с применением комплексного мультидисциплинарного подхода.
Описание клинического случая
Больной В., 2004 г.р. Наблюдается с рождения по поводу гипоплазии мошонки. Ребенок от 1 беременности нормального течения. Масса тела при рождении 2450 (-2,77 SD), длина тела при рождении 46 см (-2,55 SD) (табл. 1). Рост матери – 163 см, рост отца – 163 см. Оценка по шкале Апгар 8/9 балов. Осматривался генетиком – хромосомная патология исключена, кариотип 46 XY.
В возрасте 7, 18 и 36 месяцев проводились курсы лечения хорионическим гонадотропином по 500 Ед. В возрасте 3 лет ребенку проведено оперативное лечение – ревизия пахового канала с двух сторон. Интраоперационно установлено отсутствие правой гонады, слева – гонада в состоянии выраженной атрофии размерами 5*3 мм, выполнена орхэктомия. Клинический диагноз – анорхизм.
В 2019 г. в возрасте 15 лет проведено эндокринологическое обследование в условиях стационара. Рост пациента – 161,8 см, масса тела – 50,0 кг. Standard Deviation Score – коэффициент стандартного отклонения (SDS роста) = – 0,94 SD, индекс массы тела (ИМТ) – 19,1 кг/м2, SDS ИМТ = -0,17; площадь поверхности тела(ППТ) – 1,51 м2 (табл. 1). По внутренним органам без видимых изменений. Андрологический статус: кавернозные тела длиной 2,7 см, половое развитие по Таннер V1 P2 L0 G1 Ax 0 F0 (табл. 2).
Таблица 1. Динамика физического развития
Table 1. Dynamics of physical development
| Возраст Age |
Рост, см Height, cm |
Масса, кг Weight, kg |
SDS роста, SD SDS Height, SD |
ИМТ, кг/м2 BMI, kg/m2 |
SDS ИМТ, SD SDS BMI, SD |
ППТ, м2 BSA, m2 |
|---|---|---|---|---|---|---|
| При рождении At birth |
46 | 2,450 | -2,55 | — | -2,77 | — |
| 15 лет 8 мес 15 years 8 months |
161,8 | 50,0 | -0,94 | 19,1 | - 0,17 | 1,51 |
| 17 лет 7 мес 17 years 7 months |
169,0 | 59,7 | -0,51 | 20,9 | + 0,37 | 1,68 |
Таблица 2. Динамика половой формулы
Table 2. Dynamics of the sexual formula
| Возраст Age |
Половое развитие по Таннер Sexual development on the Tanner scale |
|||||
|---|---|---|---|---|---|---|
| 15 лет 8 мес 15 years 8 months |
V1 | Р2 | L0 | G1 | Ax0 | F0 |
| 17 лет 7 мес 17 years 7 months |
V2 | Р5 | L0 | G1 | Ax4 | F3 |
Гормональный профиль: тиреотропный гормон (ТТГ) – 1,29 мМЕ/мл (0,27-4,7); тироксин свободный (Т4 свободный) – 17,89 пг/мл (0,00-20,00); антитела к тиреоидной пероксидазе (АТ к ТПО) – 48 МЕ/мл (0-60); антитела к тиреоглобулину (АТ ТГ) – 22,8 МЕ/мл (0-60); эстрадиол – 11,8 пг/мл (0,0-39,8); тестостерон – 0,3 нг/мл (2,41-8,27); кортизол – 14,75 нг/мл (4,3-22,4); альфа-фетопротеин (АФП) – 1,2 нг/мл (0-8); бетасубъединица хорионического гонадотропина человека(бета-ХГЧ) – 0,94 мЕд/мл (0 – 2,67); лютеинизирующий гормон (ЛГ) – 42,45 мМЕ/мл (0-6); фолликулостимулирующий гормон (ФСГ) – 127,06 мМЕ/мл (1,4-18,1).
Ультразвуковое исследование щитовидной железы: контуры ровные, четкие; капсула тонкая, ровная; перешеек 2,3 мм, не утолщен. Правая доля 1,4*4,1*1,2 см, объем – 3,3 см3 . Левая доля 1,3*4,2*1,1 см, объем – 2,8 см3 . Суммарный объем – 6,1 см3. Эхогенность паренхимы средняя. Структура однородная. Сосудистый рисунок в режиме цветного доплеровского картирования (ЦДК) не изменен. Регионарные лимфатические узлы не увеличены. Область паращитовидных желез не изменена.
Ультразвуковое исследование органов брюшной полости, надпочечников, органов мочевыводящей системы – в пределах нормы.
Ультразвуковое исследование органов мошонки – яички отсутствуют в мошонке, паховых каналах.
Ультразвуковое исследование предстательной железы: размеры 1,36*1,06*1,38 см, объем – 1,04 см3. Паренхима однородная. Заключение: снижение объема (гипоплазия?) предстательной железы.
Рентгенография не доминантной (левой) кисти: костный возраст соответствует 14 годам, расчетные данные костного возраста стандартное отклонение (SD) = -1,3.
Диагноз: гипергонадотропный гипогонадизм. Анорхизм. Микропенис. Снижение объема предстательной железы.
Начата заместительная гормональная терапия: Сустанон-250 0,2 мл (50 мг) в/м каждые 28 дней с контролем уровня тестостерона на 6 день после инъекции и за 2 дня перед последующей инъекцией.
В последующем регулярное обследование каждые 6 месяцев для оценки гормонального статуса.
Через год после начала заместительной терапии проведено этапное имплантирование тестикулярных протезов.
03.07.2020 – имплантирование слева паховым доступом импланта «Promedon» T-Large.
10.11.2020 – имплантирование справа паховым доступом импланта «Promedon» T-Large.
В ходе выполнения вмешательства обращал на себя внимание малый объем мошонки, что создавало риск нарушения трофики тканей вследствие напряжения оболочек мошонки над имплантом. С целью снижения риска осложнений принято решение о выполнении протезирования раздельно с временным интервалом 4 месяца, что обеспечивало адаптацию тканей к наличию импланта и полное заживление раны к моменту выполнения протезирования с контралатеральной стороны.
Последняя госпитализация в отделение в августе 2021 года (17 лет, 7 месяцев). Рост 169 см, масса тела – 59,7 кг. SDS роста -0,51 SD; ИМТ – 20,9 кг/м2, SDS ИМТ= +0,37 ППТ= 1,68 м2 (табл. 1). Половые органы развиты по мужскому типу, кавернозные тела развиты удовлетворительно, размерами 6 см. Половое развитие по Таннер V2 P5 L0 G1 Ax 4 F3 (табл. 2).
Гормональный профиль: тиреотропный гормон (ТТГ) – 2,25 мМЕ/мл (0,7-6,5); тироксин свободный (Т4 свободный) – 1,18 пг/мл (0,88-1,76); антитела к тиреоидной пероксидазе (АТ к ТПО) – <28 МЕ/мл (0-60); антитела к тиреоглобулину (АТ ТГ) – <15 МЕ/мл (0-60); эстрадиол – 58 пг/мл (10,1-46); тестостерон – 1,49 нг/мл (1,36-12,01); инсулин – 7,61 мкМЕ/мл (2,6-11,1); кортизол – 16,88 нг/мл (4,3-22,4); глобулин связывающий половые гормоны (ГСПГ) – 44,9 нмоль/л (10,46-75,25); индекс свободного тестостерона – 11,52% (15,5-102); альфа-фетопротеин (АФП) – 0 нг/мл (0-8); бета-субъединица хорионического гонадотропина человека (бета-ХГЧ) – 1,94 мЕд/мл (0 – 2,67).
Ультразвуковое исследование щитовидной железы: контуры ровные, четкие, капсула тонкая, ровная; перешеек 4 мм, не утолщен. Левая доля 1,54*4,92*1,36 см. объем – 4,93 см3 . Правая доля 1,41*5,07*1,55 см, объем – 5,3 см3. Суммарный объем – 10,23 см3 (норма 7,43- 14,39 см3). Эхогенность паренхимы средняя. Структура однородная. Сосудистый рисунок в режиме ЦДК не изменен. Регионарные лимфатические узлы не увеличены. Область паращитовидных желез не изменена.
Ультразвуковое исследование органов брюшной полости, надпочечников, органов мочевыводящей системы – в пределах нормы.
Ультразвуковое исследование органов мошонки – яички отсутствуют в мошонке и паховых каналах. В мошонке определяются два эндопротеза. Ультразвуковое исследование предстательной железы: размеры 1,48*1,28*1,56 см. объем – 3,09 см3. Паренхима однородная. Заключение: снижение объема предстательной железы.
Диагноз клинический: гипоплазия единственного яичка, состояние после орхэктомии. Гипергонадотропный гипогонадизм.
В настоящее время получает поддерживающую терапию: тестостерон 0,4 мл (100 мг) в/м (Сустанон250) через 14 дней с контролем уровня тестостерона на 5-7 день после и за 2 дня до введения препарата.
Гормональный статус соответствует должному, фенотип – мужской, пациент удовлетворен своим внешним видом, социально адаптирован. Мошонка соответствует должному внешнему виду, полностью имитируя собственные гонады (рис. 1).
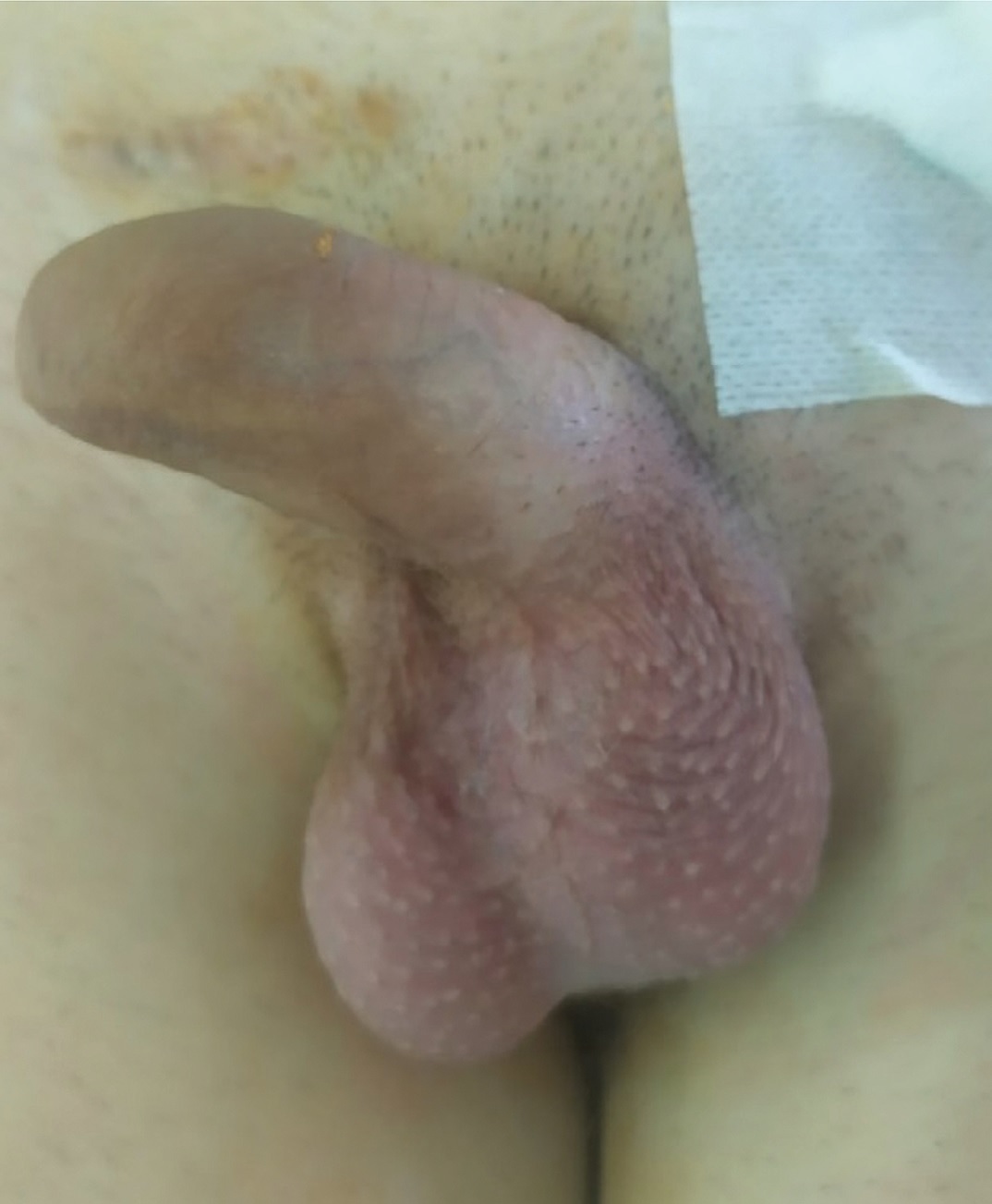
Рис. 1. Внешний вид мошонки после протезирования второго яичка. С момента установки первого импланта прошло 9 месяцев
Fig. 1. The appearance of the scrotum after prosthetics of the second testicle. 9 months have passed since the first implant was installed
ОБСУЖДЕНИЕ
В настоящее время необходимость проведения заместительной терапии у данной категории пациентов не является предметом дискуссии. Обсуждаемы лишь сроки начала терапии, при этом превалирует мнение о целесообразности назначения терапии не ранее 13,5-14 лет [1, 2].
Критериями эффективности проводимой терапии являются: развитие вторичных половых признаков, развитие костной и мышечной массы, достижение приемлемых показателей роста и веса [3].
Необходимый возраст к моменту протезирования является одним из спорных вопросов. Ряд авторов говорят о протезировании гонад во взрослом возрасте, приводя значительные по объему серии наблюдений, не рассматривая вопрос протезирования у подростков в принципе или касаясь его очень поверхностно. По их мнению, тестикулярное протезирование является преимущественно уделом урологии взрослого возраста и касается пациентов прежде всего с опухолями органов мошонки, предстательной железы, утраты гонады после травмы и т.д. [4, 5]. Между тем в литературе последних лет обобщен мультицентровой опыт протезирования в детском и подростковом возрасте, охватывающий несколько сотен случаев и рассматривающий протезирование до 18 лет как этап комплексной социальной и половой реабилитации, однако он освещает преимущественно опыт у пациентов с перекрутом яичка, его гипоплазией или монорхизмом [6]. Коррекция мошонки у пациентов эндокринными заболеваниями, нарушениями формирования пола носит характер единичных вмешательств, не подлежащих обобщенному опыту.
В подавляющем большинстве случаев протезирование выполняется с одной стороны при сохраненной контралатеральной гонаде, т.к. чаще всего, причина ее утраты или отсутствия носит односторонний характер – перекрут, крипторхизм, монорхизм, травма [7]. Сложности протезирования возрастают при необходимости билатерального вмешательства и обусловлены травматичностью операции, а также малым объемом скротальной полости, что обуславливает повышенный риск осложнений. Возможное натяжение тканей в данной ситуации делает нецелесообразным трансскротальный доступ [8]. Вышесказанное предопределяет проведение операции протезирования с разделением на этапы.
Следует отметить, что протезирование яичка преследует своей целью не просто воссоздание мошонки анатомически правильной формы, но и социальную реабилитацию пациента. Качественное выполнение протезирования позволяет максимально скомпенсировать дефект и получить результат, наиболее приемлемый для пациента с точки зрения адаптации его в социальной и половой сфере [9, 10]. В случае отсутствия второго собственного яичка социальная значимость протезирования существенно возрастает.
ВЫВОДЫ
Начатая в оптимально выбранные сроки заместительная гормональная терапия и своевременная этапная хирургическая коррекция наружных половых органов при скоординированной работе специалистов различных профилей позволяют к наступлению паспортной зрелости полностью компенсировать эндокринный статус и фенотип, ликвидировать косметический дефект половых органов и обеспечить адекватную социальную реабилитацию.
ЛИТЕРАТУРА
1. Дедов И.И., Петеркова В.А. Руководство по детской эндокринологии. М.: «Универсум Паблишинг» 2006; 600 с. 1. [Dedov I.I., Peterkova V.A. Pediatric Endocrinology Guide. M.: «Universum Publishing» 2006; 600 p. (In Russian)].
2. Bin-Abbas B., Conte F.A., Grumbach M.M., Kaplan S.L. Congenital hypogonadotropic hypogonadism and micropenis: effect of testosterone treatment on adult penile size why sex reversal is not indicated. J. Pediatr 1999; May;134(5):579-583. https://doi.org/10.1016/ s0022-3476(99)70244-1.
3. Dissaneevate P., Warne G.L., Zacharin M.R. Clinical evaluation in isolated hypogonadotrophic hypogonadism. J. Pediatr Endocrinol Metab 1998; Sep-Oct;11(5):631-638. https://doi.org/10.1515/ jpem.1998.11.5.631.
4. Mohammed, A., Yassin M., Ytndry D., Walker G. Contemporary of testicular prosthesis insertion. Arab. J. Urol 2015;13(4):282-286. https://doi.org/10.1016/j.aju.2015.09.001.
5. Hayon S., Michael J., Coward R.M. The modern testicular prosthesis: patient selection and counseling, surgical technigue, and outcomes. Asian Journal of Andrology 2020(22):64-69. https://doi.org/10.4103/ aja.aja_93_19.
6. Шорманов И.С., Щедров Д.Н., Куликов С.В., Комарова С.Ю., Сизонов В.В., Каганцов И.М.и др. Опыт протезирования яичка в детском и подростковом возрасте: результаты мультицентрового исследования. Экспериментальная и клиническая урология 2018(3):84- 90. [Shormanov I.S., Schedrov D.N., Kulikov S.V., Komarova S.Yu., Sizonov V.V., Kagantsov I.M. et al. Experience of testicular prosthetics in children and adolescents: the results of a multicenter study. Eksperimentalnaya i klinicheskaya urologiya=Experimental and Clinical Urology 2018(3):84-90. (In Russian)].
7. Marshal S.M.D. Potential problems with testicular prostheses. Urology 1986;28(5):388-390. https://doi.org/10.1016/0090-4295(86)90068-3.
8. Шорманов И.С., Щедров Д.Н., Морозов Е.В., Писарева М.В., Гарова Д.Ю. Варианты осложнений при синдроме острой мошонки у детей. Урология 2020(3):77-80. [Shormanov I.S., Schedrov D.N., Morozov E.V., Pisareva M.V., Garova D.Yu. Complications of the «acute scrotum syndrome» in children. Urologiya=Urology 2020(3):77-80. (In Russian)]. https://doi.org/10.18565/urology.2020.3.77-80.
9. Шорманов И.С., Щедров Д.Н. Особенности протезирования яичка у пациентов, перенесших орхэктомию в аспекте медико-социальной реабилитации. Урологические ведомости 2018;8(2):43-52. [Shormanov I.S., Schedrov D.N. Medical and social rehabilitation following testicular prosthesis in post-orchiectomy patients. Urologicheskie vedomosti=Urological statements 2018;8(2):43-52. (In Russian)]. https://doi.org/10.17816/ uroved8243-52.
10. Trost L. Future considerations in prosthetic urology. Asian Journal of Andrology 2020(22):70-75. https://doi.org/10.4103/aja.aja_103_19.







