ВВЕДЕНИЕ
Перкутанная нефролитотрипсия (ПНЛ) является наиболее распространенной, доступной и применяемой в клинической работе операцией для лечения нефролитиаза [1].
Важный этап для улучшения результатов ПНЛ — тщательно спланированная тактика вмешательства, которая напрямую зависит от опыта и навыков хирурга. Основой планирования становится выбор объема хирургического вмешательства, размер инструмента, количество и локализация доступов. Выбор осуществляется методом анализа клинических показателей пациента, особенностей течения заболевания, строения верхних мочевых путей (ВМП) и нефролито-метрических показателей [2-4].
Одним из главных ограничений для обработки больших объемов информации специалистом является время [5]. В последние годы было предложено множество технологических инноваций для улучшения результатов хирургических вмешательств и снижения послеоперационных осложнений. Важным трендом на сегодняшний день становится обработка больших объемов данных с применением машинного обучения (МО), объективизация принятия решений [6-8].
Использование искусственного интеллекта (ИИ) в медицине показало широкий спектр возможностей для увеличения эффективности принятия решений в клинической работе [9, 10].
И позволяет оптимизировать процессы обработки информации, уменьшая количество времени, затрачиваемого на получение искомых решений, на 88% [11]. По данным исследований, преобладающее большинство специалистов испытывают доверие к ИИ и считают полезным использование алгоритмов в качестве инструмента принятия решений. Данный подход позволяет увеличить точность и ускорить процесс выполнения клинической работы [12].
С целью прогнозирования решений для персонализированного подхода в лечении нефролитиаза с применением ПНЛ нами была разработана и предложена модель алгоритма для применения в клинической работе.
МАТЕРИАЛЫ И МЕТОДЫ
Общее количество пациентов, получавших лечение в НИИ урологии и интервенционной радиологии имени Н.А. Лопаткина – филиале ФГБУ «НМИЦ радиологии» Минздрава России и принявших участие в исследовании, составило 1000 человек, мужчин было 419 (41,9%), женщин – 581 (58,1%). Возраст пациентов, входящих в исследование, колебался от 18 до 88 лет (52,3±13,47).
Критерии включения:
- возраст пациента старше 18 лет;
- ПНЛ как первое хирургическое вмешательство в текущую госпитализацию;
- нормальные показатели свертывающей системы крови;
- отсутствие злокачественных новообразований почки на стороне операции.
Критерии исключения:
- острый воспалительный процесс любой локализации;
- отсутствие сохранности почечной паренхимы (истончение паренхимы до размеров менее 1 см);
- другие сопутствующие заболевания в стадии декомпенсации.
Все пациенты были обследованы следующим способом: собран анамнез, проведено ультразвуковое исследование (УЗИ), выполнена урография, компьютерная томография (КТ) мочевыводящих путей с определением размера конкрементов и плотности по HU, взят биохимический анализ крови (креатинин, мочевина), общий анализ крови, посев мочи. Все пациенты были госпитализированы в плановом порядке.
Интраоперационно пациенту однократно проводилась антибактериальная терапия по результатам посева мочи; при развитии пиелонефрита лечение продолжалось до купирования инфекционно-воспалительного процесса.
Контрольное обследовании на наличие резидуальных конкрементов проводилось на 2-3 сутки после операции и включало в себя УЗИ и КТ мочевыводящих путей. Резидуальные конкременты расценивались как клинически значимые при размере более 4 мм.
Все переменные в наблюдениях поделены на 2 группы.
Первую группу представляют данные входных переменных – это информация, которую мы получили о пациентах до начала лечения. К ним отнесли информацию о сопутствующих заболеваниях, конституционных особенностях, данные КТ и лабораторные анализы.
Во вторую группу вошли данные переменных, полученные в процессе лечения — метод хирургического вмешательства, количество доступов и т.д. (табл. 1). Вторая группа переменных будет персонализировано предсказываться алгоритмом МО для упрощения принятия решения лечащим врачом.
Таблица 1. Перечень переменных
Table 1. List of variables
| № | Показатель/Value | № | Показатель/Value |
|---|---|---|---|
| 1 | Пол/Gender | 1 | Размер нефроскопа/Size of nephroscope |
| 2 | Возраст/Age | 2 | Интраоперационная установка стента Intraoperative stent placement |
| 3 | ИМТ/BMI | 3 | Одномоментная уретероскопия/КУЛТ /Simultaneous ureteroscopy/ ureterolithotripsy |
| 4 | ССЗ/Сardiovascular diseases | 4 | Количество доступов/Number of accesses |
| 5 | Гипертоническая болезнь/Hypertension | 5 | Доступ через верхнюю группу/Access through the upper pole |
| 6 | Сахарный диабет/Diabetes mellitus | 6 | Доступ через среднюю группу/Access through the middle calyx |
| 7 | ХБП/CKD | 7 | Доступ через нижнюю группу/Access through the lower calyx |
| 8 | Предварительное дренирование/Pre-drainage | 8 | Длительность операции (в мин.)/Operative time (min.) |
| 9 | Рецидивирующий характер заболевания/ Recurrence of the disease | 9 | Наличие резидуальных конкрементов/ Presence of Residual Stones |
| 10 | Предыдущее лечение/Previous treatment | ||
| 11 | Посев мочи/Urine culture | ||
| 12 | Концентрация креатинина/Creatinine concentration | ||
| 13 | Концентрация мочевины/Urea concentration | ||
| 14 | Лейкоциты в ОАК/Leukocytes in the CBC | ||
| 15 | Гидронефроз/Hydronephrosis | ||
| 16 | Кисты почки/Kidney cysts | ||
| 17 | Нарушение уродинамики (в мес.)/Violation of urodynamics | ||
| 18 | Аномалия ВМП/Anomaly of the upper urinary tract | ||
| 19 | Стриктура мочеточника/Ureteral stricture | ||
| 20 | Визуализация конкремента на урографии/ Visualization of the stone on X-ray | ||
| 21 | Плотность (по HU)/Density (according to HU) | ||
| 22 | Размер конкремента/Stone size | ||
| 23 | Локализация/Localization |
Разделение на обучающую и контрольную выборку отличалось в зависимости от целевой переменной для получения наиболее точного результата. Максимальное различие в выборках составило 600 и 400 случаев (пациентов) (60% и 40%), минимальное –
800 и 200 (80% и 20%). Для итоговой проверки алгоритма (тестовая выборка) было добавлено 30 тестовых клинических случаев (или 3% от общей выборки, используемой для разработки алгоритма ИИ). Обучающая выборка содержит записи данных, используемые для обучения модели. Контрольная выборка представляет собой независимый набор наблюдений, применяемый для проверки качества модели. Тестовые наблюдения были добавлены после создания алгоритма, для проверки качества и удобства применения модели в клинической работе.
При предсказании тестовых клинических случаев, использовалось поэтапное предсказание (где для создания последовательности лечения, алгоритм опирается на предсказанные раннее значения).
В первую группу переменных вошли данные по 23 показателям: пол, возраст, индекс массы тела (ИМТ), наличие сердечно-сосудистых заболеваний (ССЗ), стадия гипертонии, сахарный диабет (СД), хроническая болезнь почек (ХБП), наличие предварительного дренирования чашечно-лоханочной системы (ЧЛС), рецидивирующий характер мочекаменной болезни, наличие и характер предыдущего лечения, креатинин и мочевина в биохимическом (БХ) анализе крови до операции, лейкоциты в общем анализе крови (ОАК), бактериологические исследования мочи, наличие и длительность расширения ЧЛС, наличие и размер кист почек на стороне операции, патологии верхних мочевых путей (ВМП) и мочеточника, визуализация конкремента на урографии, плотность, размер и локализация конкремента.
Ко второй группе переменных (прогнозируемых) отнесли 9 показателей: размер нефроскопа, потребность в одномоментной уретероскопии/контактной уретеролитотрипсии (КУЛТ), интраоперационную установку стента, количество и локализацию доступов, длительность операции, наличие резидуальных конкрементов (табл. 1).
Адекватность распределения и достоверность различий выходных результатов проверены с использованием критериев Пирсона и критерия Стъюдента.
Достоверными признавались различия при значении р не менее 0,05. Связь между данными оценивалась с помощью методики парной корреляции и вычислением r – коэффициента. При значении r>0,7 сопряжение признавалось сильным, при значении r от 0,5 до 0,7 корреляции связь была средней и при значении коэффициента r<0,5 связь признавалась слабой. Затем определялись значения важности переменных. Сумма важности предикторов равна 1,0, а значения являются относительными. Для создания алгоритма использовались только предикторы с сильной связью, далее определялась их важность для прогнозирования. Важность предикторов высчитывалась в контрольной выборке и не связана с точностью модели. Обработка данных проводилась с применением программ IBM SPSS Statistics и Modeler методом моделирования нейронных сетей (многослойного перцептрона).
РЕЗУЛЬТАТЫ
Первый изучаемый блок переменных включал в себе информацию о планировании объема хирургического вмешательства.
Нами была проанализирована взаимосвязь входных переменных с размером применяемого нефроскопа, потребностью в одномоментной уретероскопии/КУЛТ или в интраоперационной установке стента.
Выбор размера нефроскопа не только определяет продолжительность оперативного вмешательства, но и оказывает влияние на послеоперационные осложнения, такие как геморрагические или инфекционно-воспалительные [13, 14]. В исследовании использовались 2 нефроскопа: стандартный (с тубусом диаметром 24 или 26 CH) и/или миниатюризированный (c тубусом 15 или 16,5 CH). Точность прогноза составила 82,2%, AUC – 0,838. При ранжировании с применением критерия Пирсона наиболее значимыми предикторами для построения модели по предсказанию оптимального размера нефроскопа для применения стали следующие показатели: размер камня – 0,21, локализация камня – 0,15, ССЗ и лейкоциты ОАК – 0,10, ИМТ – 0,09, визуализация конкремента на урографии – 0,09, предварительное дренирование – 0,07, нарушение уродинамики – 0,06, гипертония – 0,05 и гидронефроз – 0,04. При использовании алгоритма на тестовой выборке, точность составила 73,8%/AUC 0,772.
Важным аспектом планирования хирургического вмешательства может стать необходимость подготовки нужных расходных материалов.
Интраоперационная установка стента будет пролонгировать длительность вмешательства и при длительном ношении внутреннего стента (более 3 дней) приведет к необходимости повторного вмешательства для удаления/замены стента. Также внутренние стенты могут способствовать развитию пиелонефрита в послеоперационном периоде [15, 16]. Все интраоперационные установки стентов проводились антеградно через тубус нефроскопа. Точность модели составила 93,3%, AUC 0,93. Были выявлены Наиболее важные предикторы для по- строения модели: наличие стриктуры мочеточника – 0,20, наличие и характер предыдущего лечения – 0,13, локализация конкремента – 0,13, уровень мочевины – 0,12 и аномалии ВМП – 0,12, визуализация конкремента на урографии – 0,09, предварительное дренирование – 0,09, гидронефроз – 0,05, размер камня – 0,04 и результаты посева мочи – 0,03. На тестовых наблюдениях точность составила 84%, AUC 0,768.
Применение сочетанных хирургических вмешательств, всегда сопряжено с удлинением времени операции и увеличением рисков послеоперационных осложнений. КУЛТ применялась не только при камнях мочеточника, но и при мигрировании фрагментов конкремента во время выполнения ПНЛ. Также при выявлении стриктуры мочеточника и при невозможности установки первым этапом мочеточникового стента могла быть выполнена уретероскопия для визуализации протяженности, проходимости и состояния слизистой в зоне стриктуры. Точность модели для принятия решения в проведении одномоментной КУЛТ/уретероскопии составила 98,5, AUC 0,736. При построении модели наиболее важными переменными для алгоритма были определены: стриктура мочеточника – 0,12, предварительное дренирование – 0,09, длительность нарушения уродинамики – 0,08, предыдущее лечение – 0,08 и локализация конкремента – 0,08, гипертония – 0,06, ССЗ – 0,06, лейкоциты в ОАК – 0,05, размер камня – 0,05 и уровень креатинина – 0,05. Тестовые наблюдения при анализе алгоритмом показали высокую точность ИИ, и составили 94,5%, AUC 0,776 (табл. 2).
Таблица 2. Важность предикторов при предсказании объема хирургического вмешательства.
Table 2. The importance of signs in predicting the extent of surgical intervention
| Показатель/ Indicators | Размер нефроскопа Size of nephroscope |
Интраоперационная установка стента Intraoperative stent placement | Одномоментная уретероскопия/КУЛТ Simultaneous ureteroscopy/ ureterolithotripsy |
|---|---|---|---|
| Точность/AUC Accuracy/AUC | 82,2%/ 0,838 | 93,9%/0,930 | 98,5%/0,736 |
| Предикторы Predictor |
Важность предикторов. Predictor importance | ||
| Аномалии ВМП Anomaly of the upper urinary tract |
– | 0,12 | – |
| Гидронефроз Hydronephrosis |
0,04 | 0,05 | – |
| Гипертония Hypertension |
0,05 | – | 0,06 |
| Длительность нарушения уродинамики Violation of urodynamics |
0,06 | – | 0,08 |
| ИМТ BMI |
0,09 | – | – |
| Лейкоциты ОАК Leukocytes in the CBC |
0,10 | – | 0,05 |
| Локализация конкремента Localization |
0,15 | 0,13 | 0,07 |
| Стриктура мочеточника Ureteral stricture |
– | 0,20 | 0,12 |
| Посев мочи Urine culture |
– | 0,03 | – |
| Предварительное дренирование Pre-drainage |
0,07 | 0,09 | 0,09 |
| Предыдущее лечение Previous treatment |
– | 0,13 | 0,08 |
| Размер камня Stone size |
0,21 | 0,04 | 0,05 |
| Визуализация конкремента на урографии. Visualization of the stone on X-ray | 0,09 | 0,09 | – |
| ССП Сardiovascular pathology |
0,10 | – | 0,06 |
| Концентрация креатинина Creatinine concentration |
– | – | 0,05 |
| Концентрация мочевины Urea concentration |
– | 0,12 | – |
Помимо определения методов оперативного вмешательства, хирургу необходимо знать количество и расположение доступов в ЧЛС. Наиболее эффективным по точности и удобству созданию пункционных доступов является одномоментная поочередная расстановка струнроводников по чашечкам предполагаемого интереса через пункционную иглу до момента первого бужирования. Доступы совершаются под УЗ- и рентген-контролем. Если в ходе операции потребуется дополнительные доступы, УЗ-визуализация может ухудшиться вследствие развития гематомы. Точность прогноза по количеству доступов составила 92,6%, AUC 0,824. Заданные значения были от 1-3 (больше доступов среди исследуемых клинических случаев не наблюдалось). Наибольший вес имели предикторы: мочевина – 0,28, размер камня – 0,16, локализация – 0,14, возраст – 0,12, гидронефроз – 0,08, ХБП – 0,08, результат посева мочи – 0,06, размер нефроскопа – 0,05 и пол – 0,04. При применении тестовых исследований на алгоритме, точность составила 90,9%, AUC 0,934.
Для расчета локализации доступа ЧЛС условно была поделена на верхнюю, среднюю и нижнюю группу чашечек. Доступ через верхнюю группу сопряжен с наибольшим количеством трудностей для хирурга. Это и повреждение плевральной полости, и развитие кровотечения, и большее угловое отклонение тубусом при работе в ЧЛС, которое, растягивая ткань почки, может привести к множеству серьезных осложнений [17, 18]. Помимо этого, при высоком, межреберном доступе увеличивается и болевой симптом в послеоперационном периоде в сравнении с доступами через среднюю или нижнюю группу чашечек [19]. Несмотря на трудности и риски, часто верхняя локализация доступа бывает необходима для конкретного клинического случая. В такой ситуации для хирурга важно еще до начала операции понимать оправданность его решений. Для верхней группы точность предсказания составила 95%, AUC 0,933. Важными предикторами были выявлены: аномалии ВМП – 0,25, локализация конкремента – 0,23, количество доступов – 0,17, патологии мочеточника – 0,11, размер камня – 0,07, гипертония – 0,06, гидронефроз – 0,03, ожирение – 0,03. При прогнозировании создания пункционного доступа через верхнюю группу чашечек в тестовой группе, точность прогноза составила 88,0%, AUC 0,856.
Доступ через среднюю группу чашечек часто применяется при невозможности нефроскопии средней группы из классического доступа через нижнюю группу чашечек. В силу анатомии ЧЛС нефроскопию верхней группы чашечек из доступа средней группы сделать практически во всех случаях невозможно, но немаловажным преимуществом является хороший обзор на лоханочно-мочеточниковый сегмент и удобный угол для антеградной установки стента. Точность предсказания для средней группы чашечек составила 91,2%, AUC 0,834. Предикторы, имевшие наибольший вес при построении модели и относящиеся к категории «важные»: количество доступов – 0,31, локализация – 0,14, предыдущее лечение – 0,13, лейкоциты в ОАК – 0,10, ХБП – 0,07, концентрация креатинина – 0,06, гидронефроз – 0,06, предварительное дренирование – 0,06, интраоперационная установка стента – 0,04 и посев мочи – 0,02. Точность прогноза для тестовой выборки составила 86,1%, AUC 0,731.
Наиболее безопасным доступом является доступ через нижнюю группу чашечек, точность прогноза для данной локализации составила 91,2 %, AUC 0,825. При создании алгоритма, было выявлено, что к наиболее важным предикторам относятся: аномалия ВМП – 0,38, локализация камня – 0,29, лейкоциты ОАК – 0,08, предварительное дренирование – 0,05, количество доступов – 0,05, размер нефроскопа – 0,02, посев мочи – 0,02 и интраоперационная установка стента – 0,02 (табл. 3). Точность прогноза для тестовых наблюдений составила 82,46%, AUC 0,716.
Таблица 3. Важность предикторов при предсказании количества и локализации доступов
Table 3. The importance of signs in predicting the number and location of accesses
| Показатель/ Indicators | Количество доступов Number of accesses |
Верхняя группа Access through the middle calyx | Средняя группа Simultaneous ureteroscopy/ ureterolithotripsy | Нижняя группа Access through the lower calyx |
|---|---|---|---|---|
| Точность/AUC Accuracy/AUC | 92,6 % / 0,824 | 95%/0,933 | 91,2%/0,834 | 91,2%/0,825 |
| Предикторы Predictor |
Важность предикторов. Predictor importance | |||
| Аномалии ВМП Anomaly of the upper urinary tract |
– | 0,25 | – | 0,38 |
| Возраст Age |
0,12 | – | – | – |
| Гидронефроз Hydronephrosis |
0,08 | 0,03 | 0,06 | – |
| Гипертония Hypertension |
– | 0,06 | – | – |
| Интраоперационная установка стента Intraoperative stent placement |
– | – | 0,04 | 0,02 |
| Количество доступов Number of accesses |
– | 0,17 | 0,31 | 0,05 |
| Лейкоциты ОАК Leukocytes in the CBC |
– | – | 0,10 | 0,13 |
| Локализация конкремента Localization |
0,14 | 0,23 | 0,14 | 0,29 |
| ИМТ BMI |
– | 0,03 | – | – |
| Стриктура мочеточника Ureteral stricture |
– | 0,11 | – | – |
| Пол Gender |
0,04 | – | – | – |
| Посев мочи Urine culture |
0,06 | 0,02 | 0,02 | 0,02 |
| Предварительное дренирование Pre-drainage |
– | – | 0,06 | 0,08 |
| Предыдущее лечение Previous treatment |
– | – | 0,13 | – |
| Размер конкремента Stone size |
0,14 | 0,07 | – | – |
| Размер нефроскопа Size of nephroscope |
0,05 | 0,02 | – | 0,02 |
| Концентрация креатинина Creatinine concentration |
– | – | 0,07 | – |
| Концентрация мочевины Urea concentration |
0,28 | – | – | – |
| ХБП CKD |
0,08 | – | 0,07 | – |
Длительность оперативного вмешательства, напрямую влияющая на вероятность развития осложнений, может быть предсказана с точностью 87,3%. Наиболее важными предикторами оказались локализация, размер камня и количество доступов. Их значимость составила по 0,20. Менее значимыми переменными оказались: верхняя группа с весом 0,06, размер нефроскопа – 0,06, средняя группа – 0,05, мочевина – 0,04, рецидивность заболевания – 0,03, предыдущее лечение – 0,03 и гидронефроз – 0,03. Применение алгоритма на тестовой группе показало точность 73,8%. Прежде чем проводить исследования и разрабатывать алгоритм принятия решения, мы должны быть уверены, что решения, принятые в исследуемых наблюдениях, были правильными или хотя бы максимально приближеными к идеальным благодаря опыту и навыку врачей, проводивших нефролитотрипсию. Эффективность ПНЛ можно выразить в цифрах, отсутствие резидуальных конкрементов («stone free») является прямым показателем качества проведенной операции. Не всегда при вмешательстве удается достичь «stone free» результата в силу кровотечения, или продолжительности вмешательства, или иных обстоятельств.
Вероятность наличия резидуальных конкрементов после оперативного вмешательства определяет потребность в дополнительных вмешательствах и длительность госпитализации пациента. На наличие резидуальных конкрементов влияет множество факторов. Помимо локализации конкремента, важнейшей составляющей становится опыт хирурга при выполнении ПНЛ. Выборка наблюдений в нашем клиническом исследовании не является типичной для большинства стационаров, так если рассматривать локализацию конкремента наиболее распространенной становится локализация в лоханке (222 случаев), а на втором месте – коралловидные конкременты стадии К4 (127 случаев). В исследовании для коралловидных камней и камней с локализацией в разных чашечках применялись отдельные метки. Соответственно, учитывая высокий процент пациентов с выраженной каменной нагрузкой, из 1000 прооперированных пациентов резидуальные конкременты наблюдались только у 168 больных в ЧЛС и у 16 в мочеточнике, что отражает большой опыт хирургов в исследуемых наблюдениях.
Прогноз резидуальных конкрементов осуществлялся как на наличие резидуальных камней в ЧЛС, так и миграцию фрагментов в мочеточник. Точность составила 84,1%, AUC 0,712. Переменные, имевшие наибольший вес связей и ранжированные алгоритмом как важные, стали сл. показатели: длительность операции – 0,21, размер камня – 0,17, локализация – 0,16, гидронефроз – 0,08, ИМТ – 0,07, результат посева мочи – 0,07, длительность нарушения уродинамики – 0,05, предварительное дренирование – 0,05, количество доступов – 0,05 и рецидивность заболевания – 0,05 (табл. 4). При прогнозировании в тестовой выборке, точность составила 82,6%, AUC 0,659.
Таблица 4. Важность предикторов при предсказании наличия резидуальных камней
Table 4. The importance of signs in predicting the presence of residual stones
| Показатель/ Indicators | Резидуальные конкременты Residual fragments |
|---|---|
| Точность/AUC Accuracy/AUC | 84,1%/0,712 |
| Предикторы Predictor |
Важность предикторов Predictor importance |
| Длительность операции Operative time |
0,21 |
| Размер конкремента Stone size |
0,17 |
| Локализация конкремента Localization |
0,16 |
| Гидронефроз Hydronephrosis |
0.08 |
| ИМТ BMI |
0,07 |
| Посев мочи Urine culture |
0.07 |
| Нарушение уродинамики Violation of urodynamics |
0,05 |
| Предварительное дренирование Pre-drainage |
0,05 |
| Количество доступов Number of accesses |
0.05 |
| Рецидивность заболевания Recurrence of the disease |
0,05 |
В тестовых наблюдениях информация о данных переменных максимально приближена к клиническому применению алгоритма. Предсказанная переменная включалась в набор данных и в последующем применялась для прогноза дальнейших переменных. Предсказание происходило поэтапно, каждый раз с добавлением «новой» информации.
Клинический пример
Пациентка Н., 54 года. Диагноз: Аномалия ВМП: подковообразная почка, мочекаменная болезнь (МКБ), камень лоханки правой половины подковообразной почки. Из анамнеза: длительно страдает МКБ, в 2013 году выполнена ПНЛ справа, в 2017 – КУЛТ справа, выявлена девиация и стриктура в/3 правого мочеточника.
Данные КТ: Размер конкремента 2,5 х 1,5 см, плотность 1100 HU. При в/в контрастировании определяется пиелоэктазия, девиация и непротяженная стриктура в/3 правого мочеточника.
При сравнении клинического случая с прогнозом алгоритма отмечается высокий уровень точности. Выбор размера нефроскопа, потребность в одномоментной уретероскопии, установки стента, локализации и количества доступа, наличие резидуальных камней полностью совпало с клиническим случаем. Все переменные были предсказаны верно, кроме длительности оперативного вмешательства, где алгоритм спрогнозировал продолжительность 71,5 минут, но само хирургическое вмешательство в общей сложности заняло 80 минут (табл.5).
Таблица 5. Пример прогнозирования для хирургического вмешательства пациента с аномалией развития по типу подковообразной почки
Table 5. Example of prediction for surgical intervention of a patient with a developmental anomaly such as a horseshoe kidney
| Предиктор Predictor |
Точность Accuracy/AUC |
Решение нейросети Neural network solution |
Клинический случай Clinical case |
|---|---|---|---|
| Размер нефроскопа Size of nephroscope |
0,774 | ПНЛ/PCNL | ПНЛ/PCNL |
| Одномоментная уретероскопия/КУЛТ Simultaneous ureteroscopy/ ureterolithotripsy |
0,995 | Нет/No | Нет/No |
| Интраоперационная установка стента Intraoperative stent placement |
0,589 | Да/Yes | Да/Yes |
| Количество доступов Number of accesses |
0,973 | 1 | 1 |
| Доступ через верхнюю группу Access through the upper pole |
0,809 | Да/Yes | Да/Yes |
| Доступ через среднюю группу Access through the middle calyx |
0,934 | Нет/No | Нет/No |
| Доступ через нижнюю группу Access through the lower calyx |
1,0 | Нет/No | Нет/No |
| Длительность операции (в мин) Operative time (min) | 0,758 | 71,5 | 80 |
Наличие резидуальных конкрементов |
0,969 |
Нет/No |
Нет/No |
ОБСУЖДЕНИЕ
Несмотря на высокие показатели эффективности, точности и AUC, при использовании в клинической работе применение ИИ все еще имеет свои ограничения.
Основными ограничениями остается недостаточное техническое оснащение и недопонимание целей применения алгоритмов МО.
В работах, посвященных разработке и применению ИИ для лечении нефролитиаза, существует разный подход к созданию алгоритма персонализированного лечения. Часть исследований основной целью ставит определение минералогического состава конкремента (используя только КТ или биохимический анализ мочи), в то время как другие прогнозируют эффективность выполнения ПНЛ [20-24].
Последние годы отмечается возросший интерес научного сообщества к применению ИИ в медицине, вместе с тем участились и ошибки в разработке дизайна исследований. Преобладающее количество ошибок – использование упрощенных методов МО и недостаточный объем выборки [25, 26].
В крупных исследованиях, посвященных персонализированному подходу при лечении больных МКБ, обычно рассматриваются разные методы лечения (включая дистанционную литотрипсию (ДЛТ), КУЛТ, пиелотомию, ретроградную интраренальную хирургию (РИРХ)), где в каждой подгруппе количество наблюдений составляет не более нескольких сотен [27]. Этот малый объем выборки приводит к ошибкам в вычислениях и в последствии к ложным результатам и прогнозам.
Одним из ключевых и наиболее сложно решаемых вопросов в МО остается необходимость в больших объемах данных, что является проблематичным при разработке алгоритмов для редких болезней или технически сложных операций. Расчет адекватного объема выборки остается актуальной проблемой [28]. Для преодоления этой технической трудности, в зарубежных исследованиях появилась тенденция к мультицентровым исследованиям с объемом выборки составляющей до 10 000 наблюдений [29-31].
Несмотря на многочисленные упоминания в научных работах о важности расчета адекватного объема выборки, в данном исследовании мы выявили закономерности, которые важно учитывать при дальнейших работах по созданию ИИ в медицине.
Так, например, в выборке при одиночных камнях лоханки доступ через нижнюю группу чашечек составлял 89,6% (200 случаев).
При этом при некоторых аномалиях развития ВМП, в частности, подковообразных почках, единственной чашечкой для создания безопасного доступа, согласно данным литературы, является верхняя группа [32, 33].
Всего с аномалией ВМП по типу подковообразной почки в исследовании наблюдалось 20 больных, при этом, доступ через верхнюю группу был выполнен у 17 (включая и сочетанные доступы). Поскольку не менее важным для принятия решения о проекции доступа является локализация конкремента, стоит отметить, что одиночный конкремент лоханки, при подковообразной почке составляла всего 6 случаев.
Но при прогнозировании алгоритмом чашечки доступа наиболее важными предикторами при расчете доступа через нижнюю или через верхнюю группу является аномалия развития ВМП.
Фактически при создании модели важен не столько объем клинических данных, сколько закономерность «исключений» из правил, позволяющих при появлении «аномалий выборки» или «редкого клинического случая» грамотно спрогнозировать персонализированный подход.
Если рассматривать вес переменных для прогнозирования количества доступов, обращает на себя внимание высокая связь с концентрацией мочевины в крови и абсолютное отсутствие связи с концентрацией креатинина. Оба показателя связаны с экскреторной функцией почки и имеют отношение к каменной нагрузке ЧЛС. При рассмотрении графика зависимости становится видно, что среднее значение концентрации креатинина для трех доступов лишь на 1/5 отличается от остальных, а для уровня мочевины эта разница значительна, и в среднем отличается в 2,5 раза (рис. 1). В зависимости от характера предыдущих вмешательств, изменяется и прогноз наиболее оптимальной локализации доступа. Так наличие у пациента в анамнезе ПНЛ на стороне операции в количестве 1 и более раз или пиелолитотомии увеличивает, по данным вы- строенных алгоритмом, вероятность наиболее оптимального доступа через среднюю группу чашечек.
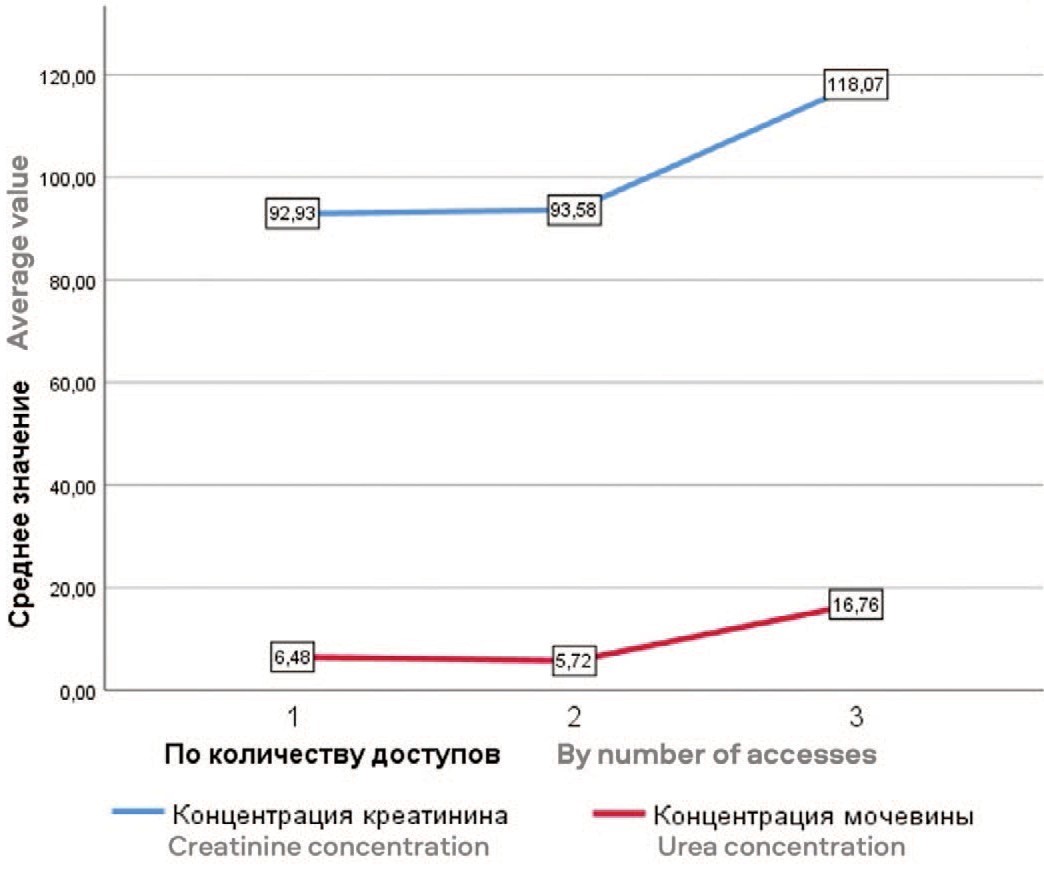
Рис. 1. График взаимосвязи среднего значения креатинина и мочевины в зависимости от количества доступов
Fig. 1. Graph of the relationship between the average values of creatinine and urea depending on the number of accesses
При исследовании взаимосвязей нами была подтверждена зависимость применяемого нефроскопа от размера конкремента, влияние потребности в проведении уретероскопии от стриктуры мочеточника (всего таких случаев было выявлено 17 на 1000 наблюдений), локализации доступов от расположения конкремента и аномалии ВМП, наличие резидуальных камней от длительности проведения хирургического вмешательства.
Также нами была выявлена зависимость пролонгирования оперативного вмешательства не только от размера и локализации конкремента, но и от локализации доступа, например, при доступе через верхнюю группу чашечек.
Вышеотмеченные наблюдения не являлись целью исследования, но отражение данных фактов в работе может стать подтверждением адекватности выборки и точности алгоритма.
При тестировании в клинической работе ИИ демонстрирует вариативность и правильность принятия решений, сопоставимую с клиническим мышлением опытного в данной области врача. Помимо этого, большой объем выборки и широкий спектр представленных в базе клинических случаев позволяет использовать прогностическую модель при самых неоднозначных и редких медицинских случаях.
ЗАКЛЮЧЕНИЕ
Результаты применения алгоритма для персонализированного прогноза при хирургическом лечении нефролитиаза показали высокую точность и эффективность. Несмотря на удобство использования алгоритма в клинической работе, применение ИИ все еще имеет ограничения. Так, например, одним из главных недостатков применения данной разработки, остается ограниченность методов хирургического лечения в принятии решений (в алгоритме прогноз совершался только для ПНЛ). Одним из вариантов решения данной задачи может стать разработка дополнительных алгоритмов для персонализированного прогноза альтернативных методов хирургического вмешательства, таких как РИРХ или ДЛТ. При объединении данных станет возможным выбор наиболее оптимального и наименее инвазивного метода хирургического лечения, основываясь на результатах прогноза ИИ.
Данные разработки позволят сократить клиническим врачам время на прогнозирование лечения, оптимизировать работу стационаров, дать «второе мнение» для молодых специалистов при анализе сложных клинических случаев и «унифицировать» стратегию принятия решения при разборе случаев врачебных ошибок или послеоперационных осложнений.
Рассматривая перспективу применения данных технологий на практике, учитывая их удобство в клинической работе, в научном сообществе станет возможным создать алгоритмы по каждому из нозологических случаев и методов лечения.
ЛИТЕРАТУРА
- Türk C, Petřík A, Sarica K, Seitz C, Skolarikos A, Straub M. EAU guidelines on inter- ventional treatment for urolithiasis. Eur Urol 2016;69(3):475–82. https://doi.org/10.1016/ j.eururo.2015.07.041
- Kallidonis P, Kyriazis I, Kotsiris D, Koutava A, Kamal W, Liatsikos E. Papillary vs non- papillary puncture in percutaneous nephrolithotomy: a prospective randomized trial. J Endourol 2017;31(S1):S4–S9. https://doi.org/10.1089/end.2016.0571
- Kyriazis I, Kallidonis P, Vasilas M, Panagopoulos V, Kamal W, Liatsikos E. Challenging the wisdom of puncture at the calyceal fornix in percutaneous nephrolithotripsy: feasibility and safety study with 137 patients operated via a non-calyceal percutaneous track. World J Urol 2017;35(5):795–801. https://doi.org/10.1007/s00345-016-1919-y
- Kallidonis P, Kalogeropoulou C, Kyriazis I, Apostolopoulos D, Kitrou P, Kotsiris D. Per- cutaneous nephrolithotomy puncture and tract dilation: evidence on the safety of ap- proaches to the infundibulum of the middle renal calyx. Urology 2017;107:43–8. https://doi.org/10.1016/j.urology.2017.05.038
- Mintz Y, Brodie R. Introduction to artificial intelligence in medicine. Minimally Invasive Therapy & Allied Technologies 2019;28(2):73-81. https://doi.org/10.1080/13645706.2019.1575882.
- Checcucci E, Amparore D, Volpi G, Piramide F, De Cillis S, Piana A et al. Percutaneous puncture during PCNL: new perspective for the future with virtual imaging guidance. World J Urol 2022;40(3):639-50. https://doi.org/10.1007/s00345-021-03820-4.
- Antoniou V, Gauhar V, Kallidonis P, Skolarikos A, Veneziano D, Liatsikos E et al. Edu- cation and training evolution in urolithiasis: A perspective from European School of Urol- ogy. Asian J Urol 2023;10(3):281-8. https://doi.org/10.1016/j.ajur.2023.01.004.
- Nedbal C, Cerrato C, Jahrreiss V, Castellani D, Pietropaolo A, Galosi AB et al. Th role of 'artifi intelligence, machine learning, virtual reality, and radiomics' in PCNL: a review of publication trends over the last 30years. Ther Adv Urol 2023;15:17562872231196676. https://doi.org/10.1177/17562872231196676.
- McDonald L, Ramagopalan SV, Cox AP, Oguz M. Unintended consequences of machine learning in medicine. J Americаn Med Assoc 2017;318(6):517–8. https://doi.org/10.12688/ f1000research.12693.1
- Lee JG, Jun S, Cho YW, Lee H, Kim GB, Seo JB, Kim N. Deep learning in medical im- aging: general overview. Korean J Radiol 2017;18(4):570–84. https://doi.org/10.3348/ kjr.2017.18.4.570.
- McKinney SM, Sieniek M, Godbole V, Godwin J, Antropova N, Ashrafian H, et al. International evaluation of an AI system for breast cancer screening. Nature 2020;577(7788):89-94. https://doi.org/10.1038/s41586-019-1799-6.
- Ahmed A, Brychcy A, Abouzid A, Witt M, Kaczmarek E. Perception of Pathologists in Poland of Artifi Intelligence and Machine Learning in Medical Diagnosis—A Cross- Sectional Study. J Pers Med 2023;13:962. https://doi.org/10.3390/jpm13060962
- Wishahi M, El Feel A, Elkhouly A, Fahmy A, Roshdy M, Elbaz AG, et al. Concerns about stone free rate and procedure events of percutaneous nephrolithotripsy (PCNL) for 2-4 cm kidney stones by standard-PCNL vs mini-PCNL- comparative randomised study. BMC Urol 2023;23(1):96. https://doi.org/10.1186/s12894-023-01270-1.
- Th pa BB, Niranjan V. Mini PCNL Over Standard PCNL: What Makes it Better? Surg J (N Y) 2020;6(1):e19-e23. https://doi.org/10.1055/s-0040-1701225.
- Jiang G, Li J, Long H, Qiulin C, Jin R, Yaodong Y et al. Study on risk factors, bacterial species, and drug resistance of acute pyelonephritis associated with ureteral stent after per- cutaneous nephrolithotomy. Eur J Clin Microbiol Infect Dis 2021;40(4):707-13. https://doi.org/10.1007/s10096-020-04050-z.
- Bhojani N, Paranjpe R, Cutone B, Eisner BH. Infectious Complications, Healthcare Resource Use, and Medical Costs Associated with Delays in Percutaneous Nephrolithotomy Among Patients with Stone Disease and Ureteral Stent Placement. J Endourol 2023;37(6):654-9. https://doi.org/10.1089/end.2022.0489.
- Patel AP, Bui D, Pattaras J, Ogan K. Upper pole urologist-obtained percutaneous renal access for PCNL is safe and effi us. Can J Urol 2017;24(2):8754-8.
- Soares RMO, Zhu A, Talati VM, Nadler RB. Upper Pole Access for Prone Percutaneous Nephrolithotomy: Advantage or Risk? Urology 2019;134:66-71. https://doi.org/10.1016/j.urology.2019.08.031.
- Lightfoot M, Ng C, Engebretsen S, Wallner C, Huang G, Li R et al. Analgesic use and complications following upper pole access for percutaneous nephrolithotomy. J Endourol 2014;28(8):909-14. https://doi.org/10.1089/end.2014.0035.
- Kriegshauser JS, Silva AC, Paden RG, He M, Humphreys MR, Zell SI, et al. Ex vivo renal stone characterization with single-source dual-energy computed tomography: a mul- tiparametric approach. Acad Radiol 2016;23(8):969–76. https://doi.org/10.1016/ j.acra.2016.03.009
- Kazemi Y, Mirroshandel SA. A novel method for predicting kidney stone type using ensemble learning. Artif Intell Med 2018;84:117–26. https://doi.org/10.1016/ j.artmed.2017.12.001
- Aminsharif A, Irani D, Tayebi S, Jafari Kafash T, Shabanian T, Parsaei H. Predicting the Postoperative Outcome of Percutaneous Nephrolithotomy with Machine Learning System: Soft re Validation and Comparative Analysis with Guy's Stone Score and the CROES Nomogram. J Endourol 2020;34(6):692-9. https://doi.org/10.1089/end.2019.0475
- Aminsharifi A, Irani D, Pooyesh S, Parvin H, Dehghani S, Yousofi K et al. Artifcial Neural Network System to Predict the Postoperative Outcome of Percutaneous Nephrolitho- tomy. J Endourol 2017;31(5):461-7. https://doi.org/10.1089/end.2016.0791
- Shabaniyan T, Parsaei H, Aminsharifi A, Movahedi MM, Jahromi AT, Pouyesh S et al. An artifcial intelligence-based clinical decision support system for large kidney stone treatment. Australas Phys Eng Sci Med 2019;42(3):771–9. https://doi.org/10.1007/ s13246-019-00780-3
- Tang A, Tam R, Cadrin-Chênevert A, Guest W, Chong J, Barfett J, et al. Canadian As- sociation of Radiologists white paper on artifi intelligence in radiology. Canad Assoc Radiol J 2018;69(2):120-35. https://doi.org/10.1016/j.carj.2018.02.002.
- Wagner MW, Namdar K, Biswas A, Monah S, Khalvati F, Ertl-Wagner BB. Radiomics. Machine learning, and artificial intelligence-what the neuroradiologist needs to know. Neuroradiology 2021;63(12):1957-67. https://doi.org/10.1007/s00234-021-02813-9
- Nedbal C, Cerrato C, Jahrreiss V, Castellani D, Pietropaolo A, Galosi AB et al. Th role of 'artifi intelligence, machine learning, virtual reality, and radiomics' in PCNL: a review of publication trends over the last 30years. Ther Adv Urol 2023;15:17562872231196676. https://doi.org/10.1177/17562872231196676.
- Infante G, Miceli R, Ambrogi F. Sample size and predictive performance of machine learning methods with survival data: A simulation study. Stat Med 2023;42(30):5657-75. https://doi.org/10.1002/sim.9931.
- Kuwabara M, Ikawa F, Sakamoto S, Okazaki T, Ishii D, Hosogai M et al. Effectiveness of tuning an artificial intelligence algorithm for cerebral aneurysm diagnosis: a study of 10,000 consecutive cases. Sci Rep 2023;13(1):16202. https://doi.org/10.1038/s41598-023-43418-x.
- Jin C, Chen W, Cao Y, Xu Z, Tan Z, Zhang X et al. Development and evaluation of an artificial intelligence system for COVID-19 diagnosis. Nat Com- mun 2020;11(1):5088. https://doi.org/10.1038/s41467-020-18685-1.
- Shoshan Y, Bakalo R, Gilboa-Solomon F, Ratner V, Barkan E, Ozery-Flato M et al. Artificial Intelligence for Reducing Workload in Breast Cancer Screening with Digital Breast Tomosynthesis. Radiology 2022;303(1):69-77. https://doi.org/10.1148/radiol.211105.
- Maugeri O, Di Grazia E, D'Arrigo L, Agliozzo R, Calvano G, Trovato F et al. Supine mini percutaneous nephrolithotomy in horseshoe kidney. Arch Ital Urol Androl 2023;95(3):11605. https://doi.org/10.4081/aiua.2023.11605.
- Blackburne AT, Rivera ME, Gettman MT, Patterson DE, Krambeck AE. Endoscopic Management of Urolithiasis in the Horseshoe Kidney. Urology 2016;90:45-9. https://doi.org/10.1016/j.urology.2015.12.042.







