Патогенез доброкачественной гиперплазии предстательной железы (ДГПЖ) до настоящего времени вызывает дискуссии связи с выявлением его многофакторности [1-3]. Хотя основным патогенетическим фактором считается увеличение активности фермента 5α-редуктазы, катализирующего трансформацию тестостерона в биологически более активный дигидротестостерон [4, 5], важную роль могут играть эстрогены [6], другие гормоны и факторы роста, усиливающие пролиферацию клеток, в частности инсулина и инсулиноподобного фактора роста [7-9], а также хроническое нарушение кровоснабжения предстательной железы (ПЖ) как в результате заболевания сосудов таза (атеросклероз, сахарный диабет 2-го типа), так и развития эндотелиальной дисфункции вследствие возрастных нарушений баланса оксида азота и эндотелина [10-14]. Сопутствующие ДГПЖ ирритативные расстройства мочеиспускания также связывают с развитием андрогенного дефицита, приводящего к активации α-адренорецепторов [1518], и с хронической ишемией тазовых органов. Предлагается даже ввести такое понятие, как «ишемический мочевой пузырь» [19]. Обсуждение роли андрогенов в патогенезе ДГПЖ осложняется недостатком данных о корреляции концентрации этих гормонов в крови и в ткани ПЖ [20].
Целью данного экспериментального исследования явилось изучение патогенетической значимости двух факторов патогенеза ДГПЖ, которым придается ведущее значение – действию андрогенов и хронической ишемии, и их возможной взаимосвязи.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проведены в хронических экспериментах на 18 крысахсамцах линии «Август» в 3-х сериях. 1-ю серию (контрольную) составили 5 интактных животных. Во 2-й серии (8 крыс) индуцировали формирование ДГПЖ терапией андрогенами. Для этого крысам еженедельно в течение 1 месяца внутрибрюшинно вводили комплекс эфиров тестостерона различной длительности действия (препарат Сустанон) в дозе, эквивалентной 3мг/кг тестостерона. Такая дозировка используется в экспериментальных исследованиях для индукции ДГПЖ у животных [2123]. Крыс обследовали в сроки от 1 до 4 недель после начала терапии. В 3-й серии (5 крыс) моделировали хроническую ишемию тазовых органов путем дозированного сужения нижней полой вены. Для этого под эфирным наркозом выделяли аорту и нижнюю полую вену вблизи их бифуркации и подводили под них лигатуру. Разделения аорты и нижней полой вены не проводили в связи с наличием у крыс общего плотного соединительного футляра, покрывающего оба сосуда, и высокой опасности повреждении вены при ее отделении от аорты. Поверх сосудов помещали полипропиленовый катетер диаметром 0,9 мм и затягивали лигатуру. После удаления катетера нижняя полая вена частично расправлялась, но оставалась суженной. Кровоток по аорте сохранялся, что подтверждалось сохранением пульсации подвздошных артерий. Животных обследовали через 1-1,5 месяца после моделирования ишемии.
У всех подопытных крыс изучали состояние кровоснабжения ПЖ и мочевого пузыря (МП), характер и выраженность нарушений функции МП, состояние гормонального фона, а также характер и выраженность гистологических изменений в ПЖ.
Состояние кровоснабжения ПЖ и МП оценивали методом гармонического анализа их биоимпеданса [24, 25]. С этой целью к верхушке и шейке МП, а также к боковым долям ПЖ подшивали хлорсеребряные электроды, посредством которых регистрировали биоимпеданс ПЖ и МП. Гармонический анализ биоимпеданса проводили с помощью оригинального аппаратнопрограммного комплекса, разработанного в НИИ урологии Минздрава России совместно с НПФ «Биола». Амплитудные спектры колебаний биоимпеданса автоматически вычисляли методом быстрого преобразования Фурье в частотной полосе 0,05–15,0 Гц. О состоянии кровоснабжения ПЖ и МП судили по величинам кардиальных пиков С1, регистрируемых в этих органах на частоте сердцебиения (3,5-5,0 Гц) и представляли в единицах эффективного сопротивления (мОм).
Импеданс МП и ПЖ регистрировали одновременно с давлением в МП, которое измеряли с помощью цистостомического катетера № 18G (диаметр 1,3 мм), пункционно введенного в область верхушки МП и соединенного через 3-ходовой кран с датчиком давления и системой для инфузии. Измерения проводили при минимальном наполнении МП мочой, а затем во время его постепенного наполнения физиологическим раствором до момента мочеиспускания (инфузионная цистометрия).
В конце эксперимента удаляли ПЖ и МП, определяли их массу взвешиванием и брали образцы крови и тканей для проведения гормонального и гистологического исследований. Концентрацию гормонов в крови (тестостерон, дигидротестостерон, эстрадиол и инсулин) определяли иммунохемилюминесцентным методом на иммунохимическом анализаторе Access 2 (Beckman Coulter, США). Для определения концентрации гормонов ткани ПЖ (тестостерон, дигидротестостерон и эстрадиол) готовили гомогенат в соотношении ткань/ физиологический раствор 1:10. Этот гомогенат центрифугировали при 3000 об/мин в течение 5 минут, после чего отбирали супернатант, который хранили до момента исследования при температуре –80оС. Концентрацию гормонов в супернатанте определяли иммуноферментным методом (DRG Instrument GmbH, ФРГ) на анализаторе Artemis K-101 HTRF Microplate Reader (Berthold Technologies GmbH & Co. KG, ФРГ). Тканевую концентрацию гормонов пересчитывали на 1 г ткани.
Гистологические исследование осуществляли по стандартной методике с фиксацией образцов ткани в нейтральном формалине и окраской парафиновых гистологических срезов гематоксилином и эозином.
Достоверность оценивали по t-критерию Стьюдента. Данные представляли в виде m±SE.
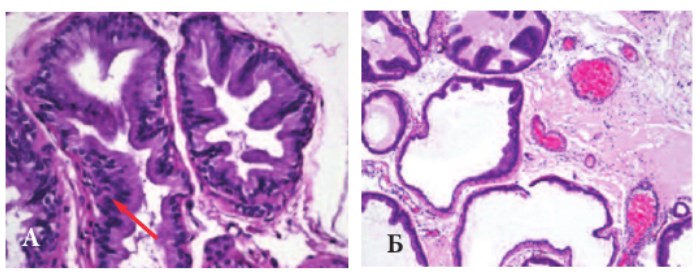
Рис. 1. Гистологическая картина ДГПЖ при андрогенной стимуляции (А) и хронической ишемии ПЖ (Б). Окраска гематоксилином и эозином. Ув. 200.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Измерение массы предстательной железы выявило ее увеличение в обеих экспериментальных сериях. В опытах с андрогенной стимуляцией она возросла с 0,82±0,04 г в контроле до 1,52±0,08 (p< 0,01), а в опытах с хронической ишемией ПЖ – до 0,98±0,04 г (p< 0,05), что свидетельствовало о формировании ДГПЖ. Гистологическое исследование подтвердило развитие гиперплазии, однако, изменения в разных сериях были различными (рис. 1).
В опытах с андрогенной стимуляцией выявляли выраженную гиперплазию эпителия простатических желез с наличием множественных очагов простатическая интраэпителиальная неоплазия (ПИН) низкой степени (указано стрелкой), что позволяет характеризовать эти изменения как резко выраженную железистую форму ДГПЖ. При хронической ишемии ПЖ гиперплазия железистого эпителия была выражена в значительно меньшей степени и не во всех железах, тогда как выявлялось выраженное разрастание стромы при значительном расширении внутриорганных сосудов. Эти изменения можно трактовать, как стромально-железистую форму ДГПЖ.
Разрастание соединительно-тканной стромы органа характерно для состояния его хронической гипоксии. Исследование состояния кровотока в ПЖ и МП подтвердило выраженное ухудшение их кровоснабжения. Амплитуда кардиального пика С1 в обоих органах уменьшалась практически в 3 раза (рис. 2, табл. 1).
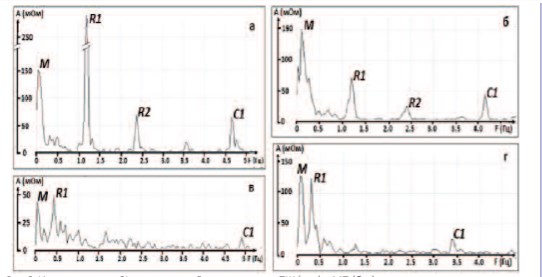
Рис. 2. Изменения пика С1 в импедансной спектрограмме ПЖ (а, в) и МП (б, г) при моделировании ишемии тазовых органов (в, г) по сравнению с нормой (а, б)
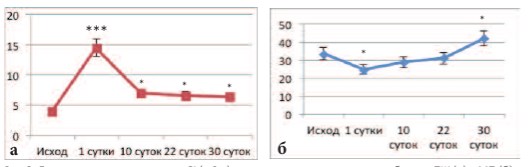
Рис. 3. Динамика кардиального пика С1 (мОм) отражающая состояния кровоснабжения ПЖ (а) и МП (б) в процессе андрогенной терапии. Достоверность различий по сравнению с нормой: * p<0,05, *** p<0,001)
Исследование состояния кровоснабжения ПЖ и МП в серии опытов с моделированием ДГПЖ путем андрогенной терапии выявило другую динамику. Уже с 1-го дня терапии кровоток в ПЖ резко возрастал с тенденцией к постепенному снижению в дальнейшем, однако к концу формирования ДГПЖ он оставался на значениях, достоверно превышающих контрольные значения, полученные у интактных крыс (рис. 3а). В то же время в МП в начале терапии кровоснабжение органа ухудшалось с дальнейшей тенденцией к его нормализации. К концу терапии кровоток в стенке МП достоверно превышал контрольные значения (рис. 3б).
Таблица 1. Количественные значения пика С1 на импедансной спектрограмме предстательной железы и мочевого пузыря (мОм)
| Пик С1 ПЖ | Пик С1 МП | |
|---|---|---|
| Контрольная группа | 9,1±0,5 | 29,3±1,2 |
| Хроническая ишемия | 3,2±0,6*** | 10,2±0,8*** |
Различия в состоянии кровоснабжения МП сказывались на его функциональном состоянии. Данные инфузионной цистометрии показали, что в опытах с хронической ишемией тазовых органов базальное внутрипузырное давление (Pdet), а также давление, при котором начиналось мочеиспускание, достоверно не отличались от значений, полученных в контрольной группе у интактных крыс (табл. 2). Это свидетельствовало об отсутствии формирования у них инфравезикальной обструкции, несмотря на увеличение массы ПЖ. В то же время амплитуда спонтанных колебаний Pdet в фазу наполнения МП достоверно возрастала (рис. 4), указывая на формирование гиперактивности детрузора.
В серии опытов с андрогенной терапией также не выявили признаков формирования инфравезикальной обструкции, несмотря на значительное увеличение массы ПЖ. При этом амплитуда спонтанных сокращений детрузора в фазу наполнения МП не только не возрастала, но была достоверно меньше, чем у интактных крыс, что свидетельствовало о снижении возбудимости детрузора и благоприятном влиянии андрогенной терапии на накопительную функцию МП.
Важным моментом в нашем исследовании было выявление вопроса, не связано ли формирование ДГПЖ и сопутствующей дисфункции МП при хронической ишемии тазовых органов с индукцией гормональных нарушений, вызывающих пролиферацию клеток ПЖ. Определение гормонального фона в этой серии опытов (табл. 3) показало, что уровни андрогенов (тестостерона и дигидротестостерона), эстрадиола и инсулина в крови достоверно не отличались от значений, полученных в контрольной серии у интактных крыс того же возраста. В ткани ПЖ концентрация тестостерона повышалась при минимальной степени достоверности различий, а концентрация дигидротестостерона оставалась на уровне контроля.
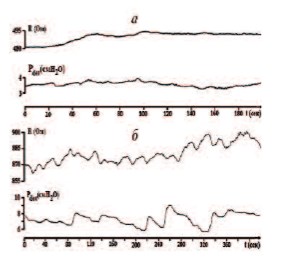
Рис. 4. Примеры записи колебаний базового импеданса (R) и детрузорного давления (Pdet) у интактной крысы (а) и у крысы через 1 месяц после моделирования ишемии тазовых органов (б)
Таблица 2. Параметры инфузионной цистометрии у крыс с разными вариантами моделирования ДГПЖ
| Контроль | Хроническая ишемия | Андрогенная терапия | |
|---|---|---|---|
| P det базальное | 5,8±0,6 | 5,4±0,4 | 5,4±0,4 |
| Колебания P det | 2,1±0,3 | 8,7±0,5*** | 1,1±0,1* |
| P det при мочеиспускании | 38,4±2,1 | 36,8±2,7 | 38,2±3,1 |
Достоверность различий по сравнению с контролем: * p<0,05, *** p<0,001
Таблица 3. Концентрация гормонов в крови и ткани предстательной железы в норме и при моделировании хронической ишемии тазовых органов
| Гормоны | Концентрация в крови | Концентрация в ткани | ||
|---|---|---|---|---|
| Контроль | Ишемия | Контроль | Ишемия | |
| Тестостерон | 3,8±0,7нг/мл | 3,7±0,3 нг/мл | 2,5±0,2 пмоль/г | 3,2±0,1 пмоль/г* |
| Дигидротестостерон | 537±48 пг/мл | 440±36 пг/мл | 88±3 пг/г | 80±2 пг/г |
| Эстрадиол | 28,4±3,6 пг/мл | 22,5±4,1 пг/мл | <10 пг/г# | <10 пг/г# |
| Инсулин (мкЕд/мл ) | 0,06±0,02 | 0,10±0,01 | - | - |
Примечание. Достоверность различий между группами: * p< 0,05, # значения ниже порога определения,
определение не производили
В серии опытов с индукцией ДГПЖ андрогенной терапией, как и ожидалось, выявили резкое повышение концентрации тестостерона и дигидротестостерона как в крови, так и в ткани ПЖ (табл. 4). Особенно резко изменения были выражены в ткани ПЖ, где увеличение уровня этих гормонов происходило уже с 1-го дня терапии и сохранялось весь срок наблюдения, тогда как в крови достоверные изменения происходили лишь через 10 дней, а после завершения терапии уровень андрогенов быстро возвращался к норме. Наряду с возрастанием уровня андрогенов происходило увеличение концентрации эстрадиола в крови, а в ткани ПЖ обнаружили его увеличение в 1-е сутки после начала андрогенной терапии, тогда как в последующем, как и в других сериях опытов, тканевая концентрация этого гормона была ниже порога определения. На фоне максимальной андрогенной стимуляции происходило также достоверное возрастание уровня инсулина в крови с его нормализацией к концу терапии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами результаты позволили заключить, что хроническая ишемия ПЖ может приводить к формированию ДГПЖ независимо от уровня гормональных факторов, стимулирующих пролиферацию клеток ПЖ (андрогены, инсулин). Увеличение тканевой концентрации тестостерона, выявленное в этой серии опытов, на наш взгляд, не имеет существенного патогенетического значения, поскольку более значимым является уровень дигидротестостерона [5, 26], а он в этих опытах не возрастал. Механизм возрастания тканевой концентрации тестостерона при ишемии предстательной железы без изменения его уровня в крови, вероятно, связан с возможностью его образования в самой ткани ПЖ из холестерина участием ферментов семейств CYP и HSD, выявляемых в ткани ПЖ с частотой от 16 до 82% [27], однако, влияние ишемии на этот процесс не изучено.
С другой стороны, андрогенная стимуляция вызывает формирование ДГПЖ, не ухудшая кровоснабжения ПЖ, а, наоборот, его усиливая, что согласуется с данными о прямом вазодилататорном действии тестостерона [28, 29]. То есть, в данном случае реализуется прямой стимулирующий эффект гормонов через андрогеновые рецепторы клеток эпителия простатических желез. Дополнительную стимуляцию пролиферации может оказывать возрастание уровня инсулина в крови, однако, на наш взгляд, значимость этого фактора можно учитывать лишь при резком увеличении уровня андрогенов в крови, так как гиперинсулинемия развивалась синхронно с гиперандрогенемией и не коррелировала с тканевой концентрацией этих гормонов. Важно отметить, что уровень андрогенов в крови не коррелировал с их тканевой концентрацией, которая может быть повышена при нормальном уровне гормонов в крови. Увеличение уровня эстрогенов на фоне андрогенной стимуляции, в том числе и в ткани ПЖ, можно рассматривать как компенсаторный процесс, направленный на ограничение пролиферативной активности клеток ПЖ, поскольку описан механизм трансформации избытка тестостерона в эстрогены [30].
Таблица 4. Изменение гормонального фона при индукции ДГПЖ андрогенной терапией
| Дигидротестостерон | Тестостерон | Эстрадиол | Инсулин | ||||
|---|---|---|---|---|---|---|---|
| В крови (пг/мл) | В предстательной железе (пг/г) |
В крови (нг/мл) | В предстательной железе (пмоль/г) |
В крови (пг/мл) | В предстательной железе (пг/г) |
В крови (мкЕд/мл) |
|
| Норма | 413±36 | 95±4 | 2,41±0,43 | 2,85±0,16 | 23±2 | <10 | 0,06±0,02 |
| 1 сутки | 397±27 | 1248±56*** | 2,66±0,32 | 13,7±0,59*** | 32±3* | 13,4±0,09* | 0,05±0,01 |
| 10 сутки | 2067±165*** | 1248±56*** | 9,96±0,77*** | 14,7±0,83*** | 32±2* | <10 | 0,39±0,04*** |
| 22 сутки | 2452±148*** | >2500*** | 6,66±0,45*** | 55,2±1,74*** | 39±3* | <10 | 0,23±0,02*** |
| 30 сутки | 30 сутки | 496±23*** | 4,06±0,29* | 52,9±1,41*** | 13±1* | <10 | 0,11±0,02 |
Примечание. Достоверность разницы результатов по сравнению с нормой: * p<0,05, ** p<0,01, *** p<0,001.<10 – меньше порога определения
В отношении механизма дисфункции МП при формировании ДГПЖ полученные нами данные подтвердили данные литературы, что именно ишемия органа является ведущим патогенетическим фактором этого состояния [19, 31, 32]. Только в опытах с моделированием хронической ишемии тазовых органов выявили формирование гиперактивности МП, причем, она развивалось при отсутствии инфравезикальной обструкции. То есть, не повышение внутрипузырного давления при инфравезикальной обструкции приводит к развитию гиперактивности детрузора, связь между которыми выявил ряд авторов, а связанное с ним ухудшение кровоснабжения органа, причем не столько за счет механического сдавления интраорганных сосудов, сколько за счет нейрогенных и метаболических воздействий, приводящих к длительному вазоспастическому эффекту, сохраняющемуся даже после ликвидации обструкции [33]. Влияние гормонального фактора на функциональное состояние МП, по всей видимости, ограничивается уменьшением расслабляющего эффекта тестостерона на клетки детрузора, подтвержденного в наших опытах, при выраженном андрогеном дефиците. Косвенным подтверждением этого предположения являются данные о развитии гиперактивности детрузора у крыс с метаболическим синдромом и андрогенной недостаточностью [34].
Таким образом, хроническую ишемию ПЖ и стимулирующее действие андрогенов можно рассматривать как два независимых патогенетических фактора формирования ДГПЖ. Вероятно, этим объясняется выявление более высокой частоты выявления ДГПЖ у пациентов, страдающих заболеванием сосудов (артериальная гипертония, атеросклероз, сахарный диабет 2-го типа) без существенных изменений уровня половых гормонов или при их существенном снижении [8, 11, 12]. Наличием или отсутствием фактора хронической ишемии тазовых органов может объясняться разная выраженность дизурии у пациентов с ДГПЖ, а также сохранение у значительной части пациентов (до 30%) выраженной ирритативной симптоматики после оперативного лечения и ликвидации обструкции мочевых путей [35-37] в связи с сохранением ишемии МП.
Все вышеизложенное позволяет считать актуальным изучение значимости включения противоишемической терапии в схему медикаментозной терапии больных доброкачественной гиперплазией предстательной железы
ЛИТЕРАТУРА
1. Jannini EA, Gravina GL, Morgentaler A, Morales A, Incrocci L, Hellstrom WJ. Is testosterone a friend or a foe of the prostate? // J Sex Med. 2011. Vol. 8, N 4. P. 946-955.
2. Тюзиков И.А., Фомин А.Н., Калиниченко С.Ю., Мартов А.Г. Системный патогенез заболеваний предстательной железы (литературный обзор). // Андрология и генитальная хирургия. 2012. № 2. С. 4-12.
3. Кирпатовский В.И., Мкртчян К.Г., Фролова Е.В., Казаченко А.В. Роль гормональных факторов и нарушения кровоснабжения предстательной железы в патогенезе ДГПЖ. // Экспериментальная и клиническая урология. 2013. №2. С. 38-45.
4. Van der Sluis TM, Vis AN, van Moorstelaar RJ, Bui HN, Blankenstein MA, Meuieman EJ, Heijboer AC. Intraprostatic testosterone and dihydrotestosterone. Part. 1: concentrations and methods of determination in men with benign prostatic hyperplasia and prostate cancer. // BJU Int. 2012. Vol. 109, N 2. P. 176-182.
5. Shidaifat F, Lin YC. Testosterone effect on the expression of genes that mediate testosterone metabolism and genes that mediate the effect of those metabolites on the prostate. // Life Sci. 2012. Vol. 91, N 5-6. P. 194-198.
6. Kusljic S, Exintaris B. The effect of estrogen supplementation on cell proliferation and expression of c-kit positive cells in the rat prostate. // Prostate. 2010. Vol. 70, N 14. P. 1555-1562.
7. Vikram A, Jena G. Role of insulin and testosterone in prostatic growth: who is doing what? // Med Hypotheses. 2011. Vol. 76, N 4. P. 474-478.
8. Hammarsten J, Peeker R. Urological aspects of the metabolic syndrome. // Nat Rev Urol. 2011. Vol. 8, N 9. P. 483-494.
9. Wang Z, Olumi AF. Diabetes, growth hormone-insulin-like growth factor pathways and association to benign prostatic hyperplasia. // Differentiation. 2011. Vol. 82, N 4-5. P. 261-271.
10. Ghafar MA, Puchner PJ, Anastasiadis AG, Cabelin MA, Buttyan R. Does the prostatic vascular system contribute to the development of benign prostatic hyperplasia? // Curr Urol Rep. 2002. Vol. 3, N 4. P.292-296.
11. Hammarsten J, Hogstedt B., Holthuis N., Mellstrom D. Components of metabolic syndrome-risk factors for the development of the benign prostatic hyperplasia. // Prostate Cancer, Prostatic Dis. 1998. Vol. 1, N 3. P. 157-162.
12. Mc Vary KT. Lower urinary tract symptoms and sexual dysfunction: epidemiology and pathophysiology. // BJU Int. 2006. Vol. 97. Suppl. 2. P. 23-28.
13. Berger AP, Horninger W, Bektic J, Pelzer A, Spranger R, Bartsch G, Frauscher F. Vascular resistance in the prostate evaluated by colour Doppler ultrasonography: is benign prostatic hyperplasia a vascular disease? // BJU Int. 2006. Vol. 98, N 3. P.587-590.
14. Tsuru N, Kurita Y, Masuda H, Suzuki K, Fujita K. Role of Doppler ultrasound and resistive index in benign prostatic hypertrophy. // Int J Urol. 2002. Vol. 9, N 8. P. 427-430.
15. Корнеев И.А. Глазнева С.Ю. Уровень тестостерона и расстройства мочеиспускания у больных с доброкачественной гиперплазией предстательной железы. // Мат. IV Всерос. Конгресса «Мужское здоровье». Москва. 2008. С. 49-50.
16. Kim MK, Zhao C, Kim SD, Kim DG, Park JK. Relationship of sex hormones and nocturia in lower urinary tract symptoms induced by benign prostatic hyperplasia. // Aging Male. 2012. Vol. 15, N 2. P. 90-95.
17. Старцев В.Ю., Киселев Е.А. Оценка состояния нижних мочевых путей у пациентов с возрастным гипогонадизмом. // Мат. XIII Конгресса Российского общества урологов. Москва. 2013. С. 183-184.
18. Medina JJ, Parra MO, Moore RG. Benign prostatic hyperplasia (aging prostate).// Med Clin North Amer. 1999. Vol. 83, N5. P. 1213-1229.
19. Вишневский А.Е. Роль нарушений энергетического метаболизма в патогенезе расстройств мочеиспускания у больных доброкачественной гиперплазией простаты и обоснование его медикаментозного лечения. // Дисс. докт. М., 2006. 240 с.
20. van der Sluis TM, Meuleman EJ, van Moorselaar RJ, Bui HN, Blankenstein MA, Heijboer AC, Vis AN. Intraprostatic testosterone and dihydrotestosterone. Part II: concentrations after androgen hormonal manipulation in men with benign prostatic hyperplasia and prostate cancer. // BJU Int. 2012. Vol. 109, N 2. P.183-188.
21. Jang H, Ha US, Kim SJ, Yoon BI, Han DS, Yuk SM, Kim SW. Anthocyanin extracted from black soybean reduces prostate weight and promotes apoptosis in the prostatic hyperplasia-induced rat model. // J Agric Food Chem. 2010. Vol. 58, N 24. P.12686-12691.
22. Nahata A, Dixit VK. Ganoderma lucidum is an inhibitor of testosterone-induced prostatic hyperplasia in rats. // Andrologia. 2012. Vol. 44, Suppl 1. P. 160-174.
23. Oudot A, Oger S, Behr-Roussel D, Caisey S, Bernabé J, Alexandre L, Giuliano F. A new experimental rat model of erectile dysfunction and lower urinary tract symptoms associated with benign prostatic hyperplasia: the testosterone-supplemented spontaneously hypertensive rat. // BJU Int. 2012. Mar 27.
24. Кирпатовский В.И., Мудрая И.С., Ревенко С.В., Нестеров А.В., Гаврилов И.Ю., Хромов Р.А., Баблумян А.Ю. Оценка интрамурального кровотока и нейрогенной регуляции в интактном и гипертрофированном мочевом пузыре крыс с помощью гармонического анализа биоимпеданса. // Бюл. экспер.биол. мед. 2012. Т. 153, № 4. С. 422-427.
25. Кирпатовский В.И., Мудрая И.С., Мкртчян К.Г., Кабанова И.В., Ефремов Г.Д., Надточий О.Н., Казаченко А.В. Особенности вегетативной регуляции и кровоснабжения мочевого пузыря и предстательной железы у старых крыс с возрастной гиперплазией предстательной железы в патогенезе ДГПЖ и СНМП. // Экспериментальная и клиническая урология. 2013. № 4. С. 10-14.
26. Kobayashi H, Gotanda K, Shibata Y, Watanabe J, Nakano Y, Shinbo A, Suzuki K. Suppressive effects of the antiandrogen agent, chlormadinone acetate and the 5alpha-reductase inhibitor, dutasteride on prostate weight and intraprostatic androgen levels in rats. // Arzneimittelforschung. 2011. Vol. 61, N 9. P. 515-520.
27. Bennett NC, Hooper JD, Lambie D, Lee CS, Yang T, Versey DA, Samaratunga H, Johnson DW, Gobe GC. Evidence for steroidogenic potential in human prostate cell lines and tissues. // Am J Pathol. 2012. Vol. 181, N 3. P. 1078-1087.
28. Navarro-Dorado J, Orensanz LM, Recio P, Bustamante S, Benedito S, Martínez AC, García-Sacristán A, Prieto D, Hernández M. Mechanisms involved in testosterone-induced vasodilatation in pig prostatic small arteries. // Life Sci. 2008. Vol. 83, N 15-16. P. 569-573.
29. Ono Y, Suzuki K, Kashiwagi B, Shibata Y, Ito K, Fukabori Y, Yamanaka H. Androgen-dependent blood flow control and morphological changes of the capillaries in rat prostate. // Int J Androl. 2004. Vol. 27, N 1. P. 50-56.
30. Nicholson TM, Ricke WA. Androgens and estrogens in benign prostatic hyperplasia: past, present and future. // Differentiation. 2011. Vol. 82, N 4-5. P. 184-199.
31. Аль-Шукри С.Х., Кузьмин И.В., Амдий Р.Э., Борискин А.Г., Слесаревская М.Н., Лукина Е.Е. Состояние микроциркуляции в стенке мочевого пузыря и клинические проявления гиперактивности мочевого пузыря у женщин. // Экспериментальная и клиническая урология. 2010. № 2. С. 52-55.
32. Mitterberger M, Pallwein L, Gradl J, Frauscher F, Neuwirt H, Leunhartsberger N, Strasser H, Bartsch G, Pinggera GM. Persistent detrusor overactivity after transurethral resection of the prostate is associated with reduced perfusion of the urinary bladder. // BJU Int. 2007. Vol. 99, N 4. P. 831-835.
33. Кирпатовский В.И., Плотников Е.Ю., Мудрая И.С., Хромов Р.А., Ревенко С.В., Зоров Д.Б. Ишемия мочевого пузыря, как причина его дисфункции после острой задержки мочи. // Экспериментальная и клиническая урология. 2012. №3. С. 9-14.
34. Кирпатовский В.И., Мудрая И.С., Греков Е.А., Кабанова И.В., Голованов С.А., Дрожжева В.В., Надточий О.Н. Влияние экспериментально вызванного метаболического синдрома на функциональное состояние Экспериментальная и клиническая урология. 2013. № 1. С. 8-13.
35. Чепуров А.К., Школьников М.Е., Буланцев Д.Ю. Роль комбинированного уродинамического исследования в выборе тактики лечения у больных доброкачественной гиперплазией простаты. // Мат. 3 Всес. конф. «Мужское здоровье», Москва, 2006, с. 125-126.
36. Akino H, Gobara M, Okada K. Bladder dysfunction in patients with benign prostatic hyperplasia: relevance of cystometry as a prognostic indicator of the outcome after prostatectomy. // Int J Urol. 1996. Vol.3, N 6. P. 441-447.
37. Белик С.М. Влияние открытой и трансуретральной аденомэктомии на функциональное состояние детрузора у больных аденомой предстательной железы. // Автореф. … дисс. канд. мед. наук. М. 2010. 28 с.







