До недавнего времени открытые хирургические вмешательства для коррекции лоханочно-мочеточникового сегмента у больных с гидронефрозом, имели подавляющее преимущество. Открытая резекционная пластика лоханочно-мочеточникового сегмента (ЛМС), предложенная Andersen и Hynes в 1949 г. [1], при использовании в течении длительного времени доказала свою надежность и высокую эффективность – процент хороших результатов составил более 90% [2-10, 12, 13]. Именно поэтому данная методика остается «золотым стандартом» лечения гидронефроза с которым сравнивают любую новую технику коррекции сужения пиелоуретрального сегмента.
Лапароскопическая пиелопластика (ЛП) у ребенка впервые была выполнена в 1995 г. С. Peters и соавт. [14]. По данным литературы около 30 центров в мире сообщили об использовании лапароскопическогой пиелопластики, при этом эффективность операции составляет от 59% до 100% [3, 4, 7, 8, 10, 13, 15-44]. Основные преимущества ЛП перед открытой пиелопластикой (ОП) это снижение болевых ощущений в послеоперационном периоде, сокращение сроков госпитализации и быстрое восстановление нормальной физической активности больных [2-4, 7, 8, 10, 13, 43].
В спектр эндовидеохирургических оперативных вмешательств, направленных на восстановление проходимости лоханочно-мочеточникового сегмента, входит ретроградная баллонная дилатация, ретроградная дилатация рассекающим баллоном (Acucaise эндопиелотомия) и перкутаннная уретеропиелотомия. Однако эффективность минимально инвазивных эндоскопических вмешательств колеблется от 32 [45] до 76% [46], причем эндотомия мочеточника и лоханки нередко сопровождается серьезными осложнениями, в частности, кровотечением, что может потребовать переливания крови, эмболизации почечной артерии или, в крайнем случае, нефрэктомии [47]. Большинство авторов указывают на низкую результативность эндопиелотомии при добавочном сосуде [48].
Вместе с тем известно, что при гидронефрозе имеются различные морфо-функциональные состояния, связанные с обструкцией лоханочномочеточникового сегмента. Патогенез заболевания в детском возрасте имеет свои особенности, важно уметь отличать функциональные нарушения уродинамики, обусловленные незрелостью пиелоуретерального сегмента, и органические сужения мочеточника, которые требуют хирургического лечения [49].
Несмотря на большое число исследований истинная эффективность и потенциальные преимущества лапароскопической пиелопластики по сравнению с открытыми операциями у детей остаются спорными. Важен не только короткий период выздоровления и снижение послеоперационной боли при ЛП по сравнению с открытым оперативным вмешательством, требуется сопоставимый процент успешных результатов для широкого использования данного метода [50]. Необходимо оценить возможности лапароскопической пластики ЛМС для коррекции рецидивирующей обструкции лоханочномочеточникового соустья.
Целью исследования было изучение особенностей выполнения лапароскопической пиелопластики в зависимости от различных факторов (возраст, наличие уролитиаза, количество и сроки ранее перенесенных операций на ЛМС, степень снижения функции почки), выбор оптимального способа и сроков дренирования почки в послеоперационном периоде, а также разработка методов профилактики осложнений лапароскопической пиелопластики.
МАТЕРИАЛЫ И МЕТОДЫ
В период с 2006 по 2014 гг. на базе детского уроандрологического отделения ФГБУ «НИИ урологии» было прооперировано 112 детей с гидронефрозом в возрасте от 9 мес. до 16 лет, средний возраст составил 3,4 года.
На дооперационном этапе всем больным проводилось стандартное урологическое обследование, включавшее в себя:
- УЗИ почек и мочевыводящих путей с доплеровским картированием,
- экскреторную урографию,
- цистографию,
- статическую нефросцинтиграфию.
Для исключения функциональной обструкции, по показаниям, выполнялось УЗИ с диуретической нагрузкой (лазикс) и ретроградная уретеропиелография.
В своей работе мы использовали международную классификацию гидроне-фроза [11]:
- Гидронефроз 1 степени – расширение почечной лоханки;
- Гидронефроз 2 степени – расширение почечной лоханки и чашечек;
- Гидронефроз 3 степени – расширение лоханки чашечек и истончение паренхимы до ½;
- Гидронефроз 4 степени – расширение паренхимы и чашечек с истончением паренхимы более ½.
Причиной обструкции у 86 пациентов (76,7%) была сегментарная дисплазия стенки мочеточника и у 26 детей (23,2%) выявлен абберантный (пересекающий) сосуд.
Гидронефроз 1-2 степени выявлен у 38 детей (табл. 1), 2-3 – у 50, гидронефроз 3-4 степени – у 24 пациентов. 5-ти больным с гидронефрозом 4 степени, выраженной дилятацией чашечно-лоханочной системы и истончением паренхимы, значительным нарушением паренхиматозного кровотока и снижением функции почки более, чем на 75%, выполнена пункционная нефростомия с целью оценки резервных возможностей органа. Через 1 мес. у трех детей младенческого возраста отмечено улучшение функции почки (на 25% и более) на фоне сокращения размеров ее коллекторной системы и улучшения почечного кровотока. Этим пациентам выполнена органосохраняющая операция. У двух других больных не отмечено значительного улучшения функции пораженной почки, в связи с чем этим пациентам была выполнена органоуносящая операция (дети в исследование не вошли).
Показаниями к операции явились отрицательная динамика размеров чашечно-лоханочной системы почки в течение 6 месяцев наблюдения, истончение паренхимы почки по сравнению с возрастной нормой и в динамике, частые обострения пиелонефрита (до 3-4 раз в год) или эпизоды лейкоцитурии (более 8-10 в п/з), боли в животе и признаки снижения функции почки по данным статической нефросцинтиграфии в сочетании с нарушением уродинамики по данным динамической нефросцинтиграфии.
10 пациентам с гидронефрозом 1-2 степени для уточнения характера обструкции (функциональная или органическая) и определении тактики лечения было выполнено ультразвуковое исследование почек с диуретической нагрузкой. Сохранение расширения лоханки и чашечек более 30% от исходного спустя два часа после введения лазикса считалось признаками обструкции. При проведении у 4-х детей динамической нефросцинтиграфии с диуретическими пробами, выявлены признаки органической обструкции – сохранение 50% изотопа через 20 мин после введения лазикса.
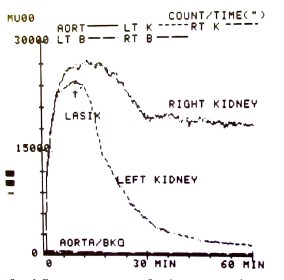
Рис. 1. Данные динамической нефросцинтиграфии с лазиксной нагрузкой у больного В. , 10 л., с диагнозом: гидронефроз справа
Всем больным было выполнено оперативное лечение по методике Хайнса-Андерсена открытым или эндовидеохирургическим способом. В зависимости от метода вмешательства было выделено две группыбольных: 1 группа (50 чел.) – пациенты, перенесшие открытое вмешательство; 2 группа (62 чел.) – больные, которым была выполнена лапароскопическая пиелопластика: из них 10 пациентам произведена повторная операция (по нашему мнению, рецидив заболевания после перенесенной ранее открытой операции не является противопоказанием для применения лапароскопической методики вмешательства), 2 больным во время пиелопластики выполнялась пиелолитоэкстракция.
Таблица 1. Распределение больных в зависимости от степени снижения функции почки (по данным статической нефросцинтиграфии)
| Степень гидроне фроза (по между-народной класси-фикации) |
Кол-во больных (чел | ||||
|---|---|---|---|---|---|
| Нарушения функции почки нет |
Снижение функции почки на 0-25% |
Снижение функции почки на 26-50% |
Снижение функции почки на 51-75% |
ВСЕГО: | |
| 1-2ст | 32 |
6 |
0 |
0 |
38 |
| 2-3ст | 0 |
39 |
11 |
0 |
50 |
| 3-4ст | 0 |
8 |
7 |
9 |
24 |
| ИТОГО: | 32 | 53 | 18 | 9 | 11 |
Необходимо отметить, что в период с 2006 по 2010 гг. в НИИ урологии пациентам с гидронефротической трансформацией, как правило, выполнялось открытое оперативное вмешательство. С 2010 г. всем больным коррекция стриктуры ЛМС выполнялись лапароскопическим доступом (у 2 пациентов был применен ретроперитонеоскопический доступ). Ретроперитонеоскопический доступ не нашел широкого распространения в нашей клинической практике, поскольку у детей младшего возраста недостаточно пространства в забрюшинной области для удобного и надежного проведения пластики ЛМС. Кроме того, при пересекающем сосуде ретроперитонеальный доступ несколько затрудняет, по нашему мнению, формирование антевазального анастомоза из-за особого положения камеры и инструментов.
ОПЕРАТИВНАЯ ТЕХНИКА
Больной укладывался на операционном столе в положение на боку, с поворотом в ¾. Во всех случаях использовали трансперитонеальный доступ. Первый троакар диаметром 5 мм, устанавливали в области пупка. После создания пневмоперитонеума, под контролем зрения, вводили рабочие троакары 3 мм и 5 мм. Детям 1-7 лет операцию выполняли трехмиллиметровыми инструментами. Рассекали париетальную брюшину и смещали толстую кишку медиально. Лоханку и мочеточник выделяли на таком протяжении, которого было достаточно для формирования анастомоза без натяжения. Через брюшную стенку накладывали лигатуру, фиксирующую лоханку в стабильном положении. После пересечения лоханки выше зоны сужения производилась спатуляция мочеточника до здоровых тканей на протяжении 2-3-х см. Анастомоз формировали непрерывным швом Monocril 6/0. Далее, после создания задней стенки анастомоза перкутанно устанавливался JJ стент. Для этого при помощи пункционной иглы антеградно вводили проводник через анастомоз по мочеточнику в мочевой пузырь. Отверстие на коже растягивали бужами и устанавливали стент. Следующим этапом проводилось ушивание передней стенки анастомоза. В 7 случаях (13,5%) перед наложением анастомоза почка дренировалась нефростомой. В брюшную полость устанавливали страховой дренаж, мочевой пузырь дренировался уретральным катетером. Дренажи удаляли на третьи сутки. Стент извлекали через 4-6 недель.
Выбор метода дренирования почки зависел от степени гидронефроза и проходимости пузырно-мочеточникового сегмента. Стандартным вариантом дренирования у больных с гидронефрозом 2-3-4 степени была установка JJ стента (4Сн-4,5Сн-6Сн) в зависимости от возраста ребенка. Стент устанавливали антеградно перкутанно по проводнику. В случае затруднения проведения стента через пузырно-мочеточниковый сегмент у 7 детей была выполнена его ретроградная установка с дилятацией устья мочеточниковыми бужами. У детей с гидронефрозом 4 степени и выраженным расширением коллекторной системы почки установку JJ стента сочетали с нефростомией для лучшего дренирования почки. Средняя продолжительность дренирования стентом составила 5 недель. Однако при сужении предпузырного отдела мочеточника и гидронефрозе 4 степени стент удаляли через 6-7 недель. Удаление нефростомы проводили после извлечения стента в случае удовлетворительной проходимости ЛМС. Перед удалением из почки нефростомический дренаж в течение 5 дней перекрывали, последовательно увеличивая время пережатия на 2-4-8-16-24 часа. Отсутствие почечной колики, большого объема остаточной мочи и температуры свидетельствовало об удовлетворительной проходимости ЛМС.
В случае сочетания гидронефроза с мочекаменной болезнью (5 больных) выполняли лапароскпическую пластику ЛМС с предварительным извлечением конкрементов из лоханки и чашечек. Троакар использовался в качестве тубуса, а лигатура на лоханке вокруг троакара позволяла обеспечить ток жидкости для оптимальной визуализации при нефрокаликолитоэкстракции.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При оценке результатов лечения учитывались следующие показатели: длительность операции, общая продолжительность пребывания пациента в клинике, осложнения, ультразвуковые данные о состоянии собирательной системы почек и толщины паренхимы, а также показатели функции почки по данным статической нефросцинтиграфии (табл. 2).
Отдаленные результаты лечения были изучены в сроки от 6 мес. до 6 лет.
Хорошим результатом лечения гидронефроза считали: отсутствие конверсии при лапароскопической пиелопластике, повторных операций (манипуляций); исчезновение жалоб, уменьшение размеров лоханки и чашечек, улучшение/стабилизацию функции почек.
Таблица 2. Сравнение результатов оперативного лечения гидронефроза открытым и лапароскопическим доступами
| Показатели | Открытая пиелопластика | Лапароскопическая пиелопластика |
|---|---|---|
| Кол-во больных, чел |
50 |
62 |
| Наличие конверсии при лапароскопическом доступе |
– |
1 |
| Продолжительность операции, мин. |
104 (58-172) |
157 (90-312) |
| Пребывание в клинике, дн. |
17,2 (14-35) |
7,5 (6-12) |
| Осложнения (всего), чел. (%) |
6(12) |
6(9,7) |
| о. пиелонефрит (консервативное лечение) |
2 (4)* |
1(1,9) |
| Нефростомия (мочевой затек) |
1(2)* |
2 (3,2) |
| повторная операция |
4 (8) |
3 (4,8) |
| Уменьшение размеров ЧЛС через 4-6 мес. |
46 (92) |
59 (95,1) |
| Эффективность операции | 46 (92) | 59 (95,1) |
* обострение пиелонефрита и мочевой затек наблюдали у одного ребенка
Как видно из таблицы 2, большинство лапароскопических операций были выполнены без осложнений, требующих конверсии. Только у одного больного с подковообразной почкой, трижды оперированного ранее, потребовалась конверсия из-за сложностей идентификации лоханки в грубых рубцах. В ближайшем послеоперационном периоде у трех больных наблюдалось обострение пиелонефрита: у двоих после открытой операции и у одного ребенка – после лапароскопической пиелопластики.
В 1 группе у 4-х больных отме-чено осложнение в виде рубцевания в зоне анастомоза, что потребовало повторной операции (двум пациентам операция была проведена лапароскопическим методом с успешным результатом). Во 2 группе у двоих(3,2%) больных наблюдали формирование мочевого затека небольших размеров, что послужило показанием для установки пункционной нефростомы. Также, в этой группе двум пациентам (3,2%) в связи со стенозом зоны анастомоза выполнена эндопиелотомия, с хорошим результатом. У одного (1,9%) пациента, в связи с высоким дефицитом функции почки – 79%, в отдаленные сроки, несмотря на восстановленный пассаж мочи, потребовалось выполнение нефрэктомии в связи с дальнейшим снижением функции органа. Повторные операции у пациентов обеих групп были успешны.
Длительность ЛП колебалась от 90 до 312 мин (в среднем 157 мин), зависела в основном от времени мобилизации пиелоуретерального сегмента и выраженности спаечного процесса при повторных операциях. Время формирования пиелоуретероанастомоза варьировало от 40 до 60 мин. Важно отметить, что после выполнения первых 30 ЛП и набора опыта, продолжительность операций сократилась в два раза. После лапароскопической операции пациенты не требовали частого применения анальгетиков и наблюдалось быстрое восстановление физической активности. Более чем в два раза сократились средние сроки госпитализации: с 17,2 дней при ОП до 7,5 дней при ЛП. Большая продолжительность пребывания в клинике при открытых операциях была обусловлена операционной травмой и наличием нефростомического или пиелостомического дренажа.
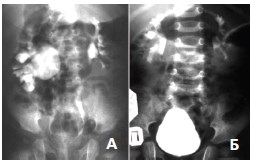
Рис.2. Экскреторная урография у больной Н., 2 лет, диагноз: Гидронефроз справа. А. До операции. Б. Через 6 мес. после лапароскопической пластики ЛМС
При контрольном обследовании (через 4-6 мес) уменьшение размеров коллекторной системы почки наблюдали у 46 (92%) больных в 1 группе и у 59 (95,1%) детей в 2 группе. Успешный результат удалось достигнуть у 46 (92%) детей 1 группы (ОП) и у 59 (95,1%) пациентов после лапароскопической пластики ЛМС (рис. 2). Косметические результаты ЛП были удовлетворительными (рис. 3).
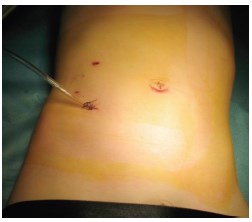
Рис. 3. Больной К., 3 лет. Косметический результат после пластики ЛМС справа
ОБСУЖДЕНИЕ
В настоящее время лапароскопическая пиелопластика у детей получила широкое распространение. Результаты данного метода сопоставимы с результатами открытых операций, а частота осложнений постепенно снижается с 36 до 2% [2-4, 7, 8, 10, 13, 43]. Известны преимущества лапароскопической пиелопластики: хорошая визуализация анатомических структур за счет оптического увеличения, локальное выделение пиелоуретерального сегмента, возможности прецизионного наложения швов, достаточное рабочее пространство для выполнения пиелоуретероанастомоза, хороший косметический эффект, короткий послеоперационный период и быстрое восстановление физической активности.
Проведение вмешательства в первые недели и месяцы жизни у большинства детей связаны с неоправданно более высоким риском хирургических и анестезиологических осложнений. Более сложным дренированием коллекторной системы почки, невозможностью установки стента из-за малого диаметра уретеровезикального соустья, малым пространством для выполнения качественного прецизионного шва анастомоза мочеточника и лоханки. У 95% пациентов с гидронефрозом возможно отложить операцию до 6-10-ти месячного возраста, без угрозы снижения функции почки при тщательном динамическом наблюдении за ребенком.
Большинство европейских детских урологов стараются отказаться от операций в первые недели и месяцы жизни ребенка, для проведения качественной дифференциальной диагностики гидронефроза с морфофункциональной незрелостью ЛМС и избежать неоправданного хирургического вмешательства [7, 8, 10, 12]. Конечно, существуют исключения, когда отмечается прогрессивный рост размеров лоханки и чашечек, рецидивирующий воспалительный процесс, снижение функции почки. В таких случаях используют либо временное отведение мочи пункционной нефростомой (что на наш взгляд предпочтительно) или проводят открытую пластику ЛМС. Как показывает наш опыт, оптимальным возрастом для выполнения эндовидеохирургических операций является период 6-12 мес.
Учитывая анатомо-физиологические особенности детей младшей возрастной группы (0-1 год) существует естественное ограничение использования лапароскопических операций.
Ряд авторов выполняет ЛП только детям старше одного года [7, 13, 21, 26, 31, 40, 42], после 2 лет [17, 19], старше трех лет [3, 22, 23, 32-34, 37, 43]. Возрастные ограничения объясняются высокими требованиями к аппаратуре и особенно к навыкам хирурга в связи с техническими сложностями проведения операции, что, в совокупности, значительно увеличивает ее продолжительность по сравнению с открытыми пиелопластиками [7, 8, 10, 13, 43]. Небольшое забрюшинное пространство у младенцев ограничивает проведение операции ретроперитонеоскопическим доступом, отдавая предпочтение лапароскопии. Меньшие размеры мочеточника и особенности тканей младенцев (рыхлость и склонность к отеку) определяют необходимость соблюдения принципа прецизионности при наложении микрошвов в процессе формирования уретеропиелоанастомоза. Существуют объективные сложности дренирования мочевых путей, проблемы проведения мочеточниковых стентов через пузырно-мочеточниковый сегмент у детей младшей возрастной группы. Ограничение метода может быть обусловлено воспалительным процессом, ранее перенесенными операциями на почке или брюшной полости. Эти особенности объясняют большой процент осложнений (35%) у младенцев в виде повторных операций после лапароскопической пиелопластики, а также довольно большое число конверсий (18%) [16, 34].
Предварительная тренировка хирургов на моделях для отработки шва анастомоза лоханки с мочеточником (рис. 4) позволяет снизить число конверсий и осложнений [51, 52, 53, 54].

Рис.4. Схема тренажера пластики ЛМС из тканевого макета
В нашем исследовании первичную ЛП мы выполняли после получения достаточного навыка работы на тренажере, а проведение повторной ЛП у больных с рецидивом гидронефроза (6 больных) стало возможным только после получения достаточного опыта выполнения первичных операций (ЛП). Опыт отработки шва анастомоза на тренажере помогает получить необходимые навыки и сократить время операции. По мере накопления опыта операций возможно и снижение возрастных ограничений для ЛП.
Проведение повторной пиелопластики лапароскопическим доступом у детей у многих специалистов вызывает сомнения. Однако имеющиеся исследования показывают возможность ее выполнения. H. Tan представил серию наблюдений 18 детей, в которой 2 пациента после неудачных первичных лапароскопических пиелопластик были успешно прооперированы повторно тем же способом [55]. P. Casale с соавт. сообщили об успешных повторных лапароскопических пиелопластиках после 4 неудачных лапароскопических пиелопластик в качестве первичной операции [56]. Наши успешные результаты повторных ЛП у 6 больных подтверждают данные зарубежных исследователей.
ЗАКЛЮЧЕНИЕ
Лапароскопическая пиелопластика имеет успешные результаты лечения гидронефроза сопоставимые с результатами открытых операций. ЛП имеет ряд преимуществ: меньшая травматичность вмешательства, быстрое восстановление физической активности, более короткий период госпитализации, хороший косметический эффект. Использование лапароскопической пиелопластики для лечения гидронефроза у младенцев первых месяцев жизни возможно при достижении успеха подобных операций у детей старше одного года. Данные операции возможны при рецидиве гидронефроза, а также при сочетании гидронефроза и мочекаменной болезни. Опыт отработки шва анастомоза на тренажере помогает получить необходимые навыки и сократить время операции.
ЛИТЕРАТУРА
1. Anderson JC, Hynes W. Retrocaval ureter: a case diagnosed preoperatively and treated successfully by a plastic operation. // Br J Urol. 1949. Vol. 21. P. 209-214.
2. Bonnard A, Fouquet V, Carricaburu E, Aigrain Y, ElGhoneimi A. Retroperitoneal laparoscopic versus open pyeloplasty in children. // J Urol. 2005. Vol. 173. P. 1710-1713.
3. Yee DS, Shanberg AM, Duel BP, Rodriguez E, Rajpoot D. Initial comparison of robot-ic-assisted laparoscopic versus open pyeloplasty in children. // Urology. 2006. Vol. 67. P. 599-602.
4. Yee DS, Shanberg AM, Duel BP, Rodriguez E, Rajpoot D. Initial comparison of robotic-assisted laparoscopic versus open pyeloplasty in children. // Urology. 2006. Vol. 67. P. 599-602.
5. Lee RS, Retik AB, Borer JG, Peters CA. Pediatric robot assisted laparoscopic dismembered pyeloplasty: comparison with a cohort of open surgery. // J Urol. 2006. Vol. 175. P. 683-687.
6. Chacko JK, Koyle AAA, Mingin GC, Furness PD. The minimally invasive open pye-loplasty. // J Pediatr Urol. 2006. Vol. 2. P. 368-372.
7. Piedrahita YK, Palmer JS. In one-day hospitalization after open pyeloplasty possible and safe? // Urology. 2006. Vol. 67. P. 181-184.
8. Ravish IR, Nerli RB, Reddy MN, Amarkhed SS. Laparoscopic pyeloplasty compared with open pyeloplasty in children. // J Endourol. 2007. Vol. 21. P. 897-901.
9. Piaggio LA, Franc-Guimond J, Noh PH, Wehry M, Figueroa TE, Barthold J, González R. Transperitoneal laparoscopic pyeloplasty for primary ureteropelvic junction obstruction in infants and children: comparison with open surgery. // J Urol. 2007. Vol. 178. P. 1579-1583.
10. Braga LHP, Lorenzo AJ, Farhat WA, Bagli DJ, Khoury AE, Pippi Salle JL. Outcome analysis and cost comparison between externalized pyeloureteral and standard stents in 470 consecutive open pyeloplasties. // J Urol. 2008. Vol. 180. P. 1693-1698.
11. Onen A. An alternative grading system to refine the criteria for severity of hydro-nephrosis and optimal treatment guidelines in neonates with primary UPJ-type hydro-nephrosis. // J Pediatr Urol. 2007. Vol. 3. P. 200-205.
12. Valla JS, Breaud J, Griffin SJ, Sautot-Vial N, Beretta F, Guana R, Gelas T, Carpentier X, Leculee R, Steyaert H. Retroperitoneoscopic vs open dismembered pyeloplasty for ureteropelvic junction obstruction in children. // J Pediatr Urol. 2009. Vol. 5. P. 368-373.
13. Ninan GK, Sinha C, Patel R, Marri R. Dismembered pyeloplasty using double J stent in infants and children. // Pediatr Surg Int. 2009. Vol. 25. P. 191-194.
14. Penn HA, Gatti JM, Hoestje SM, DeMarco RT, Snyder CL, Murphy JP. Laparoscopic versus open pyeloplasty in children: preliminary report of a prospective randomized trial. // J Urol. 2010. Vol. 184. P. 690-695.
15. Peters CA, Schlussel RN, Retik AB. Pediatric laparoscopic dismembered pyeloplasty. // J Urol. 1995. Vol. 153. P. 1962-1965.
16. Yeung CK, Tam YH, Sihoe YDY, Lee KH, Liu KW. Retroperitoneoscopic dismembered pyeloplasty for pelviureteric junction obstruction in infants and children. // BJU Int 2001. Vol. 87. P. 509-513.
17. El-Ghoneimi A, Farhat W, Bolduc S, Bagli D, McLorie G, Aigrain Y, Khoury A. Laparoscopic dismembered pyeloplasty by a retroperitoneal approach in children. // BJU Int. 2003. Vol. 92. P. 104-108.
18. Canon SJ, Jayanthi VR, Lowe GJ. Which is better retroperitoneoscopic or laparo-scopic dismembered pyeloplasty in children. // J Urol. 2007. Vol. 178. P. 1791-1795.
19. Shoma AM, El Nahas AR, Bazeed MA. Laparoscopic pyeloplasty: a prospective ran-domized comparison between the transperitoneal approach and retroperitoneoscopy. // J Urol. 2007. Vol. 178. P. 2020-2024.
20. Atug F, Woods M, Burgess SV. Robotic assisted laparoscopic pyeloplasty in children. // J Urol. 2005. Vol. 174. P. 1440-1442.
21. Kutikov A, Nguyen M, Guzzo T, Canter D, Casale P. Robot assisted pyeloplasty in the infantlessons learned. // J Urol. 2006. Vol. 176. P. 2237-2240.
22. Olsen LH, Rawashdeh YF, Jorgensen TM. Pediatric robot assisted retroperitoneoscopic pyeloplasty: a 5-year experience. // J Urol. 2007. Vol. 178. P. 2137-2141.
23. Franco I, Dyer LL, Zelkovic P. Laparoscopic pyeloplasty in the pediatric patient: hand sewn anastomosis versus robotic assisted anastomosis is there a difference? // J Urol. 2007. Vol. 178. P. 1483-1486.
24. Najmaldin A, Antao B. Early experience of tele-robotic surgery in children. // Int J. Med Robot 2007. Vol. 3. P. 199-202.
25. Tan HL. Laparoscopic Anderson-Hynes dismembered pyeloplasty in children. // J Urol. 1999. Vol. 162. P. 1045-1048.
26. Casale P, Grady RW, Joyner BD, Zelster IS, Figueroa ТЕ, Mitchel ME. Comparison of dismembered and nondismembered laparoscopic pyeloplasty in the pediatric patient. // J Endourol. 2004. Vol. 18. P. 875-878.
27. Reddy M, Nerli RB, Bashetty R, Ravish IR. Laparoscopic dismembered pyeloplasty in children. // J Urol. 2005. Vol. 174. P. 700-702.
28. Metzelder ML, Schier F, Petersen C, Truss M, Ure BM. Laparoscopic transabdominal pyeloplasty in children is feasible irrespective of age. // J Urol. 2006. Vol. 175. P. 688-691.
29. Kutikov A, Resnick M, Casale P. Laparoscopic pyeloplasty in the infant younger than 6 months is it technically possible? // J Urol. 2006. Vol. 175. P. 1477-9.
30. Singh H, Ganpule A, Malhotra V, Manohar T, Muthu V, Desai M. Transperitoneal laparoscopic pyeloplasty in children. // J Endourol. 2007. Vol. 21. P. 1461-1466.
31. Cascio S, Tien A, Chee W, Tan HL. Laparoscopic dismembered pyeloplasty in children younger than 2 years. // J Urol. 2007. Vol. 177. P. 335-338.
32. Lam PN, Wong C, Mulholland TL, Campbell JB, Kropp BP. Pediatric laparoscopic pyeloplasty: 4-year experience. // J Endourol. 2007. Vol. 21. P. 1467-1471.
33. Yu J, Wu Z, Xu Y, Li Z, Wang J, Qi F, Chen X. Retroperitoneal laparoscopic dismembered pyeloplasty with a novel technique of JJ stenting in children. // BJU Int. 2011. Vol. 108. P. 756-759.
34. Braga LH, Pippi-Salle J, Lorenzo AJ, Bagli D, Khoury AE, Farhat WA. Pediatric laparoscopic pyeloplasty in a referral center: lesson learned. // J Endourol. 2007. Vol. 21. P. 738-742.
35. Yucel S, Samuelson ML, Nguyen MT, Baker LA. Usefulness of short-term retrievable ureteral stent in pediatric laparoscopic pyeloplasty. // J Urol. 2007. Vol. 177. P. 720-725.
36. Vicentini FC, Denes FT, Borges LL, Silva FAQ, Machado MG, Srougi M. Laparo-scopic pyeloplasty in children: is the outcome different in children under 2 years of age? // J Pediatr Urol. 2008. Vol. 4. P. 348-351.
37. Chacko JK, Piaggio LA, Neheman A, Gonzalez R. Pediatric laparoscopic pyeloplasty: lessons learned from the first 52 cases. // J Endourol. 2009. Vol. 23. P. 1307-1311.
38. Hadley DA, Wicher C, Wallis MC. Retrograde percutaneous access for kidney internal splint stent catheter placement in pediatric laparoscopic pyeloplasty: avoiding stent removal in the operating room. // J Endourol. 2009. Vol. 23. P. 1991-1994.
39. Lopez M, Guye E, Becmeur F, Molinaro F, Moog R, Varlet F. Laparoscopic pyeloplasty for repair of pelviureteric junction obstruction in children. // J Laparoendosc Adv Surg Tech A. 2009. Vol. 19. P. 91-93.
40. Nerli RB, Reddy M, Prabha V, Koura A, Patne P, Ganesh MK. Complications of lapa-roscopic pyeloplasty in children. // Pediatr Surg Int. 2009. Vol. 25. P. 343-347.
41. Kojima Y, Sasaki S, Mizuno K, Tozawa K, Hayashi Y, Kohri K. Laparoscopic dismembered pyeloplasty for ureteropelvic junction obstruction in children. // Int J Urol. 2009. Vol. 16. P. 472-476.
42. Szavay PO, Luithle T, Seitz G, Warmann SW, Haber P, Fuchs J. Functional outcome after laparoscopic dismembered pyeloplasty in children. // J Pediatr Urol. 2010. Vol. 6. P. 359-363.
43. Sedlacek J, Kocvara R, Molcan J, Dite Z, Dvoracek J. Transmesocolic laparoscopic pyeloplasty in children: a standard approach for the left side repair. // J Pediatr Urol. 2010. Vol. 6. P. 171-177.
44. Braga LH, Lorenzo AJ, Bagli DJ, Mahdi M, Salle JL, Khoury AE, Farhat WA.Comparison of flank, dorsal lumbotomy and laparoscopic approaches for dismembered pyeloplasty in children older than 3 years with ureteropelvic junction obstruction. // J Urol. 2010. Vol. 183. P. 306-311.
45. Sofras F. Retrograde acucise endopyelotomy: is it worth its cost? // J Endourol. 2004. Vol. 18. N. 5. P. 466-468.
46. Lewis-Russell JM. Ten years' experience of retrograde balloon dilatation of pelviureteric junction obstruction. // BJU Int. 2004. Vol. 93. N. 3. P. 360-363.
47. Tallai В. Endopyelotomy in childhood: our experience with 37 patients. // J En-dourol. 2004. Vol. 18. N. 10. P. 952-958.
48. Knudsen ВЕ. Percutaneous antegrade endopyelotomy: longterm results from one institution. // Urology. 2004. Vol. 63. N. 2. P. 230-234.
49. Ростовская В.В. Клиническое значение профилометрии пиелоуретерального сегмента при врожденном гидронефрозе у детей. // Урология. 2003. № 2. С. 46-50.
50. Zhang X, Li HZ, Ma X, Zheng T, Lang B, Zhang J, Fu B, Xu K, Guo XL. Retrospec-tive comparison of retroperitoneal laparoscopic versus open dismembered pyeloplasty for ureteropelvic junction obstruction. // J Urol. 2006. Vol. 176. P. 1077.
51. Fu B, Zhang X, Lang B, Xu K, Zhang J, Ma X, Li HZ, Zheng T, Wang BJ. New model for training in laparoscopic dismembered ureteropyeloplasty. // J Endourol. 2007. Vol. 21. P. 1381-1385.
52. Ramachandran A, Kurien A, Patil P, Symons S, Ganpule A, Muthu V, Desai M. A novel training model for laparoscopic pyeloplasty using chicken crop. // J Endourol. 2008. Vol. 22. P. 725-728.
53. Yang B, Zhang ZS, Xiao L, Wang LH, Xu CL, Sun YH. A novel training model for retroperitoneal laparoscopic dismembered pyeloplasty. // J Endourol. 2010. Vol. 24. P. 1345-1349.
54. Ooi J, Lawrentschuk N, Murphy DL, Fracs BS. Training model for open or laparoscopic pyeloplasty. // J Endourol. 2006. Vol. 20. P. 149-152.
55. Tan H: Laparoscopic Anderson-Hynes dismembered pyeloplasty in children. // J Urol. 1999. Vol. 162. P. 1045.
56. Casale P, Grady R, Joyner B, Zeltser I, Figueroa T and Mitchell M: Comparison of dismembered and nondismembered laparoscopic pyeloplasty in the pediatric patient. // J Endourol. 2004. Vol. 18. P. 875.







