Брахитерапия имеет более чем 100-летнюю историю. В 1914 г. были опубликованы первые результаты внедрения радиевой иглы в предстательную железу больному раком предстательной железы (РПЖ). В 30-х годах XX века Хью Грант провел более 5 тысяч имплантаций источников радиоактивного излучения в предстательную железу с достаточно хорошими результатами. Главным сдерживающим фактором развития метода стали отсутствие стандартизированных источников излучения, дозиметрического контроля и визуализации.
В 70-х годах прошлого века были разработаны источники, конструкция которых применяется до настоящего времени. В 1983 г. появилась методика введения источников в предстательную железу под ультразвуковым контролем. В 1995 г. была решена проблема миграции источ-ников после имплантации путем их размещения на полимерной нити или в оплетке. Первые результаты десятилетнего наблюдения за больными РПЖ, перенесшими брахитерапию, опубликованы в 1998 г. Продемонстрировано, что отдаленные результаты брахитерапии приближаются к таковым после радикальной простатэктомии и дистанционной лучевой терапии.
Опыт НИИ урологии
1 марта 2000 г. в НИИ урологии была выполнена первая брахитерапия в России. За годы применения в стенах нашего института метод подвергся эволюции:
- усовершенствовалась техника имплантации радиоактивных зерен;
- внедрено планирование брахитерапии в режиме реального времени, что позволило выполнять ее более прецизионно и умень-шить нагрузку на критические органы;
- достигнуто снижение продолжительности операции, которая составляет от пятнадцати минут до получаса;
- немаловажным фактором является проведение послеоперационного контрольного планирования, позволяющего оценить качество проведенного лечения (рисунок 1).
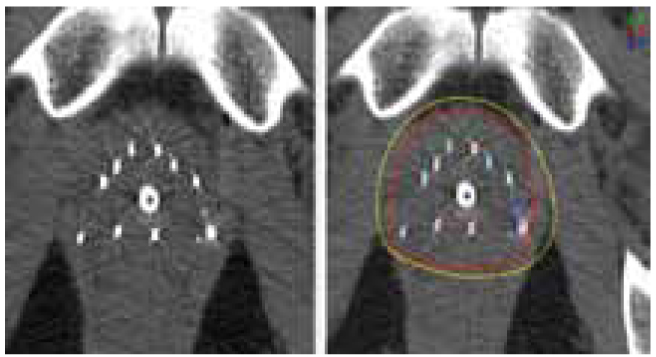
Рисунок 1. Контроль положения зерен с помощью КТ и постоперационная дозиметрия
В 2008 г. на Пленуме российских онкоурологов были доложены 5-летние результаты применения брахитерапии в нашей клинике, которые соответствуют мировым данным: специфическая выживаемость составила 96%, безрецидивная – 78%. Проанализированы результаты 56 больных, их которых 18% были низкого риска, 46% – промежуточного, а 36% – высокого риска (таблицы 1, 2).
Таблица 1. Пятилетние результаты применения брахитерапии в НИИ урологии
| N = 56 | Безрецидивная выживаемость (%) | Специфическая выживаемость (%) |
|---|---|---|
| Пациенты низкого риска | 89 | 100 |
| Пациенты промежуточного риска | 81 | 100 |
| Пациенты высокого риска | 56 | 88 |
Таблица 2. Безрецидивная выживаемость
| Автор | % | лет |
|---|---|---|
| Beyer & Brachman | 71 | 5 |
| Ragde et al. | 66 | 10 |
| Grado et al. | 79 | 5 |
| Stock & Stone | 75 | 5 |
| Zelefsky et al. | 71 | 5 |
| Gritz et al. | 88 | 5 |
| Blasko et al. | 85 | 10 |
| ESTRO | 71-93 (65-85) | 5-10 |
| НИИ урологии | 78 | 5 |
В настоящее время под наблюдением в НИИ урологии состоят более 230 пациентов с РПЖ в возрасте от 42 до 81 года и сроком наблюдения до 11 лет.
Необходимо подчеркнуть важность отбора больных. В частности, при разделении пациентов на группы наихудшие результаты были получены у пациентов, имевших индекс Глисона 7 и выше (рисунок 2). Такая же тенденция наблюдается для уровня простатического антигена (ПСА) более 10 нг/мл (рисунок 3). В своей практике мы используем следующие критерии отбора:
- клиническая стадия T1c-T2b;
- уровень ПСА менее 10 нг/мл;
- объем ПЖ до 50 см3 (по данным ТРУЗИ) при отсутствии выраженной инфравезикальной обструкции;
- показатель Глисона менее 7 баллов;
- низкий риск экстракапсулярного распространения опухоли, поражения семенных пузырьков и лимфатических узлов по данным МРТ и номограмм.
При бóльших размерах ПЖ рекомендовано назначение гормональной терапии сроком до 3-х месяцев.
Пациентам стадий T2b-T3a целесообразно комбинированное лечение с применением дистанционной лучевой терапии (40 Гр).
В систематическом обзоре Noederhaug, представленном в 2003 г., только работа Stokies и соавторов (2000) удовлетворяла всем принципам доказательной медицины. Это рандомизированное исследование не показало различий в безрецидивной 5-летней выживаемости для пациентов низкого и промежуточного риска, которая составила 70%.
Нами были разработаны ряд приемов, улучшающих результативность и безопасность лечения. Изменения техники имплантации позволили снизить частоту миграции источников (рисунок 4).
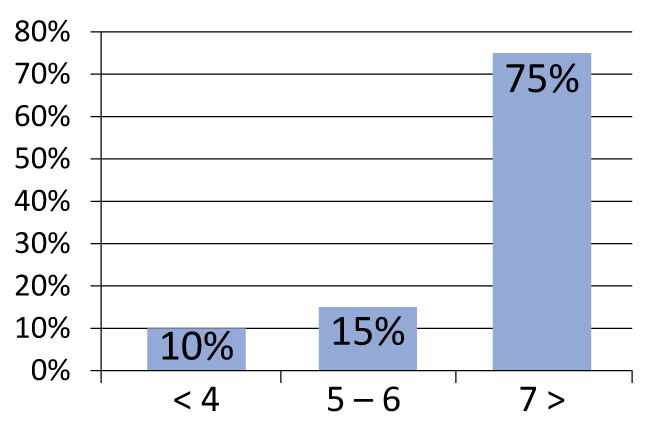
Рисунок 2. Частота рецидивов в зависимости от стадии по Глисону
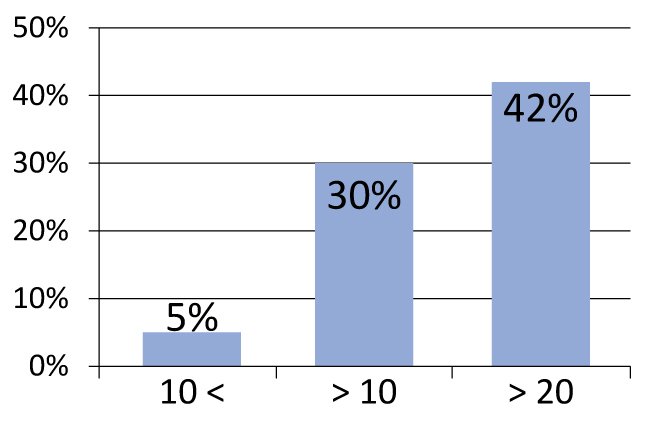
Рисунок 3. Частота рецидивов в зависимости от исходного уровня ПСА
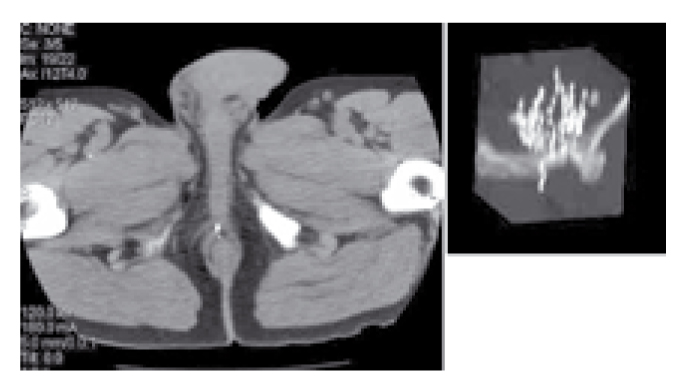
Рисунок 4. Миграция имплантов
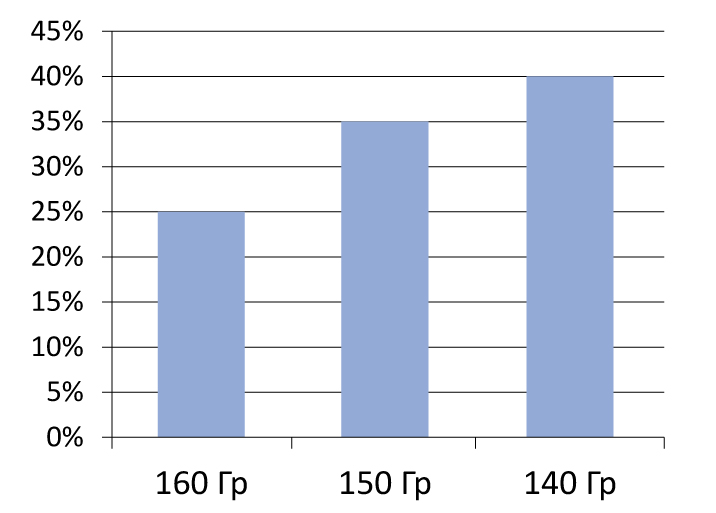
Рисунок 5. Частота биохимического рецидива в зависимости от дозы
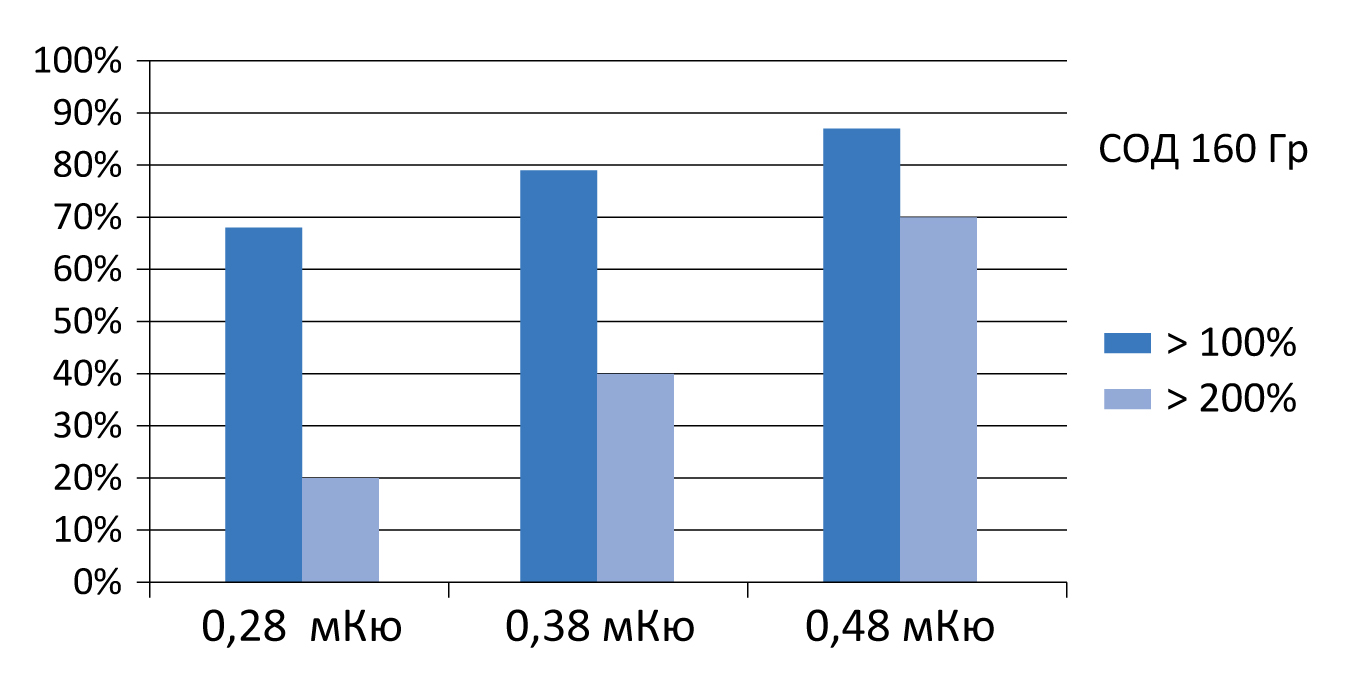
Рисунок 6. Использование источников низкой активности обеспечивает лучший результат
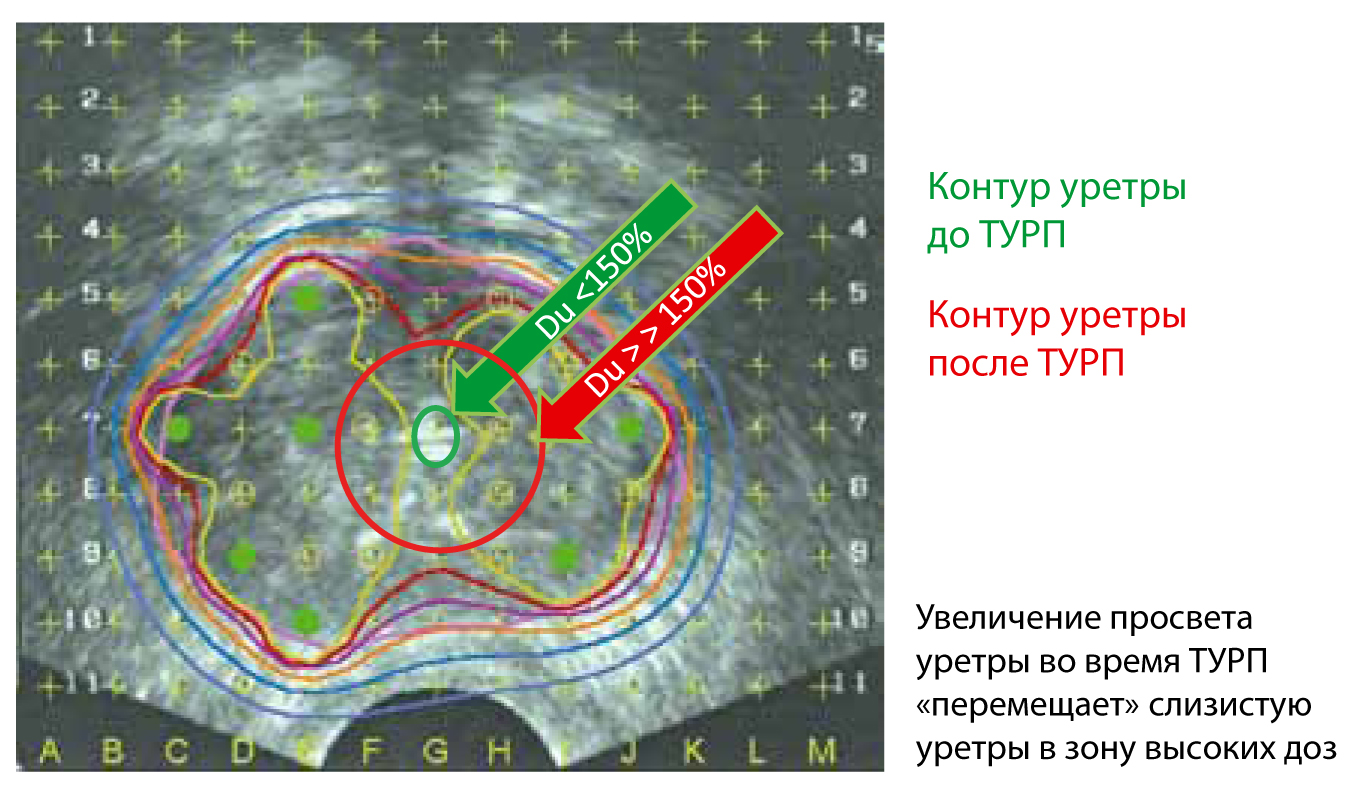
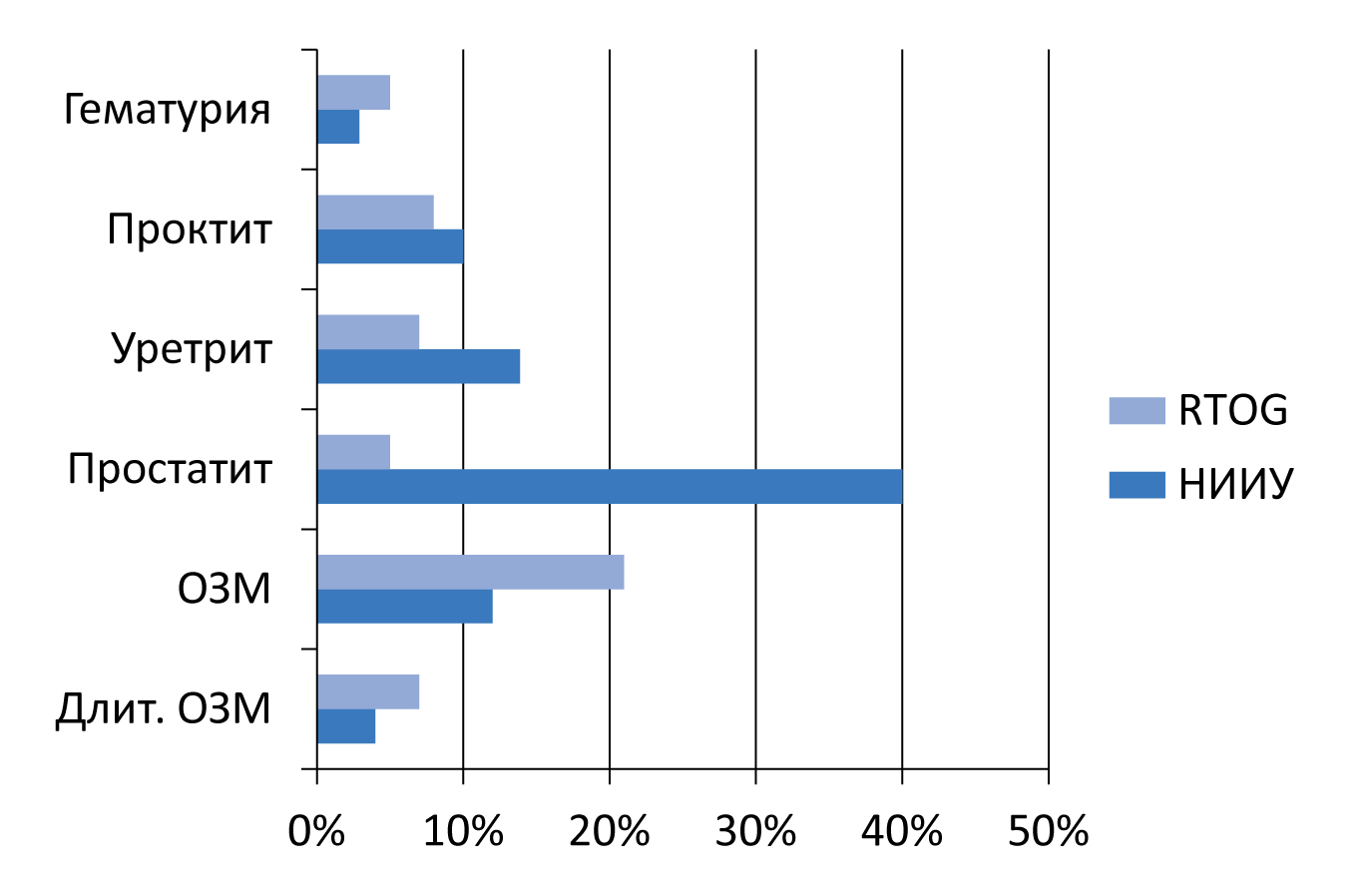
Рисунок 8. Осложнения брахитерапии РПЖ
Эффективность и безопасность лечения прямо зависят от дозы подведенного излучения (рисунок 5). Поэтому важной задачей является достижение необходимого баланса между этими критериями (рисунок 6)
Мы используем для имплантации «зерна» разной активности, помещая в боковые доли предстательной железы источники более высокой активности, а вблизи уретры и прямой кишки, для уменьшения нагрузки на эти органы, – низкой.
Дизурия – это основная проблема, с которой приходится сталкиваться при ведении пациентов, перенесших брахитерапию. В этой связи, при отборе больных мы особое внимание уделяем качеству их мочеиспускания. Наличие выраженной инфравезикальной обструкции, скорее всего, создаст серьезные проблемы после брахитерапии у данной категории больных.
Брахитерапия – это частный случай лучевой терапии, и развитие лучевых реакций неизбежно. В первую очередь, тяжелые осложнения связаны с превышением дозы облучения в области уретры, то есть превышением 150%-дозного порога, а также наличием инфравезикальной обструкции до лечения. В большом исследовании Gutman (2000), представленного в BJU, было показано, что после брахитерапии происходит уменьшение качества мочеиспускания, при оценке симптомов по шкале IPSS оно составляет примерно 5 баллов. Чем более выражены исходные симптомы ИВО, тем значительней они станут после лечения.
Для коррекции данного состояния мы стандартно используем альфа1-адреноблокаторы. Нами было проведено пилотное исследование по неоадъювантному применению альфа1-АБ, в котором было получено почти двукратное уменьшение частоты развития обструктивных осложнений в послеоперационном периоде.
У пациентов с бóльшим объемом предстательной железы мы проводим неоадъювантную гормональную терапию, цель которой – уменьшить размеры органа.
Вопрос применения превентивной трансуретральной резекции (ТУР) остается открытым. Тем не менее, если больному предстоит выполнить брахитерапию и имеется выраженная ИВО, то ТУР лучше выполнить до брахитерапии за 6-12 месяцев, чем после. Это связано с достаточно высоким риском развития серьезных осложнений – стриктуры уретры и недержания мочи. Основной причиной этих осложнений является развитие поверхностного уретрального некроза (рисунок 7). Долгое время считалось, что брахитерапия противопоказана пациентам, перенесшим ТУРП, в связи с высоким риском развития недержания мочи. Наш опыт свидетельствует, что брахитерапия выполнима с высокой степенью безопасности в отдаленном периоде после ТУРП, тщательной дозиметрии и прецизионной установки источников.
Заключение
Брахитерапия – современный и безопасный метод лечения локализованного РПЖ у пациентов низкого и умеренного риска. Достигнутые нами результаты лечения соответствуют таковым в ведущих специализированных клиниках мира (рисунок 8).






