В предыдущем исследовании [1-3] мы показали, что четырехчасовая острая задержка мочи (ОЗМ) у крыс приводит к выраженным функциональным нарушениям сократительного аппарата мочевого пузыря, проявляющимся повышением тонуса детрузора, усилением спонтанных его сокращений, не связанных с актом мочеиспускания, и снижением способности к максимальному сокращению. Функциональные нарушения сопровождались массивным выходом ферментов (цитоплазматических, митохондриальных и лизосомальных) из стенки мочевого пузыря в мочу, свидетельствуя о выраженном повреждении.
При этом спектр ферментурии после ОЗМ был схожим с выходом ферментов после ишемии мочевого пузыря, вызванной пережатием сосудов, питающих этот орган. В связи с этим было высказано предположение о существенной роли ишемического фактора в генезе функциональных и биохимических изменений, вызываемых ОЗМ.
В литературе также имеются данные о негативном влиянии ОЗМ на кровоснабжение мочевого пузыря: даже при небольшой ее длительности (30-60 минут) у крыс с перерастяжением мочевого пузыря выявляли ухудшение кровотока в его стенке, что сопровождалось развитием функциональных нарушений [4, 7 - 9]. В клиническом исследовании Kershen R.T. et al. [6] с помощью лазерной допплеровской флоуметрии установили, что при максимальном наполнении мочевого пузыря, когда внутрипузырное давление повышалось с 25,2 до 43,5 см водн. ст., кровоток в мочевом пузыре снижался на 36 % с уменьшением эластичности его стенки. Его опорожнение вызывало состояние реактивной гиперемии (кровоток возрастал в 1,6 раза) при нормализации показателя эластичности. Ухудшение кровоснабжения мочевого пузыря сопровождалось снижением парциального давления кислорода в его стенке, то есть приводило к развитию тканевой гипоксии [7].
В связи с этим нами было проведено исследование, направленное на изучение состояния кровоснабжения мочевого пузыря во время и после ОЗМ и метаболических изменений, потенциально способных негативно влиять на функцию детрузора, а именно, на показатели функционального состояния митохондрий, отражающих адекватность энергопродукции для поддержания нормального метаболизма клеток и активность генерации активных форм кислорода (АФК) как показатель выраженности деструктивных процессов.
МАТЕРИАЛ И МЕТОДЫ
Опыты были проведены на 30 белых беспородных крысах-самках массой 220 - 260 г (10 крыс служили контролем, 20 составляли опытную серию). В опытной серии ОЗМ моделировали путем пережатия предпузырного отдела уретры с предварительным наполнением мочевого пузыря физиологическим раствором. Для этого в стерильных условиях под эфирным наркозом вскрывали брюшную полость и выделяли предпузырный отдел мочеиспускательного канала. По уретре проводили кубитальный катетер № 18G и наполняли мочевой пузырь, после чего катетер удаляли, а уретру пережимали мягким микрососудистым зажимом. Брюшную полость ушивали, оставляя зажим на уретре. Через четыре часа производили релапаротомию для снятия зажима. Животных обследовали на следующие сутки. В контрольной группе никаких вмешательств не производили.
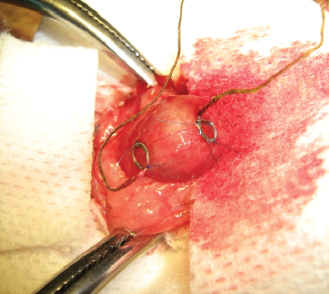
Состояние кровоснабжения оценивали с помощью разработанной в НИИ урологии совместно с НПФ «Биола» методики высокочувствительной импедансометрии мочевого пузыря со спектральным анализом малых колебаний биоимпеданса по методу Фурье (Фурье- импедансометрия) [5]. К стенке мочевого пузыря подшивали два электрода (ближе к верхушке и около шейки) (рис. 1А), с помощью которых регистрировали динамику биоимпеданса на разработанном аппаратном комплексе (рис. 1Б) с последующим спектральным анализом малых колебаний импеданса с помощью специально созданной компьютерной программы.
 A A |
 Б Б |
Рисунок 1. Регистрирующие электроды, наложенные на мочевой пузырь крысы (А)
и комплекс аппаратуры (Б) для регистрации биоимпеданса органа и проведения
спектраль-ного анализа его малых колебаний.
На полученной спектрограмме выделяли несколько основных пиков, один из которых, совпадающий по частоте с ритмом сердца и поэтому называемый кардиальным, характеризовал состояние кровообращения в стенке мочевого пузыря [5]. Уменьшение его расчетных параметров, в частности показателя мощности пика, близкого по значению к площади под кривой пика, свидетельствовало об уменьшении кровотока, что было доказано кратковременным пережатием тазового отдела аорты, сопровождающимся уменьшением этого параметра более чем на 90 %. Типичная спектрограмма мочевого пузыря и выделенный кардиальный пик представлены на рис. 2.
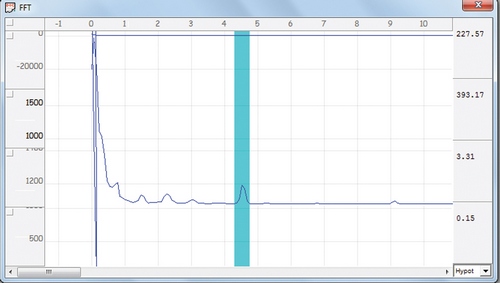
Рисунок 2. Типичная спектрограмма интактного мочевого пузыря. Выделен кардиальный пик, характеризующий состояние кровоснабжения органа.
Метаболические последствия ОЗМ, характеризующие функциональное состояние митохондрий и активность генерации АФК, выявляли с помощью лазерной конфокальной микроскопии стенки мочевого пузыря при его обработке специфическими флуоресцентными зондами. Для проведения этого исследования мочевой пузырь удаляли, рассекали вдоль - от шейки до верхушки, растягивали на специальной подставке и помещали в питательную среду с добавлением флуоресцентных зондов - этилового эфира тетраметил- родамина (TMRE) и ацетатного эфира дихлорфлуоресцеина (DCF). Зонд TMRE избирательно накапливается в функционально полноценных митохондриях с высоким трансмембранным потенциалом, и интенсивность его флуоресценции характеризует их АТФ-синтезирующую способность и энергообеспеченность клеток. Флуоресценция зонда DCF возникает при взаимодействии его молекул с АФК, и ее интенсивность характеризует активность свободнорадикальных процессов. Подробно методика описана в работах В.И. Кирпатовского и Е.Ю. Плотникова [2, 6]. Флуоресценцию зондов оценивали раздельно со стороны слизистой оболочки, что характеризовало состояние эпителиальной выстилки и подслизистого слоя мочевого пузыря, и со стороны наружной стенки - это отражало состояние детрузора.
Статистическую обработку цифрового материала осуществляли с помощью компьютерной программы «Statistica 6.0», используя непараметрические критерии достоверности различий для малых выборок.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
Четырехчасовая ОЗМ на фоне высокого внутрипузырного давления приводила к достоверному ухудшению кровоснабжения мочевого пузыря, что проявлялось в снижении мощности кардиального пика на спектрограмме при Фурье-импедансометрии (табл. 1). После опорожнения и нормализации давления в мочевом пузыре гипоперфузия стенки пузыря сохранялась. Более того, через одни сутки после ликвидации обструкции мочевых путей и восстановления мочеиспускания мощность кардиального пика, а следовательно, и кровоснабжение мочевого пузыря оставались на сниженных значениях, даже более низких, чем сразу после снятия обструкции, несмотря на низкие цифры внутрипузырного давления.
Таблица 1. Взаимосвязь внутрипузырного давления и мощности кардиального пика на Фурье-спектрограмме при ОЗМ и после ее ликвидации
| Этапы исследования | Детрузорное давление (см вод. ст.) | Площадь кардиального пика (10' Ом2) |
| Интактный мочевой пузырь | 4,6 ± 1,4 | 0,60 ± 0,04 |
| ОЗМ | 50,3 ± 2,7*** | 0,24 ± 0,06*** |
| После опорожнения | 6,8 ± 1,8 | 0,44 ± 0,04* |
| Через одни сутки | 5,7 ± 1,3 | 0,16 ± 0,05** |
Примечание. Достоверность разницы результатов по сравнению с интактным мочевым пузырем: * - p < 0,05, ** - p < 0,01, *** - p < 0,001.
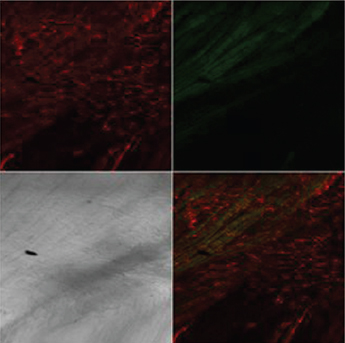
Стойкое ухудшение кровоснабжения обструктивного мочевого пузыря сопровождалось метаболическими изменениями в стенке кровеносных сосудов, что выявилось методом лазерной конфокальной микроскопии c флуоресцентным зондом TMRE. В кровеносных сосудах интактного мочевого пузыря определялась интенсивная флуоресценция этого зонда в эндотелиальных и гладкомышечных клетках (рис. 3А), что свидетельствовало о наличии функционально активных митохондрий, обеспечивающих адекватное энергоснабжение этих клеток. В стенке сосудов мочевого пузыря, перенесшего ОЗМ, флуоресценции TMRE практически не наблюдалась (рис. 3Б), указывая на утрату митохондриями способности поддерживать трансмембранный потенциал, необходимый для синтеза АТФ. Исходя из этих данных, можно предположить, что стойкое ухудшение кровоснабжения мочевого пузыря, сохраняющееся даже после ликвидации ОЗМ и опорожнения мочевого пузыря, обусловлено сосудистым спазмом вследствие гипоксического повреждения эндотелия и гладкомышечных клеток артериол.
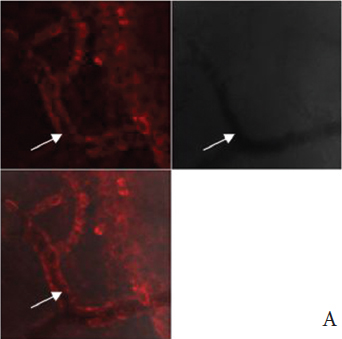 |
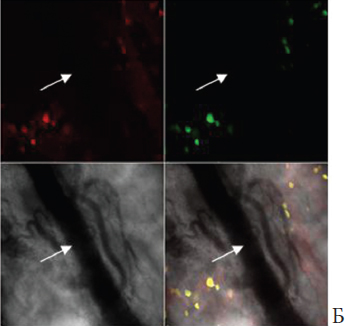 |
Рис. 3. Флуоресценция зоны TMRE (красное свечение) в клетках стенки кровеносных сосудов (указаны стрелками) интактного мочевого пузыря (А) и ее отсутствие в сосудах мочевого пузыря, перенесшего четырехчасовую ОЗМ (Б). Конфокальная микроскопия с окраской TMRE и DCF. Серые квадранты — фазово-контрастная микроскопия. |
|
При исследовании сосудов мочевого пузыря через одни сутки после четырехчасовой ОЗМ было выявлено восстановление флуоресценции TMRE в эндотелиальной выстилке и гладкомышечных элементах сосудистой стенки, что свидетельствует о нормализации функционального состояния митохондрий в этих клетках. Однако при этом в них отмечалась выраженная флуоресценция зонда DCF, указывающая на активизацию продукции активных радикалов кислорода (рис. 4). Из данных литературы известно, что продукты перекисного окисления мембранных липидов, которые образуются вследствие атаки клеточных структур кислородными радикалами, обладают вазоконстриктивным действием [11]. Исходя из этого, можно предполагать, что стойкое снижение кровоснабжения мочевого пузыря после ликвидации острой задержки мочи может поддерживаться (или даже усугубляться) так называемым оксидантным стрессом, обусловленным активацией процессов свободнорадикального окисления мембранных структур, что затрагивает и интраорганные кровеносные сосуды, вызывая их стойкий спазм.
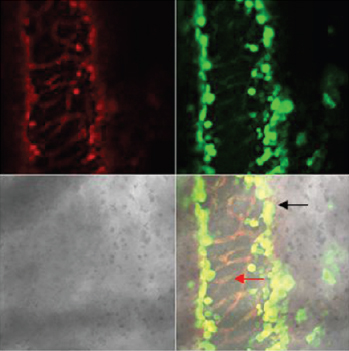
Рис. 4. Состояние интраорганных сосудов мочевого пузыря через сутки после четырехчасовой ОЗМ. Конфокальная микроскопия с окраской TMRE и DCF. Красная окраска — флуоресценция TMRE, зеленая флуоресценция DCF. Нижние квадраты фазовоконтрастная микроскопия и наложение всех изображений друг на друга. Черная стрелка — эндотелиальная выстилка, красная стрелка — гладкомышечные клетки. Наложение изображений свидетельствует, что кислородные радикалы генерируется в основном в эндотелии (наложение зеленого цвета на красный дает желтую окраску) (на рисунке отмечено черной стрелкой), тогда как лейомиоциты их практически не образуют (по-прежнему окрашены в красный цвет) Это показано красной стрелкой.
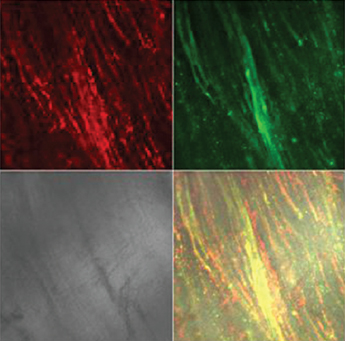
Длительное ухудшение кровоснабжения мочевого пузыря после ОЗМ приводило к резкому усилению продукции АФК как в слизистой, так и в мышечной оболочках, индикатором чего служило увеличение интенсивности флуоресценции DCF в этих отделах стенки мочевого пузыря (рис. 5). С увеличением длительности ОЗМ от двух до четырех часов продукция АФК возрастала. Активация продукции радикалов кислорода была стойкой, поскольку выявлялась не только сразу после ликвидации ОЗМ, но и на следующие сутки примерно с такой же интенсивностью (табл. 2).
 А А |
 Б Б |
 В В |
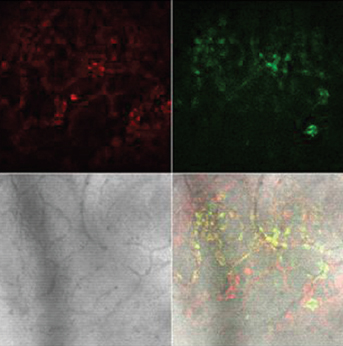 Г Г |
Рисунок 5. Влияние ОЗМ на интенсивность флуоресценции зондов TMRE (красное свечение) и DCF (зеленое свечение) в слизистой и мышечной оболочках мочевого пузыря. Серый квадрат - фазово-контрастная микроскопия, нижний правый квадрат — наложение всех изображений друг на друга. Конфокальная микроскопия с окраской TMRE и DCF. А — слизистая интактного мочевого пузыря, |
|
Изменения интенсивности флуоресценции TMRE, характеризующей состояние митохондрий, носили фазный характер как в слизистой оболочке, так и в детрузоре (табл. 2). Во время ОЗМ интенсивность свечения зонда имела тенденцию к возрастанию с достижением максимальных значений через четыре часа ОЗМ, причем в детрузоре прирост флуоресценции оказался статистически достоверным. Однако через сутки отмечалось резкое уменьшение флуоресценции во всех слоях стенки мочевого пузыря, что может свидетельствовать о повреждении митохондрий лейомиоцитов, а также клеток слизистой оболочки и подслизистого слоя (эпителий, интерстициальные клетки).
Таблица 2. Интенсивность флуоресенции DCF и TMRE в разных слоях стенки мочевого пузыря сразу и через сутки после ликвидации четырехчасовой ОЗМ
| Этапы исследования | DCF | TMRE | ||
| Слизистая оболочка | Детрузор | Слизистая оболочка | Детрузор | |
| Норма | 0,5 ± 0,1 | 4,9 ± 0,4 | 27,6 ± 2,9 | 28,1 ± 5,6 |
| Два часа ОЗМ | 7,2 ± 0,8*** | 22,8 ± 2,9*** | 25,1 ± 3,1 | 38,8 ± 3,9 |
| Четыре часа ОЗМ | 17,8 ± 1,5*** | 34,7 ± 3,1*** | 35,3 ± 3,4 | 46,2 ± 3,1* |
| Через сутки после четырехчасовой ОЗМ | 21,9 ± 2,3*** | 30,2 ± 2,6*** | 22,1 ± 1,8# | 18,9 ± 1,7*, # |
Примечание: * - p < 0,05 по сравнению с нормой, *** - p < 0,001, # - p < 0,05 по сравнению с ОЗМ
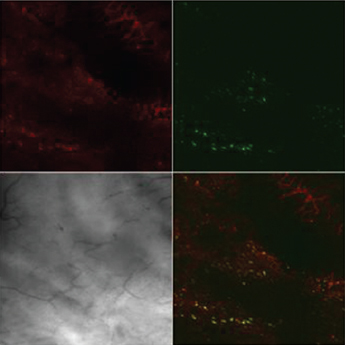
Лазерная конфокальная микроскопия показала, что после ОЗМ в мышечной оболочке резко увеличивается количество округлых клеток, активно продуцирующих АФК, что проявлялось в их интенсивной флуоресценции при обработке зондом DCF (рис. 6). Предположительно это могут быть лейкоциты, инфильтрирующие интерстициальное пространство и мышечную оболочку мочевого пузыря, активно генерирующие АФК. Подсчет количества этих клеток в поле зрения микроскопа при одинаковом увеличении показал, что если сразу после ликвидации ОЗМ увеличение их количества было умеренным, то через сутки степень инфильтрации возрастала более чем в десять раз (рис. 7). По всей видимости, инфильтрация стенки обструктивного мочевого пузыря клетками, активно продуцирующими АФК, вносит существенный вклад в развитие окислительного стресса, вызванного ОЗМ.
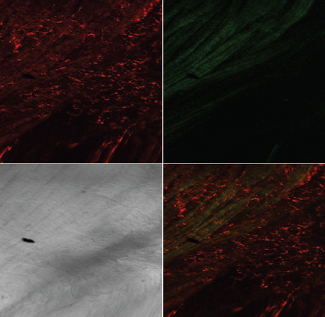 А А |
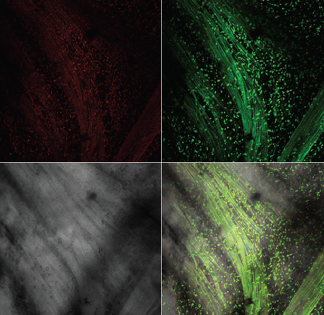 Б Б |
Рисунок 6. Инфильтрация мышечного слоя клетками, активно продуцирующими АФК, после ОЗМ. Конфокальная микроскопия с окраской TMRE и DCF. А — интактный мочевой пузырь, |
|
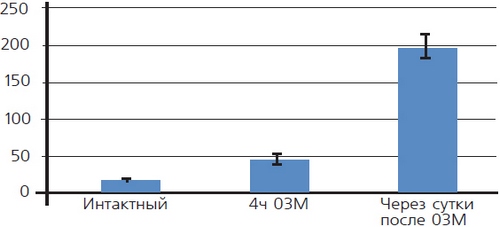
Рисунок 7. Количество клеток, инфильтрирующих мышечную оболочку мочевого пузыря после ОЗМ, в поле зрения микроскопа при одинаковом увеличении.
Выраженная клеточная инфильтрация стенки мочевого пузыря может свидетельствовать о развитии в ней воспалительного процесса. Учитывая методику наших экспериментов, можно полагать, что она не связана с бактериальным фактором, а является асептическим воспалением, вызванным повреждением эпителиальной выстилки слизистой мочевого пузыря, утратой ее барьерных свойств и проникновением мочи в интерстиций. Подтверждением этого предположения являются полученные нами данные о развитии выраженной гидропической дистрофии эпителиоцитов в различных участках слизистой мочевого пузыря при сильной флуоресценции в них зонда DCF (рис. 8), что говорит о выраженном повреждении этих клеток.
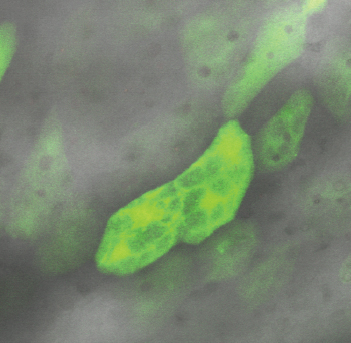
Рисунок 8. Выраженная вакуольная дистрофия эпителиоцитов слизистой мочевого пузыря через сутки после четырехчасовой ОЗМ. Конфокальная микроскопия с окраской DCF. Выраженная зеленая флуоресценция клеток свидетельствует об активной продукции АФК в их цитоплазме.
Об этом же сведетельствуют результаты ранее проведенных экспериментов, свидетельствующие о массивном выходе внутриклеточных ферментов из стенки мочевого пузыря в мочу [3].
ЗАКЛЮЧЕНИЕ
Полученные нами данные убедительно доказывают, что ОЗМ сопровождается выраженным ухудшением кровоснабжения мочевого пузыря, причем механический фактор (сдавление интрамуральных сосудов в результате повышенного внутрипузырного давления) может иметь значение только на ранних этапах патологического процесса, поскольку ликвидация обструкции мочевых путей и нормализация внутрипузырного давления после ОЗМ не приводит к нормализации кровоснабжения органа. В сохранении гипоперфузии мочевого пузыря, по-видимому, играет роль стойкий спазм сосудов, вызванный гипоксическими изменениями в стенке самих сосудов, а также активацией генерации АФК в клетках слизистой и мышечной оболочек, обладающих вазоконстриктивным и цитотоксическим действием. Стойкая ишемия мочевого пузыря и оксидантный стресс сопровождаются ухудшением функционального состояния митохрондрий, свидетельством чего является уменьшение флуоресценции TMRE, способного накапливаться только в функционально полноценных митохондриях с высоким трансмембранным потенциалом. Это означает снижение АТФ-синтезирующей способности митохондрий и развитие энергодефицитного состояния, негативно влияющего на способность клеток детрузора к сокращениям. Аналогичные процессы в эпителии слизистой оболочки ведут к повреждению эпителиоцитов и потере ее барьерных свойств, что может приводить к попаданию мочи в интерстициальное пространство и развитию асептического воспаления, отражением чего является его инфильтрация клетками, активно продуцирующими АФК. Это усугубляет развивающееся оксидантное повреждение клеточных структур и функциональные нарушения.
Полученные данные о важной роли ишемии мочевого пузыря и усилении генерации АФК в его клетках при длительном переполнении ставят вопрос о целесообразности изучения включения фармакологических препаратов с вазоактивным и антиоксидантным действием в схемы лечения больных ДГПЖ и ОЗМ.
Ключевые слова: ишемия мочевого пузыря, острая задержка мочеиспускания, дисфункция мочевого пузыря, оксидантный стресс, лазерная конфокальная микроскопия.
Keywords: bladder ischemia, acute urinary renention, bladder dysfunction, oxidative stress, laser confocal microscopy.
ЛИТЕРАТУРА
- Биленко М.В. Ишемическое и реперфузионное повреждение органов. М.: «Медицина», 1989. 369 с.
- Кирпатовский В.И., Плотников Е.Ю., Казаченко А.В., Голованов, С.А., Сыромятникова Е.В., Высоких М.Ю., Зоров Д.Б. Роль генерации митохондриями активных форм кислорода и оксида азота в постишемических расстройствах функции почки. // Урология. 2006. - № 4. - С. 19 - 23.
- Кирпатовский В.И., Мудрая И.С., Федяков Р.П., Голованов С.А., Дрожжева В.В., Черников Д.Ю., Елисеев Д.Э., Надточий О.Н., Сыромятникова Е.В.. Ферментурия, как маркер повреждения мочевого пузыря при острой задержке мочи. // Экспериментальная и клиническая урология. - 2012. - № 1. - С. 20 - 23.
- Мудрая И.С., Ибрагимов А.Р., Кирпатовский В.И., Ревенко С.В., Нестеров А.В., Гаврилов И.Ю. Оценка функционального состояния мочевого пузыря крыс методом Фурьеимпедансной цистометрии. // Экспериментальная и клиническая урология. - 2010. - № 3- С. 21-26.
- Нестеров А.В., Гаврилов И.Ю., Селектор Л.Я., Мудрая И.С., Ревенко С.В. Фурье-анализ вариаций биоимпеданса пальца человека. // Бюлл. экспер. биол. мед. 2010. Т. 150, № 7. С. 31 - 37.
- Плотников Е.Ю., Высоких М.Ю., Цвиркун Д.В., Казаченко A.B., Кирпатовский В.И., Зоров, Д.Б. Митохондриальная регуляция продукции активных форм кислорода и азота в клетках почки крысы при ишемии / реперфузии. // Доклады академии наук, 2005. Т. 400. № 5. С. 80 - 83.
- Bajory Z, Szabli A, Kirgyly I, Pajor L, Messmer K. Involvement of nitric oxide in microcirculatory reactions after ischemia-reperfusion of the rat urinary bladder. //Eur Surg Res, 2009. Vol.42, N 1. P. 28 - 34.
- Shimizu S, Saito M, Kinoshita Y, Kazuyama E, Tamamura M, Satoh I, Satoh K. Acute urinary retention and subsequent catheterization cause lipid peroxidation and oxidative DNA damage in the bladder: preventive effect of edaravone, a free-radical scavenger. // BJU Int, 2009. Vol.104, N 5. P 713 - 717.
- Ohmasa F., Saito M., Shimizu S., Taniguchi S., Dimitriadis F, Satoh I, Kinoshita Y, Satoh K. The role of ATP-sensitive potassium channel on acute urinary retention and subsequent catheterization in the rat. // Eur J Pharmacol. 2010. Vol. 635, N 1-3. P 194-197.
- Kershen RT, Azadzoi KM, Siroku MB. Blood flow, pressure and compliance in the male human bladder. // J Urol, 2002. Vol. 168, N 1. P. 121 - 125.
- Scheepe J.R, Amelink A, Wolffenbuttel K.P, De Jong B.W.D, Kok D.J. Changes in bladder wall perfusion in the overactive obstructed bladder. // Eur Urol Suppl, 2010. Vol. 9, N 2. P. 114.






