Мочекаменная болезнь (МКБ) является весьма распространенным заболеванием среди населения различных стран. По оценкам не менее 2% населения испытывают симптомы этого заболевания хотя бы раз, причем наиболее часто уже на 2-м или 3-м десятилетии своей жизни [1]. Существует несколько типов мочевых камней, которые классифицируют по химическому составу. Оксалат кальция является основным компонентом подавляющего большинства камней [2,3]. Некоторые факторы, такие как возраст, пол, климат, расстройства метаболизма и наследственность имеют связь с развитием МКБ. Метаболические нарушения литогенного характера являются наиболее важными факторами, поскольку, регулируя их воздействие можно снижать риск возникновения мочевых камней.
Повышение литогенности мочи происходит при нарушении экскреции различных ионов и веществ, способных влиять на камнеобразование [4]. К числу этих факторов риска развития МКБ относят такие метаболические нарушения, как повышенная экскреция фосфатов (гиперфосфатурия) и сниженная суточная экскреция магния (гипомагнийурия). Однако результаты ряда работ не подтверждают литогенного эффекта этих метаболических нарушений [5-7].
С практической точки зрения весьма важен вопрос о том, способна ли различная интенсивность воздействия экскретируемых с мочой веществ и ионов влиять на формирование камней определенной химической природы. Цель настоящей работы — изучение влияния интенсивности воздействия таких метаболических факторов риска камнеобразования, как фосфатурия и магнийурия на частоту и риск формирования мочевых камней различных метаболических типов.
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 437 больных МКБ (200 мужчин и 237 женщин в возрасте от 16 до 75 лет). Минеральный состав мочевых конкрементов и метаболические показатели определяли методами описанными ранее [8]. Классификацию мочевых камней проводили по преобладающему минеральному компоненту, составляющему более 50% минеральной основы камня [9-11].
Для исследования влияния величины изучаемого метаболического фактора на частоту выявления конкрементов определенного минерального состава значения каждого изучаемого метаболического показателя распределили на квартили. При этом из всей совокупности больных выделили две группы с самыми низкими значениями каждого изучаемого метаболического показателя (Q1, первый квартиль) и — с самыми высокими (Q4, четвертый квартиль).
Оценку риска формирования мочевых камней различных типов при высоких и низких значениях показателей экскреции с мочей каждого из исследуемых веществ определяли по относительному риску — Relative Risk (RR) [12].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фосфатурия
Результаты анализа показывают, что различная степень выраженности фосфатурии по разному влияет на риск образования камней различных метаболических типов у пациентов с МКБ (табл.1).
Таблица 1. Фосфатурия и риск формирования камней различных типов
| Степень фосфатурии | Мочевые камни | |||
|---|---|---|---|---|
| Оксалатные | Уратные | Карбонатапатитные | Струвитные | |
| > 33,6 мМоль/сут Q4 (n=110) | 49 | 3200,00% | 22 | 300% |
| < 18,3 мМоль/сут Q1 (n=110) | 32 | 2200,00% | 41 | 1200% |
| Относительный риск (RR) | 1,53 | 1,45 | 0,54 | 0,25 |
| Показатель p | 0,0199 | 0,1214 | 0,0062 | 0,0281 |
Примечание: Q1 – первый (нижний) квартиль распределения значений фосфатурии, Q4 – четвертый (верхний) квартиль распределения значений фосфатурии, p — статистический показатель достоверности различия отношения рисков
Установлено, что повышенная экскреция неорганических фосфатов (более 33,6 мМол/сут) увеличивает в 1,53 раза риск формирования кальций-оксалатных камней у пациентов с МКБ по сравнению с пациентами, имеющими низкие показатели суточной экскреции фосфатов (табл. 1, RR = 1,53, p = 0,0199).
Следует отметить, что повышение активности формирования оксалатных камней при гиперфосфатурии наблюдается в условиях выраженной гиперкальцийурии (до 7,08 ± 0,25 мМоль/сут) и гиперурикурии (до 4,83 ± 0,11 мМоль/сут, табл. 2). Эти два последних фактора, как было показано в другом нашем исследовании, в значительной мере способствуют усилению оксалатного литогенеза [8].
Таблица 2. Показатели крови и мочи при фосфатурии низкой (Q1) и высокой (Q4) степени
| Показатели | Q1 фосфатурия < 18,3 мМоль/сут | Q4 фосфатурия > 33,6 мМоль/сут | p | ||
|---|---|---|---|---|---|
| (M ± m) | n | (M ± m) | n | ||
| Сыворотка крови (мМоль/л) | |||||
| Кальций | 2,402 ± 0,019 | 110 | 2,400 ± 0,016 | 110 | н.д. |
| Мочевая к-та | 0,345 ± 0,009 | 110 | 0,371 ± 0,008 | 110 | <0,05 |
| Фосфор | 1,107 ± 0,024 | 110 | 1,095 ± 0,019 | 110 | н.д. |
| Магний | 0,861 ± 0,015 | 80 | 0,873 ± 0,015 | 76 | н.д. |
| Моча (мМоль/сут) | |||||
| Кальций | 3,040 ± 0,187 | 110 | 7,078 ± 0,250 | 110 | <0,000001 |
| Мочевая к-та | 2,466 ± 0,082 | 110 | 4,831 ± 0,109 | 110 | <0,000001 |
| Фосфор | 13,937 ± 0,324 | 110 | 42,254 ± 0,758 | 110 | <0,000001 |
| Магний | 2,806 ± 0,192 | 80 | 5,124 ± 0,215 | 76 | <0,000001 |
| Удельный вес мочи (г/л)х1000 | 1014,80 ± 0,704 | 110 | 1020,59 ± 0,670 | 105 | <0,000001 |
| рН (усл. ед) | 6,095 ± 0,093 | 110 | 5,642 ± 0,053 | 105 | <0,00005 |
| Диурез (мл/сут) | 1763,64 ± 74,31 | 110 | 2008,27 ± 66,22 | 110 | <0,02 |
| ИМТ (кг/м2) | 27,28 ± 0,59 | 95 | 29,48 ± 0,59 | 104 | <0,006 |
Примечание: Q1 – первый (нижний) квартиль распределения значений фосфатурии, Q4 – четвертый (верхний) квартиль распределения значений фосфатурии, P — статистический показатель достоверности различия, н.д. – нет достоверных статистических различий, ИМТ – индекс массы тела
Наблюдаемая зависимость роста частоты выявления оксалатных камней от гиперфосфатурии, по-видимому, связана с особенностями генеза кальций-оксалатных камней.
Известно, что формирование при идиопатическом кальций-оксалатном уролитиазе начинается в виде разрастания кристаллов на поверхности папиллярных интерстициальных бляшек, состоящих из апатита (карбонат-апатита, то есть, кальция фосфата). Начальная нуклеация кристаллов апатита служит основой для формирования роста камня, для которого минеральной основой в последствии становится оксалат кальция. Зародышевые центры кристаллизации апатита (нуклеация) возникают в результате перенасыщенности мочи карбонатапатитом, что наблюдают практически у всех пациентов с кальций-оксалатным уролитиазом [13,14].
Таким образом, по-видимому, высокая концентрация неорганических фосфатов мочи в большей степени способствует образованию известных бляшек Рэндалла (Randall's plaques), являющихся своеобразными затравочными элементами для формирования камней из оксалата кальция. Очевидно, этим следует объяснить более высокую частоту формирования кальций-оксалатных камней при гиперфосфатурии, выявленную в данной работе.
Отмеченная зависимость подтверждается также существованием тесной положительной корреляции между повышением степени фосфатурии и ростом частоты выявления оксалатных камней у пациентов с МКБ (г = 0,759; p = 0,0108). Графически это представлено на рисунке 1.
Заметного влияния выраженной гиперфосфатурии (>33,6 мМоль/сут) на риск развития уратных камней не отмечено, которое проявлялось в виде слабой тенденции (табл. 1, RR=1,45; p = 0,1214). Тем не менее отмечена прямая корреляция между степенью фосфатурии в 10 числовых интервалах (2,87-65,4 мМоль/сут, рис. 1) и частотой встречаемости уратных камней у пациентов с МКБ (г = 0,749; p = 0,0127).
Анализ влияния повышенной экскреции фосфатов на литогенез фосфатных камней показал, что в группе больных МКБ с гиперфосфатурией выше 33,6 мМоль/сут частота формирования собственно фосфатных камней даже снижалась: риск развития струвитных (инфекционных) камней уменьшался в 4 раза (табл. 1, RR= 0,25; p = 0,0281), а карбонатапатитных — почти в 2 раза (табл. 1, RR= 0,54; p = 0,0062).
Корреляционный анализ данных 10 интервальных значений фосфатурии и частот выявления фосфатных конкрементов показал, что с нарастанием фосфатурии отмечены устойчивые тенденции к более редкому выявлению у пациентов камней из карбонатапатита (r = -0,724; p = 0,0178) и струвита (r = -0,690; p = 0,0272). Эту динамику иллюстрируют соответствующие кривые на рисунке 1.
Описанные в литературе наблюдения указывают на то, что повышенная экскреция фосфатов с мочой является независимым фактором повышающим риск образования кальциевых (оксалатно-фосфатных) камней у мужчин и молодых женщин, но не у женщин более старшего возраста [15]. Однако в этой работе не уточнено, на формирование камней какого метаболического типа — кальций-оксалатных или кальций-фосфатных — гиперфосфатурия оказывает более сильное влияние.
Конкретные механизмы кальций-фосфатного литогенеза при гиперфосфатурии пока остаются не известными. Однако можно полагать, что наблюдаемое в настоящем исследовании снижение частоты формирования карбонатапатитных камней при гиперфосфатурии (табл.1, RR= 0,54; p = 0,0062) в большей степени связано со снижением рН мочи, препятствующим преципитации фосфатов кальция, и не зависит от нарастания выраженности гиперфосфатурии.
Действительно, у пациентов с экскрецией неорганических фосфатов более 33,6 мМол/сут наблюдали ацидификацию мочи. При этом рН мочи соответствовал 5,64 ± 0,05 по сравнению с 6,10 ± 0,09 в группе пациентов с экскрецией фосфатов менее 18,3 мМол/сут (табл. 2, p< 0,00005). Отсюда становится понятным более частое выявление струвитных камней при сниженной экскреции фосфатов, сопровождающейся защелачиванием мочи (табл. 2, рис. 1). Таким образом, различная степень фос-фатурии разнонаправленно влияет на образование кальциевых камней каждого типа. При нарастании фос-фатурии усиливается оксалатный литогенез и снижается образование камней из карбонатапатита (рис.1). Однако, в целом, как показал корреляционный анализ, степень фосфатурии не влияла на частоту выявления кальций-содержащих оксалат-но-фосфатных камней (г = 0,059; p = 0,8719).
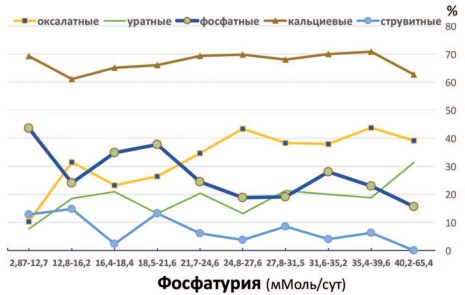
Рис. 1. Частота выявления камней различных типов (в %) при различной степени фосфатурии
Повышенная экскреция неорганических фосфатов (более 33,6 мМол/сут), особенно в сочетании с гиперкальцийурией и гиперурикурией, как было отмечено в другом нашем исследовании, может являться дополнительным метаболическим фактором, способным повышать риск формирования кальций-оксалатных камней [8].
Можно полагать, что формирование фосфатных камней из карбонатапатита, непосредственно не связано с гиперфосфатурией и имеет другие патогенетические механизмы. То же, по-видимому, следует отнести и к инфекционным (струвитным) камням, в генезе которых, ключевую роль играет не сама фосфатурия, а щелочная реакция мочи и уреазопродуцирующая мочевая флора [16].
Магнийурия
При анализе влияния степени магнийурии на частоту формирования камней того или иного метаболического типа обнаружено, что увеличение экскреции магния с мочой (более 5,1 мМол/сут) сопровождается значительным (в 1,81 раза) повышением риска образования оксалатных камней, по сравнению с пациентами, имеющими низкие показатели суточной экскреции магния (табл. 3, RR =1,81; p = 0,0026).
Таблица 3. Магнийурия и риск формирования камней различных типов
| Степень магнийурии | Мочевые камни | |||
|---|---|---|---|---|
| Оксалатные | Уратные | Карбонатапатитные | Струвитные | |
| > 5,1 мМоль/сут Q4 (n=79) | 44 | 17 | 12 | 3 |
| < 2,65 мМоль/сут Q1(n=78) | 24 | 17 | 24 | 10 |
| Относительный риск (RR) | 1,81 | 101,00% | 0,49 | 30% |
| Показатель p | 0,0026 | 96,65% | 0,0252 | 6% |
Примечание: Q1 – первый (нижний) квартиль распределения значений магнийурии, Q4 – четвертый (верх- ний) квартиль распределения значений магнийурии, p — статистический показатель достоверности различия отношения рисков
В экспериментах in vitro показано, что ионы магния обладают способностью дестабилизировать ионные пары кальция оксалата и уменьшать размеры их агрегатов [17]. Однако роль магния, как ингибитора образования кальций-оксалатного камнеобразования, до сих пор остается спорной из-за противоречивых результатов клинических испытаний последних лет [18-21].
Пока нет убедительных доказательств того, что дефицит магния является одной из главных причин развития кальций-оксалатного уролитиаза. Так, в ряде работ у пациентов с рецидивирующим оксалатным уролитиазом не обнаружено снижения экскреции магния с мочой [22-24].
Результаты одновременного обследования 284 пациентов (crosssectional study) с идиопатическим рецидивирующим кальциевым уро-литиазом показали, что повышенная экскреция магния ассоциирована с усилением экскреции кальция, калия, натрия, белка, и в меньшей степени цитратов [25].
Сочетанное повышение экскреции с мочой кальция и магния наблюдали также и другие исследователи [26-28].
Подобные данные были получены и в настоящем исследовании. Повышенная экскреция магния (более 5,1 мМоль/сут) сочеталась с усилением экскреции кальция — в среднем до 6,206 ± 0,315 против 3,662 ± 0,243 мМоль/сут в группе пациентов, имеющих показатели экскреции магния менее 2,65 мМоль/сут (табл. 4, p < 0,000001). При этом риск формирования кальций-оксалатных камней в условиях гипермагнийурии был высоким (табл. 3, RR = 1,81; p = 0,0026).
Анализ связи степени проявления магнийурии с частотой формирования мочевых камней различных метаболических типов выявил отчетливую тенденцию усиления оксалатного литогенеза при нарастании магнийурии от самых низких значений до самых высоких (рис.2, r = 0,7862; p = 0,007).
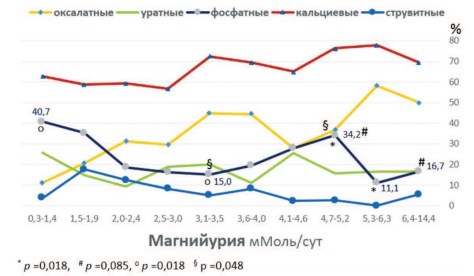
Рис. 2. Частота выявления камней различных типов (в %) при различной степени фосфатурии
Как отмечено в ряде работ, у подавляющего большинства пациентов с оксалатным уролитиазом (89-95%) регистрируют сниженную суточную экскрецию магния. Так, B. Schwartz и соавт. при обследовании 2147 пациентов с камнями, состоящими только из оксалата кальция, гипомагнийурию (< 1,9 мМоль/сут) обнаружили всего у 235 пациентов, т.е. у 11% [29]. G. Preminger и соавт. сообщали, что только 4,3% пациентов из 1116 имели гипомагнийурию (< 2,2 мМоль/сут) [30]. По данным крупной клинической лаборатории Litholink (Chicago, IL), занимающейся обследованием и лечением пациентов с уролитиазом, только 5% людей в популяции имеют уровень экскреции магния ниже 2 мМоль/сут [31]. При обследовании больных МКБ старше 18 лет только в 1434 образцах суточной мочи из 31300 образцов, взятых для анализа, была зарегистрирована гипомагнийурия ниже уровня в 2 Ммоль/сут (J. Asplin, цит по [31]). Имеются данные, указывающие на роль ионов магния в формировании брушитных [CaHPO4] нуклеусов, которые способны активировать оксалатный литогенез [32].
Интересно отметить, что в настоящее время препараты магния практически не назначают при метафилактике кальций-оксалатного уролитиаза в качестве монотерапии, ввиду их низкой эффективности и отсутствия очевидных доказательств клинического эффекта [33,34].
Таким образом, анализ литературы и собственные данные позволяют сделать вывод, что повышенная экскреция магния с мочой не является протективным фактором в отношении развития кальций-оксалатного уролитиаза.
В противоположность окса-латному уролитиазу риск формирования кальциевых карбонатапатит-ных камней при гипермагниурии (выше 5,1 мМоль/сут), был в 2 раза ниже, чем у пациентов с более низкими показателями экскреции магния (табл. 3, RR =0,49; p = 0,0252). Этот факт, возможно, объясняется способностью гипермагнийурии ингибировать рост кальций-фос-фатных камней [35].
Можно предположить, что эта способность к ингибированию каль-ций-фосфатного литогенеза проявляется только при высокой магний-урии выше 5,2 мМоль/сут, о чем свидетельствует снижение частоты выявления фосфатных камней с 34,2% до 11,1% и 16,7% при уровне магнийурии 5,3-6,3 и 6,4-14,4 соответственно (рис. 2, р=0,018 и p=0,085 соответственно).
Интересно отметить, что эффект ингибирования наблюдают при нарастании магнийурии с 0,3 до 3,5 мМоль/сут в отношении снижения частоты фосфатных (карбонатапатитных) камней с 40,7% до 15,0% (рис. 2, p =0,018).
В то же время дальнейшее нарастание экскреции магния от 3,5 до 5,2 мМоль/сут связано с образованием карбонатапатитных камней (рис.2, с 15,0% до 34,2%, p = 0,048), что указывает на разнонаправленность эффекта магнийурии диапазона 0,3-5,2 мМоль/сут на формирование фосфатных камней из карбонатапатита (U-образный эффект).
Тем не менее, отмечено, что между магнийурией и частотой выявления камней, состоящих из окса-латов и фосфатов (кальциевых камней), существует отчетливая корреляционная зависимость (г = 0,651; p = 0,041), которую отражает соответствующая кривая на рисунке 2.
Риск образования фосфатных инфекционных камней из струвита при гипермагнийурии имел явную тенденцию к снижению (табл. 2, RR =0,30, p = 0,0568). Это отчетливо заметно на графике снижения частоты встречаемости струвитных камней при магнийурии от 1,5-1,9 мМоль/сут до 6,4-14,4 мМоль/сут (рис. 2). В этом диапазоне магний-урии отмечается обратная корреляционная зависимость между увеличением экскреции магния и частотой выявления струвитных камней (г = -0,684, p =0,042).
По-видимому, это связано с известным фактом усиления струвитного литогенеза при щелочных значениях рН мочи, благодаря развитию уреазопродуцирующей флоры. Действительно, при низкой экскреции магния (ниже 2,65 мМоль/сут) отмечали более щелочную реакцию мочи, соответсвующую значениям рН 6,18 ± 0,11, тогда как средние показатели рН мочи при магнийурии выше 5,1 мМоль/сут составляли 5,76 ± 0,07 (табл. 4, p < 0,002).
Таблица 4. Показатели крови и мочи при магнийурии низкой (Q1) и высокой (Q4) степени
| Показатели | Q1 магнийурия < 2,65 мМоль/сут | Q4 фосфатурия > 33,6 мМоль/сут | Р | ||
|---|---|---|---|---|---|
| (M ± m) | n | (M ± m) | n | ||
| Сыворотка крови (мМоль/л) | |||||
| Кальций | 2,360 ± 0,018 | 78 | 2,388 ± 0,018 | 79 | н.д. |
| Мочевая к-та | 0,342 ± 0,011 | 78 | 0,357 ± 0,009 | 79 | н.д. |
| Фосфор | 1,106 ± 0,023 | 7800,00% | 1,114 ± 0,024 | 7900% | н.д. |
| Магний | 0,804 ± 0,012 | 7800,00% | 0,910 ± 0,014 | 7900% | <0,000001 |
| Моча (мМоль/сут) | |||||
| Кальций | 3,662± 0,243 | 78 | 6,206 ± 0,315 | 79 | <0,000001 |
| Мочевая к-та | 2,941 ± 0,112 | 78 | 4,306 ± 0,136 | 79 | <0,000001 |
| Фосфор | 20,11 ± 0,942 | 78 | 34,81 ± 1,226 | 79 | <0,000001 |
| Магний | 1,697 ± 0,062 | 78 | 6,373 ± 0,158 | 79 | <0,000001 |
| Удельный вес мочи (г/л)х1000 | 1015,33 ± 0,792 | 77 | 1018,46 ± 0,856 | 77 | <0,01 |
| рН (усл. ед) | 6,179 ± 0,113 | 77 | 5,756 ± 0,072 | 77 | <0,002 |
| Диурез (мл/сут) | 1923,21 ± 98,58 | 78 | 2263,04 ± 89,36 | 79 | <0,02 |
| ИМТ (кг/м2) | 27,73 ± 0,69 | 64 | 28,08 ± 0,65 | 67 н.д. | н.д. |
Примечание: Q1 – первый (нижний) квартиль распределения значений магнийурии, Q4 – четвертый (верхний) квартиль распределения значений магнийурии, P — статистический показатель достоверности различия, н.д. – нет достоверных статистических различий, ИМТ – индекс массы тела
Риск образования уратных камней при гипермагнийурии не изменялся (табл.3, RR= 1,01, p = 0,966), несмотря на некоторое влияние таких факторов уратного литогенеза, как повышение экскреции мочевой кислоты с мочой с 2,94 ± 0,11 мМоль/сут до 4,31 ± 0,14 мМоль/сут, (табл. 4, p<0,000001) и снижение рН мочи с 6,18 ± 0,11 до 5,76 ± 0,07 (табл. 4, p < 0,002). Не отмечено зависимости между выраженностью магнийурии и частотой выявления уратных камней у пациентов с МКБ (г = -0,095, p = 0,794).
Таким образом, полученные результаты позволяют сделать вывод, что повышенную экскрецию магния с мочой (> 5,1 мМоль/сут,) очевидно, можно рассматривать в качестве протективного фактора в отношении развития кальций-фосфатных карбонатапатитных и, возможно, струвитных камней. При этом оптимальными значениями экскреции магния, при которых имеется минимальный риск образования камней из карбонатапатита, по-видимому, следует считать диапазон от 2,0 до 4,0 ммоль/сут (рис. 2). В отношении кальций-оксалатного уролитиаза этот защитный эффект гипермагнийурии не проявляется.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о разнонаправленном характере влияния интенсивности экскреции фосфатов и магния на частоту и риск формирования мочевых камней определенного метаболического типа. Показатели экскреции фосфатов и магния у больных МКБ, с учетом сопутствующих им других метаболических нарушений, могут быть использованы для прогноза формирования камня определенного минерального состава и выбора соответствующих методов противорецидивного лечения.
ЛИТЕРАТУРА
1. Stamatelou KK, Francis ME, Jones CA, Nyberg LM, Curhan GC. Time trends in reported prevalence of kidney stones in the United States: 1976-1994. Kidney Int 2003; 63: 1817-1823. DOI: 10.1046/j.1523-1755.2003.00917.x.
2. Knoll T, Schubert AB, Fahlenkamp D, Leusmann DB, Wendt-Nordahl G, Schubert G. Urolithiasis through the ages: data on more than 200,000 urinary stone analyses. J Urol 2011;185(4):1304-1311; DOI: 10.1016/ j.juro.2010.11.073.
3. Shoag J, Tasian GE, Goldfarb DS, Eisner BH. The New Epidemiology of Nephrolithiasis. Adv in Chronic Kidney Dis Vol 22, No 4 (July), 2015: pp 273-278. DOI: 10.1053/j.ackd.2015.04.004.
4. Turk C, Knoll T, Petrik A, Sarica K, Skolarikos A , Straub M, Seitz C. Guidelines on Urolithi-asis — EAU,2015, URL: http://uroweb.org/wp-con-tent/uploads/22-Urolithiasis_LR_full.pdf.
5. Robertson WG, Peacock M, Heyburn PJ, Marshall DH, Clark PB. Risk factors in calcium stone disease of the urinary tract. Br J Urol 1978 Dec;50(7):449-54.
6. Ahmad I, Pansota MS, Tariq M, Tabassum SA. Frequency of metabolic abnormalities in urinary stones patients. Pak J Med Sci 2013;29(6):1363-1366. doi: http://dx.doi.org/10.12669/pjms.296.4007;
7. Pak CY, Poindexter JR, Adams-Huet B, Pearle MS — Predictive value of kidney stone composition in the detection of metabolic abnormalities. Am J Med 2003; 115(1):26-32.
8. Голованов С.А., Сивков А.В., Дрожжева В.В., Анохин Н.В. Метаболические факторы риска и формирование мочевых камней. Исследование I: влияние кальцийурии и урикурии. Экспериментальная и клиническая урология 2017;(1): 52 — 57.
9. Rendina D, De Filippo G, De Pascale F, Zampa G, Muscariello R, De Palma D, Ippolito R, Strazzullo P. The changing profile of patients with calcium nephrolithiasis and the ascendancy of overweight and obesity: a comparison of two patient series observed 25 years apart. Nephrol Dial Transplant 2013;28( Suppl 4):iv146-51. doi: 10.1093/ndt/gft076.
10. Cho ST, Jung SI, Myung SC, Kim TH. Correlation of metabolic syndrome with urinary stone composition. Int J Urol 2013 Feb;20(2):208-13. doi: 10.1111/j.1442-2042.2012.03131.x. Epub 2012 Sep 30.
11. Daudon M, Lacour B, Jungers P. Influence of body size on urinary stone composition in men and women. Urol Res 2006 Jun;34(3):193-9. DOI: 10.1007/ s00240-006-0042-8
12. Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины. [Пер. с англ.] М: Медиа Сфера 1998; 352 c.
13. Bergsland KJ, Coe FL, Gillen DL, Worcester EM. A test of the hypothesis that the collecting duct calcium-sensing receptor limits rise of urine calcium molarity in hypercalciuric calcium kidney stone formers. Am J Physiol Renal Physiol 2009;297(4):F1017-23. doi: 10.1152/ajprenal.00223.2009. Epub 2009 Jul 29.
14. Coe FL, Evan A, Worcester E. Pathophysiology-based treatment of idiopathic calcium kidney stones. Clin J Am Soc Nephrol 2011;6(8):2083-92. doi: 10.2215/CJN.11321210.
15. Curhan GC, Taylor EN — 24-h uric acid excretion and the risk of kidney stones. Kidney Int 2008;73(4):489-96. DOI: 10.1038/sj.ki.5002708.
16. Griffith DP. Struvite stones. Kidney Int 1978;13:372-82.
17. Riley JM, Kim H, Averch TD, Kim HJ. Effect of magnesium on calcium and oxalate ion binding. J Endourol 2013;27(12):1487-92. doi: 10.1089/ end.2013.0173.
18. Guerra A, Meschi T, Allegri F, Prati B, Nouvenne A, Fiaccadori E, Borghi L. Concentrated urine and diluted urine: The effects of citrate and magnesium on the crystallization of calcium oxalate induced in vitro by an oxalate load. Urol Res 2006;34:359-64; DOI: 10.1007/s00240-006-0067-z.
19. Jaipakdee S, Prasongwatana V, Premgamone A, Reungjui S, To-sukhowong P, Tungsanga K, et al. The effects of potassium and magnesium supplementations on urinary risk factors of renal stone patients. J Med Assoc Thai 2004;87:255-263.
20. Kato, Y, Yamaguchi S, Yachiku S, Nakazono S, Hori J, Wada N, Hou K. Changes in urinary parameters after oral administration of potassium-sodium citrate and magnesium oxide to prevent urolithiasis. Urology 2004;63(1):7-112.
21. Schwille PO, Schmiedl A, Herrmann U, Fan J, Gottlieb D, Manoharan M, et al. Magnesium, citrate, magnesium citrate and magnesium-alkali citrate as modulators of calcium oxalate crystalli-zation in urine: Observations in patients with recurrent idiopathic calcium urolithiasis. Urol Res 1999;27:117-26.
22. Resnick MI, David Munday D, Boyce WH. Magnesium excretion and calcium oxalate urolithiasis. Urology 1982;20(4):385-9. 10.1016/0090-4295 (82)90461-7.
23. Schwartz BF, Bruce J, Leslie S, Stoller ML. Rethinking the Role of Urinary Magnesium in Calcium Urolithiasis. J Endourol 2001;15(3):233-5. DOI: 10.1089/089277901750161638.
24. Morita N, Moriyama M, Miyazawa K, Tanaka T, Suzuki K. Evolution of strategy to measure urinary supersaturation. Hinyokika Kiyo 2011;57(1):35-8.
25. Schmiedl A, Schwille PO. Is magnesium a marker of disordered mineral metabolism in males with idiopathic recurrent calcium urolithiasis? Observations focussing on fasting magnesiuria and magnesiemia, protein and other substances in urine and plasma. Magnes Res 2003;16(3):192-205.
26. Perinpam M, Ware EB, Smith JA, Turner ST, Kardia SL, Lieske JC. Effect of Demographics on Excretion of Key Urinary Factors Related to Kidney Stone Risk. Urology 2015;86(4):690-6. doi: 10.1016/j.urology.2015.07.012. Epub 2015 Jul 20.
27. Аляев Ю.Г., Егшатян Л.В., Рапопорт Л.М., Ларцова Е.В. Гормонально-метаболические нарушения как системный фактор формирования мочевых камней. Урология 2014;(5):35-39.
28. Bonny O, Rubin A, Huang CL, Frawley WH, Pak CY, Moe OW. Mechanism of urinary calcium regulation by urinary magnesium and pH. Am Soc Nephrol 2008;19(8):1530-7. doi: 10.1681/ASN.2007091038.
29. Schwartz BF, Bruce J, Leslie S, Stoller ML. Rethinking the role of urinary magnesium in calcium urolithiasis. J Endourol 2001;15(3):233-5. DOI: 10.1089/089277901750161638.
30. Preminger GM, Baker S, Peterson R, Poindexter J, Pak CYC. Hypomag-nesiuric hypocitraturia: An apparent new entity for calcium nephrolithiasis. Lith Stone Dis. 1989;1:22-25.
31. Massey L. Magnesium therapy for nephrolithiasis. Magnes Res 2005;18(2):123-6.
32. Pak CY, Chu S. A simple technique for the determination of urinary state of saturation with respect to brushite. Invest Urol 1973; 11(3):211-5
33. Голованов С.А., Сивков А.В. Способны ли препараты магния снижать риск рецидивирования мочекаменной болезни? Экспериментальная и клиническая урология 2011;(4):28-32.
34. Skolarikos A, Straub M, Knoll T, Sarica K, Seitz C, Petrik A et al. Metabolic evaluation and recurrence prevention for urinary stone patients: EAU guidelines. Eur Urol 2015;67(4):750-63. doi: 10.1016/j.eururo.2014.10.029.
35. Tiselius H.G. Metabolic risk-evaluation and prevention of recurrence in stone disease: does it make sense? Urolithiasis 2016;44(1):91-100. doi: 10.1007/s00240-015-0840-y.







