Молниеносная гангрена мошонки или гангрена Фурнье (ГФ), названная так в честь французского дерматовенеролога J.A. Fournier (1883 г.), является одной из редких форм инфекционного некротизирующего фасциита, которая преимущественно поражает наружные половые органы и промежность; клинически характеризуется внезапным началом, стремительно прогрессирующим септическим течением и высокой летальностью [1-5]. Несмотря на успехи современной антибактериальной терапии, летальность при ГФ варьирует от 24% до 88%, составляя в среднем 35 – 40% [6, 7].
ГФ относится к острым хирургическим заболеваниям, в связи с чем она требует проведения неотложных диагностических и лечебных мероприятий [4, 5, 8-10]. Благоприятный прогноз при ГФ, прежде всего, зависит от ранней диагностики и своевременного хирургического вмешательства: ревизии пораженных мягких тканей и некрэктомии [11-13]. Срочное хирургическое лечение ГФ в первые сутки заболевания сопровождается относительно низкой летальностью, составляющей 12%; задержка в операции увеличивает летальность, в среднем, на 12% в каждые последующие сутки заболевания, достигая к 6-м суткам 80% [14].
Согласно последним литературным данным, применение лучевых методов визуализации, особенно в клинически неясных и спорных случаях, помогает уточнить диагноз, объем поражения мягких тканей аногенитальной области и источник заболевания в 95 – 97% случаев, что позволяет не только выбрать адекватную тактику лечения, но и тем самым – уменьшить количество летальных исходов [4, 5, 15, 16]. Благодаря широкому использованию средств лучевой визуализации ГФ в подавляющем большинстве случаев перестала быть «врачебной загадкой» или «нозологией с неустановленной этиологией» [1, 2, 4].
Цель предпринятого исследования состояла в изучении возможностей современных и традиционных лучевых методов исследования и их роли в диагностике ГФ.
ПОКАЗАНИЯ К ЛУЧЕВЫМ МЕТОДАМ ИССЛЕДОВАНИЯ ПРИ ГАНГРЕНЕ ФУРЬЕ
В радиологической литературе лучевым методам исследования, применяемым для диагностики ГФ, адресовано сравнительно небольшое количество работ (порядка 30ти публикаций, большая часть из которых относится к концу ХХ-го и началу XXI-го столетий). Среди них обзорных аналитических работ, в которых детально обсуждаются возможности лучевых методов исследования при ГФ и показания к их применению, всего лишь две: они представлены D.K. Rajan и K.A. Scharer [16] и R.B. Levenson и соавт.[15]. Кроме того, во многих современных руководствах по хирургии, урологии и радиологии, а также клинических статьях вопросы, связанные с лучевой диагностикой ГФ, как правило, подробно не освещаются или даже не рассматриваются вовсе. Данную ситуацию можно объяснить двумя причинами. Во-первых, пациенты с ГФ обычно поступают в хирургические стационары довольно поздно: в среднем, на 6-е – 8-е сутки заболевания, то есть в развернутой стадии болезни [4, 10, 11]. В таких случаях ввиду яркой клинической картины диагностика ГФ, как правило, не представляет затруднений; лечебные мероприятия обычно осуществляются сразу же при поступлении больного в стационар без применения каких-либо лучевых методов визуализации [4, 10]. Во-вторых, необходимо принять во внимание редкость заболевания, что не позволяет подробно изучить информативность и сравнительную эффективность различных лучевых методов визуализации при ГФ на большом клиническом материале [1, 3].
Углубленное знакомство с клиническими особенностями заболевания показывает, что возможности клинико-лабораторных методов диагностики при ГФ существенно ограничены. Независимо от стадии заболевания, почти в каждом конкретном случае ГФ имеются показания для применения лучевых методов визуализации с диагностической или дифференциальной целью. Например, в ранней стадии заболевания, при которой ГФ нередко проявляется неспецифической клиниколабораторной картиной, симулируя различные кожные, венерологические, хирургические, урологические и инфекционные заболевания [1517]. В развернутой стадии заболевания, при которой кожно-некротические изменения мягких тканей аногенитальной зоны, выявленные клиническими методами, как правило, не соответствуют некротическим изменениям глублежащих тканей, определяемым лучевыми и патоморфологическими методами, и обычно значительно меньше их по площади и объему (так называемый клинический симптом «айсберга») [2, 4, 10]. Помимо этого, более чем в половине случаев ГФ при клиническом обследовании источник заболевания остается неясным и для уточнения причины ГФ (входных ворот) требуется дополнительное применение методов лучевой визуализации [1, 4, 7, 15, 16]. Становится очевидным, что более частое использование лучевых методов исследования на дооперационном этапе могло бы значительно улучшить диагностику ГФ и выбрать правильную лечебную тактику [15, 16, 18].
Согласно современным представлениям лучевые методы исследования необходимы для диагностики ГФ во всех случаях, за исключением редких случаев заболевания в ранней (неосложненной) стадии (при установленных входных воротах и объеме поражения мягких тканей, достаточных для выработки адекватной лечебной тактики) [15, 19 – 21]. Лучевые методы исследования абсолютно показаны в следующих случаях: 1) в клинически неясных и спорных ситуациях с дифференциально-диагностической целью; 2) при клинически установленном диагнозе ГФ – для объективизации (документации) гнойно-некротических изменений мягких тканей и определения причины (источника) заболевания; 3) при уточнении границ распространения ГФ (масштаба поражения), что крайне важно для планирования предстоящего хирургического вмешательства; 4) в осложненном послеоперационном периоде с целью выявления резидуальных или рецидивных гнойно-некротических изменений мягких тканей, требующих повторного хирургического вмешательства (рис. 1) [1-7, 15, 16, 21].
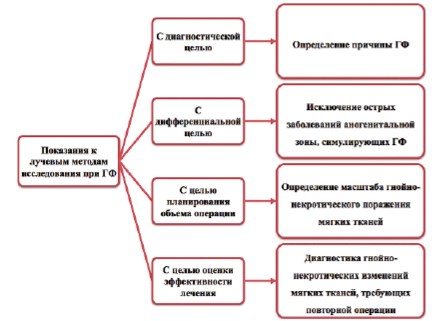
Рис. 1. Показания к лучевым методам исследования при ГФ
Среди лучевых методов визуализации в настоящее время при ГФ применяются компьютерная томография (КТ), магнитно-резонансная томография (МРТ), традиционная рентгенография (РГ) и ультразвуковое (рис. 2).
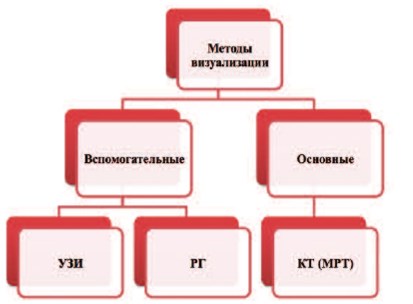
Рис.2. Классификация лучевых методов исследования при ГФ
ОБЗОР МЕТОДОВ ВИЗУАЛИЗАЦИИ
1. Компьютерная томография. КТ имеет широкий спектр возможностей и преимуществ перед другими методами визуализации при ГФ [15, 16, 18 – 41]. Она позволяет быстро осуществить панорамное исследование половых органов, мягких тканей передней брюшной стенки, промежности и нижних конечностей, органов брюшной полости и забрюшинного пространства; оценить такие структуры как сосуды, мышцы, жир, кости и связки одновременно [15, 22, 35]. В отличие от других лучевых методов исследования (кроме МРТ), КТ способна обнаружить ничтожно малые скопления свободного газа и жидкости практически любой локализации [16, 23, 34, 35, 37].
КТ позволяет установить причины (входные ворота) ГФ, например такие частые, как перианальный абсцесс, свищ прямой кишки; выявить различные инфекционновоспалительные и травматические факторы внутрибрюшной или забрюшинной локализации, приводящие к ГФ [24 – 26]. В случаях ГФ, вызванных перфорацией толстой кишки, применение КТ с усилением помогает уточнить локализацию зоны перфорации, наличие свободного газа и жидкости в брюшной полости или в забрюшинном пространстве [27, 34].
КТ с высокой точностью позволяет определить масштаб гнойнонекротического поражения мягких тканей, захватывающий нескольких анатомических регионов одновременно, что очень важно при планировании хирургического вмешательства [4, 8, 10, 17, 26, 32 – 35]. При этом степень некротических изменений подкожной жировой клетчатки и фасций, выявленные при КТ, хорошо коррелируют с границами поражения мягких тканей на операции и при патоморфологическом исследовании [20, 34].
КТ позволяет быстро и надежно оценить эффективность проводимой терапии и в связи с этим активно применяется в ближайшем послеоперационном периоде с целью выявления резидуальных или вновь сформированных (при прогрессировании заболевания) гнойных затеков, требующих повторного дренирования [33, 35]. В этой связи представляют интерес данные M. Becker и соавт., которые были получены при проведении КТ в ближайшем послеоперационном периоде у пациентов с ГФ и некротизирующим фасциитом другой локализации [24]. У 11 (80%) из 14 больных при КТ были выявлены глубокие межмышечные и межфасциальные гнойные скопления в малом тазу, которые не обнаруживались при физикальном, ультразвуковом и рутинном рентгенологическом исследованиях. После проведения КТ у 9 (82%) из них была предпринята повторная операция (вскрытие и дренирование гнойников), полностью подтвердившая данные КТ [24].
Общая КТ семиотика ГФ включает отечно-воспалительные и некротические изменения мягких тканей аногенитальной зоны в виде утолщения кожи, подкожной клетчатки, поверхностных и глубоких фасциальных структур, скопление жидкости и газа в мягких тканях, стратификацию подкожной жировой клетчатки (в виде симптома «матового стекла») вокруг зоны некроза [15, 16, 21, 23, 33, 35]. В ранней стадии для ГФ характерны отек наружных половых органов и скопления газа в стенке и перегородке мошонки (рис. 3) [29, 30, 34]. Эмфизема мягких тканей аногенитальной зоны является патогномоничным признаком ранней стадии ГФ и обнаруживается при КТ почти в 100% случаев [18, 27, 34]. Образующийся газ распространяется вдоль фасций: от мошонки и промежности к паховой области, на бедра и брюшную стенку. Однако в более поздних стадиях заболевания подкожная эмфизема может отсутствовать [35].
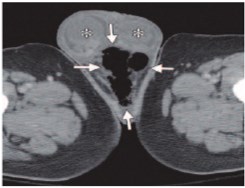
Рис. 3. КТ с усилением при ГФ. Газ в мягких тканях мошонки (стрелки – газ, астериксы – яички) (фотография из работы Avery L.L. и Scheinfeld M.H. (2013) [19])
Среди КТ признаков ГФ можно выделить перманентные и транзиторные [18, 21, 23, 33, 35]. К перманентным КТ симптомам ГФ относятся диффузное утолщение и инфильтрация кожи (дерматит), подкожной клетчатки (целлюлит); диффузное усиление и/или утолщение поверхностной и глубокой фасций (фасциит); утолщение мышц (миозит); межмышечные и межфасциальные скопления жидкости и газа [18, 33]. Некротические ткани, обнаруженные при КТ с усилением, являются дополнительным абсолютным подтверждением некротизирующего фасциита при ГФ [38, 40, 41]. Следует учитывать, что два других упомянутых выше КТ признака (асимметричное утолщение и повышение плотности мягких тканей и фасций, наличие межфасциальных жидкостных скоплений) являются неспецифичными для ГФ и встречаются также при гнойном миозите другой этиологии [15, 18, 40, 43]. Однако при этом, как при ГФ, так и при гнойном миозите, результаты КТ не влияют на тактику лечения, так как в обоих случаях, согласно принципам гнойной хирургии, показано неотложное хирургическое вмешательство [41]. Транзиторные КТ признаки ГФ включают реактивный выпот в различных анатомических полостях (в перикарде, плевральных синусах, средостении), что наблюдается при генерализации септического процесса [16, 40].
Диагностическая ценность КТ была подробно изучена N. Zacharias и соавт. у 67 пациентов с инфекционным некротизирующим фасциитом различной локализации,включая пациентов с ГФ [38]. КТ осуществлялась на 16-ти и 64-срезовых томографах с внутривенным усилением и толщиною среза 1,25 мм и 0,625 мм, соответственно; при шаге спирали томографа – 2,5 мм. 58 (87%) больных из них были прооперированы. На операции некротизирующий фасциит был выявлен у 25 (43%) пациентов, у остальных – обнаружены различные воспалительные недеструктивные заболевания мягких тканей. Согласно данным этих авторов, КТ признаки ГФ включали: 1) зоны воспаления и ишемии мягких тканей (выявлены у 100% больных); 2) некроз мышц (у 100%); 3) эмфизему мягких тканей и межфасциальный выпот (у 36% и в 28%, соответственно). Чувствительность КТ при ГФ составила 100%, специфичность – 81%, положительная предсказательная ценность теста – 76%, отрицательная предсказательная ценность теста – 100%. Ложные результаты КТ наблюдались у 5 (19%) больных гнойным миозитом промежности. Авторы пришли к выводу, что диагностическая ценность КТ при ГФ высокая и не зависит от типа томографа (16-ти или 64-срезового). Положительные результаты КТ с большой долей вероятностью указывают на наличие ГФ, а отрицательные результаты КТ надежно исключают это заболевание. При этом обращает внимание, что у пациентов с ложноположительными результатами КТ и у пациентов с ложноотрицательными результатами различия в клиниколабораторной картине и стадии ГФ выявлены не были [38].
Таким образом, высокие диагностические возможности в сочетании с быстротой получения информации позволяют большинству авторов считать КТ методом выбора для диагностики ГФ и определения лечебной тактики [1, 4, 8, 10, 11, 13, 15, 17, 21, 25, 27, 32, 42-44]. В отношении очередности применения КТ по отношению к хирургической операции в литературе нет единого мнения. Одни авторы считают необходимым применение КТ на предоперационном этапе сразу при поступлении пациента с ГФ в стационар с целью определения масштаба поражения мягких тканей и объема предстоящей операции [4, 8, 10, 11, 27, 32]. Другие авторы, при поступлении пациента с ГФ в стационар, сначала выполняют неотложное хирургическое вмешательство, а КТ применяют по показаниям в послеоперационном периоде: при осложненном его течении с целью выявления резидуальных гнойных затеков или рецидивных гнойно-некротических изменений мягких тканей, требующих повторного вмешательства [25, 42].
В последнее время появились единичные публикации об успешном совместном (фузионном) применении позитронно-эмиссионной томографии и КТ (F-ФДГ ПЭТ / КТ) для ранней диагностики ГФ [27, 34]. При этом было отмечено повышенное накопление изотопа F-18 флюородеоксиглюкозы (F18-ФДГ) в очагах воспалительной инфильтрации мягких тканей малого таза и промежности и скопление газа еще до появления клинических признаков ГФ. Данная фузионная методика является многообещающей и находится на этапе освоения; предполагается, что с ее помощью можно будет точно локализовать зоны воспалительных и некротических изменений мягких тканей уже в ранней стадии заболевания [34].
2. Магнитно-резонансная томография. Диагностические возможности МРТ при ГФ изучены в меньшей степени, чем КТ и они сопоставимы с диагностическими возможностями КТ (рис. 4) [7, 43, 45-51]. Специфическими МРТ признаками ГФ являются: 1) утолщение поверхностных фасций аногенитальной зоны ≥ 3 мм, низкая интенсивность сигнала на Т1 – взвешенных изображениях и высокая интенсивность сигнала на Т2 – взвешенных изображениях с подавлением сигнала от жира (фасциит); 2) отсутствие контрастирования фасций на Т1 – взвешенных изображениях при внутривенным введение препаратов гадолиния-DTPA (абсолютный признак некроза фасций); 3) утолщение подкожной клетчатки на T2-взвешенных изображениях, повышение контрастности подкожной клетчатки и поверхностной фасции (целлюлит) [43, 45, 47, 50, 51]. К дополнительным МРТ критериям некротизирующего фасциита при ГФ относят вовлечение глубокой фасции промежности (утолщение и повышение контрастности глубокой фасции на фоне внутривенного контрастирования), межфасциальные скопления жидкости [47, 49, 51].
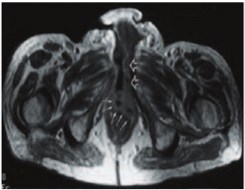
Рис. 4. МРТ с гадолинием (Т1ВИ SE) при ГФ. Абсцесс промежности (маленькие стрелки), переходящий на луковицу полового члена (открытые стрелки) (фотография из работы Kikuth R. и соавт. (2001) [51])
Считается, что при поражении подкожной клетчатки и поверхностной фасции целлюлит и некротизирующий фасциит при ГФ могут быть дифференцированы при помощи МРТ с высокой точностью [43, 45]. Однако, при вовлечении в процесс глубоких фасций промежности возможна гипердиагностика ГФ, так как только одно контрастное усиление глубокой фасции промежности при МРТ не позволяет надежно дифференцировать структивную и недеструктивную формы фасциита. В подобных случаях рекомендуется данные МРТ сопоставлять с клинико-лабораторной картиной заболевания. Это позволит избежать гипердиагностики ГФ и, как следствие, неоправданных операций [46, 48, 50, 51].
Ряд авторов полагает, что МРТ является оптимальным методом для диагностики ГФ, благодаря ее способности выявлять тонкие различия в контрастности мягких тканей [45 – 48, 50]. Некоторые авторы считают, что диагностические возможности МРТ при ГФ даже превышают возможности КТ. Например, S. Paz Maya и соавт. полагают, что поражение глубокой фасции промежности при ГФ за счет накопления жидкости и реактивной гиперемии лучше отображается при МРТ, чем при КТ [7]. A. Yoneda и соавт. приводят интересное наблюдение 57-летнего пациента с ГФ, у которого при КТ были обнаружены абсцесс и свободный газ в мягких тканях правой ягодичной области, что было подтверждено в дальнейшем при операции. Однако после операции в первые сутки состояние пациента внезапно ухудшилось вследствие развития септического шока. Дополнительное применение МРТ (через сутки после КТ) выявило наличие выраженного глубокого некротизирующего фасциита правого бедра, очевидно, вовремя нераспознанного при предшествующей КТ. Повторное эксплоративное вмешательство подтвердило результаты МРТ. Авторы не без основания полагают, что при ГФ применение МРТ является более предпочтительным, чем КТ [43]. По данным M.R. Schmidt и соавт., полученных с учетом указанных выше диагностических МРТ критериев ГФ и при использовании среднепольного томографа мощностью 1,5 Тесла, чувствительность, специфичность и точность МРТ при ГФ составили 100%, 86% и 94%, соответственно [49]. По обобщенным данным литературы последних лет, специфичность МРТ при ГФ варьирует в диапазоне от 50% до 85% и составляет в среднем 68% [43, 45, 47].
Однако, несмотря на высокие диагностические возможности, применение МРТ при ГФ, в настоящее время, ограничено двумя факторами [43]. Во-первых, при дифференцировании ГФ, банальных форм целлюлита и дерматомиозита при помощи МРТ наблюдается высокий процент ложноположительных результатов, что может привести к неоправданному хирургическому вмешательству с диагностической целью [37, 43]. Вовторых, применение МРТ ограничено большой продолжительностью исследования и невысокой доступностью метода [37, 48, 50, 51]. Именно длительность процедуры или времязатратность, превышающая таковую при современной мультислайсовой КТ в десятки и даже в сотни раз, является серьезным ограничением для широкого клинического использования МРТ в диагностике ГФ. Данный факт становится более понятным, если учесть соматически тяжелый контингент пациентов с ГФ и быструю прогрессию заболевания, измеряемую в часовом формате. Поэтому в настоящее время МРТ применяется у ограниченного контингента пациентов с ГФ: мобильных и психически адекватных пациентов, со стабильной гемодинамикой, способных перенести данное исследование [48-51].
3. Рентгенография. Возможности традиционной РГ в диагностике ГФ значительно ограничены. РГ позволяет выявить выраженный отек наружных половых органов, определить инородное тело, спровоцировавшее начало заболевания; диагностировать подкожную эмфизему мошонки и промежности в сроки, незначительно (в течение нескольких часов) опережающие появления подкожной крепитации при физикальном исследовании (рис. 5) [15, 16]. Высокая эффективность РГ в диагностике подкожной эмфиземы, относительно возможностей клинического метода, была отмечена многими авторами [1-7, 15, 16, 52]. В ретроспективном обзоре 26 пациентов с ГФ J.R. Fisher и соавт. отметили, что при РГ эмфизема мягких тканей аногенитальной зоны была выявлена у 19 (73%) пациентов, в то время как при физикальном исследовании – лишь у 5 (19%) [52]. При этом РГ позволила лишь приблизительно оценить границы подкожной эмфиземы при распространении ее в паховые области, на переднюю брюшную стенку, нижние конечности и в забрюшинное пространство [15, 16, 52].
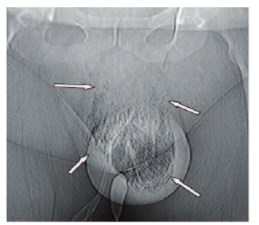
Рис. 5. Рентгенография при ГФ. Газ в мягких тканях мошонки (стрелки) (фотография из работы Levenson R.B. и соавт. (2008) [15])
Многие авторы полагают, что при диагностике ГФ традиционная РГ обладает низкой чувствительностью и специфичностью [15, 16, 52]. По сводным данным, в развернутой стадии ГФ РГ позволяет выявить свободный газ в пораженных мягких тканях наружных половых органов и промежности в 57 – 90% случаев (в среднем в 65% случаев) [1, 4, 16, 52]. РГ не способна обнаружить наличие свободного газа в первые сутки заболевания, а также по ходу глубоких фасциальных структур, что является существенным недостатком этого метода [10, 15, 16, 21, 28, 52]. Поэтому в настоящее время РГ относится к методам первичной визуализации при ГФ; она применяется, когда другие высокоинформативные методы, такие как КТ и МРТ, противопоказаны или недоступны [15, 16, 52].
4. Ультразвуковое исследование. Диагностические возможности УЗИ при ГФ изучены в незначительном количестве публикаций [15, 16, 17, 53-55]. При ГФ УЗИ способно выявить утолщение и отек мягких тканей мошонки и промежности; глубокие внутритканевые скопления жидкости, недоступные пальпации; свободный газ в стенке мошонки в виде множественных дискретных гиперэхогенных артефактов реверберации (рис. 6) [17, 53-55]. Свободный газ в стенке мошонки визуализируется при УЗИ еще до появления признаков крепитации, обнаруживаемых при физикальном исследовании [1, 16, 54, 55]. При этом УЗИ позволяет различить наличие газа в стенке мошонки при ГФ и присутствие газа в просвете или в стенке кишки при осложненной пахово-мошоночной грыже, что важно при дифференциации этих заболеваний, имеющих в ранней стадии схожую клиническую картину [55]. УЗИ, также как РГ, позволяет приблизительно оценить границы подкожной эмфиземы при ее распространении на промежность, тазовую клетчатку, на паховую область, бедра и переднюю брюшную стенку [15, 16].
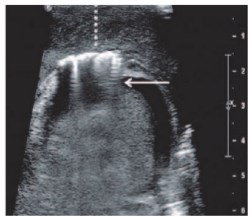
Рис. 6. УЗИ при ГФ. Утолщение и газ в стенке мошонки (стрелка – газ, астериксы – утолщение стенки мошонки) (фотография из работы Gupta N. и соавт. (2014) [39])
При УЗ допплеровском картировании кровотока по скорости или энергии у пациентов с ГФ дополнительно выявляется гиперваскуляризация стенки мошонки, которая в норме сосудистые сигналы не обнаруживает [17, 51]. Размеры и эхотекстура яичек при ГФ обычно не изменяются, что объясняется раздельным кровоснабжением яичек и стенки мошонки [5, 10, 21, 28]. По данным УЗИ у пациентов с ГФ нередко обнаруживается одноили двустороннее реактивное гидроцеле небольших размеров, что впрочем, не имеет большого клинического значения [17, 53].
M.G. Begley и соавт. показали, что утолщение мягких тканей промежности, задних отделов мошон-ки, перианальной области лучше выявляется при УЗИ в декубитальном положении – на боку с приведенными к животу ногами [53]. Авторы рекомендуют эту укладку для клинического применения у пациентов с ГФ.
При сравнительной оценке диагностических возможностей УЗИ и РГ у пациентов с ГФ УЗИ значительно превосходит РГ. УЗИ в отличие от РГ позволяет определить локализацию внутритканевой эмфиземы; провести дифференциацию ГФ с другими схожими острыми заболеваниями пахово-мошоночной области (например, с острым эпидидимоорхитом, острым заворотом яичка, ущемленной пахово-мошоночной грыжей); оценить мягкотканую структуру наружных и внутренних половых органов, промежности, живота, таза и нижних конечностей [11, 15, 16, 19, 53].
В диагностике подкожной эмфиземы УЗИ по чувствительности не уступает КТ и МРТ [1, 15, 16, 51, 53]. C.H. Butcher и соавт. в эксперименте на аутопсийном материале показали высокую информативность УЗИ в обнаружении внутритканевой эмфиземы при использовании линейных датчиков высокого разрешения 6 – 13 МГц, имеющих максимальный диапазон сканирования по глубине до 4-х см. Чувствительность УЗИ в выявлении эмфиземы мягких тканей, по данным авторов, составила 100%, специфичность – 87,5% [54].
Специфическими недостатками УЗИ являются высокая операторозависимость, необходимость прямого контакта УЗ датчика с раневой поверхностью и давления на пораженные мягкие ткани, что плохо переносится пациентами; ограничение диапазона сканирования, не позволяющее оценить глубоко лежащие мягкие ткани аноректальной области и малого таза, особенно у тучных пациентов [11, 15-17].
УЗИ, также как и РГ, относится к методам первичной визуализации ГФ и обычно применяется совместно с РГ, когда КТ или МРТ противопоказаны или недоступны [1, 10, 16, 53, 55]. В последнее время УЗИ отводится роль «прикроватного» метода диагностики ГФ (bedside sonography) у соматически тяжелых пациентов, находящихся в блоке интенсивной терапии [15, 16, 55]. При этом позитивные результаты УЗИ в отношении ГФ позволяют незамедлительно начать проведение целенаправленных терапевтических мероприятий непосредственно в реанимационном отделении и, тем самым, благоприятно повлиять на исход заболевания. Отсутствие лучевой нагрузки делает УЗИ методом выбора у пациентов детского возраста [17, 53, 55]. Тем не менее, некоторые авторы советуют критически относиться к негативным результатам УЗИ при клиническом подозрении на ГФ и рекомендуют в любом случае, независимо от результатов УЗИ, выполнять КТ или МРТ (если такая возможность имеется) или эксплоративное хирургическое вмешательство с интраоперационной биопсией мягких тканей для надежной верификации диагноза [1-3, 7].
ЗАКЛЮЧЕНИЕ
Таким образом, лучевые методы исследования показаны во всех случаях ГФ, за исключением редких неосложненных случаев ГФ с установленными причинами заболевания и масштабом поражения мягких тканей. Возможности лучевых методов исследования при ГФ находятся в стадии изучения. Диагностический алгоритм применения лучевых методов визуализации при ГФ остается неразработанным.
По мнению большинства авторов, методом выбора в диагностике ГФ является КТ, которая позволяет с высокой степенью надежности диагностировать заболевание, установить причину и масштаб распространения ГФ, определить объем оперативного вмешательства. КТ незаменима для контроля эффективности лечения: в послеоперационном периоде она позволяет выявить гнойные затеки, требующие повторного дренирования.
Помимо высоких диагностических возможностей, КТ имеет важное преимущество перед другими методами визуализации в скорости получения диагностической информации. Учитывая соматически тяжелый контингент пациентов и продолжительность исследования, этот фактор имеет большое значение для благоприятного исхода заболевания. Именно продолжительность исследования ограничивает применение МРТ в тех случаях, когда имеется выбор в диагностических средствах.
Возможности МРТ при диагностике ГФ изучены в меньшей степени, чем КТ, но они сопоставимы с диагностическими возможностями КТ, и по данным некоторых авторов даже превосходят их.
РГ и УЗИ относятся к методам первичной визуализации при ГФ и применяются, когда КТ и МРТ недоступны или противопоказаны. РГ и УЗИ могут быть полезны для использования в палатах интенсивной терапии и при положительных результатах позволяют безотлагательно начать лечебные мероприятия. В связи с отсутствием лучевой нагрузки УЗИ особенно показано пациентам детского возраста. С дифференциальнодиагностической целью УЗИ может быть также рекомендовано для исключения острых заболеваний пахово-мошоночной области, симулирующих ГФ (таб. 1).
Таблица 1. Основные характеристики лучевых методов исследования при ГФ
| Метод | Диагностические характеристики |
Диагностические возможности |
Назначение | Основные недостатки метода |
|---|---|---|---|---|
| КТ | Высокие чувствительность и специфичность, быстродествие |
Уточнение причины ГФ и объема поражения, оценка эффективности лечения |
Метод выбора | Лучевая нагрузка, при использовании рентгеноконтрастных средств у больных ГФ возможны непереносимость и высокий риск развития почечной недостаточности |
| МРТ | Высокие чувствительность и специфичность, отсутствие лучевой нагрузки |
Уточнение причины ГФ и объема поражения, оценка эффективности лечения |
Метод выбора (при невозможности КТ) |
Большая продолжительность исследования |
| УЗИ | Высокие чувствительность и специфичность, отсутствие лучевой нагрузки |
Выявление свободного газа и выпота в мягких тканях мошонки и промежности |
Метод выбора у детей, в палатах интенсивной терапии, при дифференциальной диагностики ГФ с острыми заболеваниями органов мошонки |
Операторозависимость, малоэффективно у тучных пациентов, при открытых ранах и глублежащих поражениях мягких тканей |
| РГ | Низкие чувствительность и специфичность |
Выявление подкожной эмфиземы мошонки и промежности |
Вспомогательный метод (при невозможности КТ, МРТ, УЗИ) |
Лучевая нагрузка, малоэффективна в ранней стадии ГФ и при эмфиземе глублежащих мягких тканей |
Сравнительная информативность лучевых методов визуализации изучена в единичных публикациях (табл. 2). При выявлении подкожной эмфиземы наружных половых органов, промежности и передней брюшной стенки информативность всех лучевых методов сопоставима друг с другом. Однако, в диагностике свободного газа и жидкости в глубоких тканях промежности в брюшной полости, забрюшинном пространстве и в малом тазу УЗИ и РГ значительно уступают КТ и МРТ.
Таблица 2. Информативность лучевых методов исследования при ГФ
| Диагностические характеристики метода |
КТ [38] | МРТ [43, 45, 49] | УЗИ [54] | РГ [1, 4, 16, 52] |
|---|---|---|---|---|
| Чувствительность (Se), % | 100 | 100 | 100 | 57 90 |
| Cпецифичность (Sp), % | 81 | 50-86 | 87,5 | 50 |
Лучевая семиотика ГФ состоит из 4 основных признаков, среди которых внутритканевая эмфизема является патогномоничным лучевым симптомом ГФ (рис. 7). Важно помнить, что негативные результаты лучевых методов исследования при наличии клинико-лабораторной картины ГФ, не исключают заболевания и не служат поводом для отказа от эксплоративной хирургической операции с диагностической и лечебной целью. Применение лучевых методов визуализации при ГФ ни в коем случае не должно задерживать выполнения срочного хирургического вмешательства.
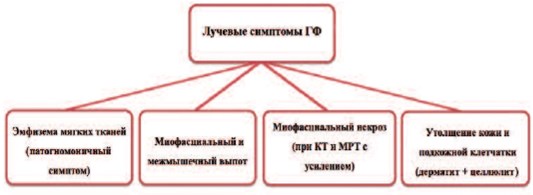
Рис. 7. Основные лучевые симптомы ГФ
ЛИТЕРАТУРА
1. Misiakos EP, Bagias G, Patapis P, Sotiropoulos D, Kanavidis P, Machairas A. Current concepts in the management of necrotizing fasciitis. // Frontiers in surgery. 2014. Vol. 1, N 36. P. 1 – 10.
2. Sartelli M, Malangoni MA, May AK, et al. World Society of Emergency Surgery (WSES) guidelines for management of skin and soft tissue infections. // World J Emerg Surg. 2014. Vol. 9, N 57. P. 2 – 18.
3. Sadasivan J, Maroju NK, Balasubramaniam A. Necrotizing fasciitis. // Indian J Plast Surg. 2013. Vol. 46, N 3. P. 472 – 478.
4. Altarac S, Katušin D, Crnica S, Papeš D, Rajković Z, Arslani N. Fournier’s gangrene: etiology and outcome analysis of 41 patients. // Urol Int. 2012. Vol. 88, N 3. P. 289 – 293.
5. Пытель Ю.А., Золотарев И.И. Неотложная урология. М.: Медицина, 1985. с. 320
6. Al Shukry S, Ommen J. Necrotizing fasciitis – report of 10 cases and review of recent literature. // J Med. Life. 2013. Vol. 6, N 2. P. 189 – 194.
7. Paz Maya S, Dualde Beltran D, Lemercier P, Leiva-Salinas C. Necrotizing fasciitis: an urgent diagnosis. // Skeletal Radiol. 2014. Vol. 43, N 5. P. 577 – 589.
8. Тиктинский О.Л., Михайличенко В.В. Андрология. СПб., 1999. 464 с.
9. Урология: Национальное руководство [Под ред. Н.А. Лопаткина]. М.: ГЭОТАР – Медиа, 2009. 1024 с.
10. Алиев С.А., Алиев Е.С, Зейналов В.М. Болезнь Фурнье в свете современных представлений. // Хирургия. 2014. N 4. С. 34 – 39.
11. Furgitt JB, Puckett ML, Quigley MM, Kerr SM. Necrotizing fasciitis. // RadioGraphics. 2004. Vol. 24, N 5. P. 1472 – 1476.
12. Gonzalez SB, Vilanova JC, Battle XT, Bierry G, Compostela S. Imaging findings of soft tissue infections. // ESSR 2013. Poster No.: P-0018. DOI-Link: http://dx.doi.org/10.1594/essr2013/P-0018.
13. Puvanendran R, Huey JCM, Pusapathy S. Necrotizing fasciitis. // Canadian Family Physician. 2009. Vol. 55, N 10. P. 981 – 987.
14. Stamenkovic I, Lew D. Early recognition of potentially fatal necrotizing fasciitis – the use of frozen-section biopsy. // N Engl J Med. 1984. Vol. 310. P. 1689 – 1693.
15. Levenson RB, Singh AK, Novelline RA. Fournier gangrene: role of imaging. // Radiographics. 2008. Vol. 28, N 2. P. 519 – 528.
16. Rajan DK, Scharer KA. Radiology of Fournier’s gangrene. // Am J Roentgenol. 1998. Vol. 170, N 1. P. 163 – 168.
17. Васильев А.Ю., Ольхова Е.Б. Ультразвуковая диагностика в детской андрологии и гинекологии (учебное пособие). М.: ГЭОТАР – Медиа, 2008. 152 с.
18. Amendola MA, Casillas J, Joseph R, Antun R, Galindez O. Fournier’s gangrene: CT findings. // Abdom Imaging. 1994. Vol. 19, N 5. P. 471 – 474.
19. Avery LL, Scheinfeld MH. Imaging of penile and scrotal emergencies. // Radiographics. 2013. Vol. 33, N 3. P. 721 – 740.
20. Garcelan Trigo JA Tello Moreno M, Talavera Martinez L, A. Bedmar Perez, Rabaza Espigares M J, Romero Manjon MI. Gangrena de Fournier, evaluacion de luso de pruebas de diagsticopor la imagen en unaserie de 9 casos. // Presentación Electrónica Educativa. SERAM 2014 / S-0025. http://dx.doi.org/10.1594/seram2014/S-0025.
21. Chadnry AA, Baker KS, Gould ES, Gupta R. Necrotizing fasciitis and its mimics: what radiologists need to know. // AJR Am J Roentgenol. 2015. Vol. 204, N 1. P. 128 – 139.
22. Ash L, Hale J. CT findings of perforated rectal carcinoma presenting as Fournier’s gangrene in the emergency department. // Emerg Radiol. 2005. Vol. 11, N 5. P. 295 – 297.
23. Bernaldo de Quirós JM, Argüelles Riera Y, Portela Carril M, Ruiz Fontán J, Pazos Riveiro A. Fournier’s gangrene: computerized tomography findings. // Arch Esp Urol. 1997. Vol. 50, N 3. P. 294 – 296.
24. Becker M, Zbären P, Hermans R, Becker CD, Marchal F, Kurt AM, Marré S, Rüfenacht DA, Terrier F. Necrotizing fasciitis of the head and neck: role of CT in diagnosis and management. // Radiology. 1997. Vol. 202, N 2. P. 471 – 476.
25. Cullen IM, Larkin JO, Moore M, Fitzgeral E, O'Ríordáin M, Rogers E. Fournier’s gangrene-findings on computed tomography. // Scientific World Journal. 2007. Vol. 12, N 7. P. 1839 – 1841.
26. Jean-Charles N, Sadler MA. Necrotizing perineal fasciitis in two paraplegic nursing-home residents: CT imaging findings. // Abdom Imaging. 2001. Vol. 26, N 4. P. 443 – 446.
27. Hsu CT, Kao PF, Huang CC, Huang HH, Lee JK. FDG PET/CT images demonstrating Fournier gangrene with bilateral pelvic muscle extension in a patient with recurrent rectosigmoid cancer. // Clin Nucl Med. 2014. Vol. 39, N 1. P. 52 – 53.
28. Hosseinzadeh K, Heller MT, Houshmand G. Imaging of the female perineum in adults. // Radiographics. 2012. Vol. 32, N 4. P. 129 – 168.
29. Lang EK, Hanano A, Rudman E, Macchia RJ. Computerized tomography of Fournier’s gangrene. // J Urol. 2010. Vol. 183, N 2. P. 740.
30. Michel F, Fauchery A, Belhadj M, Couailler JF, Martin-Champetier R. The contribution of imagery in the diagnosis of Fournier’s gangrene. // Prog Urol. 1997. Vol. 7, N 3. P. 471 – 475.
31. Piedra T, Ruíz E, González FJ, Arnaiz J, Lastra P, López-Rasines G. Fournier’s gangrene: a radiologic emergency. // Abdom Imaging. 2006. Vol. 31, N 4. P. 500 – 502.
32. Shyam DC, Rapsang AG. Fournier’s gangrene. // Surgeon. 2013. Vol. 11, N 4. P. 222 – 232.
33. Sherman J, Soliday M, Paraiso E, Becker J, Mydlo JH. Early CT findings of Fournier’s gangrene in a healthy male. // Clin Imaging. 1998. Vol. 22, N 6. P. 425 – 427.
34. Surucu E, Canda AE, Kaya GC, Tuna B, Sengoz T, Yorukoglu K, Terzi C. F-18 fluorodeoxyglucose PET in Fournier gangrene. // Clin Nucl Med. 2010. Vol. 35, N 8. P. 625 – 627.
35. Villanueva Rincón JM, Pérez Nevado A, Vicente Catalán L, Marcos Sánchez F, Arbol Linde F, Milanés Nivia B. CT in Fournier’s gangrene. // Arch Esp Urol. 1998. Vol. 5, N 9. P. 873 – 880.
36. Wysoki MG, Santora TA, Shan RM, Friedman AC. Necrotizing fasciitis: CT characteristics. // Radiology. 1997. Vol. 203, N 3. P. 859 – 863.
37. Yagüe Romeo D, Angulo Hervías E, Bernal Lafuente C, Marcuello Peña MT, Mayayo Sinués E, Sarría Octavio de Toledo L. Fournier’s gangrene in a 44-year-old woman: CT scan findings. // Arch Esp Urol. 2009. Vol. 62, N 6. P. 483 – 485.
38. Zacharias N, Velmahos GC, Salama A, Alam HB, de Moya M, King DR, Novelline RA. Diagnosis of necrotizing soft tissue infections by computed tomography. // Arch Surg. 2010. Vol. 145, N 5. P. 452 – 455.
39. Gupta N, Zinn KM, Bansal I, Weinstein R. Fournier’s gangrene: ultrasound or computed tomography? // Med Ultrason. 2014. Vol. 16, N 4. P. 389 – 390.
40. Mulcahy H, Richardson ML. Imaging of necrotizing fasciitis: self-assessment module. // AJR Am J Roentgenol. 2010. Vol. 195, N 6 (suppl.). P. S66 – S69.
41. Schulze M, Overkamp D, Joanoviciu S, Horger M. CT-bildgebung der nekrotisierenden fasziitis. // Fortschr Rontgenstr. 2008. V. 180, N 7. P. 587 – 590.
42. D'Arena G, Pietrantuono G, Buccino E, Pacifico G, Musto P. Fournier’s gangrene complicating hematologic malignancies: a case report and review of literature. // Mediterr J Hematol Infect Dis. 2013. Vol. 5, N 1. E2013067.
43. Yoneda A, Fujita F, Tokai H, Ito Y, Haraguchi M, Tajima Y, Kanematsu T. MRI can determine the adequate area for debridement in the case of Fournier’s gangrene. // Int Surg. 2010. Vol. 95, N 1. P. 76 – 79.
44. Roje Z, Roje Z, Matić D, Librenjak D, Dokuzović S, Varvodić J. Necrotizing fasciitis: literature review of contemporary strategies for diagnosing and management with the case reports: torso, abdominal wall, upper and lower limbs. / World J Emerg Surg. 2011. Vol. 6, N 46. P. 2 – 17
45. Arslan A, Pierre-Jerome C, Borthne A. Necrotizing fasciitis: unreliable MRI findings in the preoperative diagnosis. // Eur J Radiol. 2000. Vol. 36, N 3. P. 139 – 143.
46. Brothers TE, Tagge DU, Stutley JE, Conway WF, Del Schutte H Jr, Byrne TK. Magnetic resonance imaging differentiaties between necrotizing and non-necrotizing fasciitis of the lower extremity. // J Am Coll Surg. 1998. Vol. 187, N 4. P. 416 – 421.
47. Gravson DE, Abbott RM, Levy AD, Sherman PM. Emphysematous infections of the abdomen and pelvis: a pictorial review. // Radiographics. 2002. Vol. 22. P. 543 – 561.
48. Hopkins KL, Bergman G. Gadolinium-DTPA-enhanced magnetic resonance imaging of musculoskeletal infectious processes. // Skeletal Radiol. 1995. Vol. 24, N 5. P. 325 – 330.
49. Schmidt MR, Kossmann T, Duewell S. Differentiation of necrotizing fasciitis and cellulitis using MR imaging. // Am J Roentgenol. 1998. Vol. 170, N 3. P. 615 – 620.
50. Twaini A, Khan A, Malik A, Cherian J, Barua J, Shergill I, Mammen K. Fournier’s gangrene and its emergency management. // Potgrad Med J. 2006. Vol. 82, N 970. P. 516 – 519.
51. Kirkuth R, Adams S, Kirchner J, Pastor J, Simon S, Liermann D. Magnetic resonance imaging in the diagnosis of Fournier’s gangrene. // Eur Radiol. 2001. Vol. 11, N 2. P. 787 – 790.
52. Fisher JR, Conway MJ, Takeshita RT, Sandoval MR. Necrotizing fasciitis. Importance of roentgenographic studies for soft-tissue gas. // JAMA. 1979. Vol. 241, N 8. P. 803 – 806.
53. Begley MG, Shawker TH, Robertson CN, Bock SN, Wei JP, Lotze MT. Fournier’s gangrene: diagnosis with scrotal US // Radiology. 1988. Vol. 169, N 2. P. 387 – 389.
54. Butcher CH, Dooley RW, Levitov AB. Detection of subcutaneous and intramuscular air with sonography: a sensitive and specific modality. // J Ultrasound Med. 2011. Vol. 30, N 6. P. 791 – 795.
55. Morrison D, Blaivas M, Lyon M. Emergency diagnosis of Fournier’s gangrene with bedside ultrasound. // Am J Emerg Med. 2005. Vol. 23, N 4. P. 544 – 547.







