В онкоурологии постоянно ведется поиск новых методов лечения и усовершен-
ствование старых методик. Одним из давно известных методов является фотодинамическая диагностика и фотодинамическая терапия. Еще 14 октября 1912 г. F. Meyer-Betz ввел себе внутривенно гематопорфирин и продемонстрировал солнечную фоточувствительность в виде отека и гиперпигментации кожи. В 1960 г. S. Schwartz получил фотосенсибилизатор с улучшенными свойствами – производный гематопорфирина, который оказывает в 2 раза более высокое фотодинамическое действие. В 1992 г. в России начаты клинические испытания фотосенсибилизатора – Фотогем. В 1994-2001 гг. в России проведены систематические исследования производных хлорофилла А, в результате которых были созданы фотосенсибилизаторы второго поколения – Фотохлорин и Фотодитазин. С 90-х гг. прошлого века наша страна занимает одно из ведущих мест в разработке фотодинамических методов диагностики и лечения.
Перспективные направления применения фотодинамического эффекта в онкоурологии:
• флуоресцентная диагностика (ФДД) – флуоресцентная навигация при эндоскопических вмешательствах, контроль радикальности лечения при эндоскопических, открытых и лапароскопических оперативных вмешательствах;
• фотодинамическая терапия (ФДТ) – первичное лечение опухолевых и воспалительных заболеваний, противорецидивное лечение, применение в комбинации или при неэффективности других методов лечения, паллиативная терапия с циторедуктивной целью.
Фотодинамическая диагностика и терапия рака почки
Заболеваемость раком почки неуклонно растет: за последние десять лет она увеличилась на 33% и достигает 10 случаев на 100 тыс. населения (В.И. Чиссов, 2008). В странах Европы заболеваемость раком почки также постоянно увеличивается и составляет от 2 до 3% всех онкологических заболеваний.
«Золотым» стандартом лечения рака почки является радикальная нефрэктомия, но в последнее десятилетие все больше предпочтения отдается органосохраняющему лечению. Резекция почки может выполняться не только по абсолютным показаниям, как это было раньше (опухоль единственной почки, интеркуррентные заболевания, резкое снижение почечной функции и т.д.), но и во всех других ситуациях, когда это технически возможно. Органосохраняющее лечение уже является стандартным в Европе и Америке.
Критериями эффективности органосохраняющего лечения являются частота местных рецидивов и отдаленная выживаемость. Причиной локального рецидива является нерадикальность выполненной резекции почки и мультифокальный рост опухоли. До 94% рецидивов проявляется в течение 1 года после оперативного вмешательства (Schlichter H. еt al., 1998). Эти рецидивы не являются истинными, скорее, они связаны с неполным удалением опухоли во время операции. Это является одним из значимых негативных факторов органосохраняющего лечения. При больших размерах опухоли может наблюдаться ее прорастание вглубь паренхимы в виде «языков», небольшие отсевы, т. е. всегда остается опасность не определить визуально границы опухоли. Во многих рекомендациях есть указания на то, что при выполнении резекции необходима экспресс-биопсия из резецируемого участка хирургического ложа. Но, экспресс- биопсия не является точным критерием оценки радикальности операции, т. к. отсутствует возможность четкого определения опухоли в крае резекции. Поэтому в настоящее время очень актуальна разработка методик, позволяющих четко визуализировать опухоль и выполнять прицельную биопсию из подозрительных участков.
Собственный опыт применения ФДД при раке почки
На базе НИИ урологии мы провели исследование по визуализизации опухоли почки с использованием фотосенсибилизаторов. В исследовании приняли участие 14 пациентов. Все они получили препарат Аласенс перорально по 1,5 г на 100 мл питьевой негазированной воды за 4 часа до операции. В качестве источника оптического излучения использовалась система спектральных измерений и анализа оптических свойств биотканей ЛЭСА-01-БИОСПЕК (рисунок 1).

Лазерное воздействие с использованием лазерной установки ЛФТ 630/675-01 «Биоспек» и цилиндрического оптиковолоконного световода TF-C20
Рисунок 1. Фотодинамическая терапия
Методом ФДД исследовалась собственная флюоресценция с участков биологической ткани и флюоресценция экзогенных флюорохромов (красителей), в том числе фотосенсебили-заторов.
Нами проводились измерения и анализ спектральных свойств оптического сигнала, полученного от ткани. Система позволяет локально определять степень накопления фотосенсибилизатора в любых органах пациента, доступных для волоконнооптического зонда.
В результате мы выяснили, что препарат Аласенс в значительной степени накапливается в опухолевой ткани (рисунок 2). По сравнению с нормальной почечной паренхимой интенсивность флуоресценции в опухолевой ткани значительно выше (рисунок 3). Метод позволяет определить радикальность выполненного оперативного лечения путем визуализации края резекции, что дает возможность уменьшить частоту местных рецидивов и повысить показатели безрецидивной выживаемости в течение 1-2-х лет. Высокая диагностическая эффективность ФДД, подтвержденная патоморфологическими исследованиями, продемонстрирована в уточнении границ основного и выявлении дополнительных первичных очагов опухоли. Чувствительность метода составила 85-100%, специфичность –63-78%.

Рисунок 2. Фотодинамическая диагностика рака почки
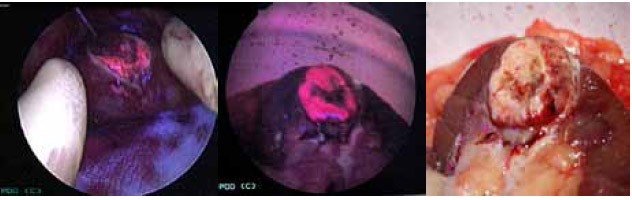
Рисунок 3. Фотодинамическая диагностика рака почки
Таким образом, применение ФДД возможно непосредственно во время операции для контроля зоны резекции, определении ее объема, и, самое главное, оценки хирургического ложа после резекции, чтобы, в случае выявления остаточной опухоли выполнить срочную биопсию из конкретного участка. В настоящее время исследование продолжается. В течение ближайших 2-3 лет будут получены результаты по безрецидивной выживаемости больных, прооперированных с использованием фотодинамического контроля. Мы надеемся, что применение этих технологий позволит снизить вероятность местных рецидивов.
ФДД при раке предстательной железы
Несмотря, на многочисленные существующие ныне методы диагностики РПЖ, нужно признать, что они несовершенны. Их недостаточная чувствительность приводит к недооценке стадии рака почти в 50% случаев (Perrotti M., Han K-R., 1999). Частота положительного хирургического края после радикальной простатэктомии (РПЭ) достигает от 6 до 79% случаев (Ackerman D.A., Barry J.M., 1993), что обусловлено степенью распространенности опухоли, ее дифференцировкой, объемом и локализацией, предоперационным уровнем ПСА,опытом хирурга.
Такая статистика делает актуальными следующие задачи:
- разработать и внедрить в клиническую практику технологии,позволяющие точно стадировать и выявлять опухоли предстательной железы;
- продолжить дальнейшее усовершенствование техники оперативных вмешательств в комбинации с методами, обеспечивающими большую радикальность операции;
- разработать методы интраоперационной диагностики опухолевой ткани (in situ) при выполнении РПЭ.
Последнюю задачу мы постарались решить с помощью интраоперационной ФДД остаточной опухолевой ткани. Метод позволяет определить группы пациентов с высоким риском местного рецидива и улучшить отдаленные результаты. Нами найдена одна работа, описывающая возможности ФДД с использованием 5-АЛК при РПЖ (C. Adam, G. Salomon, 2009).
На базе нашего института с января по декабрь 2010 г. проведено исследование с участием 45 пациентов с локализованной и местно-распространенной формами РПЖ, которым был осуществлен фотодинамический контроль РПЭ. Средний возраст больных составил 63,8 ± 6,1 года. Пациентам было выполнено 15 (33%) лапароскопических (экстраперитонеоскопических) и 30 (67%) открытых позадилонных простатэктомий. Средний уровень ПСА в обеих группах составил 11,9 ± 5,64 нг/мл, причем в группе открытой РПЭ – 13,47 ± 6,9 нг/мл, а в лапароскопической группе – 8,75 ± 2,9 нг/мл. Сумма баллов по шкале Глисона – 4-10.
Интраоперационно в синем свете через монитор оценивалась область ложа предстательной железы, шейки мочевого пузыря, задней уретры на предмет накопления фотосенсибилизатора, регистрировались зоны патологического свечения (рисунок 4).
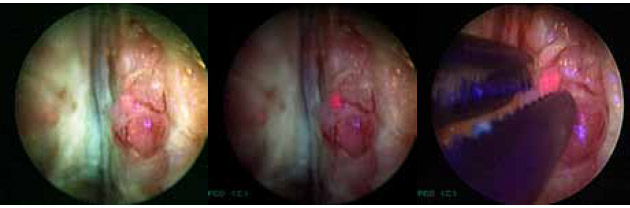
Рисунок 4. Фотодинамическая диагностика рака предстательной железы
Мы сделали вывод, что ФДД с применением 5-АЛК, во время радикальной простатэктомии может быть выполнимым и эффективным методом снижения частоты положительного хирургического края. Практически выполнение ФДД оказалось более удобным при лапароскопической РПЭ, нежели при открытых операциях.
Результаты исследования показали – у всех 6 пациентов с клинической стадией Т1 не было отмечено позитивной флюоресценции, что было подтверждено результатами патоморфологических исследований (таблица 1).
Мы установили высокую диагностическую эффективность ФДД при уточнении локализации и границ опухоли стадий T2-T3. Препарат Аласенс в значительной степени накапливался в опухоли, по сравнению с нормальной тканью предстательной железы, и интенсивность флуоресценции в опухоли была значительно выше.
Метод позволяет повысить радикальность выполняемого оперативного лечения путем визуализации хирургического края резекции. Чувствительность метода составила – 62%, специфичность – 86% (таблица 1).
Таблица 1. Результаты ФДД рака предстательной железы
| Общая группа n = 45 (100%) |
Лапароскопическая группа n = 15 (33%) |
Открытая группа n = 30 (67%) |
|
|---|---|---|---|
| Ложно-позитивное свечение | 4 (9%) | 2 (13%) | 2 (6%) |
| Ложно-отрицательное свечение | 6 (13%) | 2 (13%) | 4 (12%) |
| Чувствительность % | 62 | 60 | 64 |
| Специфичность % | 86 | 80 | 90 |
Метод интраоперационного флуоресцентного контроля радикальной простатэктомии может быть с эффектом применен для визуализации положительного хирургического края на стадии РПЖ Т2 и выше. Интраоперационная ФДД РПЖ является перспективным методом снижения частоты положительного хирургического края, что, как мы ожидаем, скажется на уменьшении частоты рецидивов заболевания (таблица 2).
Таблица 2. Результаты ФДД рака предстательной железы в зависимости от стадии
| Клиническая стадия TNM | Число больных (n = 45) | Патоморфологическая стадия pTNM, количество несовпадений |
Эффективность % |
|---|---|---|---|
| Т1 | 6 (13,3%) | pТ1 – 0 (0%) | 100 (свечения нет) |
| Т2 | 33 (73,5%) | pТ3-4 – 11 (33%) | 45 |
| Т3 | 6 (13,2%) | pТ4 – 5 (84%) | 100 |
| Специфичность % | 86 | 80 | 90 |
ФДД может применяться как для локализованных, так и местно-распространенных форм РПЖ. Причем использование ФДД при местно-распространенном раке более оправдано ввиду высокого риска нерадикальности оперативного вмешательства, и как следствие, риска рецидива заболевания.
Высокую частоту ложно-позитивных случаев на начальном этапе внедрения метода можно объяснить тенденцией хирургов классифицировать слабоинтенсивные области свечения в качестве позитивной зоны. По мере накопления опыта, согласно «кривой обучения», частота ложно-позитивных случаев уменьшается.
Фотодинамическая диагностика применима при ряде других урологических заболеваний, как рак мочевого пузыря и рак полового члена (рисунок 5).
Необходимы дальнейшие исследования по изучению эффективности и отработке метода ФДД.
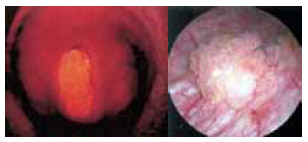
А. Рак полового члена T1-2N0M0
Б. Переходно-клеточный рак мочевого пузыря Tа-1N0M0 (первичный, рецидивный)
Рисунок 5. Фотодинамическая диагностика в онкоурологии
Ключевые слова: рак предстательной железы, рак почки, фотодинамика.
Keywords: prostate cancer, kidney cancer, photodynamic methods.






