Лечение рака предстательной железы (РПЖ) до настоящего времени остается сложной проблемой. В частности, это относится к вопросу: надо ли сочетать
гормональную терапию с другими вариантами основного лечения? Принципиально, гормональную терапию, так же как и химиотерапию, можно сочетать с основным
методом лечения (неоадъювантный или адъювантный вариант). Сложность проблемы состоит в том, что гормональная терапия не является безразличной для организма. При ее проведении меняется минеральная плотность костей, возрастает риск переломов (Daniell, 1997) (рисунок 1), развивается метаболический синдром, нарушения психики и т. д. Кроме того, сам по себе риск переломов значительно снижает продолжительность жизни больных (Oefelein et al., 2002). Таким образом, назначенная без показаний гормональная терапия является излишним и неоправданным методом лечения.
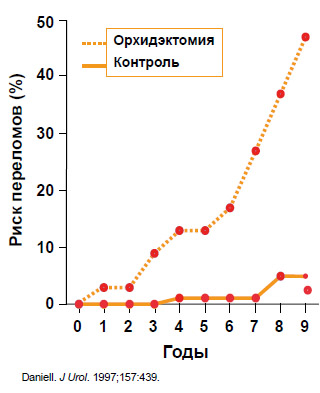
Рисунок 1. Андрогенная депривационная терапия увеличивает риск переломов
Неоадъювантная гормонотерапия РПЖ
В настоящее время существует 4 основных варианта неоадъювантной терапии рака предстательной железы.
- Неоадъювантная гормонотерапия (НеоГТ) + радикальная простатэктомия.
- Неоадъювантная химиотерапия(химиогормонотерапия) + радикальная простатэктомия.
- Неоадъювантная гормонотерапия + дистанционная лучевая терапия.
- Неоадъювантная гормонотерапия + брахитерапия и другие виды локального лечения.
Неоадъювантная гормонотерапия + радикальная простатэктомия
Вопрос о необходимости проведения гормонотерапии перед операцией остается дискутабельным. Существует теоретическое обоснование предоперационной гор-
монотерапии, включающее в себя следующее.
1. В 40-50% случаев клинически локализованного опухолевого процесса (Т1-Т2) при послеоперационном патоморфологическом исследовании выявляется экстракапсулярная инвазия (рТ3) (Zincke et al., 1994).
2. В эксперименте на животных (гормоно-чувствительная опухоль Shionogi) неоадъювантная гормонотерапия приводит к 50% снижению местных рецидивов и смертности от рака (Gleave et al., 1996).
Первым ученым, предложившим комбинированную или максимальную андрогенную блокаду, был Labrie (1993).
Основным недостатком хирургического лечения, является наличие так называемого положительного края, то есть, выявление опухоли по линии резекции, что может в дальнейшем неблагоприятно сказаться на течении заболевания. В целом, по результатам исследований, проведенных на сегодняшний день, при назначении гормональной терапии перед операцией отмечаются: уменьшение объема опу-
холи, значительное снижение ПСА, уменьшение осложнений, «измене-
ние» морфологической стадии до 77,2% (Labrie et al., 1993) (таблица 1).
Таблица 1. Неоадъювантная гормонотерапия (НеоГТ) (Labrie et al., 1993)
| НеоГТ + РПЭ | РПЭ | |
|---|---|---|
| Опухоль по линии резекции (%) | 13,0 | 38,5 |
| «Изменение» стадии (%) | рТ3 рТ2 – 23,4 | рТ2 рТ3 – 53,8 |
Преимущество НеоГТ в «изменении стадии» – 77,2%
(Labrie et al. 1993)
Однако существуют и некоторые особенности. Так, по данным Witjes et al. (1997), в группе больных с клинической стадией Т2 различия в частоте выявления опухоли по линии резекции оказались статистически достоверны в пользу НеоГТ,
в группе больных с опухолями Т3 – различия недостоверны (таблица 2).
Goldenberg et al. (1996), не отмечают различий в частоте осложнений
операции в группах пациентов, не получающих НеоГТ перед РПЭ, и пациентов, получивших данную терапию.
Таблица 2. Неоадъювантная гормонотерапия (НеоГТ) (Witjes et al., 1997)
| НеоГТ + РПЭ | РПЭ | р | |
|---|---|---|---|
| «Повышение» стадии (%) | 31 | 54 | < 0,01 |
| «Понижение» стадии (%) | 16 | 6 | < 0,01 |
| Опухоль по линии резекции (%) | 27 | 46 | < 0,01 |
В группе больных с клинической стадией Т2 различия в частоте выявления опухоли по линии резекции оказались статистически достоверны в пользу НеоГТ, в группе больных с опухолями Т3 – различия недостоверны
По данным Klotz (2003), биохимическое прогрессирование процесса наблюдалось у 33,6% в группе РПЭ и 37,5% – в группе НеоГТ при среднем периоде наблюдения за пациентами 6 лет. Безрецидивная выживаемость была одинаковой в обеих группах (р = 0,732). В подгруппе больных с исходным уровнем ПСА > 20 нг/мл отмечено существенное улучшение безрецидивной выживаемости при проведении НеоГТ.
В нерандомизированном ретроспективном анализе наблюдений не отмечено улучшения результатов при пятилетнем наблюдении по биохимическому и клиническому рецидивированию.
Meyer F. et al. (2001), показали, что у 756 больных, получавших гормональную терапию более 3 месяцев, отмечено повышение безрецидивной выживаемости по сравнению с контрольной группой.
Hack М. и соавт. (2008), продемонстрировали, что НеоГТ в течение 6 месяцев при местно-распространенном, первично нерезектабельном (> сТ3) раке с высокими ха-
рактеристиками риска (Глисон > 8) или ПСА (> 20 нг/мл), увеличивала шансы для выживания без существенного риска пери- или постоперационных осложнений.
Таким образом, можно сделать следующие выводы:
- НеоГТ приводит к уменьшению объема опухоли на 30-50%;
- НеоГТ приводит к снижению уровня ПСА на 40-90% (чаще наблюдается у больных с клинической стадиуй Т2);
- НеоГТ не приводит к увеличению числа осложнений РПЭ;
- НеоГТ приводит к «снижению» патоморфологической стадии в 30%;
- НеоГТ приводит к уменьшению числа выявления опухолевого роста по линии резекции в 18-37% (статистически достоверно только для клинической стадии Т2).
Ни в одном из исследований не выявлено статистически достоверных различий в безрецидивной выживаемости и длительности периода до развития прогрессирования у больных, которым проводили НеоГТ и у больных, которым сразу выполняли оперативное вмешательство.
НеоГТ не может в настоящее время считаться стандартным методом лечения локализованного и местно-распространенного РПЖ.
Fair et al. (1995): «Хотя невозможно в настоящее время утверждать, что каждый больной получит пользу от проведения неоадъювантной гормональной терапии, нельзя также быть догматиком в утверждении, что это лечение абсолютно бес-
полезно для больного».
Перспективным в изучении НеоГТ является назначение более длительного курса предоперационной гормонотерапии (возможно, до полного подавления уровня ПСА), более тщательный отбор больных (клиническая стадия Т2?, уровень
ПСА > 20 нг/мл?), поиск и применение новых схем гормонотерапии, химиотерапии, гормонохимиотерапии.
Неоадъювантная гормонотерапия перед дистанционной лучевой
терапией
Цель сочетанного применения лучевой терапии и гормонотерапии состоит в уменьшении объема опухоли и, соответственно, объема облучения, что приводит к снижению числа осложнений. При НеоГТ:
• 3-месячная неоадъювантная терапия агонистами ЛГРГ приводит к уменьшению объема предстательной железы на 37%;
• объем мочевого пузыря, на который приходится 95% дозы, уменьшается на 46%, объем прямой кишки – на 18% (Forman, 1995; Zelefsky, 1997).
• повышается эффективность лучевой терапии;
• снижается число клеточных клонов, которые должны быть уничтожены при лучевой терапии;
• индукция апоптоза увеличивается при сочетании гормонального и лучевого воздействия – переход клеток в S-фазу, что усиливает цитотоксическое действие облучения (Zietman, 1997; Pollak, 1997).
По данным Pilepich et al. в 2001, было выявлено, что комбинированная терапия (НеоГТ + лучевая) имеет ряд преимуществ перед монолучевой терапией.
Так, местные рецидивы при комбинированном лечении диагностированы в 30% случаев, а при лучевой терапии – в 42%.
Отдаленные метастазы выявлены соответственно у 34% и 45% больных.
Безрецидивная выживаемость составила 33% при комбинированной терапии и 21% – при лучевой. Общая выживаемость в подгруппе больных с суммой Глисона 2-6 баллов была 70% и 52% соответственно. В то же время общая выживаемость и локо-
регионарный контроль в подгруппе больных с суммой Глисона 7 и более баллов достоверно не отличались.
А по данным Канадского многоцентрового исследования, проведенного Klotz et al. в 2000 г., при среднем периоде наблюдения 3 года отмечено существенное увеличение периода до биохимического прогрессирования в группе больных,
получавших НеоГТ ципротерона ацетатом (рисунок 2).
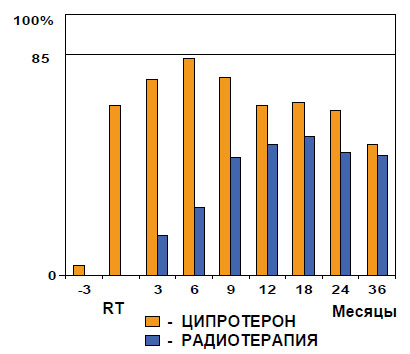
При среднем периоде наблюдения 3 года отмечено существенное увеличение периода до биохимического прогрессирования в группе больных, получавших НеоГТ ципротерона ацетатом
Рисунок 2. НеоГТ + лучевая терапия (Канадское многоцентровое исследование)
Следует отметить роль НеоГТ в уменьшении объема облучения. Результаты проведенных сравнительных исследований пациентов, находившихся на лечении в специализированных отделениях лучевой терапии в 2002-2003 гг. показали, что объем предстательной железы является прогностическим фактором токсичности при лучевой терапии локализованного РПЖ. НеоГТ может уменьшить объем железы
(рисунок 3), а следовательно и планируемый объем облучения. При трансректальном УЗИ объем простаты до ГТ был 50,65", а после лечения – 38,97" (p < 0,001), что означает уменьшение объема железы на 24%. Помимо предстательной железы, меньшая доза облучения приходится на зону семенных пузырьков, прямой кишки и мочевого пузыря.
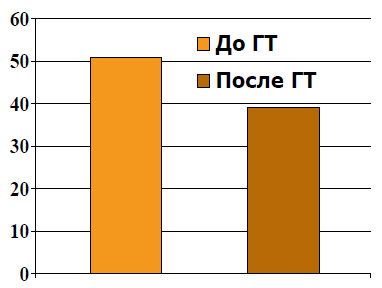
Рисунок 3. Уменьшение объема ПЖ при НеоГТ
Таким образом:
- НеоГТ значительно уменьшает объем простаты, что может существенно снизить планируемый объем облучения, а следовательно и уровень V60 прямой кишки и мочевого пузыря;
- НеоГТ приводит к уменьшению объема предстательной железы и объема облучаемых тканей, что снижает токсичность лучевой терапии;
- НеоГТ приводит к увеличению времени до биохимического прогрессирования;
- •НеоГТ в комбинации с лучевой терапией не приводит к достоверному улучшению показателей общей и специфической выживаемости (улучшение выживаемости наблюдается только у больных с опухолями 2-6 баллов по шкале Глисона).
Адъювантная терапия
Адъювантная лучевая терапия после радикальной простатэктомии
Наиболее значимыми факторами развития биохимического рецидива после радикальной простатэктомии являются, по данным F. Pintoa, T. Prayer-Galettia, M. Gardimanb et al. (2006), уровень Gleason > 7 (p = 0,0003) и позитивный хирурги-
ческий край (p < 0,0001).
Кроме того, Han M., Partin A., Zahurak M. et al. еще в 2003 г. показали, что риск биохимического рецидива в группе пациентов с распространением опухоли за пределы капсулы (pT3) или при положительном крае резекции (R1) составляет
67% в течение 5 лет. Несмотря на раннюю диагностику рака предстательной железы в рамках скрининга ПСА, около 50% пациентов после радикальной простатэктомии имеют как минимум один из вышеуказанных факторов риска (Karakiewicz P.I., Eastham J.A., Graefen. M. et al., 2005).
Существует два метода лечения пациентов, имеющих факторы риска после радикальной простатэктомии:
- адъювантная ЛТ – лучевая терапия на ложе предстательной железы непосредственно в послеоперационном периоде;
- активное наблюдение, включающее клиническое исследование и постоянное определение ПСА. Лучевая терапия и гормонотерапия остаются в резерве до момента биохимического и/или клинического рецидива (salvage- терапия).
До настоящего времени в клинических руководствах нет общепринятых показаний к применению адъювантной лучевой терапии при раке предстательной железы. Однако вопросы обоснованности применения адъювантной ЛТ, показаний и
противопоказаний к ее проведению в настоящее время являются предметом различных научных исследований. Ниже перечислены только
некоторые из рандомизированных проспективных исследований, посвященные данной проблеме:
- SWOG 8794, многоцентровое исследование Southwest Oncology Group (SWOG), набор пациентов с августа 1988 до января 1997;
- EORTC 22911 – многоцентровое исследование European Organisation for the Research and Treatment of Cancer (EORTC), набор пациентов с ноября 1992 до декабря 2001;
- ARO 96-02/AUO AP 09/95 –многоцентровое исследование Германского онкологического общества (German Cancer Society) набор пациентов с апреля 1997 по сентябрь 2004.
Проведенные исследования позволили определить показания и противопоказания к применению адъювантной лучевой терапии.
Обоснование применения адъювантной лучевой терапии
Адъювантная лучевая терапия является локальным вмешательством. Ее непосредственная задача – воздействие на резидуальные опухолевые клетки в ложе предстательной железы, чтобы свести к минимуму риск локального и биохимического рецидива.
При отсутствии лечения, резидуальные опухолевые клетки могут стать источником вторичной диссеминации и появления отдаленных метастазов, в результате чего задержка ЛТ до момента биохимического рецидива может уменьшить возможности лечения и ухудшить прогноз.
Конечной целью адъювантной ЛТ является улучшение показателей общей выживаемости, которое было продемонстрировано для других локализаций злокачественных новообразований.
Дополнительным преимуществом адъювантной по сравнению с отложенной ЛТ является отсутствие системной токсичности в результате гормонотерапии.
Противопоказания к применению адъювантной лучевой терапии
Основным аргументом против универсального применения АЛТ после простатэктомии в случае наличия факторов риска остается возможность «перелечивания» пациентов и использования ЛТ в случаях, когда необходимость в этом отсутствует.
Вторым аргументом является риск развития ранней и поздней токсичности со стороны органов малого таза, который сохраняется, несмотря на использование современных методик конформной лучевой терапии.
Решение проводить раннюю адъювантную лучевую терапию или отложить ее до развития рецидива представляет собой компромисс между стремлением продлить безрецидивный период и опасением развития поздних побочных эффектов, связан-
ных с токсическим действием ЛТ.
Адъювантная гормонотерапия (агт)
Показания к адъювантной
гормонотерапии (АГТ) после РПЭ
- Метастазы в лимфатических узлах (N+).
- Инвазия семенных пузырьков.
- Локализованные и местно-распространенные опухоли.
Основная проблема – необходимо ли проводить немедленную АГТ или нужно начинать лечение при рецидиве?
По данным Prayer-Galetti et al. (2000), при наблюдении за больными в течение 5 лет, получено 25,2% преимущество в безрецидивной выживаемости для пациентов, получающих АГТ.
Адъювантная гормональная терапия после дистанционной лучевой терапии
По данным Pilepich et al. (2005), итогам 10-летних исследований стали следующие результаты.
- Общая выживаемость при лучевой терапии составила 39%, при комбинированном лечении – 49%.
- Смертность от РПЖ при лучевой терапии составила 22%, при комбинированном лечении – 16%.
Таким образом:
- АГТ после лучевой терапии достоверно улучшает безрецидивную выживаемость;
- АГТ после лучевой терапии (рисунок 4) достоверно улучшает общую выживаемость у больных с плохим прогнозом (опухоли Т3-4, дифференцировка 8-10 баллов по Глисону).
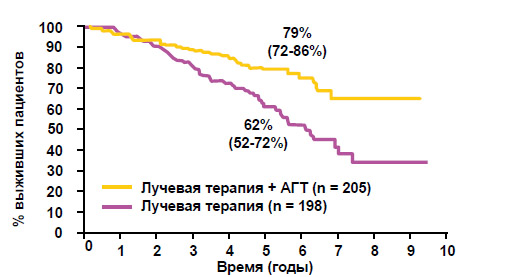
отношение рисков 0.50; 95% ДИ 0,33, 0,76; p = 0,001 Bolla et al. 1997, 1999
Рисунок 4. Лучевая терапия + АГТ (EORTC 22863)
Остается неясным вопрос: не является ли преимущество в выживаемости результатом применения гормонотерапии в большей степени, чем лучевой терапии?
Для ответа на этот вопрос Bolla M. et al. в 2007 г. выполнили протокол, в котором одна группа больных получала АГТ полгода, а другая три года. Причем авторы заранее были уверены, что результаты будут одинаковы. Однако оказалось, что практически по всем показателям результаты у больных, которые получали гормональную терапию в течение трех лет, оказались лучше, чем у больных, которые получали ее в течение шести месяцев.
Таким образом, сегодня очевидно, что адъювантная гормональная терапия после лучевой терапии, особенно у больных с плохим прогнозом, должна проводиться в течение длительного времени, что обеспечивает более стойкие результаты.
Ключевые слова: рак предстательной железы, неоадъювантная гормонотерапия, адъювантная гормонотерапия, адъювантная лучевая терапия, радикальная простатэктомия.
Keywords: prostate cancer, neoadjuvant hormone therapy, adjuvant hormone therapy, adjuvant radiation therapy, prostatectomy.






