ВВЕДЕНИЕ
У больных с терминальной стадией хронической почечной недостаточности (ТХПН), получающих лечение гемодиализом, заболеваемость почечно-клеточным раком (ПКР) в 10 раз выше, чем в общей популяции [1]. Это обуславливает необходимость выявления предикторов ПКР, выделение групп высокого риска и проведение скрининга. Особенно это важно среди пациентов, которым планируется трансплантация почки, так как раннее выявление опухоли в большинстве случаев способствует благоприятному онкологическому прогнозу и возможностьи проведения пересадки почки без задержек [1, 2].
Мужской пол, возраст, африканское происхождение, множественные кисты почек, ТХПН в исходе хронического гломерулонефрита, длительный период гемодиализа увеличивают риск развития ПКР [1-3]. E.A. Engels и соавт. сообщают о том, что заболеваемость ПКР может быть бимодальной, достигая пика в первый год после начала диализа и затем снова через 4 года [3].
В отношении скрининга на сегодняшний день нет однозначного мнения. После 3-х лет диализа у большинства пациентов развиваются приобретенные множественные кисты почек, которые часто ассоциированы с ПКР, после 10 лет – кисты почек обнаруживаются у 80% больных [1, 4]. Поскольку развитие приобретенных кист почек соответствует продолжительности диализа, некоторые авторы высказались за рутинный скрининг ПКР у пациентов, находящихся на диализе более 3-х лет [1]. Однако относительно низкая частота ПКР в сочетании с высокой общей смертностью пациентов с ТХПН и необходимостью проведения компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) для эффективного скрининга побудили других исследователей предположить, что рутинный скрининг положительным образом не влияет на смертность и не является экономически эффективным [4]. Анализ проблемы показал, что скрининг может привести к увеличению ожидаемой продолжительности жизни на 1,6 года в течение 25-летнего периода наблюдения при условии, что он проводится только среди молодых пациентов с ожидаемым длительным сроком жизни [1].
Пациенты с ТХПН всегда представляли собой сложную категорию больных для хирургического лечения. К особенностям оперативного лечения пациентов с ТХПН относится повышенный риск кровотечения ввиду таких факторов как артериальная гипертензия, проведение гемодиализа с гепарином [5]. В основе повышенной кровоточивости во время и после операции лежат морфологические изменения эндотелия сосудов, анемия, тромбоцитопения, нарушение адгезии и агрегации тромбоцитов, снижение скорости выработки тромбина и фибринолиз [6]. Еще важно и то, что при ТХПН зачастую имеется метаболический ацидоз. Риск усугубления гиперкапнии и ацидоза за счет снижения функциональной емкости легких на фоне карбоксиперитонеума ограничивает широкое использование лапароскопической нефрэктомии у пациентов, получающих лечение гемодиализом [7].
Другой проблемой является пересадка почки у пациентов, которые перенесли нефрэктомию по поводу ПКР. Несмотря на то что многие авторы сообщают об отсутствии риска прогрессии рака почки с благоприятным прогнозом после трансплантации и об отсутствии необходимости в дополнительном сроке наблюдения перед пересадкой, в ведущих центрах трансплантации в Российской Федерации до настоящего время рекомендуется срок наблюдения не менее 2-х лет после нефрэктомии по поводу рака до трансплантации почки [8-10].
В попытке лучше разобраться в очерченных проблемах мы провели ретроспективный анализ собственного опыта лечения этой категории больных.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 26 пациентов с ПКР, находящихся на лечении гемодиализом, которым выполнена нефрэктомия в ГБУЗ ГКБ № 52 ДЗМ г. Москвы за период с 2010 по 2020 гг
С целью выявления факторов риска ПКР у больных с ТХПН было проведено сравнение двух групп пациентов. Первую группу составили 26 больных с ПКР, во вторую группу были случайным образом отобраны 100 пациентов, проходящих лечение гемодиализом в указанный период. В качестве предикторов ПКР рассматривались следующие факторы: пол, возраст, продолжительность диализа, множественные кисты почек, заболевание, приведшее к ТХПН.
21 (80,8%) пациенту с ПКР выполнена лапароскопическая нефрэктомия, при этом в 5 случаях – билатеральная. Показанием к билатеральной нефрэктомии были: у одной пациентки синхронный рак, в двух случаях – осложненные кисты поликистозных почек и у двух пациентов – наличие кист по Bosniak III.
Прогноз после нефрэктомии определяли по стадии TNM, номограммы UICC и бальной оценки Лейбовича. Благоприятным прогнозом считали первую стадию заболевания по классификации TNM, вероятность пятилетней выживаемости по данным UICC не менее 91,1% и низкий риск метастазирования по шкале Лейбовича (не более 2-х баллов).
Для статистической обработки данных использовалась программа SPSS 26 версии (IBM, USA). Оценку факторов риска ПКР проводили с помощью бинарной логистической регрессии с исключением факторов по Вальду. Для оценки зависимости выживаемости пациентов от времени наблюдения использовали метод Каплана-Мейера.
РЕЗУЛЬТАТЫ
Среди пациентов с ТХПН и ПКР в значительной степени преобладали мужчины (n = 23; 88,5%), медиана возраста составила 61 год (Q1-Q3: 52-67). Медиана продолжительности диализа до постановки диагноза ПКР была 10 месяцев (Q1-Q3: 1-36), минимальный период 1 месяц, максимальный 228 месяцев.
Заболевания, приведшие к ТХПН, представлены на рисунке 1. Наиболее частыми нозологиями были хронический гломерулонефрит, гипертонический нефроангиосклероз. Эти заболевания были выявлены более чем у 50% респондентов.
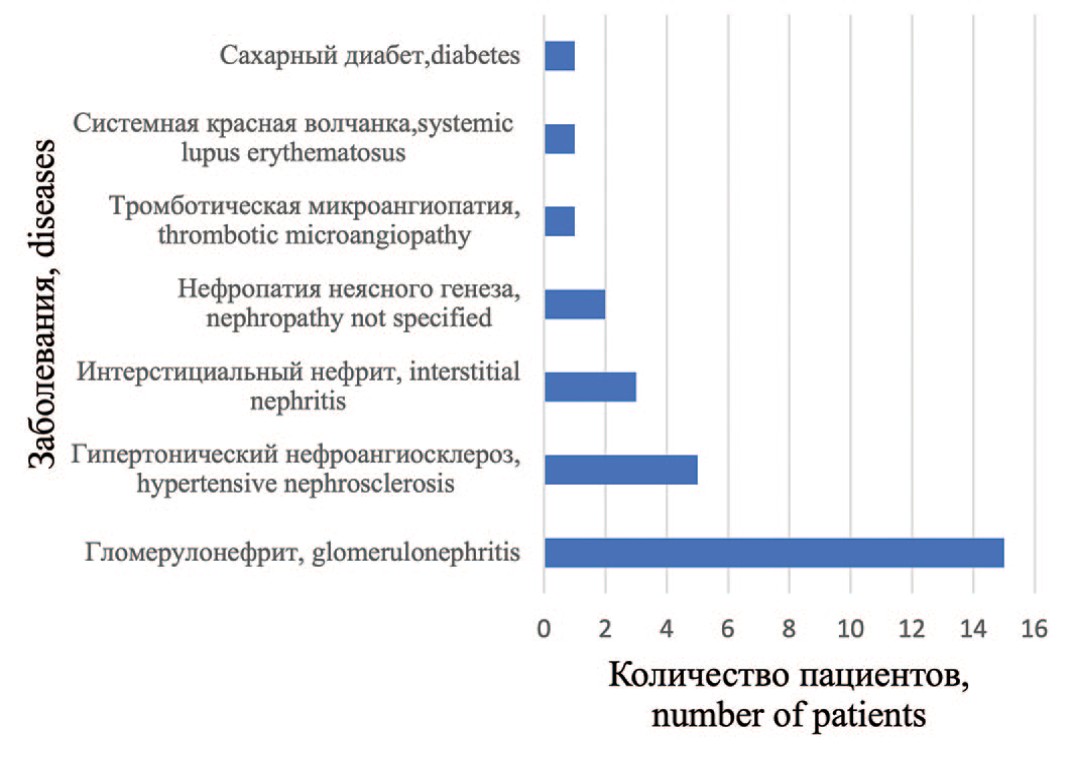
Рис. 1. Распределение пациентов с почечно-клеточным раком в зависимости от заболевания, приведшего к ТХПН
Fig. 1. Distribution of patients with renal cell carcinoma depending on the disease that led to ESRD
Мы отметили бимодальный пик выявления ПКР у пациентов на гемодиализе, в первый год и спустя 5 лет (рис. 2).
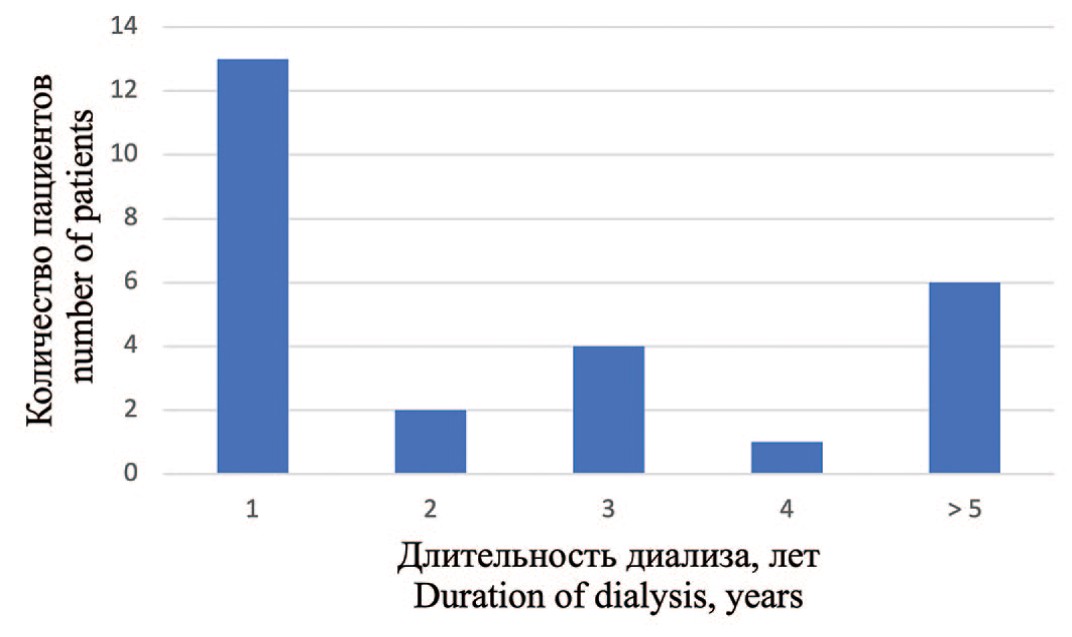
Рис. 2. Количество пациентов с первые выявленным ПКР в зависимости от продолжительности диализа
Fig. 2. The number of patients with newly diagnosed RCC, depending on the duration of dialysis
В соответствии с коэффициентами бинарной логистической регрессии было установлено, что шансы развития ПКР у пациентов, получающих лечение гемодиализом, увеличивались у мужчин (AOR 5,1; 95% ДИ 1,34-14,4; р=0,015) и при наличии множественных кист почек (AOR 3,2; 95% ДИ 1,56-16,43; р=0,008). Возраст, продолжительность диализа, заболевание, приведшее к ТХПН, статистически не влияли на риск развития ПКР.
Бессимптомное течение отмечено у 22 (84,6%) больных. У двух (7,6%) пациентов имелась рецидивирующая макрогематурия, у одного (3,8%) больного отмечалась тупая боль, в одном случае пациент поступил в экстренном порядке в связи с разрывом опухоли и забрюшинной гематомой (ПКР диагностирован только при гистологическом исследовании). У 21 (80,7%) пациента диагноз был установлен на основании ультразвукового исследования (УЗИ) органов брюшной полости, которое проводилось в связи с другими причинами, а опухоль почки была случайной находкой.
В четырех (15,4%) случаях ПКР был выявлен только при гистологическом исследовании (инцидентальный ПКР), средний размер опухоли был 1 см. Три (11,5%) пациента страдали аутосомно-доминантной поликистозной болезнью почек, один (3,8%) – множественными приобретенными кистами почек, при этом три пациента характеризовались длительным периодом гемодиализа (7, 11 и 19 лет).
Для уточнения диагноза у 16 (61,5%) пациентов выполнена МСКТ с контрастным усилением, чувствительность метода составила 75%, МРТ проведено у 9 (34,6%) больных, чувствительность составила 77,8%. Относительно низкая чувствительность данных методов была обусловлена малым размером ПКР у пациентов с поликистозом почек и в одном случае имелась обширная забрюшинная гематома, не позволившая верифицировать опухоль при МСКТ.
Медиана размера опухоли составила 3 см (Q1-Q3: 2- 4), у подавляющего числа пациентов имелись множественные кисты почек (n=21; 80,8%). Зависимость от гистологического типа, градации по Т (размер опухоли), по степени ядерной атипии по Фурману (Fuhrman) у пациентов представлены в таблице 1.
Таблица 1. Основные морфологические характеристики ПКР у пациентов, получающих лечение гемодиализом
Tablе 1. Main morphological characteristics of RСС in patients in patients on dialysis
| Характеристики Characteristics |
Результат Result |
|
|---|---|---|
| Доля светлоклеточного рака, n (%) Part of clear cell renal cell carcinoma, n (%) |
17 (65,4%) | |
| Доля папиллярного рака, n (%) Part of papillary renal cell carcinoma, n (%) |
8 (30,8%) | |
| Доля хромофорного рака Part of chromophobe renal cell carcinoma |
1 (3,8%) | |
| Размер опухоли | Т1, n (%) | 20 (76,9%) |
| Т2, n (%) | 2 (7,7%) | |
| Т3, n (%) | 4 (15,4%) | |
| Степень ядерной атипии по Фурману | G1, n (%) | 16 (61,5%) |
| G2, (n (%) | 7 (26,9%) | |
| G3, n (%) | 3 (11,5%) | |
Среднее время односторонней лапароскопической нефрэктомии составило 140±51 мин, а среднее время стационарного лечения – 7±3 дней. При билатеральной лапароскопической нефрэктомии среднее время составило 158±54 мин, длительность стационарного лечения – 8±2 дней. При проведении односторонней люмботомии время операции было меньше и составило 92±24 мин, а сроки стационарного лечения незначительно больше - 9±3 дней (одно, двухсторонняя нефрэктомия).
Согласно протоколу нашего учреждения, всем пациентам, находящимся на программном гемодиализе, накануне операции проводится сеанс диализа без использования гепарина. Тем не менее, у 5 (19,2%) больных, которым выполнена лапароскопическая нефрэктомия, сразу после операции отмечена гиперкалиемия, потребовавшая проведения гемодиализа. У одного (3,8%) пациента, оперированного в экстренном порядке через люмботомный доступ, в послеоперационном периоде развилось рецидивирующее кровотечение на фоне системной гипокоагуляции, ему трижды была выполнена релюмботомия. Еще у одного пациента в послеоперационном периоде отмечено развитие абсцесса в ложе удаленной почки, который потребовал чрескожного дренирования. Тромбоз артериовенозной фистулы для гемодиализа развился у двух (7,6%) пациентов, им успешно проведена реконструкция.
В раннем послеоперационном периоде скончалось двое (7,6%) пациентов, один в результате развития тромбоэмболии ветвей легочной артерии и второй – в связи с развитием нозокомиальной пневмонии.
На основании стадии TNM, номограммы UICC и бальной оценки Лейбовича благоприятный онкологический прогноз отмечен у 17 (65,4%) пациентов. Медиана наблюдения за пациентами после нефрэктомии составила 20 мес. (Q1-Q3: 8,5-45 мес.), минимальный срок 2 мес., максимальный – 72 мес. Скончалось 3 (11,4%) больных. Среднее время наступления летального исхода после нефрэктомии составило 62,7±4,6 мес. (95% ДИ 53,5 – 72). Ни в одном случае смерть не была связана с прогрессированием рака почки. Один пациент скончался от острого нарушения мозгового кровообращения, второй – от тромбоэмболии ветвей легочной артерии и третий – от острого инфаркта миокарда.
ОБСУЖДЕНИЕ
В нашем исследовании достоверными предикторами развития ПКР были только мужской пол и наличие множественных кист почек. В отличие от других исследований мы не отметили достоверную связь с возрастом, длительностью диализа и заболеванием, приведшем к развитию ТХПН [1, 2]. Более того, у 13 (50%) пациентов ПКР был диагностирован в течение первого года после начала гемодиализа, что согласуется с результатами E.A. Engels и соавт. [3]. Мы полагаем, что высокая частота выявления ПКР в течение первого года лечения диализом обусловлена не проведением заместительной почечной терапии, а связана с более тщательным медицинским обследованием пациентов с впервые выявленной ТХПН. Хотя длительность диализа в нашей работе не являлась статистически достоверным фактором риска ПКР, учитывая тот факт, что трое пациентов с инцидентальным ПКР много лет находились на лечении диализом, мы окончательно не отрицаем этой взаимосвязи.
Учитывая собственные и литературные данные, принимая во внимание высокую частоту ПКР в популяции пациентов с ТХПН, скрининг с использованием ультразвукового исследования является наиболее целесообразным у пациентов мужского пола с наличием множественных кист почек, начиная с первого года начала диализа. Особое внимание должно быть уделено пациентам, находящимся в листе ожидания трансплантации почки. УЗИ обладает высокой диагностической эффективностью в первичной диагностике опухоли почки у пациентов с ТХПН [11].
Мы только в одном (3,8%) случае отметили рецидивирующее кровотечение у пациента с системной гипокоагуляцией и в одном – формирование абсцесса в ложе удаленной почки после лапароскопической нефрэктомии. У 5 (19,2%) пациентов мы столкнулись с гиперкалиемией непосредственно после нефрэктомии, при этом кардиальных осложнений не было. Всем 5 пациентам проведен сеанс гемодиализа без осложнений. О высокой вероятности развития гиперкалиемии у пациентов с ТХПН после операции сообщают и другие авторы [12]. Учитывая риск гиперкалиемии необходим интра- и послеоперационный мониторинг уровня электролитов крови. Для профилактики тромбоза артериовенозной фистулы целесообразно во время операции стремиться минимизировать периоды гипотонии и соблюдать правильную укладку руки. Два летальных исхода в раннем послеоперационном периоде не были связаны непосредственно с хирургическим вмешательством. В целом, на основании наших и литературных данных можно утверждать, что радикальная лапароскопическая нефрэктомия является безопасным вмешательством у пациентов на диализе, обладает удовлетворительными онкологическими результатами [13].
Оценка прогноза после радикальной нефрэктомии является основным критерием в определении сроков трансплантации почки. Стадирование по классификации TNM является первым инструментом для прогнозирования [14, 15]. Гистологический тип ПКР является также важным прогностическим признаком. Светлоклеточный ПКР отличается худшим прогнозом по сравнению с папиллярным раком I типа и хромофобным ПКР [16, 17]. Пятилетняя выживаемость для светлоклеточного рака колеблется от 43% до 83%, для папиллярного рака – от 61% до 90% и для хромофорного рака – от 80% до 100% [18, 19]. Однако в связи с широким диапазоном выживаемости морфологические разновидности не следует учитывать как отдельный прогностический признак. Только наличие рабдоидной или саркоматоидной дифференцировки является предвестником неблагоприятного прогноза [20]. Степень ядерной атипии по Фурману еще один признак, который в отличие от морфологического типа доказал свою прогностическую значимость, однако его оценка тесно связана с опытом патологоанатома и не исключает субъективизма. В настоящее время рекомендуется упрощенная система градации по Фурману [21].
Прогностические системы рутинно не используются для оценки прогноза при локализованной форме ПКР, однако возможность измерять результат у пациентов с ТХПН может помочь в выборе тактики лечения, в том числе в определении сроков трансплантации почки [22]. Для оценки пятилетней выживаемости часто используется номограмма UICC, которая учитывает градацию по Т, степень ядерной атипии и общесоматический статус по ECOG (Eastern Cooperative Oncology Group) [23]. С целью прогнозирования риска метастазирования широко используется бальная оценка Лейбовича, суммирующая данные по параметрам Т, G, N и наличию некроза опухоли [24].
Публикации последних лет указывают на отсутствие прогрессирования ПКР после трансплантации почки без дополнительного периода наблюдения в течение 2-5 лет у больных с хорошим прогнозом [8-10]. На основании стадии TNM, номограммы UICC и бальной оценки Лейбовича благоприятный онкологический прогноз отмечен у 17 (65,4%) пациентов, а при медиане наблюдения в течение 20 мес (Q1-Q3: 8,5-45, минимальный срок 2 месяца, максимальный – 72 месяца) не зафиксировано ни одного случая прогрессирования ПКР. Мы полностью поддерживаем авторов, утверждающих о безопасной, с точки зрения прогрессии ПКР, трансплантации почки без периода ожидания после нефрэктомии, при условии благоприятного онкологического прогноза, который может быть определен с помощью вышеуказанных инструментов [8-10].
ВЫВОДЫ
Мужской пол, множественные кисты почек являются факторами риска развития ПКР независимо от длительности диализа, однако с увеличением продолжительности заместительной почечной терапии, вероятно, увеличивается доля инцидентального ПКР. Скрининг ПКР при помощи УЗИ почек целесообразен у мужчин с ожидаемой длительной продолжительностью жизни, у которых имеются множественные кисты почек, причем скрининг необходимо начинать с первого года начала диализа.
Лапароскопическая нефрэктомия обладает удовлетворительными онкологическими результатами, а частота развития инфекционно-воспалительных геморрагических осложнений невелика. Во время и после нефрэктомии показан мониторинг уровня калия крови.
Большинство пациентов с ПКР и ТХПН характеризуются благоприятным онкологическим прогнозом и у них нет необходимости в каком-либо сроке наблюдения перед трансплантацией почки. Однако этот аспект требует дальнейшего изучения.
ЛИТЕРАТУРА
- Hurst FP, Jindal RM, Fletcher JJ, Dharnidharka V, Gorman G, Lechner B, et al. Incidence, predictors and associated outcomes of renal cell carcinoma in long-term dialysis patients. Urology 2011;77(6):1271-6. https://doi.org/10.1016/j.urology.2011.01.007.
- Stewart JH, Buccianti G, Agodoa L, Gellert R, McCredie MR, Lowenfels AB, et al. Cancers of the kidney and urinary tract in patients on dialysis for end-stage renal disease: analysis of data from the United States, Europe, and Australia and New Zealand. J Am Soc Nephrol 2003;14(1):197- 207. https://doi.org/10.1097/01.asn.0000039608.81046.81.
- Engels EA, Pfeiffer RM, Fraumeni JF Jr, Kasiske BL, Israni AK, Snyder JJ, et al. Spectrum of cancer risk among US solid organ transplant recipients. JAMA 2011;306(17):1891-901. https://doi.org/10.1001/ jama.2011.1592.
- Holley JL. Screening, diagnosis, and treatment of cancer in long-term dialysis patients. Clin J Am Soc Nephrol 2007;2(3):604-10. https://doi.org/10.2215/CJN.03931106.
- Lutz J, Menke J, Sollinger D, Schinzel H, Thürmel K. Haemostasis in chronic kidney disease. Nephrol Dial Transplant 2014;29(1):29-40. https://doi.org/10.1093/ndt/gft209.
- Acedillo RR, Shah M, Devereaux PJ, Li L, Iansavichus AV, Walsh M, et al. The risk of perioperative bleeding in patients with chronic kidney disease: a systematic review and meta-analysis. Ann Surg 2013;258(6):901-13. https://doi.org/10.1097/SLA.0000000000000244.
- Sanli O, Tefik T, Ortac M, Karadeniz M, Oktar T, Nane I, et al. Laparoscopic nephrectomy in patients undergoing hemodialysis treatment. JSLS 2010;14(4):534-40. https://doi.org/ 10.4293/108680810X12924466008123.
- Frascà GM, Brigante F, Volpe A, Cosmai L, Gallieni M, Porta C. Kidney transplantation in patients with previous renal cancer: a critical appraisal of current evidence and guidelines. J Nephrol 2019;32(1):57-64. https://doi.org/10.1007/s40620-018-0542-y.
- Boissier R, Hevia V, Bruins HM, Budde K, Figueiredo A, Lledó-García E, et al. The Risk of Tumour Recurrence in Patients Undergoing Renal Transplantation for End-stage Renal Disease after Previous Treatment for a Urological Cancer: A Systematic Review. Eur Urol 2018;73(1):94-108. https://doi.org/10.1016/j.eururo.2017.07.017.
- Cognard N, Anglicheau D, Gatault P, Girerd S, Essig M, Hurault de Ligny B, et al. Recurrence of Renal Cell Cancer After Renal Transplantation in a Multicenter French Cohort. Transplantation 2018;102(5):860-867.https://doi.org/10.1097/TP.0000000000002009.
- Bellido JA, Palou J, Hübner M, Pascual M, Sagristá R, Martínez E, et al. Early ultrasound detection of renal tumors in patients with end stage renal disease in dialysis. Arch Esp Urol 2007;60(9):1.079-83. https://doi.org/10.4321/s0004-06142007000900004.
- Jung SH, Han YJ, Shin SH, Lee HS, Lee JY. Sudden Intraoperative Hyperkalemia during Laparoscopic Radical Nephrectomy in a Patient with Underlying Renal Insufficiency. Acute Crit Care 2018;33(4):271‐275. https://doi.org/10.4266/acc.2016.00696.
- Keehn A, Maiman R, Agalliu I, Taylor J, Ghavamian R. Outcomes and Management Considerations in Patients on Dialysis Undergoing Laparoscopic Radical Nephrectomy for Renal-Cell Carcinoma. J Endourol 2015;29(6):691-5. https://doi.org/10.1089/end.2014.0484.
- Novara G, Ficarra V, Antonelli A, Artibani W, Bertini R, Carini M et al. Corrigendum to «Validation of the 2009 TNM version in a large multiinstitutional cohort of patients treated for renal cell carcinoma: Are further improvements needed?» Eur Urol 2010;58(4):588-95. https://doi.org/10.1016/j.eururo.2010.10.017.
- Klatte T, Chung J, Leppert JT, Lam JS, Pantuck AJ, Figlin RA, et al. Prognostic relevance of capsular involvement and collecting system invasion in stage I and II renal cell carcinoma. BJU Int 2007;99(4):821-4. https://doi.org/10.1111/j.1464-410X.2006.06729.x.
- Wagener N, Edelmann D, Benner A, Zigeuner R, Borgmann H, Wolff I, et al. Outcome of papillary versus clear cell renal cell carcinoma varies significantly in non-metastatic disease. PLoS One 2017;12(9):e0184173. https://doi.org/10.1371/journal.pone.0184173.
- Cheville JC, Lohse CM, Zincke H, Weaver AL, Blute ML. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 2003;27(5):612-24. https://doi.org/10.1097/00000478-200305000-00005
- Leibovich BC, Lohse CM, Crispen PL, Boorjian SA, Thompson RH, Blute ML, et al. Histological subtype is an independent predictor of outcome for patients with renal cell carcinoma. J Urol 2010;183(4):1309-15. https://doi.org/10.1016/j.juro.2009.12.035.
- Moch H, Cubilla AL, Humphrey PA, Reuter VE, Ulbright TM. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part A: Renal, Penile, and Testicular Tumours. Eur Urol 2016;70(1):93-105. https://doi.org/10.1016/j.eururo.2016.02.029.
- Zhang BY, Cheville JC, Thompson RH, Lohse CM, Boorjian S, Leibovich B, et al. Impact of Rhabdoid Differentiation on Prognosis for Patients with Grade 4 Renal Cell Carcinoma. Eur Urol 2015;68(1):5-7. https://doi.org/10.1016/j.eururo.2015.01.002.
- Lang H, Lindner V, de Fromont M, Molinié V, Letourneux H, Meyer N, et al. Multicenter determination of optimal interobserver agreement using the Fuhrman grading system for renal cell carcinoma: Assessment of 241 patients with > 15-year follow-up. Cancer 2005;103(3):625-9. https://doi.org/10.1002/cncr.20812.
- Sorbellini M, Kattan MW, Snyder ME, Reuter V, Motzer R, Goetzl M, et al. A postoperative prognostic nomogram predicting recurrence for patients with conventional clear cell renal cell carcinoma. J Urol 2005;173(1):48-51. https://doi.org/10.1097/01.ju.0000148261.19532.2c.
- Patard JJ, Kim HL, Lam JS, Dorey FJ, Pantuck AJ, Zisman A, et al. Use of the University of California Los Angeles integrated staging system to predict survival in renal cell carcinoma: an international multicenter study. J Clin Oncol 2004;22(16):3316-22. https://doi.org/10.1200/JCO.2004.09.104.
- Leibovich BC, Blute ML, Cheville JC, Lohse CM, Frank I, Kwon ED, et al. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer 2003;97(7):1663-71. https://doi.org/10.1002/cncr.11234.







