Рассеянный склероз – одно из тяжелых, инвалидизирующих заболеваний центральной нервной системы, являющийся сложной комплексной медико-социальной проблемой. Развиваясь у людей в возрасте от 20 до 45 лет рассеянный склероз (РС) может быстро привести к потере трудоспособности. В настоящее время в мире около 3 миллионов больных рассеянным склерозом. В России заболеваемость рассеянным склерозом составляет от 30 до 100 случаев на 100 000 населения [1, 2].
Дисфункция нижних мочевых путей встречается по данным разных авторов у 50-96% больных РС [3, 4]. Наиболее распространенными симптомами заболевания являются: учащенное мочеиспускание (32-99%), наличие императивных позывов (32-85%) и ургентное недержание мочи (19-80%) [3, 4, 5]. Реже встречаются затрудненное мочеиспускание и хроническая задержка мочи (2-20%) [4, 5].
Традиционно для диагностики нарушений мочеиспускания у неврологических больных используется комплексное уродинамическое исследование (КУДИ). Согласно клиническим рекомендациям Европейской ассоциации урологов пациентам с нейрогенной дисфункцией нижних мочевых путей уродинамическое исследование должно выполняться 1 раз в два года при отсутствии гиперактивности детрузора и 1 раз в год при наличии гиперактивности или сниженной комплаэнтности мочевого пузыря. Учитывая инвазивность, а также малую доступность комплексного уродинамического исследования в рутинной клинической практике, поиск биологических маркеров нейрогенного мочевого пузыря является актуальной задачей. Возможно, новые биомаркеры позволят судить о тяжести состояния, прогнозировать течение заболевания и правильно подбирать оптимальную схему лечения.
Цель исследования – определить практическую значимость количественного определения потенциальных биологических маркеров гиперактивности детрузора в крови и моче пациентов, используя комплексный подход к диагностике нарушений мочеиспускания у больных рассеянным склерозом.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование вошло 20 больных рассеянным склерозом (16 женщин и 4 мужчины) в возрасте от 28 до 60 лет (43,35±9,21), предъявлявших жалобы на проблемы с мочеиспусканием. Контрольную группу составили 20 пациентов (14 женщин и 6 мужчин) в возрасте 20-72 лет (38,35±17,19), находящихся в клинике урологии СОКБ №1 по поводу заболеваний, не сопровождавшихся гиперактивностью детрузора мочевого пузыря или детрузорно-сфинктерной диссинергией (кисты почек, мочекаменная болезнь, хронический цистит и др.)
Критериями исключения для пациентов с рассеянным склерозом были: тяжесть основного заболевания, затрудняющая проведение комплексного уродинамического исследования и цистоскопии, отказ пациента от выполнения инвазивных вмешательств, наличие гиперплазии предстательной железы или стриктуры уретры у мужчин. В контрольную группу не вошли пациенты с признаками инфравезикальной обструкции, лейкоцитурией и клиническими симптомами воспаления нижних мочевых путей.
Все пациенты дали добровольное информированное согласие на проведение диагностических манипуляций, забор крови и мочи для исследования. Дизайн исследования одобрен локальным этическим комитетом ГБУЗ СО СОКБ№1 (протокол заседания №106 от 03.03.2014 г).
Пациентам основной и контрольной групп предлагалось заполнить анкеты-опросники (опросник для оценки симптомов гиперактивного мочевого пузыря, опросник SF-36), в течение 3-х суток вести дневник мочеиспусканий. Всем пациентам выполнялось лабораторное обследование, УЗ-исследование мочевых путей с определением объема остаточной мочи, комплексное уродинамическое исследование (КУДИ), уретроцистоскопия с щипковой биопсией мочевого пузыря.
Проводились общеклинические анализы крови и мочи, а также количественное определение в крови и моче методом иммуноферментного анализа фактора роста нервов (nerve growth factor, NGF), нейротрофического фактора головного мозга (brain-derived neurotrophic factor, BDNF), васкулоэндотелиального фактора роста (vascular endothelial growth factor, VEGF), кортизола, гранулоцитарного колониестимулирующего фактора (granulocyte colony stimulating factor, GCSF).
КУДИ осуществлялось с использованием уродинамической системы Triton (Laborie medical technologies) в соответствии с требованиями Международного общества по удержанию мочи [6] и включало в себя ретроградную водную цистометрию медленного наполнения (25 мл/мин.) в положении сидя, исследование «давление – поток», профилометрию уретры, электромиографию мышц тазового дна.
Биоптаты слизистой мочевого пузыря заливали в парафин и исследовали ступенчатыми срезами с окраской гематоксилин-эозином. Помимо гистологического, выполнялось иммуногистохимическое (ИГХ) исследование препаратов на наличие экспрессии рецепторов к фактору роста нервов (NGFR).
ИГХ исследование выполняли на автоматическом иммунностейнере «VentanaBenchMarkGX» с использованием мышиных моноклональных антител к NGFR (клон MRQ-21, CellMarque, США), а также системы визуализации VentanaultraViewUniversalDABDetectionKit (США). Время инкубации с антителами, при использовании смягченного режима демаскировки антигена, составило 16 минут при 37ºС. После окончания программы окрашивания дегидратированные препараты заключались под покровные стекла и исследовались на микроскопе “ZeissImagerM” (Германия). Положительным контролем окрашивания NGFR являлись миоэпителиальные клетки протоков молочной железы, отрицательным – отсутствие экспрессии NGFR на других структурах. Внутри гистологического среза стенки мочевого пузыря внутренним положительным контролем NGFR являлись нервные волокна в собственной пластинке слизистой оболочки. Оценка уровня экспрессии иммуногистохимического окрашивания проводилась с использованием балльной системы. При этом отсутствие экспрессии оценивалось как – 0 баллов, слабая экспрессия – 1 балл, умеренная экспрессия – 2 балла, сильная экспрессия – 3 балла. Экспрессию NGFR оценивали раздельно в структурах собственной пластинки слизистой мочевого пузыря, базальных и супрабазальных слоях, а также в поверхностных слоях уротелия.
Статистическую обработку данных осуществляли с помощью программного пакета SPSS 14.0 for Windows. Оценку статистической значимости различий проводили по непараметрическому критерию Манна-Уитни. Различия считались достоверными при р< 0,05. Для определения тесноты связи между переменными использовали коэффициент корреляции Спирмана [7].
РЕЗУЛЬТАТЫ
Из 20 больных РС 17 (85%) предъявляли жалобы на учащенное мочеиспускание и наличие императивных позывов, сопровождающихся у 15 (75%) ургентным недержанием мочи. Восемь (40%) пациенток отмечали недержание мочи не только на фоне сильного позыва, но также при кашле и физической нагрузке. У 9 (45%) больных ургентное недержание мочи сочеталось с затрудненным мочеиспусканием, трех (15%) пациентов беспокоила только странгурия. У одной пациентки наличие императивных позывов и учащенное мочеиспускание сопровождались постоянным дискомфортом в уретре и мочевом пузыре.
Данные анализа дневников мочеиспусканий пациентов с рассеянным склерозом приведены в таблице 1.
Пациенты с рассеянным склерозом имели достоверно большую частоту дневных и ночных мочеиспусканий и меньший объем мочи за одно мочеиспускание.
У 30% пациентов нарушения со стороны нижних мочевых путей появились одновременно с другими симптомами рассеянного склероза, у 5% предшествовали первым проявлениям заболевания. Среднее время возникновения симптомов нижних мочевых путей от момента установления диагноза РС составляло 4,0±4,2 года.
У всех больных РС, имевших симптомы ургентности, наличие гиперактивности детрузора было подтверждено в ходе комплексного уродинамического исследования.
Результаты КУДИ представлены в таблице 2.
Таблица 1. Результаты анализа дневников мочеиспусканий пациентов основной и контрольной групп
| Показатели | Пациенты с РС | Контрольная группа |
|---|---|---|
| Минимальный объем мочи за мочеиспускание, мл | 73,68±37,15* | 125±27,39 |
| Максимальный объем мочи за мочеиспускание, мл | 270,52±97,03* | 491±115,66 |
| Средний объем мочи за мочеиспускание, мл | 157,37±55,26* | 308,33±50,7 |
| Среднее количество мочеиспусканий за день | 11,53±5,6* | 6,7±0,81 |
| Среднее количество мочеиспусканий за ночь | 2,00±1,61* | 0,17±0,41 |
Данные представлены в виде: mean±S.D., p<0,05
Таблица 2. Данные комплексного уродинамического исследования пациентов с рассеянным склерозом
| Показатели | Min | Max | Mean | St. Error |
|---|---|---|---|---|
| Первый позыв на мочеиспускиние, мл | 15 | 250 | 86,21 | 14,66 |
| Нормальный позыв на мочеиспускиние, мл | 40 | 340 | 124,60 | 16,61 |
| Сильный позыв на мочеиспускиние, мл | 60 | 500 | 178,25 | 26,99 |
| Максимальная цистометрическая емкость, мл | 70 | 500 | 232,89 | 30,37 |
| Объем мочевого пузыря при первом эпизоде гиперактивности, мл |
20 | 500 | 117,52 | 27,94 |
| Давление детрузора при гиперактивности, см Н2О | 3 | 28 | 9,94 | 1,78 |
| Максимальное давление детрузора в фазу опорожнения, см Н2О |
2 | 42 | 12,26 | 2,24 |
| Давление детрузора при максимальном потоке мочи, см Н2О | 2 | 39 | 10,22 | 2,37 |
| Максимальная скорость потока мочи, мл/с | 3 | 30 | 13,89 | 1,72 |
Функциональная емкость мочевого пузыря (МП) у пациентов с рассеянным склерозом была снижена до 233±30 мл. При этом спонтанное непроизвольное сокращение МП у некоторых пациентов начиналось уже при наполнении МП до 20 мл. Средний объем МП при возникновении эпизода гиперактивности составлял 117±28 мл. В 88% случаев эпизоды гиперактивности приводили к ургентному недержанию мочи (рис. 1).
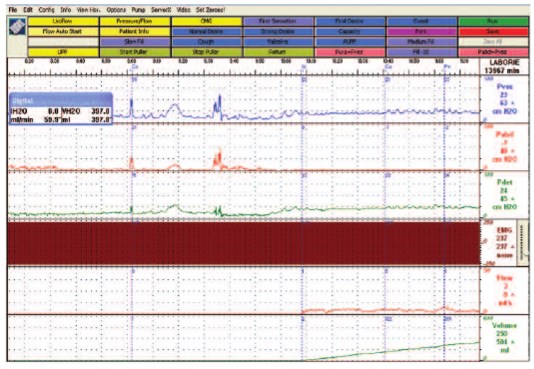
Рис.1. Цистометрия наполнения пациентки с рассеянным склерозом (женщина, 42 года). На графике представлен эпизод гиперактивности детрузора с ургентным недержанием мочи
Из 13 пациентов, предъявлявших жалобы на затрудненное мочеиспускание, у 10 (50% от общего числа больных РС) человек при исследовании «давление-поток» и электромиографии мышц тазового дна была диагностирована детрузорно-сфинктерная диссинергия (ДСД) (рис. 2). У трех пациентов объем остаточной мочи на фоне функциональной обструкции достигал 200-250 мл и ДСД сочеталась с гипотонией мочевого пузыря.
Количественная оценка содержания в крови и моче пациентов нейротрофинов показала, что уровень фактора роста нервов в моче и крови пациентов с РС выше, чем в контрольной группе (табл. 3). Нейротрофический фактор головного мозга оказался менее показательным маркером нейрогенного поражения нижних мочевых путей: его уровень в моче в двух группах не отличался, в крови был несколько выше для больных РС. Содержание васкулоэндотелиального фактора роста и гранулоцитарного колониестимулирующего фактора в моче пациентов с нейрогенным мочевым пузырем превышало уровень в контрольной группе.
Показатели этих маркеров в сыворотке крови пациентов, а также содержание кортизола в крови и моче в двух группах существенно не отличались. Полученные различия при оценке с помощью непараметрических тестов оказались статистически незначимы.
Эндоскопическая картина слизистой МП у пациентов с рассеянным склерозом не имела существенных отличий от контрольной группы, за исключением пациентов с ДСД и большим объемом остаточной мочи. У этих больных обращала на себя внимание трабекулярность слизистой оболочки стенки МП. У пациентки, предъявляевшей жалобы на дискомфорт в уретре и МП, при цистоскопии были выявлены признаки шеечного цистита.
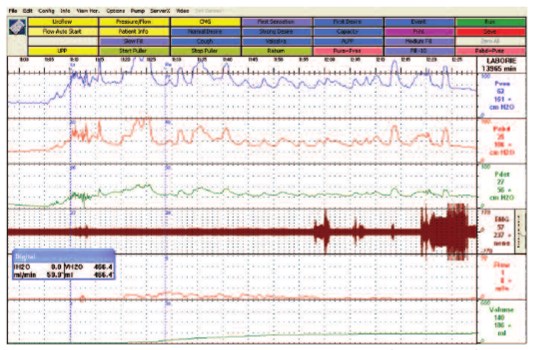
Рис.2. Исследование «Давление-поток» у пациента с рассеянным склерозом (мужчина, 36 лет): картина детрузорно-сфинктерной диссинергии
Таблица 3. Потенциальные биомаркеры нейрогенного мочевого пузыря в моче и крови пациентов основной и контрольной групп
| Показатели | Группа | |
|---|---|---|
| РС (моль/л) | Контроль (моль/л) | |
| NGF, моча | 21.0±6.7 | 8.9±1.8 |
| NGF, кровь | 79.3±22.0 | 26.8±9.5 |
| BDNF, моча | 37.0±11.5 | 41.4±9.3 |
| BDNF, кровь | 11383.3±1085.4 | 8495.4±768.9 |
| VEGF, моча | 45.5±6.8 | 35.6±4.1 |
| VEGF, кровь | 1.2±0.5 | 1.2±0.4 |
| GCSF, моча | 33.03±13.45 | 19.2±10.0 |
| GCSF, кровь | 10.64±5.9 | 9.8±6.02 |
NGF-фактор роста нервов, BDNF-нейротрофический фактор головного мозга, VEGFваскулоэндотелиальный фактор роста, GCSF-гранулоцитарный колониестимулирующий фактор
Таблица 4. Уровень экспрессии рецепторов к фактору роста нервов (NGFR) в слизистой оболочке мочевого пузыря
| Группа | Уровень экспрессии NGFR в слоях слизистой оболочки мочевого пузыря (балл) |
||
|---|---|---|---|
| Поверхностные слои уротелия |
Базальные и супрабазальные слои уротелия | Собственная пластинка слизистой | |
| Контрольная группа | 0±0 | 0,44±0,24 | 1,78±0,15 |
| Пациенты с рассеянным склерозом |
0,17±0.09 | 1,24±0,26 | 2,23±0,11 |
В каждом случае отсутствие экспрессии оценивалось как 0 баллов, слабая экспрессия – 1 балл, умеренная
экспрессия – 2 балла, сильная экспрессия – 3 балла
Гистологическое исследование биоптатов слизистой МП в 90% случаев показало наличие признаков хронического воспаления минимальной активности.
При иммуногистохимическом исследовании биоптатов слизистой МП уровень экспрессии рецепторов к фактору роста нервов во всех слоях уротелия у больных с рассеянным склерозом был выше, чем в контрольной группе (рис. 3-5). Результаты анализа данных ИГХ представлены в таблице 4.
ОБСУЖДЕНИЕ
Роль нейротрофинов в качестве потенциальных биомаркеров гиперактивного мочевого пузыря активно изучается в последние годы [8, 9]. Повышенный уровень NGF и BDNF отмечается в моче и крови пациентов с гиперактивным мочевым пузырем и имеет тенденцию к снижению на фоне лечения антимускариновыми препаратами или ботулотоксином [9, 10]. В исследовании A. Giannantoni и соавт. было показано, что инъекции ботулинического токсина в стенку мочевого пузыря уменьшают уровень NGF в тканях и усиливают экспрессию рецепторов к NGF [11].
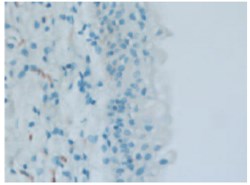
Рис. 3. Отсутствие экспрессии рецепторов к фактору роста нервов в базальных слоях уротелия пациентки контрольной группы (микрофотография ИГХ препарата). 400 х
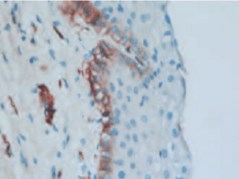
Рис. 4. Наличие экспрессии рецепторов к фактору роста нервов в базальных слоях уротелия пациента с рассеянным склерозом (микрофотография ИГХ препарата). 400 х
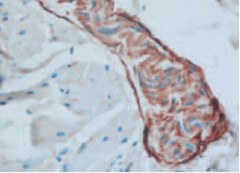
Рис. 5. Экспрессия рецепторов к фактору роста нервов в нервном волокне собственной пластинки слизистой оболочки мочевого пузыря. 400 х
Имеются и противоположные результаты. Так L.A. Birder и соавт., исследовав концентрацию NGF непосредственно в биоптатах слизистой мочевого пузыря у женщин с гиперактивностью детрузора и без нее, не нашли существенных различий [12].
Нам не встретились работы, посвященные исследованию нейротрофинов в качестве маркеров нейрогенного мочевого пузыря у пациентов с РС.
Рассеянный склероз – хроническое демиелинизирующее заболевание ЦНС, в основе которого лежат сложные иммунопатологические механизмы, приводящие к нейродегенеративному повреждению с гибелью аксонов. Параллельно с демиелинизацией при PC наблюдаются и процессы регенерации, в частности, восстановление миелина. Предполагается, что макрофагами, микроглией или другими клетками синтезируются нейротрофины, влияющие на процесс пролиферации и дифференцировки олигодендроцитов и, следовательно, процесс ремиелинизации [13]. Наиболее изученным из семейства нейротрофинов является фактор роста нервов. NGF влияет на рост аксонов и поддержание синаптических связей в нейронах головного и спинного мозга, клеток спинальных ганглиев и постганглионарных вегетативных нейронов. Кроме того, фактор роста нервов может быть вовлечен в нейроиммунные взаимодействия и внутритканевое воспаление [14].
В литературе имеются лишь единичные сообщения об изучении уровня сывороточного NGF при PC. Показано как значительное повышение содержания NGF в спинномозговой жидкости больных PC при обострении заболевания в сравнении с заметным снижением при ремиссии [15], так и его отсутствие [16]. Продемонстрировано образование аутоантител к фактору роста нервов у пациентов с РС [17].
Повышенный уровень нейротрофинов в сыворотке крови и моче пациентов с РС может быть обусловлен системным патологическим процессом, протекающим в нервной системе. Однако наличие большого числа рецепторов к NGF в слизистой мочевого пузыря указывает на вовлеченность нейротрофинов в патогенез симптомов нижних мочевых путей при РС.
Рецептор фактора роста нервов или рецептор p75 (P75NTR) является низкоаффинным рецептором нейротрофинов (NGF, BDNF, NT3, NT4), а также играет важную роль в регулировке активности других нейротрофинных рецепторов (TrkA, TrkB, TrkC). Рецепторы под воздействием нейротрофинов способствуют пролиферации, дифференциации и выживанию клетки. В присутствии NGF этот рецептор способен как запускать программированную клеточную гибель, так и защищать клетки от апоптоза [18]. Высокий уровень экспрессии рецепторов к фактору роста нервов, обнаруженный в уротелии пациентов с рассеянным склерозом, может обеспечивать реализацию таких тканевых эффектов NGF как модуляция ответа уротелия на воспаление, регуляция пролиферации и NGF-опосредованная индукция апоптоза.
При анализе данных не было выявлено корреляции между уровнем нейротрофинов и выраженностью симптомов со стороны нижних мочевых путей, в том числе, наличием ургентного недержания мочи. Уровень биомаркеров также не коррелировал с цистометрическими параметрами – минимальным объемом мочевого пузыря, при котором возникает гиперактивность детрузора, и давлением детрузора в момент непроизвольного сокращения.
Кроме того, уровни BDNF и NGF не были взаимосвязаны между собой. Однако отмечена статистически значимая корреляция между BDNF и GCSF в моче пациентов с рассеянным склерозом (коэффициент корреляции Спирмена=0,347, p< 0,05). Гранулоцитарный колониестимулирующий фактор является главным гемопоэтическим фактором роста, регулирующим гранулоцитопоэз, и широко применяется в медицине при лечении нейтропений различной этиологии. В нервной системе GCSF участвует в стимуляции нейрогенеза, оказывает противовоспалительное действие и подавляет апоптоз. В исследовании G. Ghoniem и соавт. было показано повышенное содержание GCSF в моче пациентов с гиперактивным мочевым пузырем наряду с другими воспалительными цитокинами [19].
Выявленное в ходе исследования повышение уровня NGF, VEGF и GCSF в моче, а также выраженная экспрессия рецепторов к NGF в уротелии пациентов с рассеянным склерозом и симптомами нижних мочевых путей указывают не только на процессы деи ремиелинизации в стенке мочевого пузыря, но и на наличие воспалительной реакции слизистой. Присутствие воспалительных изменений в слизистой оболочке было подтверждено в ходе гистологического исследования биоптатов. Выявленные закономерности приближают нас к пониманию патогенеза нейрогенного мочевого пузыря.
ВЫВОДЫ
Биологические маркеры нейрогенного мочевого пузыря, такие как NGF, BDNF, VEGF и GCSF, имеют хорошие предпосылки для применения в клинической практике, но на сегодняшний день не могут заменить комплексное уродинамическое исследование в диагностике нейрогенных расстройств мочеиспускания.
У пациентов с рассеянным склерозом GCSF мочи впервые представлен в качестве маркера нейрогенной гиперактивности детрузора. Требуются дальнейшие исследования, чтобы оценить его практическую значимость и возможности клинического использования.
NGF и его рецепторы в стенке мочевого пузыря могут быть потенциальными мишенями для таргетной терапии нейрогенных расстройств мочеиспускания.
ЛИТЕРАТУРА
1. Гусев Е.И., Завалишин И.А., Бойко А.Н. Рассеянный склероз: Клиническое руководство. М.: Реал Тайм, 2011. 528 с.
2. Шмитд Т.Е., Яхно Н.Н. Рассеянный склероз. М.: Медпресс, 2010. 267 с.
3. Мазо Е.Б., Завалишин И.А., Кривобородов Г.Г., Шварц П.Г. Рассеянный склероз и нарушения мочеиспускания: клиника, диагностика, лечение. // Неврологический журнал. 2002. № 4. С. 4-7.
4. Corcos J. A urological challenge: Voiding dysfunction in multiple sclerosis. // Can Urol Assoc J. 2013. Vol. 7, N.9-10. P.181-182.
5. Adli Oel Y, Corcos J. Bottulinum neurotoxin-A treatment of lower urinary tract symptoms in multiple sclerosis. // Can Urol Assoc J. 2014. Vol. 8, N.1-2. P.61-67.
6. Schäfer W, Abrams P, Liao L, Mattiasson A, Pesce F, Spangberg A, Sterling AM, Zinner NR, van Kerrebroeck P. International Continence Society Good urodynamic practices: uroflowmetry, filling cystometry, and pressure-flow studies. // Neurourol Urodyn. 2002. Vol 21, N 3. P. 261-274.
7. Герасимов А.Н. Медицинская статистика: Учебное пособие. М.: ООО «Медицинское информационное агентство», 2007. 480 с.
8. Seth JH, Sahai A, Khan MS, van der Aa F, de Ridder D, Panicker JN, Dasgupta P, Fowler CJ. Fowler Nerve growth factor (NGF): a potential urinary biomarker for overactive bladder syndrome (OAB)? // BJU Int. 2013. Vol.111, N 3. P. 372-380.
9. Fry CH, Sahai A, Vahabi B, Kanai AJ, Birder LA. What is the role for biomarkers for lower urinary tract disorders? ICI-RS 2013. // Neurourol Urodyn. 2014. Vol. 33, N 5. P. 602-605.
10. Liu HT, Chen CY, Kuo HC. Urinary nerve growth factor levels in overactive bladder syndrome and lower urinary tract disorders. // J Formos Med Assoc. 2010. Vol. 109, N. 12. P. 862-878.
11. Giannantoni A, Conte A, Farfariello V, Proietti S, Vianello A, Nardicchi V, Santoni G, Amantini C. Onabotulinumtoxin-A intradetrusorial injections modulate bladder expression of NGF, TrkA, p75 and TRPV1 in patients with detrusor overactivity. // Pharmacol Res. 2013. Vol. 68, N. 1. P. 118-124.
12. Birder LA, Wolf-Johnston A, Griffiths D, Resnick NM. Role of urothelial nerve growth factor in human bladder function. // Neurourol Urodyn. 2007. Vol. 26. P. 405-409.
13. Acosta CM, Cortes C, MacPhee H, Namaka MP. Exploring the role of nerve growth factor in multiple sclerosis: implications in myelin repair. // CNS Neurol Disord Drug Targets. 2013. Vol. 12, N. 8. P. 1242-1256.
14. Vaidyanathan S, Krishnan KR, Mansour P, Soni BM, McDicken I. p75 nerve growth factor receptor in the vesical urothelium of patients with neuropathic bladder: an immunohistochemical study. // Spinal Cord. 1998. Vol. 36, N. 8. P. 541-547.
15. Laudiero LB, Aloe L, Levi-Montalcini R, Buttinelli C, Schilter D, Gillessen S, Otten U. Multiple sclerosis patients express increased levels of beta-nerve growth factor in cerebrospinal fluid. // Neurosci Lett. 1992. Vol .147, N.1. P. 9-12.
16. Massaro AR, Soranzo C, Bigon E, Battiston S, Morandi A, Carnevale A, Callegaro L. Nerve growth factor (NGF) in cerebrospinal fluid (CSF) from patients with various neurological disorders. // Ital J Neurol Sci. 1994. Vol.15, N. 2. P. 105-108.
17. Переседова А.В. Свободнорадикальные реакции и аутоантитела к фактору роста нервов при рассеянном склерозе: автореф. дисс…канд. мед. наук. М. 1999. 27 с.
18. Kuo HC, Liu HT, Chancellor MB. Can urinary nerve growth factor be a biomarker for overactive bladder? // Rev Urol. 2010. Vol. 12. P. 69-77.
19. Ghoniem G, Faruqui N, Elmissiry M, Mahdy A, Abdelwahab H, Oommen M, Abdel-Mageed AB. Differential profile analysis of urinary cytokines in patients with overactive bladder. // Int Urogynecol J. 2011. Vol. 22, N. 8. P. 953-961.







