Доброкачественная гиперплазия и рак предстательной железы (ДГПЖ, РПЖ) являются одними из самых распространенных форм опухолевой патологии - доброкачественной и злокачественной, соответственно. ДГПЖ, встречается не менее, чем у 20% мужчин в возрасте 60 лет, регистрируется у 43% и 90% 80- и 90-летних пациентов, соответственно. Рак предстательной железы в структуре встречаемости онкологических заболеваний занимает первое место в развитых странах и второе - в России. Также, как и в случаях с ДГПЖ, вероятность развития РПЖ увеличивается с возрастом [1].
Хирургическое вмешательство является единственным методом радикального лечения локализованного РПЖ [2] и единственным методом лечения ДГПЖ при неэффективности медикаментозной терапии, выраженной инфравезикальной обструкции, сопровождающейся хронической или рецидивирующей задержкой мочеиспускания, наличии осложнений (хроническая почечная недостаточность, конкременты мочевого пузыря, интермиттирующая макрогематурия и др.) [3].
Радикальная простатэктомия (РПЭ) при локализованном раке предстательной железы и аденомэктомия в случаях с ДГПЖ могут выполняться как открытым (классическим, традиционным) способом, так и с применением лапароскопических технологий, важным преимуществом которых перед открытыми вмешательствами является значительно меньший объем рассекаемых тканей, снижение масштабов кровопотери, интенсивности болевых ощущений, встречаемости и тяжести осложнений (нарушение сократительной способности кишечных стенок, спаечный процесс, послеоперационная пневмония). Практически отсутствует риск формирования вентральных грыж или эвентрации внутренних органов. Быстрее восстанавливается физическая активность и трудоспособность, сокращается время пребывания пациента в стационаре, а также уменьшаются финансовые затраты на лекарственные препараты, прохождение реабилитационных мероприятий в послеоперационном периоде [4-6].
Однако выполнение лапароскопических операций требует создания карбоксиперитонеума, создающего рабочее пространство за счет расширения брюшной полости. Чрезмерное нагнетание углекислого газа сопровождается перерастяжением тканей передней брюшной стенки, краниальной дислокацией диафрагмы и компрессией нижней полой вены, так называемом напряженном карбоксиперитонеуме, являющемся специфическим фактором повреждения при лапароскопических вмешательствах [7,8].
Последствиями компрессии нижней полой вены, вызванной влиянием карбоксиперитонеума, является нарушение оттока крови из вен брюшной полости, таза и нижних конечностей, формирование застоя крови, отека и других расстройств микроциркуляции в этих областях с развитием гипоксии тканей и органов в пострадавших участках и нарушением их специфических и неспецифических функций. В свою очередь, застой в системах вен брюшной полости, таза и нижних конечностей приводит к уменьшению венозного возврата к правым отделам сердца, снижению ударного объема (УО), минутного объема сердца (МОС), артериального давления (АД) и линейной скорости кровотока в сосудах большого круга кровообращения. Отмеченные нарушения могут стать причинами ишемизации, гипоксии и дисфункции практически всех органов и тканей, а также роста общего периферического сопротивления сосудов (ОПСС) и развития артериальной гипертензии (последняя может быть связана также со сдавлением артериальных сосудов брюшной полости в условиях карбоксиперитонеума) [9].
Дислокация диафрагмы в краниальном направлении приводит к сдавлению легочной ткани, росту внутрилегочного (альвеолярного) давления, снижению податливости респираторной системы, увеличению эластического сопротивления легких и общей работы дыхания за счет эластической фракции работы дыхательной мускулатуры. Реализация такой патогенетической цепочки может закончиться утомлением дыхательной мускулатуры, снижением эффективной альвеолярной вентиляции и формированием гипоксемически-гиперкапнической дыхательной недостаточности II типа, кардинальным признаком которой станет увеличение парциального напряжения углекислого газа в артериальной крови выше 45 мм рт.ст. При нахождении пациента в положении Тренделенбурга отмеченные нарушения усиливаются [9]. Также имеют значение резорбция углекислого газа из брюшной полости в кровь и реализация биологических эффектов препаратов, составляющих анестезиологическое пособие.
В настоящее время радикальная простатэктомия при лечении РПЖ, основные варианты хирургического лечения ДГПЖ (трансуретральная резекция предстательной железы (ПЖ), чрезпузырная, позадилобковая и промежностная аденомэктомии), как открытые, так и лапароскопические - чаще выполняются в условиях общей эндотрахеальной анестезии (ОЭА) [10-13].
При всех достоинствах общей эндотрахеальной анестезии (полное расслабление мышц и наличие желудочного зонда, адекватная защита коркового слоя головного мозга, стабильность жизненно важных функций организма), принимая во внимание постоянное и успешное совершенствование методик ОЭА, учитывая ее нивелирующее влияние на повреждающее воздействие карбоксиперитонеума (поддержание в физиологически оптимальном диапазоне УО и МОС, минутной альвеолярной вентиляции (МАВ) и оксигенации), нельзя не отметить возможных негативных периоперационных последствий общего эндотрахеального обезболивания. Основными среди них являются: 1) острая сердечная недостаточность со снижением артериального давления и определенной вероятностью развития кардиогенного шока, нарушения ритма, а также артериальная гипертензия; 2) гипоксия циркуляторная и/или респираторная (последняя связана с неадекватностью состава, объема и проведения газовой смеси); 3) болевой шок (при недостаточном уровне обезболивания); 4) асфиксия механическая (опосредованная преждевременным извлечением интубационной трубки в сочетании с недостаточным мониторингом за состоянием пациента) или центрогенная (вследствие искажения центральной респираторной посылки при повышении порога возбудимости дыхательного центра под влиянием медикаментозной седации); 5) послеоперационная тошнота и рвота (ПОТР), регургитация, парез и динамическая непроходимость кишечника; 6) интенсивный послеоперационный болевой синдром, опосредованный неполноценной блокадой ноцицептивной афферентации на сегментарном уровне. По данным Всемирной Организации Здравоохранения, на сегодняшний день в развитых странах встречаемость отмеченных периоперационных осложнений ОЭА составляет 3-16% и осложнений ОЭА, закончившихся летальным исходом - 0,4-0,8%. Важными способствующими условиями следует считать пожилой возраст пациентов и сопутствующие заболевания [14].
Кроме того, во многих публикациях сообщается о негативной роли общей анестезии в формировании послеоперационных повреждений центральной нервной системы (ЦНС), одним из важнейших последствий которых является послеоперационная когнитивная дисфункция (ПОКД) с расстройствами внимания, памяти, гнозиса и праксиса, речи и мышления. Невозможно недооценивать медико-социальную значимость ПОКД. Даже увеличение времени пребывания в стационаре и рост финансовых затрат при развитии данного осложнения есть намного «меньшее зло» по сравнению с социально-бытовой дезадаптацией и ограничением возможностей для профессиональной деятельности пациентов, особенно в случаях, когда острые (кратковременные) послеоперационные когнитивные расстройства (в течение первой недели после вмешательства) трансформируются в ПОКД промежуточную или долгосрочную (до трех месяцев) или стойкую (до 1-2 лет и более) [15-18]. Согласно результатам различных эпидемиологических исследований, выполненных за период с 1994 г. по 2011 г., частота ПОКД составила 7-26% (исключая случаи после кардио- и нейрохирургических вмешательств), при этом послеоперационная когнитивная дисфункция, длившаяся не более трех месяцев, регистрировалась, в среднем, у 9,9% пациентов, сохраняющаяся до двух лет и более - у 1% больных [19]. Практически все авторы, занимавшиеся вопросами распространенности ПОКД в зависимости от числа прожитых лет, отмечают, что развитие этого осложнения возможно в любом возрасте, однако, подчеркивают более высокую вероятность послеоперационного когнитивного дефицита у гериатрических больных [ 18,20-23]. Патогенез ПОКД на настоящем этапе развития медицинской науки полностью не раскрыт. В качестве запускающих факторов позиционируются, во-первых, воздействие на ткань головного мозга фармакологических средств общей анестезии и продуктов их биотрансформации, в т.ч., нейротоксическое действие общих анестетиков; во-вторых - нейрональный гипоэргоз в результате гиперфункционирования во время вмешательства антиноцицептивной системы; в-третьих - гипоксия циркуляторная и/или респираторная, развитие которой является возможным негативным следствием ОЭА; в-четвертых - нарушения мозгового кровотока, в т.ч. в виде микроэмболий сосудов головного мозга; в- пятых - системный воспалительный процесс в ответ на хирургическую травму. Также следует учитывать роль особенностей генотипа и предоперационного когнитивного дефицита, если таковой имел место [24-27].
Предметом изучения и дискуссий остается вопрос о наличии/отсутствии преимуществ эпидурального обезболивания перед общей эндотрахеальной анестезией в плане формирования послеоперационной когнитивной дисфункции. Высказываются различные мнения. Так, например, согласно результатам исследований L.S. Rasmussen и соавт., среди лиц, перенесших вмешательства в условиях ЭА, кратковременная ПОКД развивается в 1,4 раза реже, чем в случаях с применением ОЭА [21], а по данным W.R. Nielson и соавт., Р. Williams-Russo и соавт., L. Evered и соавт. частота встречаемости рассматриваемого осложнения в тех и других ситуациях статистически значимо не различается между собой [28-30].
Целью настоящего исследования явилось изучение в сравнении периоперационных изменений гемодинамики и вероятности развития послеоперационной когнитивной дисфункции при хирургическом лечении РПЖ и ДГПЖ методами лапароскопической радикальной простатэктомии и эндовидеохирургической аденмэктомии, в условиях общей эндотрахеальной и эпидуральной анестезии, соответственно.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Настоящее исследование выполнено на базе Санкт-Петербургского государственного бюджетного учреждения здравоохранения Клиническая больница Святителя Луки в период с июля 2015 г. по июль 2019 г.
В исследовании приняли добровольное участие 166 мужчин в возрасте от 59 до 75 лет, которые в разное время находились на стационарном хирургическом лечении в урологическом отделении СПб ГБУЗ Клиническая больница Святителя Луки по поводу рака или доброкачественной гиперплазии предстательной железы и были прооперированы с применением эндовидеохирургических технологий. Все эти пациенты в зависимости от клинического диагноза, методики хирургического вмешательства и вида анестезиологического пособия (общая эндотрахеальная или эпидуральная анестезия ропивакаином) были разделены на 6 групп, общие характеристики которых представлены в таблице 1.
Таблица 1. Общая характеристика групп исследования
Table 1. General characteristics of study groups
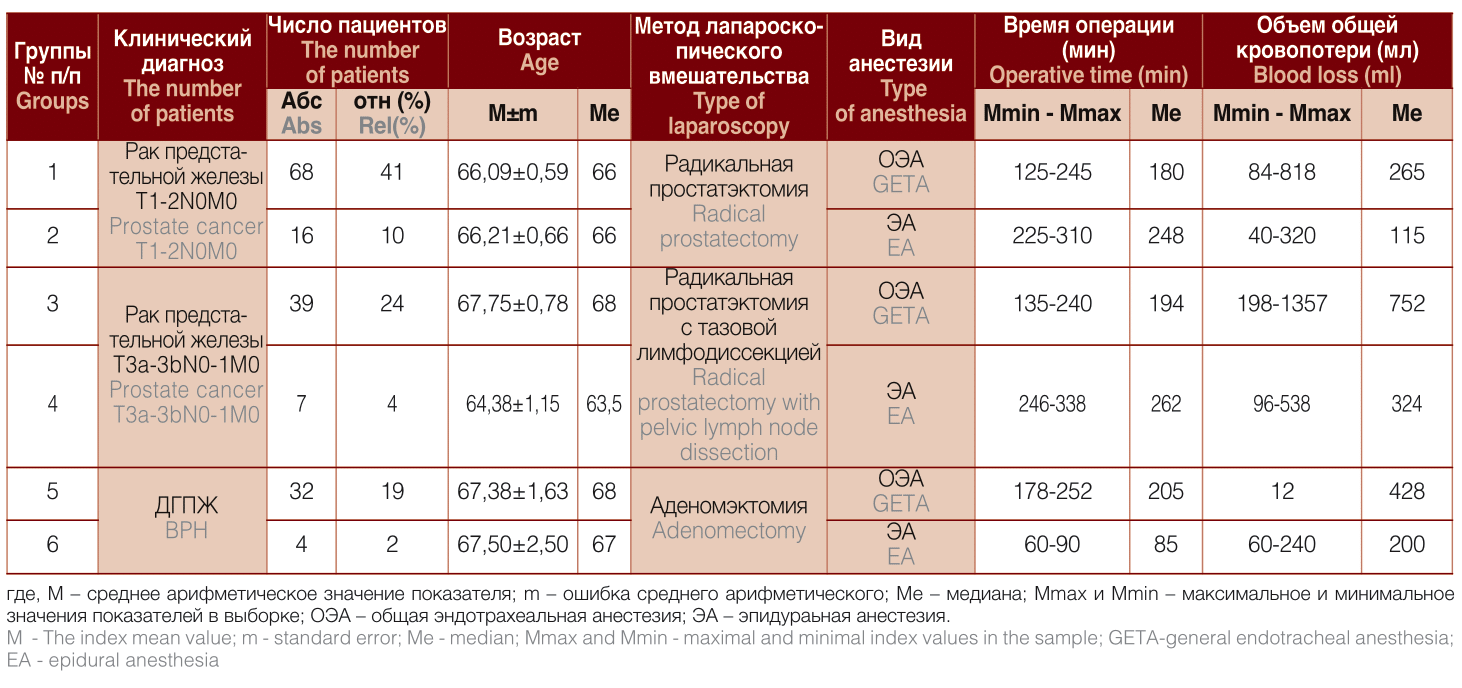
В первую и вторую группу включены больные раком предстательной железы в стадии T1-2N0M0 с суммарным индексом Глисона не более 6 баллов (низкого риска прогрессирования РПЖ). Каждому пациенту была выполнена лапароскопическая радикальная простатэктомия (ЛРПЭ): в первой группе - под общим эндотрахеальным наркозом, во второй группе - в условиях эпидуральной анестезии ропивакаином. В группах № 1 и № 2 число пациентов составило 68 (41% от общей численности участников) и 16 (10%) человек, соответственно, время хирургического вмешательства - 125- 245 минут (медиана 180) и 225-310 минут (медиана 248), объем общей кровопотери не превышал 84-818 мл (медиана 265) и 40-320 мл (медиана 115), соответственно.
Группы № 3 и № 4 были сформированы из больных раком предстательной железы в стадии T3a-3bN0-lM0 с суммарным индексом Глисона 7 и более (высокий риск прогрессирования РПЖ), перенесших в процессе лечения лапароскопическую РПЭ и тазовую лимфодиссекцию (ТЛД). В третьей группе (п=39 или 24% от общего числа участников) вмешательства проводились с применением ОЭА, их длительность варьировала от 135 до 238 минут (медиана 194), объем общей кровопотери находился в пределах 198-1357,5 мл (медиана 752). Для четвертой группы (п=7 или 4% от суммарной численности всех пациентов) время операции было равно 246- 338 минутам (медиана 262), объем общей кровопотери составил 96-538 мл (медиана 324).
В состав групп № 5 (п=32 или 19% от общей численности участников) и № 6 (п=4 или 2%) вошли пациенты с доброкачественной гиперплазией предстательной железы объемом от 220 см3 до 480 см3, которым была выполнена лапароскопическая аденомэктомия под общим эндотрахеальным обезболиванием (группа № 5) или под эпидуральной анестезией (группа № 6). В пятой группе время вмешательства и объем общей кровопотери составили соответственно 178-252 минут (медиана 205) и 115-664 мл (медиана 428) соответственно, в шестой группе - 60-90 минут (медиана 85) и 60-240 мл (медиана 200) соответственно.
Для достижения поставленной цели у пациентов всех групп определялись следующие параметры гемодинамики: ударный объем, минутный объем сердца, артериальное давление систолическое и диастолическое (САД и ДАД), общее периферическое сосудистое сопротивление. Измерения производили до начала вмешательства (первый этап), непосредственно перед инсуфляцией и через 10 минут после нее (второй и третий этапы), перед и через 10 минут после десуфляции (четвертый и пятый этапы), через 2 часа после вмешательства и через 24 часа после операции (этапы шестой и седьмой).
Всем пациентам дважды исследовали когнитивный статус: за 24-72 часа до хирургического вмешательства и через 5-7 суток после него. Одновременно применялись две методики нейропсихологического тестирования: Монреальская шкала оценки когнитивной функции (КФ) (МоСА) и короткая шкала оценки психического статуса (MMSE), позволяющие быстро (прохождение каждого из тестов требует не более 10-15 минут даже у пожилых пациентов) и объективно выполнить анализ состояния КФ (валидность МоСА и MMSE подтверждают в своих публикациях Л.В. Новицкая-Усенко, О.А. Трубникова и соавт. и другие авторы [31-34].
При статистической обработке результатов сначала устанавливали категорию переменных (количественные непрерывные) и, с помощью методов описательной статистики, характер распределения. Затем, с учетом близкого к нормальному характера распределения, в каждой из выборок рассчитывали среднеарифметическую величину М и величину среднего отклонения о. Далее, для оценки значимости различий показателей в группах использовали параметрический t-критерий Стьюдента. Изменения считали статистически значимыми при уровне достоверности р<0,05 [35]. Анализ полученных данных выполняли с помощью пакета прикладных программ статистической обработки «Microsoft Excel 2010».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данные, полученные при поэтапном мониторировании рассматриваемых параметров гемодинамики, представлены в таблице 2.
Таблица 2. Параметры гемодинамики при хирургическом лечении РПЖ и ДГПЖ в условиях ОЭА и ЭА
Table 2. Hemodynamic parameters in surgical treatment of Prostate cancer and BPH under GETA and EA
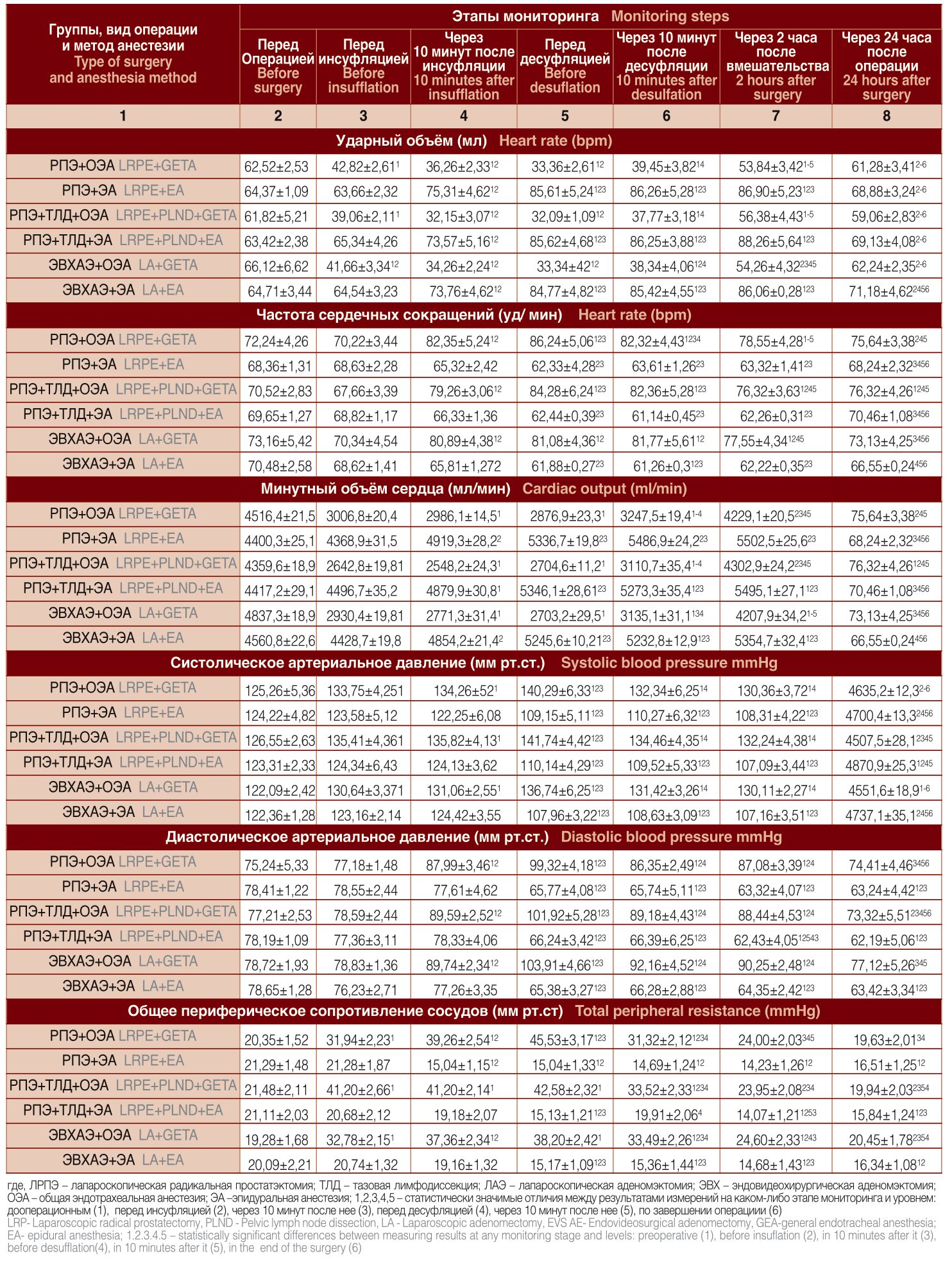
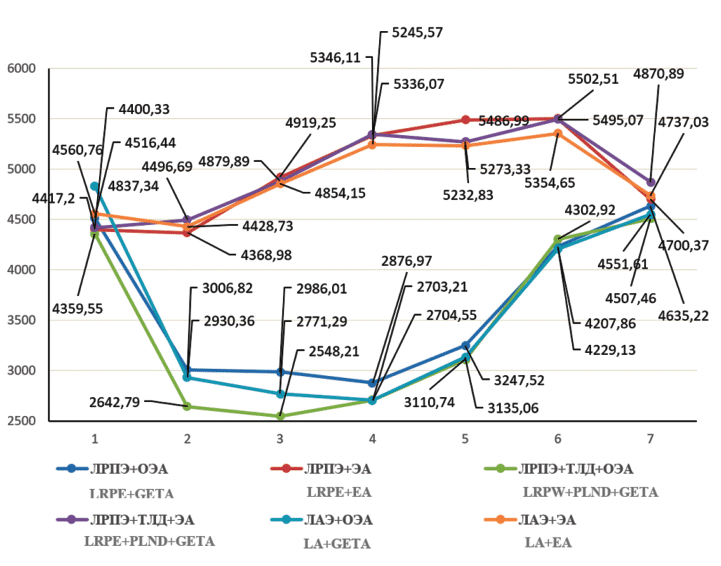
Рис. 1. Изменения МОС при выполнении ЛРПЭ, ЛРПЭ с ТЛД, ЛАЭ в условиях ОЭА и ЭА: 1 – до операции, 2 – перед инсуфляцией СО2, 3 – через 10 минут после инсуфляции, 4 – перед десуфляцией, 5 – через 10 минут после десуфляции, 6 – через 2 часа после окончания вмешательства, 7 – через 24 часа после операции
Pict. 1. Changes in cardiac output when performing LRPE, LRPE with PLND, LA in the conditions of GETA and EA: 1 – before surgery, 2 – before insuflation СО2, 3 – 10 min after insuflation, 4 – before desuflation, 5 –10 min after desuflation, 6 –2h after surgery, 7 –24h after surgery
В группах № 1, № 3 и № 5 до начала инсуфяции СОг, в условиях общего эндотрахеального обезболивания, величина УО, по сравнению с таковой перед операцией, была статистически значимо снижена в 1,5-1,6 раз (р<0,05) в связи с депрессивным влиянием анестетиков на сократительную функцию кардиомиоцитов. После наложения карбоксиперитонеума уровень УО продолжал снижаться и перед десуфляцией был практически вдвое меньше, чем до вмешательства, что могло быть обусловлено компрессией нижней полой вены, снижением венозного возврата к правым отделам сердца и депонированием крови в сосудистой сети нижней половины туловища. Тенденция к восстановлению УО появились через 10 минут после десуфляции и продолжалась в дальнейшем. Нормализация показателя была отмечена через 24 часа после завершения вмешательства.
При проведении ЛРПЭ, ЛРПЭ в комплексе с ТЛД а также ЭВХАЭ в условиях эпидуральной анестезии ропивакином перед созданием карбоксиперитонеума УО был статистически значимо не отличался от дооперационной величины (р>0,05). После инсуфляции показатель возрастал: через 10 минут превысил исходное значение в 1,17 раз, в 1,16 раз и в 1,14 раз, перед десуфляцией- в 1,33 раза, в 1,35 раз, в 1,31 раз ( группы № 2, № 4 и № 6, соответственно). Вероятными причинами повышения ударного объема могли стать, уменьшение ОПСС за счет блокирования симпатических влияний на сосудистую стенку и расслабления ее гладкомышечных элементов, перераспределение крови в положении Тренделенбурга, увеличивающее венозный возврат. После снятия карбоксиперитонеума рост УО продолжался, но происходил медленнее, через 2 часа после окончания вмешательства значение УО в группах X» 2, Xе 4 и Хв 6 было больше такового до операции в 1,35 раз, в 1,37 раз и в 1,33 раза, соответственно. На следующие сутки ударный объем оставался повышенным по отношению к предоперационному в 0,7 раз, 0,9 раз и в 0,11 раз.
Частота сердечных сокращений в группах № 1, № 3 и Хе 5 (с применением ОЭА) в период вводного наркоза статистически значимо не отличалась от таковой до операции (70,52±3,83, 72,24±4,26 и 73,56±1,42 уд/мин, соответственно).
После наложения карбоксиперитонеума рассматриваемый показатель постепенно увеличивался и перед десуфляцией СОг составил у пациентов первой, третьей и пятой групп 86,24±5,06, 84,28±6,24 и 81,08±4,36, соответственно (р<0,05). После десуфляции ЧСС постепенно снижалась и была нормализована спустя 24 часа после завершения операции. Увеличение ЧСС в период повышенного внутрибрюшного давления весьма вероятно было связано с ишемизацией и гипоксией миокарда вследствие компрессии нижней полой вены, повлекшей за собой снижение венозного возврата, УО, МОС и диастолического давления в аорте. Лучшие результаты были получены у пациентов, перенесших рассматриваемые лапароскопические вмешательства в условиях эпидурального обезболивания: у них после создания карбоксиперитонеума и до конца вмешательства регистрировалось недостоверное постепенное уменьшение ЧСС в среднем на 5-7 мм рт.ст. (табл. 2).
Минутный объем сердца, как видно из таблицы 2 и графически иллюстрировано на рисунке 1, в условиях общего эндотрахеального обезболивания (первая, третья и пятая группы) на этапе вводного ОЭА снизился по отношению к предоперационной величине на 33%, 39% и 39%, соответственно (р<0,05) и статистически значимо оставался на том же уровне на протяжении всего периода карбоксиперитонеума. Нормализация показателя состоялась после десуфляции. В группах Хз 2, Хе 4 и Хз 6, ще применялась ЭА, после наложения карбоксиперитонеума минутный объем сердца постепенно увеличивался. В момент, предшествующий десуфляции, через 2 и 24 часа после завершения вмешательств уровень МОС у всех пациентов второй, четвертой и шестой групп превышал предоперационные результаты измерения в среднем в 1,2 раза. Динамика МОС во всех рассматриваемых группах (Хз 1 -Xе 6) была сопоставима с отмеченной выше динамикой ударного объема. Худшие изменения МОС, как функции УО, в группах Хз 1, Х« 3 и X» 5 можно объяснить сдавлением нижней полой вены, снижением венозного возврата к правому сердцу и депонированием крови в сосудистой сети нижней половины туловища в условиях карбоксиперитонеума, а также медикаментозным угнетением сократимости сердечной мышцы на фоне общего эндотрахеального обезболивания. Лучшие результаты мониторинга МОС у пациентов групп Хо 2, X» 4 и X» 6, перенесших хирургическое лечение в условиях эпидуральной анестезии связаны по-видимому со снижением ОПСС и увеличением венозного возврата к правому сердцу в положении Тренделенбурга, а также с отсутствием фармакологической супрессии сократительной активности миокарда (табл. 2, рис. 1).
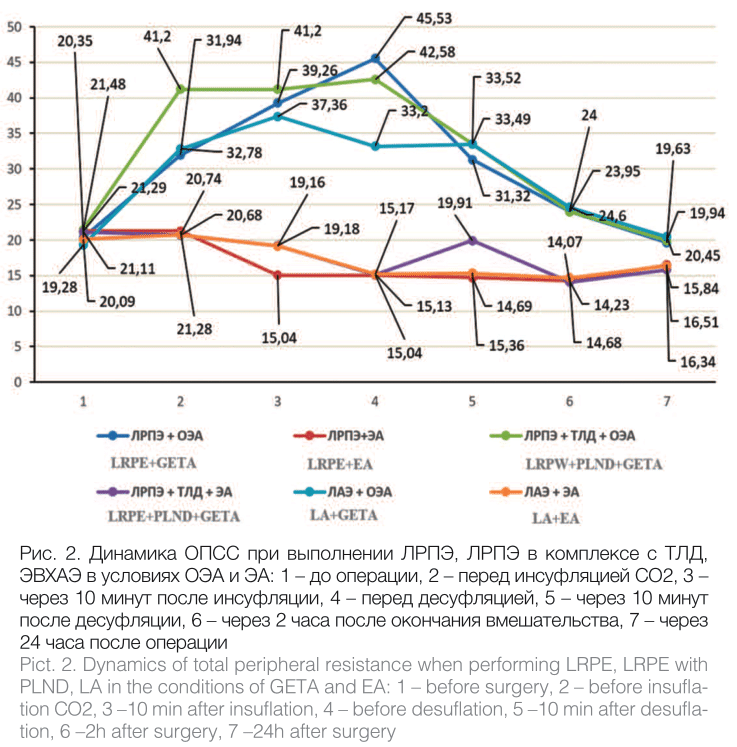
Результаты поэтапного измерения ОПСС представлены в таблице 2, динамика показателя в сравнении графически показана на рисунке 2.
Рис. 2. Динамика ОПСС при выполнении ЛРПЭ, ЛРПЭ в комплексе с ТЛД, ЭВХАЭ в условиях ОЭА и ЭА: 1 – до операции, 2 – перед инсуфляцией СО2, 3 – через 10 минут после инсуфляции, 4 – перед десуфляцией, 5 – через 10 минут после десуфляции, 6 – через 2 часа после окончания вмешательства, 7 – через 24 часа после операции
Pict. 2. Dynamics of total peripheral resistance when performing LRPE, LRPE with PLND, LA in the conditions of GETA and EA: 1 – before surgery, 2 – before insuflation СО2, 3 –10 min after insuflation, 4 – before desuflation, 5 –10 min after desuflation, 6 –2h after surgery, 7 –24h after surgery
У пациентов групп № 1, № 3 и № 5 в период вводного наркоза при использовании ЭОА уровень ОПСС увеличивался в среднем в 1,7 раз (р<0,05). В этом же временном интервале величина ОПСС в группах с эпидуральной анестезией не имела статистически значимых отличий от результатов дооперационных измерений. В период с наложенным карбоксиперитонеумом в условиях ОЭА ОПСС увеличилось в 2-2,2 раза (р<0,05), в условиях эпидурального обезболивания - снизилось в среднем в 1,4 раз (р< 0,05).
После снятия карбоксиперитонеума в группах с ОЭА величина ОПСС постепенно уменьшалась до предоперационных значений; в группах с ЭА - даже через 24 часа после вмешательства оставалась статистически значимо уменьшенной по сравнению с таковой до операции.
У лиц, перенесших ЛРПЭ, ЛРПЭ с ТЛД или ЭВХАЭ в условиях общей эндотрахеальной анестезии в период введения в наркоз отмечалось нерезко выраженное увеличение систолического АД до 133,75±4,25 мм рт.ст. (группа № 1), 135,41±4,36 мм рт.ст. (группа № 3), 130,64±3,37 мм рт.ст. (группа № 5) - в среднем, в 1,07 раз по отношению к предоперационному уровню (р<0,05). После создания карбоксиперитонеума рост САД продолжался, но происходил весьма медленно: перед десуфляцией показатель равнялся 140,29±6,33 мм рт.ст., 141,74±4,42 мм рт.ст. и 136,74±6,25 мм рт.ст. в группах № 1, № 3 и № 5, соответственно. Во время карбоксиперитонеума в значительно большей степени изменялось диастолическое АД, перед десуфляцией его величина превышала исходную в 1,32 раза (р<0,05). Учитывая отмеченное выше снижение УО и МОС, следует признать, что причиной роста ДАД в рассматриваемых условиях могло стать только повышение ОПСС вследствие активации рефлекторных сосудистых реакций в ответ на раздражение барорецепторов дуги аорты и каротидного синуса при уменьшенном УО. Применение эпидурального обезболивания ропивакином при урологических операциях позволяет сохранить уровни УО и МОС и сопровождается снижением ОПСС, что хорошо объясняет стойкую тенденцию к уменьшению систолического и диастолического АД в рассматриваемых условиях.
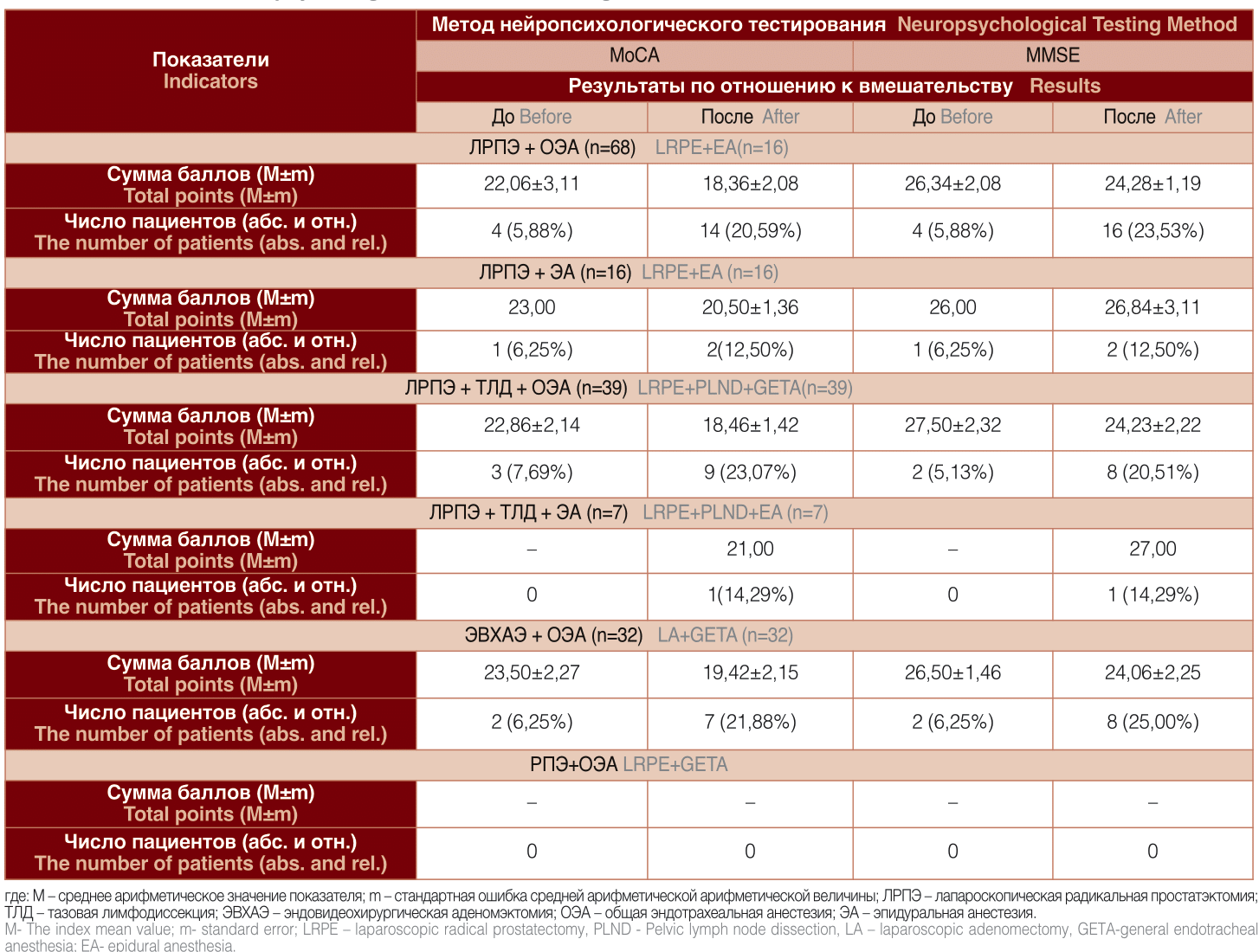
Результаты скрининг-оценки когнитивной функции за 24-72 часа до вмешательства и через 5-7 суток после него отражены в таблице 3.
Предоперационное тестирование выявило умеренные когнитивные нарушения (сумма баллов по МоСА равнялась 22-23,50, по MMSE - 26-27,50) примерно у 5- 8% пациентов, готовящихся к лапароскопической радикальной простатэктомии в условиях ОЭА или ЭА, ЛРПЭ с ТЛД в условиях ОЭА и эндовидеохирургическая аденомэктомии под общей эндотрахеальной анестезией (группы №1, №2, №3 и №5, соответственно). Среди участников исследования из групп №4 и №6 случаев с исходным когнитивным дефицитом выявлено не было, что может быть прежде всего связано с малым объемом выборок (п4=7 и п6=4). В группах, где применялась ОЭА, через 5-7 дней после операций признаки умеренной ПОКД с показателями МоСА и MMSE, равными 18,36- 19,42 и 24,06-24,26, соответственно, были отмечены у 23,53% больных, перенесших ЛРПЭ, у 23,07% пациентов после ЛРПЭ с тазовой лимфодиссекцией и у 25,00% лиц после лапароскопической аденомэктомии. После вмешательств, выполненных в условиях эпидуральной анестезии, регистрировалось меньшее число случаев ПОКД - 12,50% в группе №2 (ЛРПЭ) и 14,29% в группе №4 (ЛРПЭ с ТЛД). Выраженность когнитивных нарушений также была ниже, чем в группах сравнения.
Таблица 3. Результаты нейропсихологической оценки когнитивного статуса
Table 3. Results of a neuropsychological assessment of cognitive status
ЗАКЛЮЧЕНИЕ
При выполнении в условиях общей эндотрахеальной анестезии лапароскопической радикальной простатэктомии, в том числе в комплексе с тазовой лимфодиссекцией, при хирургическом лечении рака предстательной железы в стадиях T1-2N0M0 - T3a-3bN0-lM0, лапароскопической аденомэктомии при хирургическом лечении ДГПЖ ключевым негативным следствием общего эндотрахеального обезболивания и карбоксиперитонеума является снижение ударного и минутного объемов сердца. В результате активации срочных прессорных компенсаторных механизмов (рефлекторных сосудистых реакций) к снижению ударного объема присоединяются рост общего периферического сопротивления резистивных сосудов и подъем артериального давления, в большей степени диастолического. Таким образом, в условиях общего эндотрахеального обезболивания и карбоксиперитонеума формируются предпосылки для развития перегрузки давлением и недостаточности левого желудочка, а также ишемического повреждения миокарда, первым признаком которого становиться увеличение частоты сердечных сокращений.
Отмеченные выше гемодинамические сдвиги, ассоциированные с применением общего эндотрахеального обезболивания и карбоксиперитонеума могут послужить причинами циркуляторной гипоксии мозговой ткани и внутрисосудистых нарушений церебральной микроциркуляции, повышающих вероятность формирования ПОКД. Нейротоксическое действие общих анестетиков и продуктов их деградации остается одним из важнейших факторов риска послеоперационного когнитивного дефицита.
Применение эпидуральной анестезии в рассматриваемых ситуациях позволяет увеличить степень безопасности хирургических вмешательств в урологии за счет, во-первых, предупреждения отмеченных нарушений центральной гемодинамики вследствие блокирования вегетативных влияний на сосудистые стенки, уменьшения ОПСС и повышения венозного возврата к правым отделам сердца, отсутствия фармакологической супрессии сократительной способности миокарда, во-вторых - снижения вероятности возникновения послеоперационной когнитивной дисфункции в условиях стабильной гемодинамики и отсутствия нейротоксического воздействия общих анестетиков.
ЛИТЕРАТУРА
- Урология. Российские клинические рекомендации [под ред. Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря]. М.: ГЭОТАР-Медиа, 2015. 480 с. [Urology. Russian clinical guidelines [edit. Yu.G. Alyaev, P.V. Glyibochko, D. Yu. Pushkar]. M.: GEOTARMedia. 2017. 544 p. (In Russian)].
- Павлова Т.В., Бессмертный Д.В., Павлов И.А. Рак предстательной железы как междисциплинарная проблема (обзор литературы и собственных исследований). Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация 2012; 22 (141):93-95. [Pavlova T.V., Bessmertnyiy D.V., Pavlov I.A.Prostate cancer as an interdisciplinary problem (review of literature and own research). Nauchnyie vedomosti BelGU. Seriya: Meditsina. Farmatsiya = Scientific reports of the Belgorod State University. Series: Medicine. Pharmacy 2012;22(141):93-95. (In Russian)].
- Шайдуллин Р.М., Ситдыков Р.Н., Зубков А.Ю., Ситдыкова М.Э. Клинико-экономическое обоснование преимуществ аденомэктомии в лечении аденомы предстательной железы. Практическая медицина 2013; 1-4 (73):126-129. [Shaydullin R.M., Sitdyikov R.N., Zubkov A.Yu., Sitdyikova M.E. Clinical and economic rationale for the benefits of adenomectomy in the treatment of prostate adenoma. Prakticheskaya meditsina = Practical medicine 2013;1-4 (73):126-129. (In Russian)]
- Байтингер В.Ф. Эндоскопическая хирургия. Вопросы реконструктивной и пластической хирургии 2010;2(33):43-46. [Baytinger V.F. Endoscopic surgery. Voprosy rekonstruktivnoy i plasticheskoy khirurgii = Reconstructive and plastic surgery issues 2010;2(33):43-46. (In Russian)].
- Хубутия М.Ш., Ермолов А.С., Ярцев П.А., Гуляев А.А., Самсонов В.Т., Левитский В.Д. и др. Развитие лапароскопической хирургии в НИИ СП им. Н. В. Cклифосовского. Неотложная медицинская помощь 2016;(4):48-55. [Khubutiya M.Sh., Yermolov A.S., Yartsev P.A., Gulyayev A.A., Samsonov V.T., Levitskiy V.D. et al. The development of laparoscopic surgery at the N.V. Sklifosovsky Research Institute for Emergency Medicine. Neotlozhnaya meditsinskaya pomoshch' = Emergency medical care 2016;(4):48-55. (In Russian)].
- Jackson TD1, Wannares JJ, Lancaster RT, Rattner DW, Hutter MM. Does speed matter? The impact of operative time on outcome in laparoscopic surgery. Surg Endosc 2011;(2):13-14. doi: 10.1007/s00464-010-1550-8.
- Голубев А.А., Зуева В.А., Еремеев А.Г., Шпак Л.В., Кононова А.Г. Характер изменений вегетативной регуляции по вариабельности сердечного ритма при лапароскопических оперативных вмешательствах с использованием напряженного карбоксиперитонеума. Хирургическая практика 2013;(3): 39-47. [Golubev A.A., Zuyeva V.A., Yeremeyev A.G., Shpak L.V., Kononova A.G. e nature of the changes of autonomic regulation on heartrate variability in laparoscopic operative interventions using a busy carboxyperitoneum. Khirurgicheskaya praktika = Surgical practice 2013;(3):39-47. (In Russian)]
- Голубев А.А., Еремеев А. Г., Артемов В.В., Артемов В.В., Ситкин С.И., Кононова А.Г., Баранова В.А. О негативных эффектах карбоксиперитонеума. 2017. URL: https://efamedica.ru/learning/articles/o_negativnykh_effektakh_karboksiperi toneuma/.[Golubev A.A., Yeremeyev A. G., Artemov V.V., Artemov V.V., Sitkin S.I., Kononova A.G., Baranova V.A. On the negative effects of carboxyperitoneum. 2017.URL: https://efamedica.ru/learning/articles/o_negativnykh_effektakh_ karboksiperi toneuma/. (In Russian)].
- Коган М.И., Лоран О.Б., Петров С.Б.Радикальная хирургия рака предстательной железы. ГЭОТАР-Медиа, 2006., 352 с. [Kogan M.I., Loran O.B., Petrov S.B. Radical surgery of prostate cancer. GEOTAR-Media, 2006., 352 p. (In Russian)].
- Алексеев Б.Я., Каприн А.Д., Матвеев В.Б., Нюшко К.М. Клинические рекомендации по диагностике и лечению рака предстательной железы. M., 2014., 44 с. [Alekseyev B.YA., Kaprin A.D., Matveyev V.B., Nyushko K.M. Clinical recommendations for the diagnosis and treatment of prostate cancer. Moskva, 2014., 44 p. (In Russian)].
- Шадус В.С., Доброносова М.В., Григорьев Е.В. Ингаляционная анестезия – преимущества и недостатки. Сибирский медицинский журнал 2014;(5):5-9 [Shadus V.S., Dobronosova M.V., Grigor'yev Ye.V. Inhalation anesthesia – advantages and disadvantages. Sibirskiy meditsinskiy zhurnal = Siberian medical journal 2014;(5):5-9. (In Russian)].
- Аляев Ю.Г., Глыбочко П.В., Пушкарь Д.Ю. Урология. Российские клинические рекомендации. М.: ГЭОТАР Медиа, 2016., 496 с. [Alyayev Yu.G., Glybochko P.V., Pushkar' D.Yu. Urologiya. Rossiyskiye klinicheskiye rekomendatsii. [Urology. Russian clinical recommendations. M.: GEOTAR-Media, 2016., 496 p. (In Russian].
- Клинические рекомендации. Рак предстательной железы МКБ 10: C61 2018., 72 с. URL:http://www.oncology.ru/association/clinicalguidelines/2018/ rak_predstatelnoy_zhelezy_pr2018.pdf [Clinical recommendations. Prostate Cancer ICD 10:C61. 2018., 72 p. URL:http://www.oncology.ru/association/clinicalguidelines/2018/ rak_predstatelnoy_zhelezy_pr2018.pdf. (In Russian)]
- Овечкин А.М., Яворовский А.Г. Безопиоидная аналгезия в хирургии: от теории к практике: руководство для врачей. М.: ГЭОТАР-Медиа, 2019., 240 с. [Ovechkin A.M., Yavorovskiy A.G. Non-opioid analgesia in surgery: from theory to practice: a guide for doctors. M.: GEOTAR-Media, 2019, 240 p. (In Russian)].
- Шнайдер Н.А., Салмина А.Б. Неврологические осложнения общей хирургии. 2- е издание (переработанное и дополненное). М., Медика, 2009, 280 с. [Shnayder N.A., Salmina A.B.Neurological complications of general surgery. 2nd edition (revised and enlarged)]. M., Medika, 2009, 280 p. (In Russian)].
- Усенко Л.В., Полинчук И.С. Когнитивные нарушения после общей анестезии при экстракардиальных вмешательствах и эффект раннего введения тиоцетама в послеоперационном периоде. Международный неврологический журнал 2011;6 (44): 65-69. [Usenko L.V., Polinchuk I.S. Cognitive impairment after general anesthesia with extracardiac interventions and the effect of early administration of thiocetam in the postoperative period. Mezhdunarodnyy nevrologicheskiy zhurnal = International Neurological Journal 2011;6(44): 65-69. (In Russian)].
- Волков А.О., Клигуненко Е.Н., Ветошка И.А. Когнитивная дисфункция после оперативного родоразрешения в зависимости от вариантов анестезии. Фундаментальные исследования 2014;4 (ч.3). C. 472-478. [Volkov A.O., Kligunenko Ye.N., Vetoshka I.A. Cognitive dysfunction after surgical delivery, depending on the options for anesthesia. Basic research. 2014;4 (ch.3). P. 472-478. (In Russian)].
- Fontes MT, Swift RC, Phillips-Bute B, Podgoreanu MV, Stafford-Smith M, Newman MF, et al. Neurologic Outcome Research Group of the Duke Heart Center. Predictors of cognitive recovery after cardiac surgery. Anesth Analg 2013 Feb;116(2):435-42. doi: 10.1213/ANE.0b013e318273f37e
- Rasmussen LS, Johnson T, Kuipers HM, Kristensen D, Siersma VD, Vila P, et al. Does anesthesia cause postoperative cognitive dysfunction? A randomized study of regional versus general anesthesia in 438 elderly patients. Acta Anaesthesiol Scand 2003;47(9):260-6. doi: 10.1034/j.1399-6576.2003.00057.x
- Усенко Л.В., Ризк Шади Эйд, Криштафор А.А., Канюка Г.С. Профилактика и коррекция послеоперационных когнитивных дисфункций у больных пожилого возраста. Международный неврологический журнал 2008.;3(19):99-110. [Usenko L.V., Rizk Shadi Eyd, Krishtafor A.A., Kanyuka G.S. Prevention and correction of postoperative cognitive dysfunctions in elderly patients. Mezhdunarodnyy nevrologicheskiy zhurnal = International Neurological Journal 2008.;3(19):99-110. (In Russian)].
- Большедворов Р.В.,Кичин В.В.,ФедоровС.А.,Лихванцев В.В.Эпидемиология послеоперационных когнитивных расстройств. Анестезия и реанимация 2009;(3): 20-23. [Bol'shedvorov R.V., Kichin V.V., Fedorov S.A., Likhvantsev V.V. Epidemiology of postoperative cognitive impairment. Anesteziya i reanimatsiya = Anesthesia and resuscitation 2009;(3):20-23.
- Шнайдер Н.А., Салмина А.Б. Биохимические и молекулярные механизмы патогенеза послеоперационной когнитивной дисфункции. Неврологический журнал 2007;12(2):41-47. [Shnayder N.A., Salmina A.B. Biochemical and molecular mechanisms of the pathogenesis of postoperative cognitive dysfunction. Nevrologicheskiy zhurnal = Neurological Journal 2007;12(2):41-47. (In Russian)].
- Усенко Л.В., Криштафор А.А., Полинчук И.С. Послеоперационные когнитивные расстройства как осложнения общей анестезии. Значение ранней фармакологической нейропротекции. Медицина неотложных состояний 2015;2(65): 24-31. [Usenko L.V., Krishtafor A.A., Polinchuk I.S. Postoperative cognitive impairment as a complication of general anesthesia. The importance of early pharmacological neuroprotection. Meditsina neotlozhnykh sostoyaniy = Emergency Medicine 2015;2(65): 24- 31.(In Russian)].
- Клигуненко Е.Н., Дзяк Л.А., Площенко Ю.А. Нейропротекция в анестезиологии и интенсивной терапии (методические рекомендации). – Дніпропетровськ, 2008., 43 с. [Kligunenko Ye.N., Dzyak L.A., Ploshchenko Yu.A. Neuroprotection in anesthesiology and intensive care (guidelines)]. – Dnipropetrovs'k, 2008., 43 p. (In Russian)}
- Yin C, Gou LS, Liu Y. Repeated administration of propofol upregulated the expression of c-Fos and cleaved-caspase-3 proteins in the developing mouse brain. Indian J Pharmacol 2011; 43(6); 648-651. doi: 10.4103/0253-7613.89819.
- Vacas S, Degos V, Feng X, Maze M. The neuroinflammatory response of postoperative cognitive decline. Br Med Bull 2013;(106): 161-178. doi: 10.1093/bmb/ldt006.
- Rundshagen I. Postoperative cognitive dysfunction. Dtsch. Arztebl. Int 2014;111(8): 119-125. doi: 10.3238/arztebl.2014.0119
- Nielson W.R., Gelb A.W., Casey J.E., Penny F.J., Merchant R.N., Manninen P.H. Longterm cognitive and social sequelae of general versus regional anesthesia during arthroplasty in the elderly. Anesthesiology 1990;6(73): 1103–1109.
- Williams-Russo P, Sharrock NE, Mattis S, Szatrowski TP, Charlson ME. Cognitive effects after epidural vs general anesthesia in older adults. A randomized trial. JAMA 1995;1(274):44-50.
- Evered L., Scott D.A., Silbert B., Maruff P. Postoperative cognitive dysfunction is independent of type of surgery and anesthetic. Anesth Analg 2011;5(112):1179-1185. doi: 10.1213/ANE.0b013e318215217e
- Осипов Е.В., Гельпей М.А., Батюшин М.М. Изучение выраженности когнитивных расстройств у пациентов с артериальной гипертензией. Международный журнал прикладных и фундаментальных исследований 2015;(8): 254–258. [Osipov Ye.V., Gel'pey M.A., Batyushin M.M. Study of the severity of cognitive impairment in patients with arterial hypertension. Mezhdunarodnyy zhurnal prikladnykh i fundamental'nykh Issledovaniy = International Journal of Applied and Basic Research. 2015;(8): 254–258. (In Russian)].
- Политов М.Е., ШтайнмецА.А.,Красносельский М.Я., БастрикинС.Ю., Буланова Е.Л., Овечкин А.М. Сравнительный анализ методов оценки когнитивной дисфункции в периоперационном периоде у пациентов пожилого возраста после эндопротезирования тазобедренного и коленного суставов. Российский медицинский журнал 2015;(3):20-25. [Politov M.Ye., Shtaynmets A.A., Krasnosel'skiy M.YA., Bastrikin S.YU., Bulanova Ye.L., OvechkinA.M.Comparative analysis of methodsfor assessing cognitive dysfunction in the perioperative period in elderly patients aer hip and knee arthroplasty. Rossiyskiy meditsinskiy zhurnal = Russian medical journal 2015;(3)20-25. (In Russian)].
- Новицкая-Усенко Л.В. Послеоперационная когнитивная дисфункция в практике врача-анестезиолога. Медицина неотложных состояний 2017;4(83):9-15.[NovitskayaUsenko L.V. Postoperative cognitive dysfunction in the practice of an anesthetist. Meditsina neotlozhnykh sostoyaniy = Emergency Medicine 2017;4 (83):9-15. (In Russian)].
- Трубникова О.А., Каган Е.С., Куприянова Т.В. Нейропсихологический статус пациентов со стабильной ишемической болезнью сердца и факторы, на него влияющие. Комплексные проблемы сердечно-сосудистых заболеваний 2017;(1):112–121. [Trubnikova O.A., Kagan Ye.S., Kupriyanova T.V. Neuropsychological status of patients with stable coronary heart disease and factors influencing it. Kompleksnyye problemy serdechno-sosudistykh zabolevaniy = Complex problems of cardiovascular diseases 2017;(1):112–121.
- Субботина А.В., Гржибовский А. М. Описательная статистика и проверка нормальности распределения количественных данных. Экология человека 2014;(2):51-57. [Subbotina A.V., Grzhibovskiy A.M. Descriptive statistics and verification of the normality of the distribution of quantitative data. Ekologiya cheloveka = Human ecology 2014;(2):51-57. (In Russian)].







