ВВЕДЕНИЕ
Острое повреждение почек (ОПП) с развитием острой почечной недостаточности (ОПН) является серьезным и часто жизнеугрожающим осложнением хирургических операций, тяжелых инфекционных осложнений или интоксикаций [1-3]. Повреждение почек может быть необратимым или функция органа может полностью или частично восстановиться в зависимости от интенсивности повреждающего фактора и возможности регенерации поврежденных клеточных структур. Основными факторами, влияющими на полноту восстановления функции поврежденных почек, считается стойкое ухудшение микроциркуляции с развитием тканевой гипоксии и дисфункцией митохондрий, ведущие как к повреждению клубочков, так и канальцевого аппарата почки, а также остановка клеточного цикла и старение эпителиальных клеток почечных канальцев с изменением фенотипов и функций резидентных клеток почек, что приводит к уменьшению регенераторного потенциала клеток и усилению их апоптоза, приводящих развитию фиброза почек [3-6].
Восстановление функции почек при ОПН приобретает все большее значение, поскольку мероприятия по профилактике или лечению ОПП ограничены [7]. По мнению S. Kumar и соавт. ключевым фактором терапии ОПП является разработка стратегии усиления эндогенных процессов восстановления поврежденных почечных структур и замедления профибротических реакций, развивающихся в результате неэффективной регенераци клеток [8]. В этом плане перспективным направлением является использование клеточных технологий с трансплантацией низкодифференцированных стволовых/прогениторных клеток (СК), выделенных из различных источников (костного мозга, жировой ткани, пульпы зуба, пупочного канатика, амниотической жидкости), или введением продуктов их секреции. (так называемая бесклеточная терапия), основой которой является применение комплекса биоактивных продуктов секреции СК (секретома СК – СЭСК), изготовленных на основе кондиционированной среды культивирования СК или экстракта из эмбриональных или плодных тканей [3, 9-13]. Показано, что содержащиеся в СЭСК белки, пептиды, РНК, в том числе микроРНК и липидные медиаторы возможно выделять, концентрировать, замораживать и лиофилизировать без потери их биологической активности [12, 14].
Данные литературы свидетельствуют, что такая терапия способствует уменьшению выраженности функциональных расстройств и ускорению восстановления функциональной полноценности почек после их ишемического или токсического повреждения [3, 15-18]. При этом многие авторы отмечают, что нефропротективное действие такой терапии связано как с активацией сигнальных путей, способствующих регенерации клеток, так и с ингибированием апоптоза поврежденных клеток [9, 16, 19-23].
К такому типу препаратов относится препарат Целлекс® (AO «Фарм-Синтез», Россия), являющийся хроматографически выделенным белково-пептидным комплексом эмбриональной ткани головного мозга свиней. В ранее проведенных исследованиях нами было показано, что терапия крыс с острой постишемической ОПН препаратом Целлекс уменьшает выраженность функциональных расстройств и морфологических нарушений после ишемического повреждения почки разной степени выраженности [24]. Как при умеренно выраженной, так и при резко выраженной ОПН, которая вызывалась ишемией единственной почки в течение 60 или 90 минут соответственно, терапия СЭСК способствовала сохранению величины клубочковой фильтрации и канальцевой реабсорбции натрия и кальция на нормальном или субнормальном уровне, что было особенно выражено на ранних сроках после развития ишемического повреждения (3 суток) и при более тяжелой ОПН.
Данное исследование посвящено изучению вопроса, связано ли терапевтическое действие СЭСК с его влиянием на активность регенерации поврежденных в результате ишемии клеток и их апоптоза, как основных потенциальных механизмов репаративной регенерации.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на 40 самцах белых беспородных крыс массой 280-320 г. Наркоз осуществляли внутрибрюшинным введении смеси препаратов Золетил и Ксилавет в соотношении 1:1 при расчетной дозе Золетила 15 мг/кг. Постишемическую ОПН разной степени выраженности вызывали удалением правой почки и пережатием сосудистой ножки левой почки на 60 минут (умеренная ОПН) или 90 минут (тяжелая ОПН), как описано ранее [24]. В контрольных опытах (1-я и 2-я серии соответственно, по 10 крыс в серии) терапии не проводили, а в опытных сериях (3-я и 4-я серии соответственно, по 10 крыс в серии) ежедневно вводили препарат СЭСК подкожно в дозе 0,1 мл/кг массы тела (0,1 мг/кг активного вещества) 5 дней в неделю, всего 10 инъекций.
Через 3, 7 и 14 дней удаляли ишемизированную почку и исследовали гистологически и путем проведения гистохимического анализа. Для оценки выраженности морфологических изменений изготовленные по стандартной методике срезы почки окрашивали гематоксилином и эозином. Для количественной оценки морфометрических показателей использовали программу HistoScan. Оцифрованные изображения загружали в программу с последующим количественным определением диаметра клубочков. К гипертрофированным клубочкам относили те клубочки диаметр которых превышал максимальные значения, характерные для интактной почки. В качестве маркера активности клеточной регенерации использовали выраженность экспрессии фактора Ki-67, а маркером активности процессов апоптоза служила экспрессия антиапоптотического фактора Bcl-2, определяемых иммуно-гистохимически на автоматическом иммуногистостейнере Ventana Ultra. Использовали моноклональные антитела, готовые к употреблению (RTU) к Ki-67 (клон SP66, фирмы Roche) и к Bcl-2 (клон 30-9, фирмы Roche).
Статистическую обработку цифровых данных проводили с помощью программ MS Exel и Statistica 6.0. Определяли средние значения показателей в группах и ошибку средней (М±m), для определения достоверности различий между группами использовали критерий Стьюдента. Различия считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ
Морфометрический анализ гистологических срезов показал, что в опытах с терапией СЭСК уже на 3-и сутки после ишемического воздействия разной степени выраженности (60 или 90 минут) выявляли до 20% гипертрофированных клубочков от общего количества клубочков в препарате) (рис. 1А), тогда как в контрольных сериях при этом сроке исследования их не выявляли (рис. 1Б, В). При увеличении срока наблюдения до 7 и 14 суток в опытах с 60-минутной ишемией различия между опытной и контрольной сериями исчезали, тогда как в опытах с тяжелой ОПН (90 минутная ишемия) доля гипертрофированных клубочков в опытной серии постоянно превышала значения контрольной группы опытов.
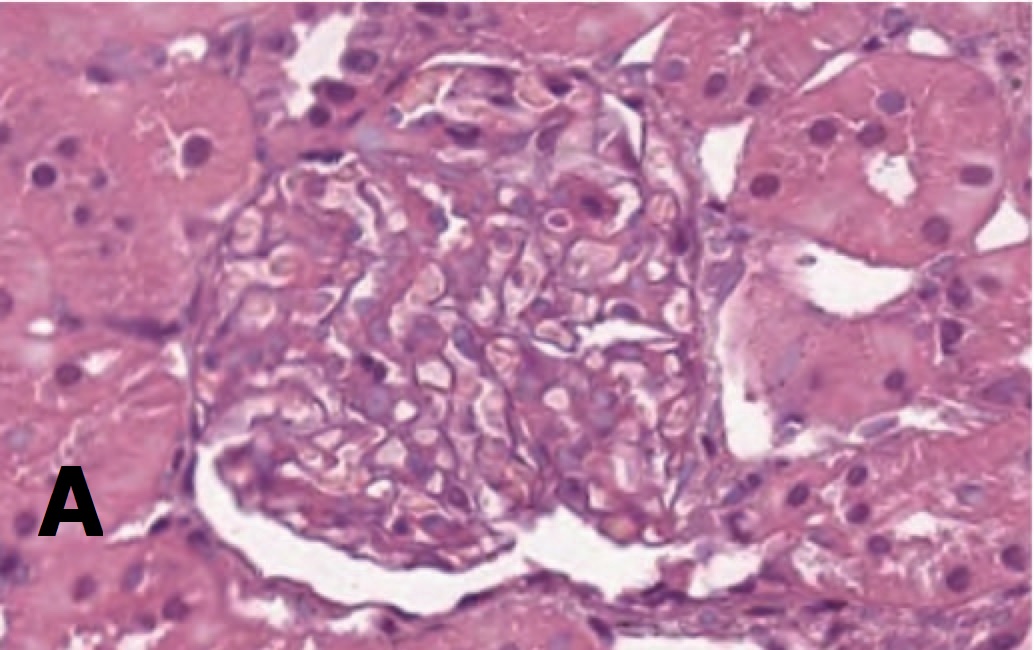
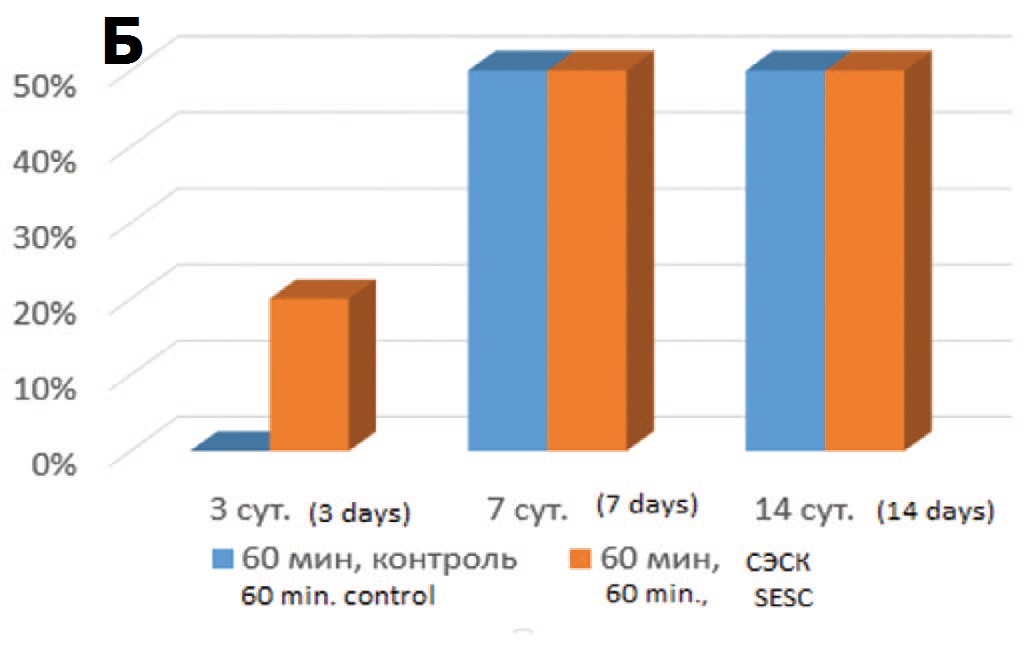
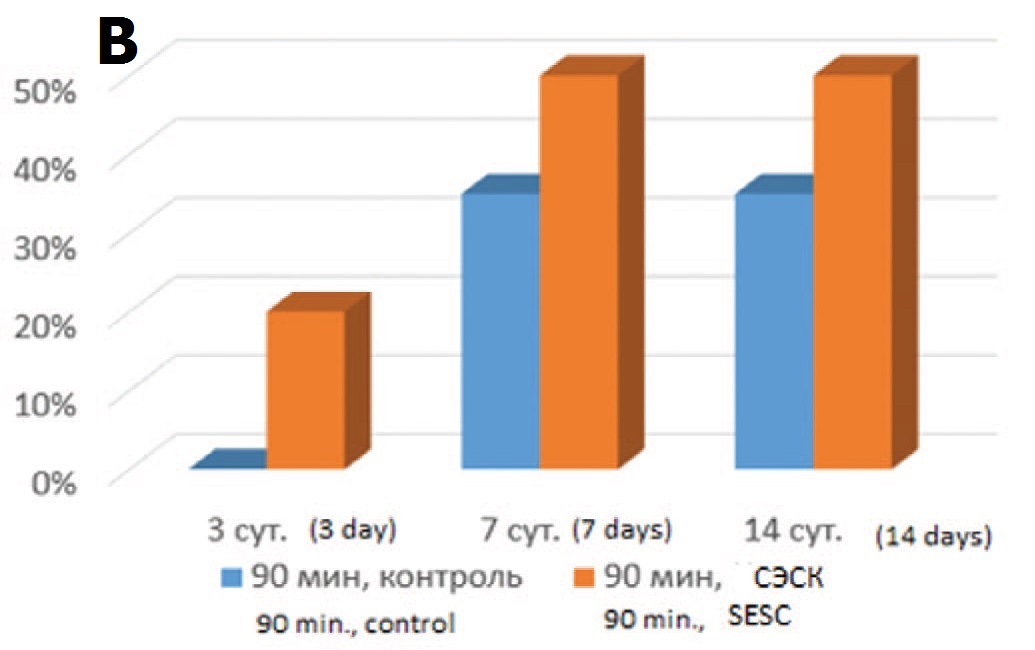
Рис. 1. А – гипертрофированный клубочек. 3 суток после 60-минутной ишемии, терапия СЭСК. Окраска гематоксилином и эозином. х 200. Б – влияние терапии СЭСК на долю гипертрофированных клубочков (% в препарате) в опытах с 60- минутной ишемией. В – влияние терапии СЭСК на долю гипертрофированных клубочков (% в прпарате) в опытах с 90-минутной ишемией
Fig. 1. A – hypertrophied glomerulus. 3 days after 60-minute ischemia, SESC ther- apy. H&E x 200. Б – the effect of SESC therapy on the proportion of hypertrophied glomeruli (% in the preparation) in experiments with 60-minute ischemia. В – the ef- fect of SESC therapy on the proportion of hypertrophied glomeruli (% in the preparation) in experiments with 90-minute ischemia
В то же время резко измененные клубочки с явлениями гломерулосклероза (рис. 2А) в опытах с терапией СЭСК в ранние сроки (3 суток) после 60-минутной ишемии не выявлялись, а после 90 минутой ишемии составляли всего 5%, тогда как в контрольных сериях их доля составляла 5% и 10% соответственно (рис. 2Б, В). В более отдаленные сроки различия между опытными и контрольными сериями сохранялись с преобладанием развития гломерулосклероза в обеих контрольных сериях. Более того, в опытах с 60-минутной ишемией и терапией СЭСК через 14 суток отмечали уменьшение доли клубочков с явлениями гломерулосклероза до минимальных значений, а при более тяжелой ОПН (90 минутная ишемия) их доля с увеличением срока наблюдения оставалась стабильной, составляя 5%, тогда как в контрольных опытах через 7 суток доля поврежденных клубочков возрастала до 10-15% и сохранялась на этом уровне до 14 суток.
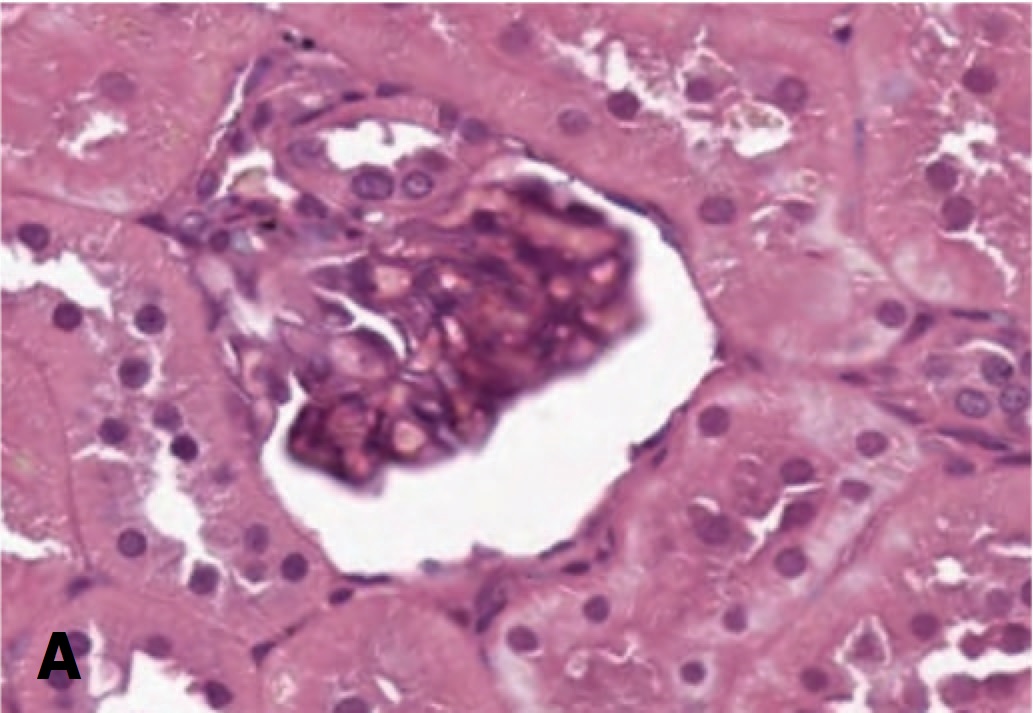
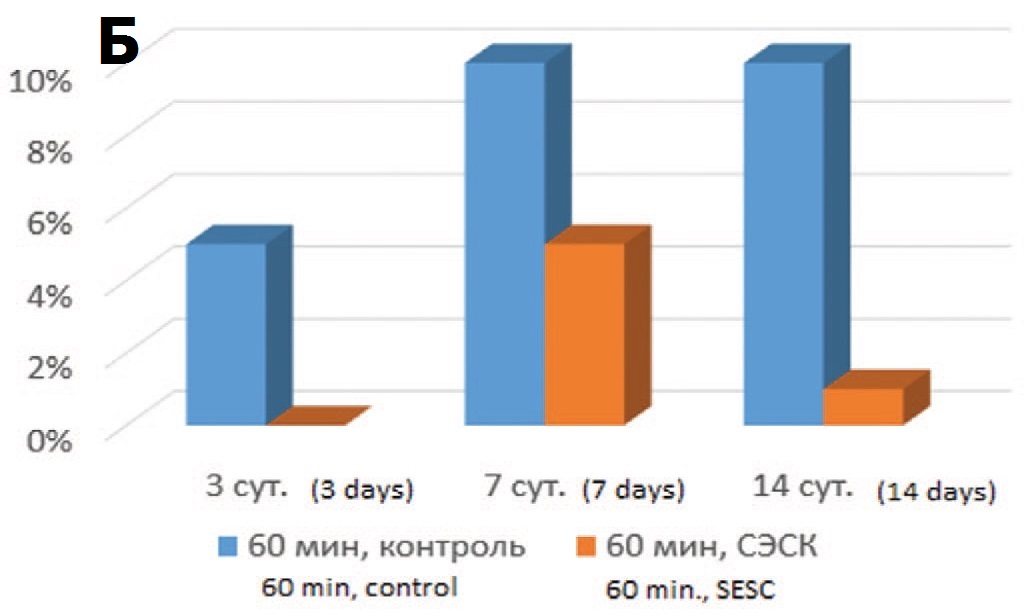
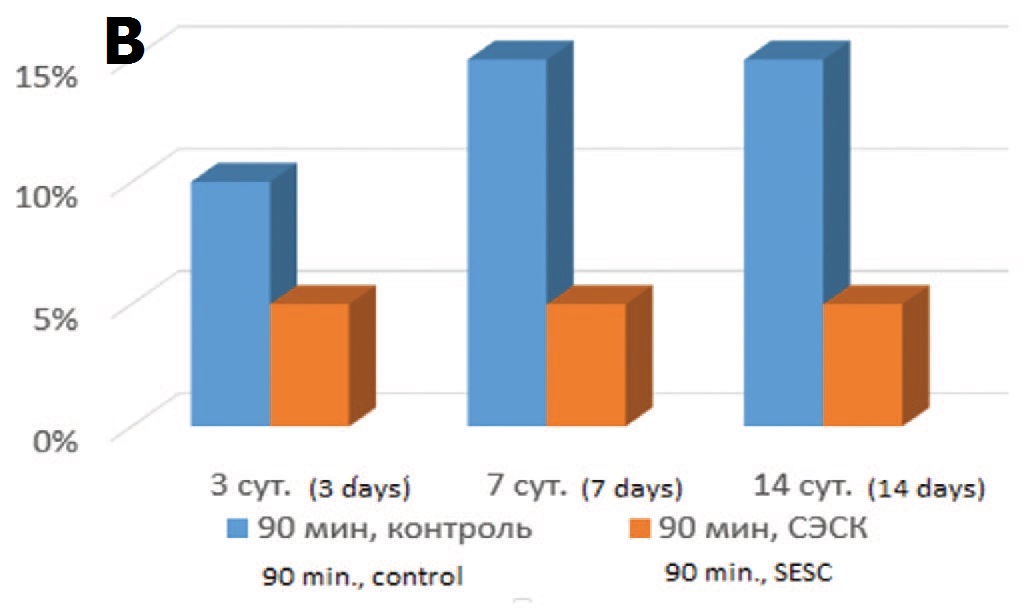
Рис. 2. А – Коллабированный клубочек с явлениями гломерулосклероза. 3 суток после 60-минутной ишемии, контрольная серия. Окраска гематоксили- ном и эозином. Ув. 200х. Б – влияние терапии СЭСК на долю клубочков с гло- мерулосклерозом (% в препарате) в опытах с 60-минутной ишемией. В – влияние терапии СЭСК на долю клубочков с гломерулосклерозом (% в препарате) в опытах с 90-минутной ишемией
Fig. 2. A – A collabated glomerulus with the phenomena of glomerulosclerosis. 3 days after 60-minute ischemia, control series. H&E x 200. Б – the effect of SESC therapy on the proportion of glomeruli with glomerulosclerosis (% in the preparation) in experiments with 60-minute ischemia. В – the effect of SESC therapy on the pro- portion of glomeruli with glomerulosclerosis (% in the preparation) in experiments with 90-minute ischemia
Терапия СЭСК способствовала также уменьшению степени повреждения почечных канальцев. В обеих контрольных сериях наблюдалась массивная гиалиново-капельная дистрофия эпителия почечных канальцев (в 40-45% канальцев) с полным некрозом эпителиальной выстилки в 5% канальцев при 60-минутой ишемии и 15% канальцев при 90-минутой ишемии (рис. 3А). В обеих опытных сериях доля канальцев с некротизированным эпителием была меньше при всех сроках наблюдения, хотя различия через 14 суток после ишемического воздействия сглаживались (рис. 3Б, В).
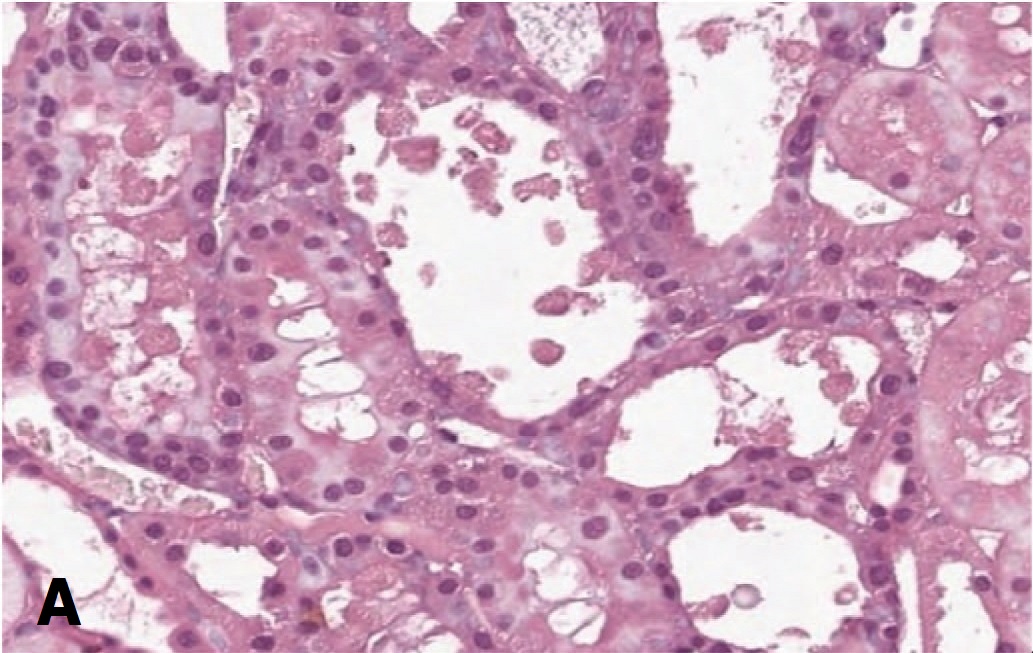
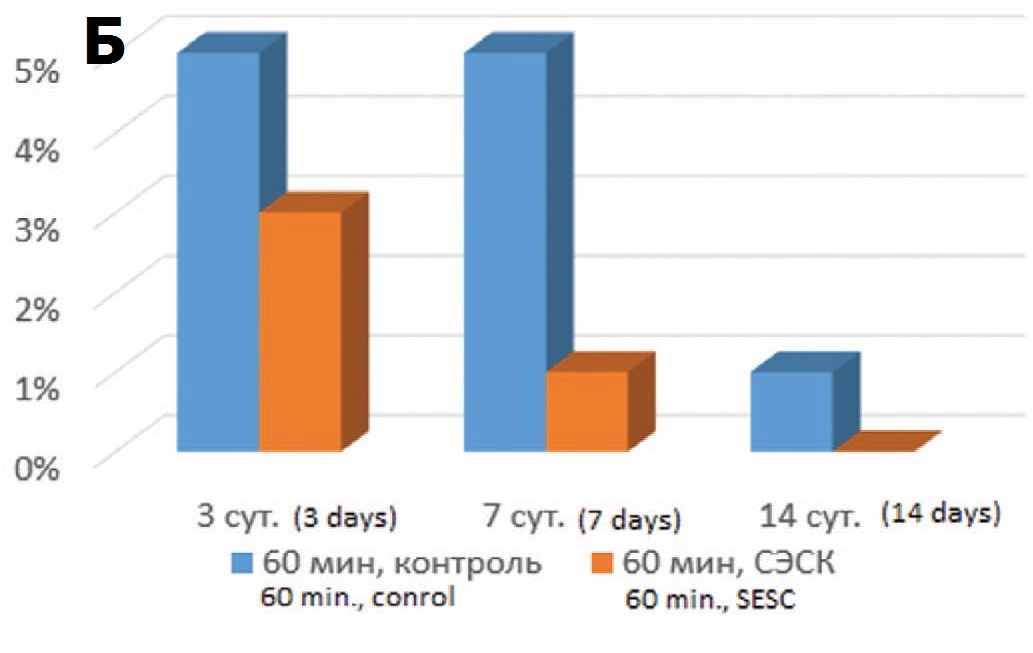
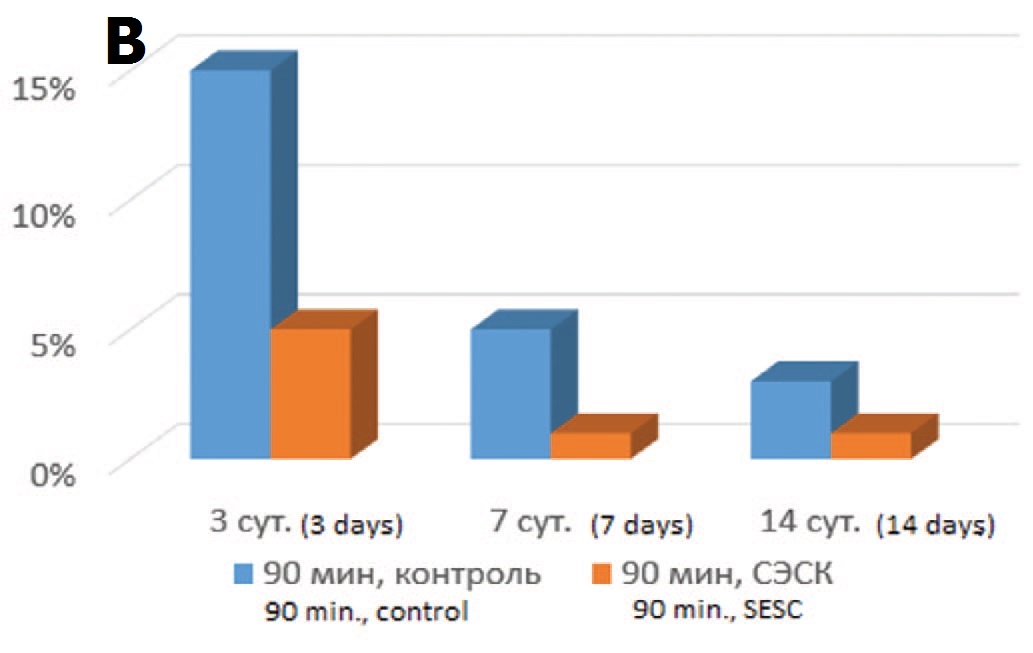
Рис. 3. А – почечные канальцы в состоянии резко выраженной дистрофии и некроза эпителия. 3 суток после 90-минутной ишемии, контроль. Окраска гематоксилином и эозином. Ув. 200х. Б – влияние терапии СЭСК на долю нек- ротизированных почечных канальцев в опытах с 60-минутной ишемией. В – влияние терапии СЭСК на долю некротизированных почечных канальцев при 90-минутной ишемии
Fig. 3. A – renal tubules in a state of pronounced dystrophy and necrosis of the epithelium. 3 days after 90-minute ischemia, control. H&E x 200. Б – the effect of SESC therapy on the proportion of necrotized renal tubules in experiments with 60- minute ischemia. В – the effect of SESC therapy on the proportion of necrotized renal tubules in 90-minute ischemia
Из этих данных можно заключить, что терапевтическое действие СЭСК в отношении уменьшения повреждения почечных клубочков и почечных канальцев реализуется преимущественно на ранних стадиях репаративного процесса, способствуя регенерации почечных структур и уменьшению склеротических процессов.
Для подтверждения способности СЭСК активировать регенерацию клеток почки мы изучили влияние препарата на экспрессию маркера клеточной пролиферации Ki-67 в структурах почки при разной выраженности ишемического повреждения. Исследование показало, что если в норме экспрессия этого маркера выявляется лишь в ядрах единичных эпителиальных клеток почечных канальцев, то после ишемического воздействия 60-минутной длительности в условиях терапии СЭСК количество клеток, экспрессирующих Ki-67, через 3 суток возрастает (рис. 4А), но через 7 и 14 дней экспрессия Ki-67 в ядрах клеток практически исчезает (рис. 4В). В контрольной серии выявляется обратная динамика – через 3 суток экспрессия Ki-67 выявляется в ядрах единичных клеток, (рис. 4Б), а через 7 и 14 дней количество клеток, экспрессирующих этот маркер, возрастает (рис. 4Г). В почечных клубочках в обеих сериях меченые клетки практически не выявлялись.
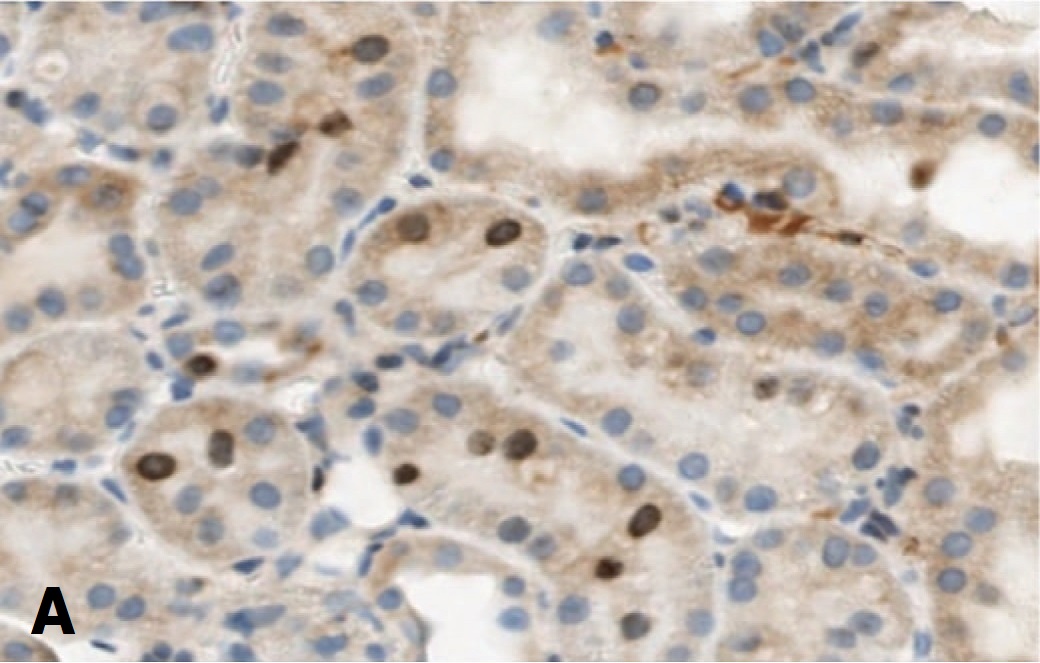
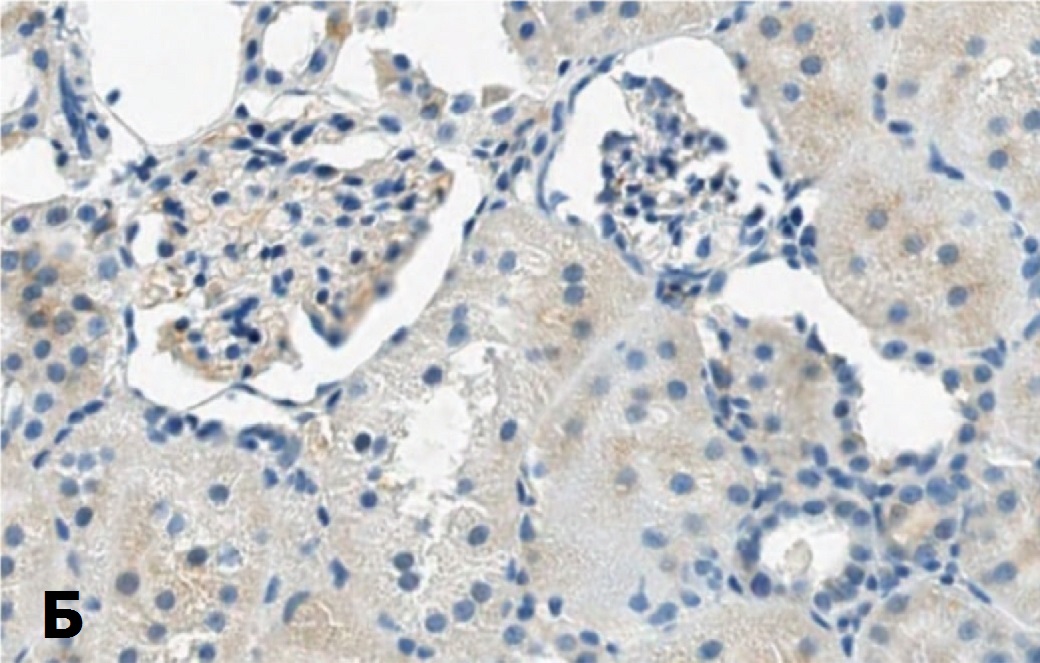
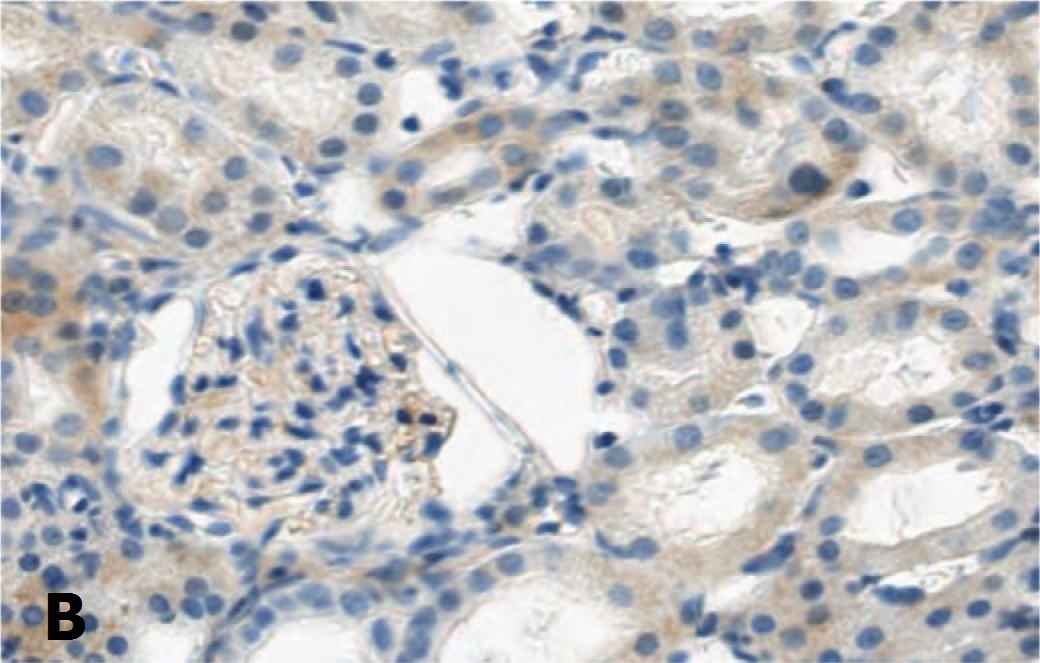
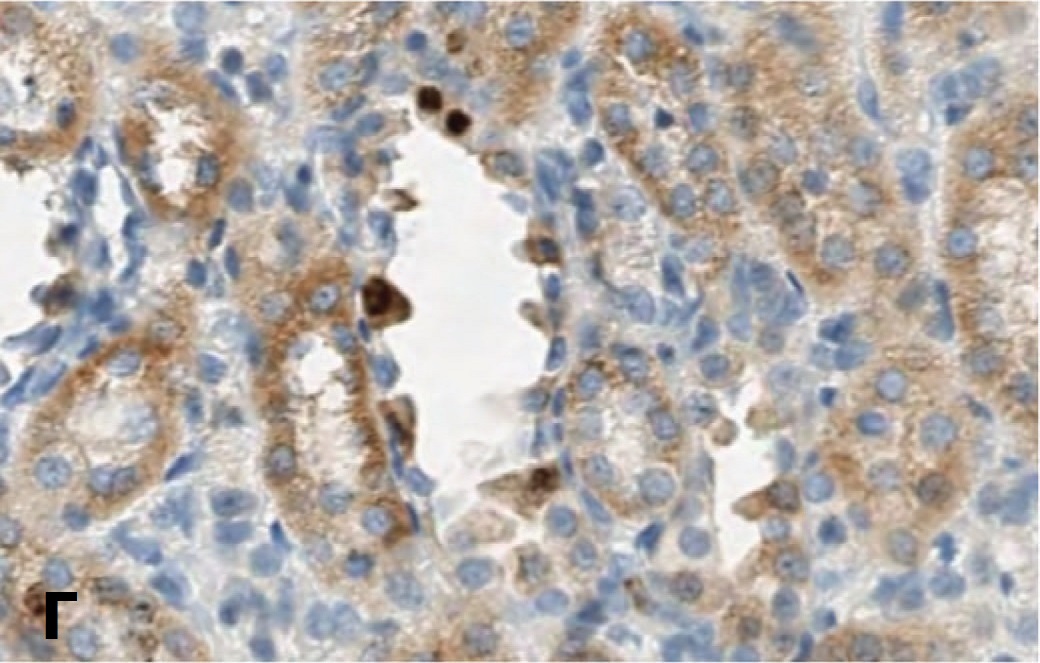
Рис. 4. Влияние терапии СЭСК на экспрессию Ki-67 в клетках почки при умеренно выраженной ОПН. А – 60 минут ишемии, 3 сутки, терапия СЭСК. Б – 60 минут ишемии, 3 сутки, контроль. В – 60 минут ишемии, 14 суток, терапия СЭСК, Г – 60 минут ишемии, 14 суток, контроль. х 200
Fig. 4. The effect of SESC therapy on the expression of Ki-67 in kidney cells with moderate acute renal failure. A – 60 minutes of ischemia, 3 days, SESC therapy. Uv.200x. B – 60 minutes of ischemia, 3 days, control. Uv.100x. C – 60 minutes of ischemia, 14 days, SESC therapy, D – 60 minutes of ischemia, 14 days, control. x 200
В опытах с более тяжелой ОПН (90 минут ишемии) и терапий СЭСК высокая пропорция клеток, экспрессирующих Ki-67 в эпителии почечных канальцев сохраняется до 14 суток после ишемического воздействия, тогда как в контрольной серии доля этих клеток была существенно ниже. В клетках почечных клубочков при терапии СЭСК выявлялись единичные клетки, экспрессирующие Ki-67, тогда как в контрольных опытах экспрессия этого маркера в клетках клубочков не выявлялась (рис. 5).
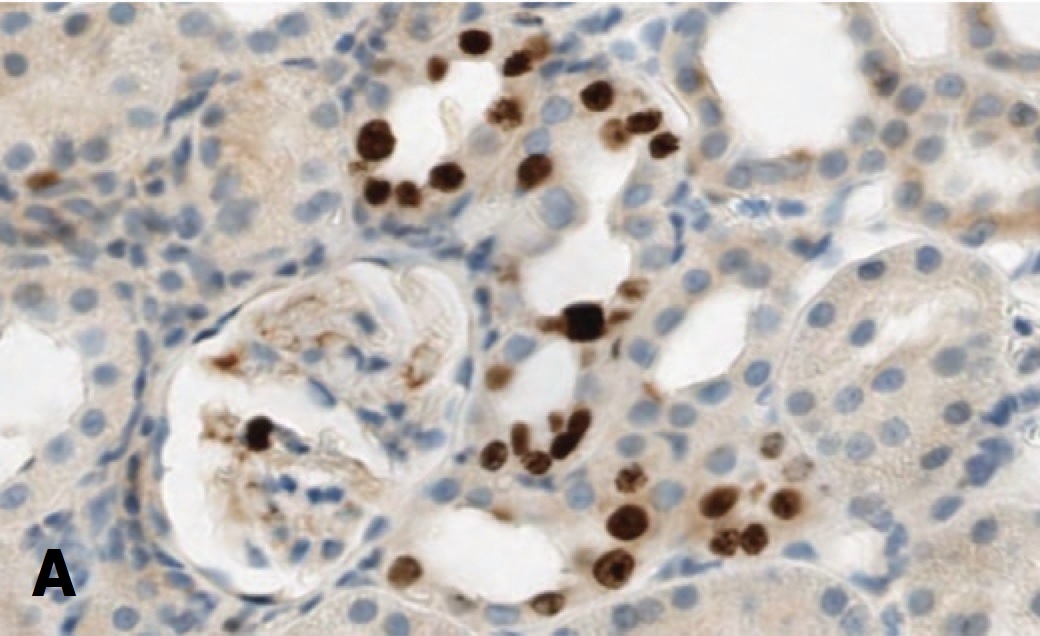
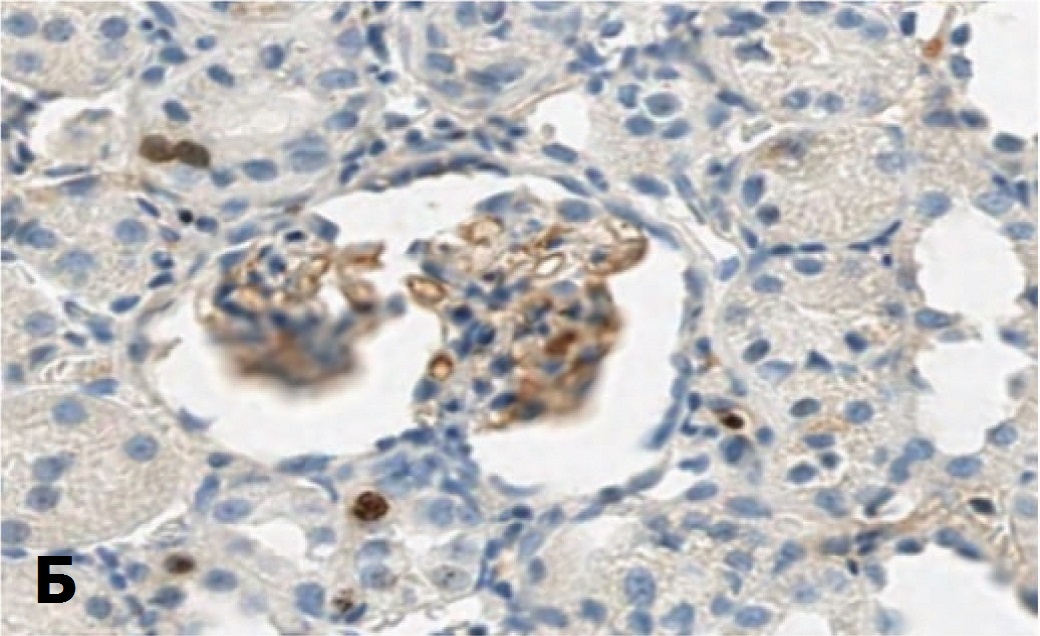
Рис. 5. Влияние терапии СЭСК на экспрессию Ki-67 в клетках почки при тяжелой ОПН. А – 90 минут ишемии, 14 суток, терапия СЭСК. Окраска гематоксилином и эозином и на Ki-67. Ув. 200х. Б – 90 минут ишемии, 14 суток, контроль. Окраска гематоксилином и эозином и на Ki-67. х 100
Fig. 5. The effect of SESC therapy on Ki-67 expression in kidney cells in severe acute renal failure. A – 90 minutes of ischemia, 14 days, SESC therapy. Staining with hematoxylin and eosin and on Ki-67. Uv. 200x. Б – 90 minutes of ischemia, 14 days, control. Staining with hematoxylin and eosin and on Ki-67. х 100
Таким образом, более быстрое восстановление функционального состояния ишемизированной почки на фоне терапия СЭСК может быть обусловлено стимуляцией регенерации эпителиальных клеток поврежденных почечных канальцев, особенно на ранних сроках после ишемического воздействия. При этом мы отметили, что продолжительность активации клеточной регенерации при терапии СЭСК была пропорциональна выраженности действия повреждающего фактора: в опытах с 60-минутной ишемией она была максимальна в первые 3 суток после развития повреждения, уменьшалась к 7-м суткам и практически исчезала через 14 суток, тогда как после 90-минутной ишемии, стимулирующий эффект сохранялся до конца периода наблюдения.
Поскольку мы не выявили существенной активации регенерации клеток почечных клубочков под влиянием терапии СЭСК (в отличии от почечных канальцев) мы изучили влияние этого препарата на апоптоз клеток, активность которого играет существенную роль в функциональных последствиях острого повреждения органов. С этой целью мы изучили влияние СЭСК на экспрессию маркера антиапоптоза Bcl-2 в структурах почки, подвергнутой ишемии различной длительности, на фоне терапии СЭСК и без терапии.
В интактной почке клетки большинства почечных клубочков (до 80%) экспрессировали Bcl-2. После ишемического воздействия количество Bcl-2-позитивных клубочков в обеих группах значительно снижалось, но более выраженно (через 3 и 7 суток после ишемии) в контрольной серии опытов (рис. 6). Через 14 суток процент Bcl-2-позитивных клубочков в опытной и контрольной группах сравнивался.
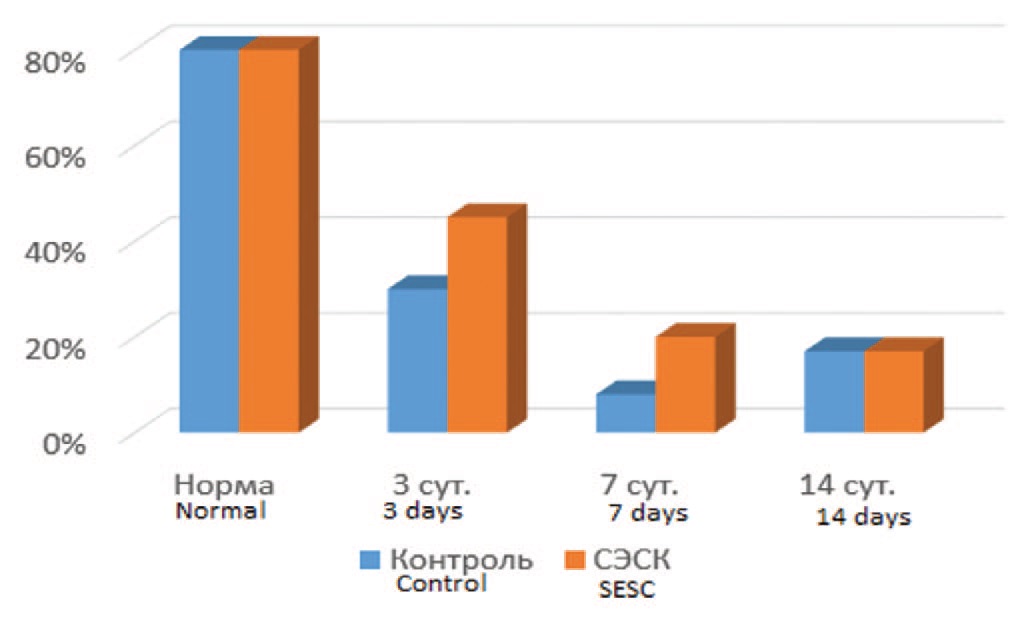
Рис. 6. Влияние терапии СЭСК на долю почечных клубочков, экспрессирующих Bcl-2
Fig. 6. The effect of SESC therapy on the proportion of glomeruli that extract Bcl-2
При этом на фоне терапии СЭСК через 3 и 7 суток после 60-минутной ишемии отмечали не только большее количество Bcl-2-позитивных клубочков, но и более выраженную экспрессию этого маркера (рис. 7А, Б). К 14 суткам различия между сериями сглаживались.
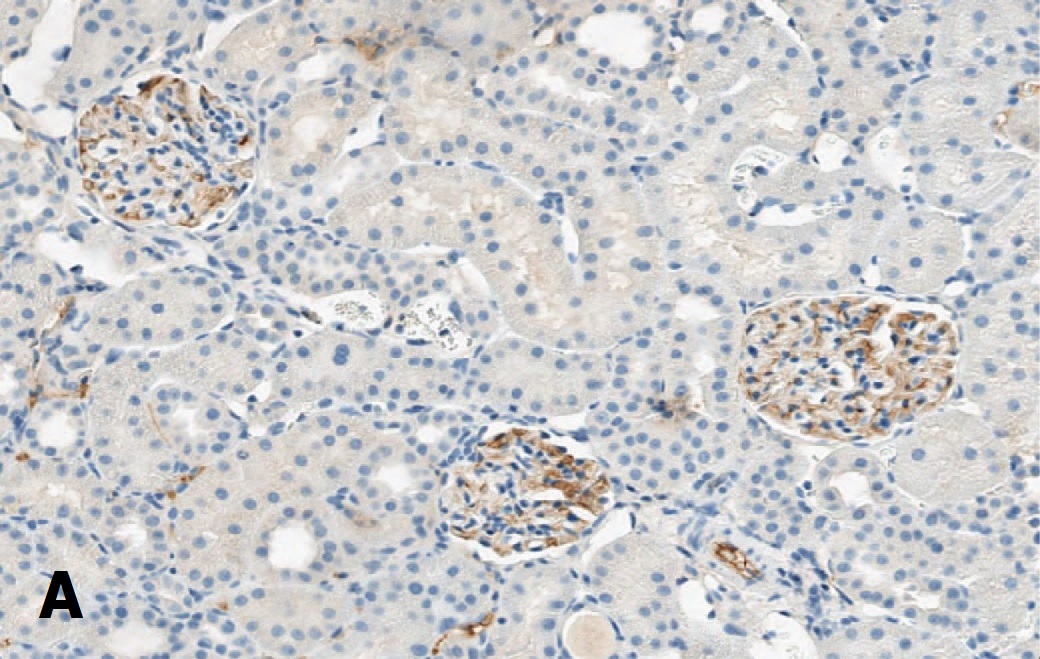
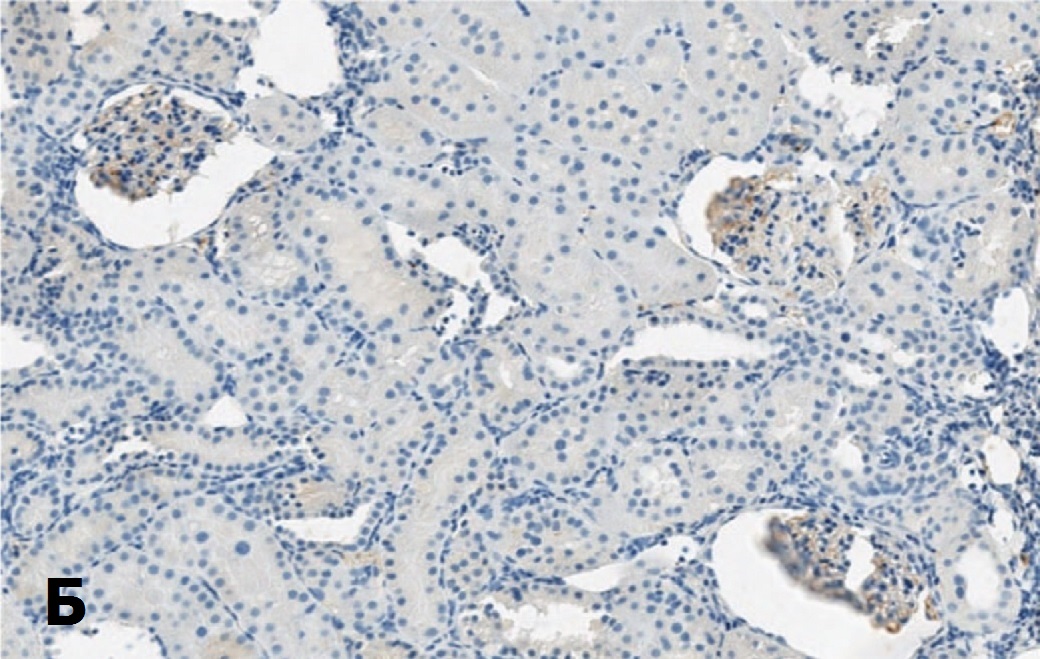
Рис. 7. Экспрессия Bcl-2 в клубочках после 60-минутной ишемии при терапии СЭСК (А) и без терапии (Б) на 3-и сутки после ишемии. х 100
Fig. 7. Bcl-2 expression in glomeruli after 60-minute ischemia with SESC therapy (A) and without therapy (Б) on the 3rd day after ischemia. х 100
В опытах с 90-минутной ишемией более высокая экспрессия Bcl-2 сохранялась до 14 суток после ишемического воздействия (рис. 8).
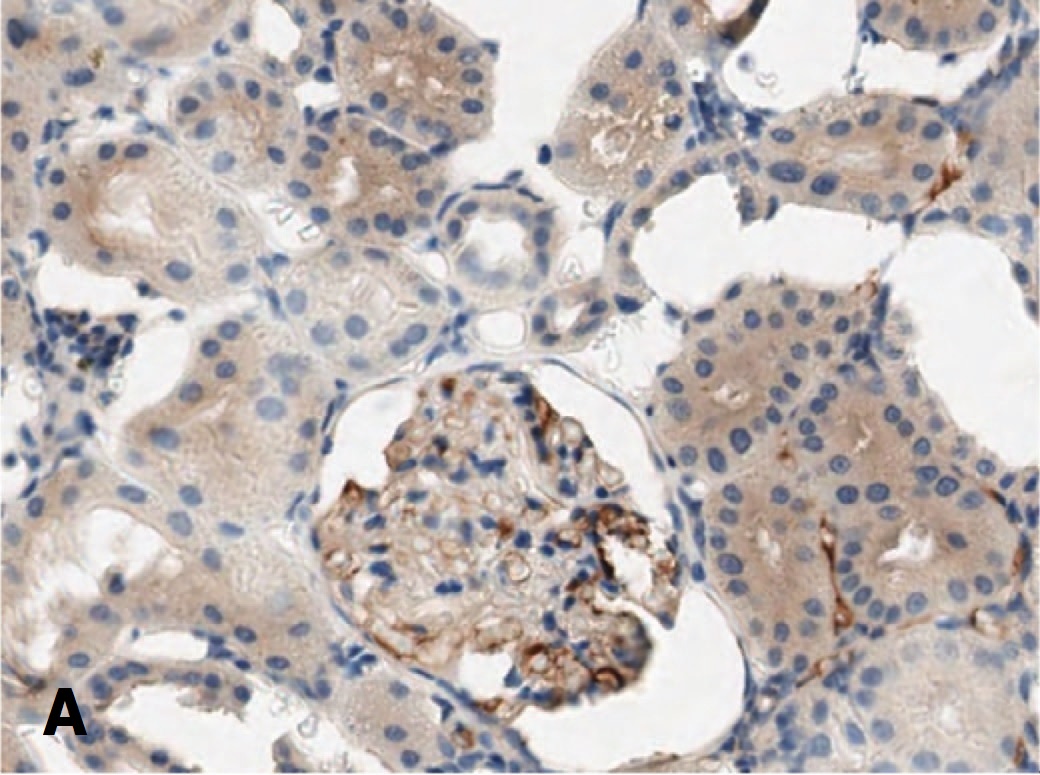
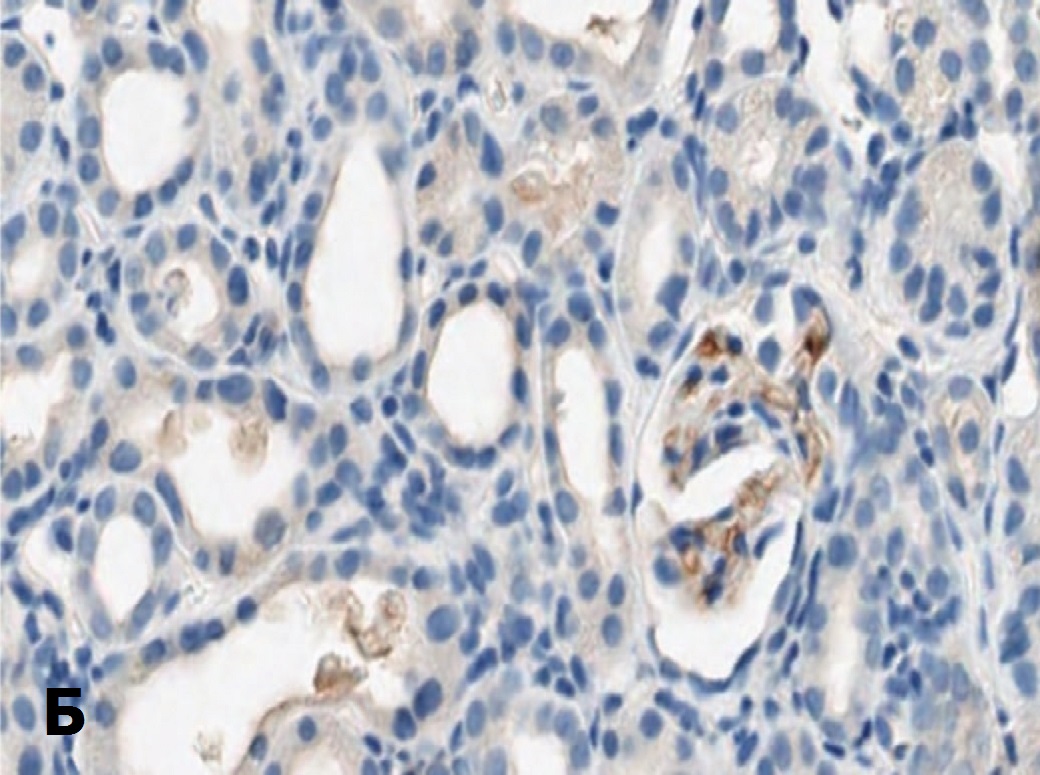
Рис. 8. Экспрессия Bcl-2 в структурах почки через 14 суток после 90-ми- нутной ишемии. А – терапия СЭСК, Б – контроль
Fig. 8. Bcl-2 expression in kidney structures 14 days after 90-minute ischemia. A – SESC therapy, B – control
Эти данные свидетельствуют, что под действием терапии СЭСК степень активации апоптоза поврежденных клеток уменьшается как при средней степени выраженности ОПН, так и при тяжелом повреждении почек, что способствует сохранению функционально активной паренхимы органа и препятствует развитию нефросклероза.
Важно отметить, что преобладающее количество меченых Bcl-2 клеток выявляли в почечных клубочках, что позволяет предполагать, что уменьшение гломерулосклероза при терапии СЭСК обусловлено именно за счет сохранения активности антиапоптотических сигнальных путей, препятствующих гибели клеток и их замещению соединительной тканью.
Обобщая полученные данные, можно предположить, что предотвращение выраженных функциональных расстройств при терапии СЭСК в отношении сохранения функции клубочков и канальцев реализуются разными путями. Если в отношении канальцевого эпителия, потенциально обладающего регенераторным потенциалом, основным механизмом является его стимуляция путем активации генома, маркером чего является повышение экспрессии Ki-67, то в отношении клубочковых клеток их защита реализуется путем подавления процессов апоптоза, на что указывает более высокая экспрессия Bcl-2.
ОБСУЖДЕНИЕ
Исход патологического процесса после развития ОПП определяется балансом между гибелью функционально активных клеток и активностью процессов регенерации поврежденных клеточных структур [1, 2, 8]. В случае преобладания деструктивных процессов возникает риск перехода острого повреждения в хроническую болезнь почек, что доказано, как в экспериментальных исследованиях, так и в клинических наблюдениях, причем хроническая форма может развиваться через некоторое время после восстановления функции почки после острого повреждения [2, 5, 6, 25, 26].
Для восстановления функции почек после ОПП по мнению H. Fattah и соавт. жизненно важно восстановление канальцев, что также обеспечивает улучшение скорости клубочковой фильтрации, и, вероятно, определяет, какие пациенты полностью выздоравливают от ОПП или прогрессируют до хронического заболевания почек [27]. Согласно данным других авторов не менее важное значение имеет восстановление поврежденных почечных клубочков с предотвращением развития гломерулосклероза, в процессе которого важную роль играет возможность сохранения жизнеспособности и регенерации подоцитов [28].
Полученные нами результаты показали, что уменьшение выраженности морфологических нарушений, определяющих более быстрое восстановление функциональной активности ишемизированной почки, при терапии СЭСК связано как со стимуляцией регенерации поврежденных клеток, так и с подавлением процесса их апоптоза. При этом фактор стимуляции регенерации играет более важную роль в отношении почечных канальцев, а фактор ингибирования апоптоза поврежденных клеток – в отношении клубочкового аппарата почки.
Для регенерации канальцевого эпителия по данным H. Fattah и соавт. необходима дедифференцировка клеток во время фазы повреждения канальцев, что способствует последующей клеточной пролиферации и замещению утраченных эпителиальных клеток [27]. Терапия СЭСК, по всей видимости, способствует стимуляции этого процесса с разблокировкой определенных генов и вступлением клеток в пролиферативный процесс, о чем свидетельствует увеличение эпителиальных клеток, экспрессирующих Ki-67.
Известно, что маркер клеточной пролиферации Ki-67 выявляет лишь начальный этап подготовки клеток к делению и не дает точной информации о последствиях активации клеточного генома – приводит ли это к гипертрофии клеток, делению клеток или гибели клеток в результате митоза из-за выраженного повреждения клеточной ДНК (митотической катастрофе) – тем не менее этот маркер используется многими исследователями для характеристики активности пролиферативного процесса, поскольку его экспрессия коррелирует с другими часто используемыми маркерами пролиферации, в частности, бром-деоксиуридином, и нефропротективным действием терапевтических средств, в том числе СК и их производными [29, 30-33].
Имеются данные, что при ишемическом воздействии максимум регенерации канальцевых клеток наступает на 3-8-й дни после ишемического повреждения [34, 35]. В наших исследованиях мы также выявили, что при терапии СЭСК наибольшее количество канальцев с клетками, мечеными Ki-67, определялось через 3 суток в опытах как с умеренно выраженной, так и при тяжелой ОПН. При этом в опытах с умеренно выраженным ОПП через 7 и 14 суток различия между опытной и контрольной сериями постепенно нивелировались за счет снижения числе меченых клеток в опытной серии и увеличения в контроле. При нарастании степени повреждения почки (тяжелая ОПН) повышенное количество меченых Ki-67 клеток в опытной группе по сравнению с контролем сохранялось до 14 суток.
Таким образом, при умеренно выраженном ОПП терапия СЭСК ускоряет процесс регенерации почечных канальцев, уменьшая функциональные последствия повреждения в наиболее критический период (первые 3 суток). Без терапии регенеративные процессы развиваются медленнее, но сохранившиеся резервы позволяют постепенно восстановить функционирование канальцевого аппарата почки. При тяжелой ОПН только терапия СЭСК позволяет адекватно стимулировать регенерацию канальцев и тем самым улучшить функцию поврежденной почки, тогда как без стимуляции резервные возможности клеток становятся недостаточными.
Помимо того, что клетки, экспрессирующие Ki-67, можно отнести к клеткам, вступившим в пролиферативный цикл, имеются данные, что эти клетки не экспрессируют αактин гладкомышечных клеток (α-АГМК), тогда как во многих клетках, не экспрессирующих Ki-67, выявляется экспрессия α-АГМК [36]. Поскольку α-АГМК обычно выявляется в миофибробластах, его экспрессия может служить индикатором развития эпителиально-мезенхимной трансформации клеток, то есть начального этапа нефросклероза. Индукция терапией СЭСК повышения экспрессии Ki-67 может свидетельствовать, что эта терапия обладает антисклеротическим действием, что подтвердилось гистологическим исследованием.
Ряд авторов предполагает, что после повреждения почки различной этиологии способность к регенерации имеется только у особой популяции клеток, называемой «клетки, длительно удерживающие метки», в частности, бром-деоксиуридин, часто используемый как маркер клеточной регенерации, и именно эти клетки после повреждения активно экспрессируют Ki-67, хотя в норме этот маркер в них не выявляют [31, 37]. При этом в условиях культивирования in vitro эти клетки могут дифференцироваться не только в клетки канальцевого эпителия, но и в подоциты, что важно для регенерации клубочков [37].
Выявленное в предыдущих исследованиях быстрое восстановление клубочковой фильтрации при терапии СЭСК может быть связано с уменьшением повреждения почечных клубочков и ускорением их регенерации и гипертрофии, что мы подтвердили в данном исследовании. Хотя при определении экспрессии Ki-67 при терапии СЭСК в структурах почечных клубочков выявлялись лишь немногие меченые париетальные подоциты и клетки мезангиума, тем не менее уже на 3 сутки до 20% клубочков не только сохраняли нормальную морфологию, но и гипертрофировались, тогда как в контрольных опытах гипертрофированные клубочки на этом сроке наблюдения отсутствовали. Обратная зависимость выявлена в отношении доли клубочков с явлениями гломерулосклероза. Если при терапии СЭСК в опытах с 60-минутной ишемии через 3 суток их не выявляли, а после 90-минутной ишемии их доля составляла 5%, то в контрольных опытах эти цифры составили 5 и 10% соответственно. На более отдаленных сроках выраженность гломерулосклероза при терапии СЭСК была в 2-3 раза ниже, чем без терапии.
Таким образом, терапия СЭСК предотвращает развитие склероза клубочков при ОПН и способствует ускорению регенерации и развитию гипертрофии малоповрежденных клубочков. То, что мы не выявили значимой экспрессии Ki-67 в почечных клубочках, возможно, связано с тем, что его экспрессия индуцируется в почечных структурах в разной степени в зависимости от вида нефропатии: в клубочках – в большей степени при гломерулопатиях, а в эпителии канальцев – при тубулопатиях [38]. При ишемическом повреждении в большей степени страдают извитые канальцы, что и определяет большую стимуляцию пролиферации их эпителия [37]. Кроме того, регенерационный потенциал эпителиальных клеток почечных канальцев существенно выше, чем клеток почечных клубочков, в которых основным источником пролиферирующих клеток являются преимущественно подоциты и в меньшей степени париетальные эпителиальные клетки наружного слоя капсулы Боумена [39, 40]. Именно в этих зонах мы выявляли отдельные меченые Ki-67 клетки.
Сохранение клубочкового аппарата при ишемическом повреждении может происходить не только через стимуляцию регенерации клубочковых клеток, но и за счет уменьшения их повреждения, в том числе за счет подавления активности апоптоза. В качестве маркера активности апоптоза часто используют Bcl-2, относящийся к семейству белков В-клеточной лимфомы 2, локализованных на внешней митохондриальной мембране. Регулирующий эффект этого соединения, относящегося к ингибиторам апоптоза, осуществляется во взаимодействии с активаторами этого процесса, в частности Bax. Конечный итог определяется балансом этих регуляторов, причем, проапоптотическая активность Bax ограничивается антиапоптотической активностью Bcl-2. Белки Bcl-2 также регулируют важнейшие функции почечных клеток, включая клеточный метаболизм, аутофагию, морфологию митохондрий (деление и слияние органелл), а также митохондриальный биогенез, что позволяет считать белки BCL-2 определяющими жизнеспособность клеток [41].
Многие авторы выявляли связь между сохранением жизнеспособности клеток почки под влиянием различных воздействий, в том числе при ишемическом повреждении, с сохранением или повышением экспрессии Bcl-2 [42-45]. Более того, искусственно вызванное увеличение экспрессии Bcl-2 у трансгенных мышей приводило к повышению резистентности почек животных к ишемическому повреждению, что сопровождалось снижением активности белка каспазы и уменьшению количества апоптотических клеток [46, 47].
В почечных клубочках в норме мРНК Bcl-2 и ее продукт – белок Bcl-2 были обнаружены в подоцитах, но не выявлялись в мезангиальныых клетках [48]. То есть, именно подоциты являются «объектом защиты» от апоптоза. При этом показано, что именно апоптоз подоцитов лежит в основе развития гломерулосклероза, а выраженное снижение экспрессии Bcl-2 в подоцитах сопровождалось увеличением степени повреждения почечных клубочков [42]. Именно такая картина была выявлена в нашем исследовании. Если в норме 80% клубочков экспрессировали Bcl-2, то после ишемического воздействия доля таких клубочков в контрольных опытах уменьшалась в 4-5 раз, что сопровождалось развитием гломерулосклероза в 10-15% почечных клубочков. В опытах с терапией СЭСК утрата экспрессии Bcl-2 в клубочках была в 1,5-2 раза менее выражена, что сопровождалось значительно меньшим количеством выявляемых клубочков в состоянии гломерулосклероза (не более 5%).
Важным моментом является то, что в клетках млекопитающих Bcl-2 имеет двойную субклеточную локализацию – в митохондриях и эндоплазматическом ретикулуме, и цитопротективный эффект этих белков в зависимости от локализации различен. Экспрессия митохондриального Bcl-2 проявляла значительное ингибирующее действие на апоптоз клеток, индуцируемый цисплатином или истощением АТФ, тогда как эндоплазматический Bcl-2 был гораздо менее эффективен. Во время истощения АТФ цитохром С высвобождался из митохондрий в цитозоль, активируя апоптоз через каспазный путь. Это высвобождение подавлялось митохондриальным Bcl-2, но не подавлялось эндоплазматическим Bcl-2. Митохондриальный Bcl-2, но не эндоплазматический Bcl-2, блокировал активацию Bax во время истощения АТФ, критического события в отношении проницаемости внешней мембраны митохондрий и высвобождения цитохрома С [49].
Ингибирование апоптоза, что проявляется сохранением более высокой экспрессии Bcl-2, может быть следствием активации аутофагии, стимулированной СЭСК, которая тормозит этот процесс на эффекторном уровне, способствуя удалению продуктов острой фазы повреждения клеточных органелл [50].
Эти данные могут свидетельствовать, что на субклеточном уровне цитопротективный эффект Bcl-2 реализуется путем защиты митохондрий от повреждения, сохранения барьерных свойств их наружной мембраны, что предотвращает выход в цитоплазму цитохроома С и последующую активацию каспазного пути развития апоптоза. Терапия СЭСК способствует сохранению этого адаптивного пути защиты от клеточного повреждения.
ВЫВОДЫ
Терапевтический эффект СЭСК (препарат Целлекс) опосредован активацией регенерации и подавлением апоптоза поврежденных клеток почки при ишемическом/реперфузионном повреждении, как умеренной, так и значительной выраженности, что способствует более быстрому восстановлению функционального состояния почки после перенесенного ОПП.
ЛИТЕРАТУРА
1. Basile DP, Anderson MD, Sutton TA. Pathophysiology of acute kidney injury. Compr Physiol 2012;2(2):1303-53. https://doi.org/10.1002/cphy.c110041.
2. Zuk A, Bonventre JV. Acute Kidney Injury. Annu Rev Med 2016(67):293-307. https://doi.org/10.1146/ annurev-med-050214-013407.
3. Missoum A. Recent Updates on mesenchymal stem cell based therapy for acute renal failure. Сurr Urol 2020;13(4):189-199. https://doi.org/10.1159/000499272.
4. Zhao L, Hu C, Zhang P, Jiang H, Chen J. Mesenchymal stem cell therapy targeting mitochondrial dysfunction in acute kidney injury. J Transl Med 2019;17(1):142. https://doi.org/10.1186/s12967-019-1893-4.
5. Yu SM, Bonventre JV. Acute kidney injury and maladaptive tubular repair leading to renal fibrosis. Curr Opin Nephrol Hypertens 2020;29(3):310-318. https://doi.org/10.1097/MNH.0000000000000605.
6. Fiorentino M, Grandaliano G, Gesualdo L, Castellano G. Acute kidney injury to chronic kidney disease transition. Contrib Nephrol 2018(193):45-54. https://doi.org/10.1159/000484962.
7. Palant CE, Patel SS, Chawla LS. Acute kidney injury recovery. Contrib Nephrol 2018(193):35-44. https://doi.org/10.1159/000484961.
8. Kumar S. Cellular and molecular pathways of renal repair after acute kidney injury. Kidney Int 2018;93(1):27-40. https://doi.org/10.1016/j.kint.2017.07.030.
9. Minocha E, Sinha RA, Jain M, Chaturvedi CP, Nityanand S. Amniotic fluid stem cells ameliorate cisplatin-induced acute renal failure through induction of autophagy and inhibition of apoptosis. Stem Cell Res Ther 2019;10(1):370. https://doi.org/10.1186/s13287-019-1476-6.
10. Hafazeh L, Changizi-Ashtiyani S(1), Ghasemi F, Najafi H, Babaei S, Haghverdi F. Stem cell therapy ameliorates ischemia-reperfusion induced kidney injury after 24 hours reperfusion. Iran J Kidney Dis 2019;13(6):380-388.
11. Yokoo T. Stem cell sheet therapy: another option for acute kidney injury? Kidney Int 2021;99(1):22-24. https://doi.org/10.1016/j.kint.2020.08.034.
12. Bogatcheva NV, Coleman ME. Conditioned medium of mesenchymal stromal cells: a new class of therapeutics. Biochemistry (Mosc) 2019;84(11):1375-1389. https://doi.org/10.1134/S0006297919110129.
13. Pan B, Fan G. Stem cell-based treatment of kidney diseases. Exp Biol Med (Maywood) 2020;245(10):902-910. https://doi.org/10.1177/1535370220915901.
14. Wang SY, Hong Q, Zhang CY, Yang YJ, Cai GY, Chen XM. miRNAs in stem cell-derived extracellular vesicles for acute kidney injury treatment: comprehensive review of preclinical studies. Stem Cell Res Ther 2019;10(1):281. https://doi.org/10.1186/s13287-019-1371-1.
15. Selim RE, Ahmed HH, Abd-Allah SH, Sabry GM, Hassan RE, Khalil WKB, Abouhashem NS. Mesenchymal stem cells: a promising therapeutic tool for acute kidney injury. Appl Biochem Biotechnol 2019 Sep;189(1):284-304. https://doi.org/10.1007/s12010-019-02995-2.
16. Vizoso FJ, Eiro N, Cid S, Schneider, Perez-Fernandez R. Mesenchymal stem cell secretome: toward cell-free therapeutic strategies in regenerative medicine. Int J Mol Sci 2017(18):1852; https://doi.org/10.3390/ijms18091852.
17. Li JS, Li B. Renal injury repair: how about the role of stem cells. Adv Exp Med Biol 2019(1165):661-670. https://doi.org/10.1007/978-981-13-8871-2_32.
18. Hafazeh L, Changizi-Ashtiyani S, Ghasemi F, Najafi H, Babaei S, Haghverdi F. Stem cell therapy ameliorates ischemia-reperfusion induced kidney injury after 24 hours reperfusion. Iran J Kidney Dis 2019 Nov;13(6):380-388.
19. Beer L, Mildner M, Ankersmit HJ. Cell secretome based drug substances in regenerative medicine: when regulatory affairs meet basic science. Ann Transl Med 2017(5):170.
20. GolleL, Gerth HU, Beul K, Heitplatz B, Barth P, Fobker M, et al. Bone marrow-derived cells and their conditioned medium induce microvascular repair in uremic rats by stimulation of endogenous repair mechanisms. Sci. Rep 2017(7):9444.
21. Lee KH, Tseng WC, Yang CY, Tarng DC. The Anti-inflammatory, anti-oxidative, and anti-apoptotic benefits of stem cells in acute ischemic kidney injury. Int J Mol Sci 2019;20(14). pii: E3529. https://doi.org/10.3390/ijms20143529.
22. Rota C, Morigi M, Imberti B. Stem cell therapies in kidney diseases: progress and challenges. Int J Mol Sci 2019(20):2790; https://doi.org/10.3390/ijms20112790.
23. Yun CW, Lee SH. Potential and therapeutic efficacy of cell-based therapy using mesenchymal stem cells for acute/chronic kidney disease. Int J Mol Sci 2019;20(7):1619. https://doi.org/10.3390/ ijms20071619.
24. Кирпатовский В.И., Сивков А.В., Голованов С.А., Дрожжева В.В., Ефремов Г.Д., Самойлова С.И. Стимуляция структурно-функционального восстановления почки у крыс с постишемической острой почечной недостаточностью разной степени выраженности терапией эмбриональным белково-пептидным комплексом. Бюллетень экспериментальной биологии и медицины 2020;169(5):551-558. [Kirpatovskiy V.I., Sivkov A.V., Golovanov S.A., Drozhzheva V.V., Efremov G.D., Samjlova S.I. Stimulation of the structural and functional recovery of the kidney in rats with post-ischemic acute renal insufficiency of varying severity by therapy with an embryonic protein-peptide complex. Byulleten' eksperimental'noy biologii i meditsiny = Bulletin of Experimental Biology and Medicine 2020;169(5):551-558. (in Russian)].
25. Ferenbach DA, Bonventre JV. Acute kidney injury and chronic kidney disease: From the laboratory to the clinic. Nephrol Ther 2016;12(Suppl 1):S41-8. https://doi.org/10.1016/j.nephro.2016.02.005.
26. Ogbadu J, Singh G, Aggarwal D. Factors affecting the transition of acute kidney injury to chronic kidney disease: Potential mechanisms and future perspectives. Eur J Pharmacol 2019(865):172711. https://doi.org/10.1016/j.ejphar.2019.172711.
27. Fattah H, Vallon V. Tubular recovery after acute kidney injury. Nephron 2018;140(2):140-143. https://doi.org/10.1159/000490007.
28. Кирпатовский В.И., Соколов М.А., Рабинович Э.З., Сивков А.В. Клеточные и гуморальные механизмы регенерации почки. Экспериментальная и клиническая урология 2017(2):42-51. [Kirpatovskiy V.I., Sokolov M.A., Rabinovich E.Z., Sivkov A.V. Cellular and humoral mechanisms of kidney regeneration. Eksperimentalnaya i Klinicheskaya urolo-giya = Experimental and Clinical Urology 2017(2):42-51. (in Russian)].
29. Thomasova D, Anders HJ. Cell cycle control in the kidney. Nephrol Dial Transplant 2015;30(10):1622-30. https://doi.org/10.1093/ndt/gfu395.
30. Liu X, Liu H, Sun L, Chen Z, Nie H, Sun A, et al. The role of long-term label-retaining cells in the regeneration of adult mouse kidney after ischemia/reperfusion injury. Stem Cell Res Ther 2016;7(1):68. https://doi.org/10.1186/s13287-016-0324-1.
31. Sakakima M, Fujigaki Y, Yamamoto T, Hishida A. A distinct population of tubular cells in the distal S3 segment contributes to S3 segment regeneration in rats following acute renal failure induced by uranyl acetate. Nephron Exp Nephrol 2008;109(2):e57-70. https://doi.org/10.1159/000142100.
32. Goodlad RA. Quantification of epithelial cell proliferation, cell dynamics, and cell kinetics in vivo. Wiley Interdiscip Rev Dev Biol 2017;6(4). https://doi.org/10.1002/wdev.274.
33. Hussein AM, Barakat N, Awadalla A, Gabr MM, Khater S, Harraz AM, et al. Modulation of renal ischemia/reperfusion in rats by a combination of ischemic preconditioning and adipose-derived mesenchymal stem cells (ADMSCs). Can J Physiol Pharmacol 2016;94(9):936-46. https://doi.org/10.1139/ cjpp-2016-0018.
34. Regner KR, Nozu K, Lanier SM, Blumer JB, Avner ED, Sweeney WE Jr, Park F. Loss of activator of G-protein signaling 3 impairs renal tubular regeneration following acute kidney injury in rodents. FASEB J. 2011;25(6):1844-55. https://doi.org/10.1096/fj.10-169797.
35. Sari FT, Arfian N, Sari DCR. Effect of kidney ischemia/reperfusion injury on proliferation, apoptosis, and cellular senescence in acute kidney injury in mice. Med J Malaysia 2020;75(Suppl 1):20-23.
36. Terada N, Karim MR, Izawa T, Kuwamura M, Yamate J. Expression of ОІ-catenin in regenerating renal tubules of cisplatin-induced kidney failure in rats. Clin Exp Nephrol 2018;22(6):1240-1250. https://doi.org/10.1007/s10157-018-1583-1.
37. Kim K, Lee KM, Han DJ, Yu E, Cho YM. Adult stem cell-like tubular cells reside in the corticomedullary junction of the kidney. Int J Clin Exp Pathol 2008;1(3):232-41.
38. Hall PA, Greenwood RA, d'Ardenne AJ, Levison DA. In situ demonstration of renal tubular regeneration using the monoclonal antibody Ki67. Nephron 1988;49(2):122-5. https://doi.org/10.1159/000185037.
39. Shankland SJ, Pippin JW, Duffield JS. Progenitor cells and podocyte regeneration. Semin Nephrol 2014;34(4):418–428. https://doi.org/10.1016/j.semnephrol.2014.06.008.
40. Wanner N, Hartleben B, Herbach N, Goedel M, Stickel N, Zeiser R, et al. Un raveling the role of podocyte turnover in glomerular aging and injury. J Am Soc Nephrol 2014;25(4):707-716. https://doi.org/10.1681/ASN.2013050452.
41. Borkan SC. The role of BCL-2 family members in acute kidney injury. Semin Nephrol. 2016 May;36(3):237-50. https://doi.org/10.1016/j.semnephrol.2016.04.001.
42. Qiu LQ, Sinniah R, I-Hong Hsu S. Downregulation of Bcl-2 by podocytes is associated with progressive glomerular injury and clinical indices of poor renal prognosis in human IgA nephropathy. J Am Soc Nephrol 2004;15(1):79-90. https://doi.org/10.1097/01.asn.0000104573.54132.2e.
43. Isaka Y, Suzuki C, Abe T, Okumi M, Ichimaru N, Imamura R, et al. Bcl-2 protects tubular epithelial cells from ischemia/reperfusion injury by dual mechanisms. Transplant Proc 2009;41(1):52-4. https://doi.org/10.1016/j.transproceed.2008.10.026.
44. Kim JH, Lee SS, Jung MH, Yeo HD, Kim HJ, Yang JI, et al. N-acetylcysteine attenuates glycerolinduced acute kidney injury by regulating MAPKs and Bcl-2 family proteins. Nephrol Dial Transplant 2010;25(5):1435-43. https://doi.org/10.1093/ndt/gfp659.
45. Hashemi M. The Study of pentoxifylline drug effects on renal apoptosis and bcl-2 gene expression changes following ischemic reperfusion injury in rat. Iran J Pharm Res 2014 Winter;13(1):181-9.
46. Suzuki C, Isaka Y, Shimizu S, Tsujimoto Y, Takabatake Y, Ito T, et al. Bcl-2 protects tubular epithelial cells from ischemia reperfusion injury by inhibiting apoptosis. Cell Transplant 2008;17(1-2):223-9. https://doi.org/10.3727/000000008783907053.
47. Chien CT, Chang TC, Tsai CY, Shyue SK, Lai MK. Adenovirus-mediated bcl-2 gene transfer inhibits renal ischemia/reperfusion induced tubular oxidative stress and apoptosis. Am J Transplant 2005;5(6):1194-203. https://doi.org/10.1111/j.1600-6143.2005.00826.x.
48. Haishima A, Murakami M, Ikeda T, Inoue K, Kamiie J, Shirota K. Detection of Bcl-2 mRNA and its product in the glomerular podocytes of the normal rat kidney. Exp Toxicol Pathol. 2012;64(6):633- 7. https://doi.org/10.1016/j.etp.2010.12.006.
49. Bhatt K, Feng L, Pabla N, Liu K, Smith S, Dong Z. Effects of targeted Bcl-2 expression in mitochondria or endoplasmic reticulum on renal tubular cell apoptosis. Am J Physiol Renal Physiol 2008;294(3):F499-507. https://doi.org/10.1152/ajprenal.00415.2007.
50. Cui J, Bai X, Chen X. Autophagy and acute kidney injury. Adv Exp Med Biol 2020;1207:469-480. dhttps://doi.org/10.1007/978-981-15-4272-5_34.







