ВВЕДЕНИЕ
Почечно-клеточный рак (ПКР) составляет 2–3% всех эпителиальных опухолей с самым высоким уровнем заболеваемости в странах Запада. В целом, последние 20 лет отмечается ежегодный прирост заболеваемости на уровне около 2% как в Европе, так и в мире. В странах Западной Европы показатели остаются стабильными в течение последних 10 лет [1]. Каждый год в мире регистрируются около 403,3 тыс. впервые выявленных случаев рака почки (РП) (2,0% среди всех злокачественных новообразований, 15-е ранговое место) и 175,1 тыс. случаев смерти от данного заболевания (2,0% среди всех умерших) [2]. В России за период с 2017 по 2018 гг. РП был первично диагностирован у 49070 пациентов [3]. Показатели заболеваемости РП в России в период с 2012 по 2017 гг. увеличились на 13,8% у мужчин (с 12,3 до 14,0 на 100 тыс. населения) и на 16,4% – у женщин (с 6,7 до 7,8 на 100 тыс. населения) [4]. По скорости роста заболеваемости РП находится на 3-м месте после рака предстательной железы и меланомы [5]. Безусловно, увеличение числа больных РП связано в первую очередь с улучшением выявляемости данного заболевания на ранних стадиях вследствие более широкого внедрения в рутинную клиническую практику таких методов диагностики, как ультразвуковое исследование, компьютерная (КТ) и магнитно-резонансная томография (МРТ). В то же время, смертность от ПКР также увеличивается, но более медленными темпами (6,67% за период 2008- 2018 гг.), что свидетельствует, вероятнее всего, о недостаточно эффективных подходах к лечению данной патологии [1].
Тем не менее, наиболее высокие показатели эффективности (93,1%) хирургического метода в качестве самостоятельного вида радикального лечения отмечены именно при РП [6]. Хирургические методики при РП активно развиваются в нескольких направлениях: с одной стороны, расширяются показания к операциям при распространенных формах заболевания, с другой — имеется тенденция к органосохраняющему лечению. Параллельно идут разработка и внедрение различных малоинвазивных подходов [7].
По стандартам международных клинических рекомендаций по лечению почечно-клеточной карциномы при опухолях почки стадии Т1 (≤7 см) целесообразно прибегать к органосохраняющим методам лечения [8]. Ранее «золотым стандартом» выполнения органосохраняющего хирургического лечения РП являлась открытая резекция почки, но в настоящее время в связи с активным развитием медицинских технологий лапароскопический и робот-ассистированный методы практически вытеснили открытый доступ в развитых странах [9]. Основным недостатком лапароскопических методик является тепловая ишемия почки, которая может привести в послеоперационном периоде к развитию почечной недостаточности. В последние годы появляется тенденция к выполнению малоинвазивных методик с минимальным временем ишемии почки. По мнению многих авторов, резекция почки в идеальном варианте должна быть выполнена без ишемии. При необходимости рекомендуется не превышать время тепловой ишемии более 20-25 минут. Робот-ассистированная резекция почки представляется многообещающей процедурой, способной преодолеть технические трудности лапароскопических техник и значительно сократить время ишемии [10].
Статистический анализ проводили с использованием программы Statistica (версия 10; StatSoft Inc., США). Значение р <0,05 было принято достаточным для множественного сравнения. Рассчитывали среднее значение ± стандартное отклонение (M ± m) количественных показателей.
В нашем исследовании представлен анализ лапароскопических (ЛРП) и робот-ассистированных резекций почки (РРП), выполненных в ГБУЗ МКНЦ имени А.С. Логинова ДЗМ.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании ретроспективно проанализированы результаты хирургического лечения пациентов, перенесших оперативное лечение по поводу РП в ГБУЗ МКНЦ им И.М. Логинова за период с 2015 по 2019 гг.
Критерии включения:
- пациенты с диагностированным РП по данным КТ и/или МРТ с контрастным усилением;
- пациенты, перенесшие лапароскопическую/роботассистированную резекцию почки;
- пациенты с верифицированным злокачественным новообразованием по данным гистологического исследования операционного материала.
Критерии исключения:
- пациенты, которым в результате оперативного лечения была выполнена радикальная нефрэктомия;
- пациенты, у которых по результатам гистологического исследования были выявлены доброкачественные новообразования.
Предоперационное стадирование проводилось по классификации TNM, основываясь на данных КТ с контрастным усилением.
Степени сложности резекции почки по шкале R.E.N.A.L. оценивается следующим образом:
- 4-6 баллов – низкая сложность;
- 7-9 баллов – средняя сложность;
- 10-12 баллов – высокая сложность (табл. 1).
В итоговый анализ вошли 153 пациента в возрасте 26–84 лет, перенесшие РРП или ЛРП в период с 2015 по 2019 гг. в ГБУЗ МКНЦ им. А.С. Логинова.
Больные были разделены на 3 группы:
- I группа – робот-ассистированные резекции почки, выполненные в условиях «тепловой» ишемии почки (69 пациентов);
- II группа – лапароскопические резекции почки, выполненные в условиях «тепловой» ишемии почки (64 пациента);
- III группа – робот-ассистированные резекции почки, выполненные без ишемии – «0» ишемия (20 пациентов).
Сопоставлены результаты РРП и ЛРП, выполненных в условиях тепловой ишемии почки – I и II группы. В таблице 2 подробно дана характеристика пациентов обеих групп, статистически значимых различий между признаками не выявлено.
Таблица 1. Шкала R.E.N.A.L.
Table 1. R.E.N.A.L. score
| Характеристики опухоли Tumor characteristics |
Индекс сложности резекции почки Difficulty index of kidney resection |
||
|---|---|---|---|
| 1 балл 1 point |
2 балла 2 point |
3 балла 3 point |
|
| R – радиус (макс диаметр, см) R - radius (maximum diameter, sm) |
≤ 4 см | 4-7 см | ≥ 7 см |
| Е – экзофитность E – exophytic/endofitic |
≥Экзофитный рост ≥ 50% опухоли проецируется кнаружи от почки ≥ 50% of the tumor is projected outward of the kidney |
Эндофитный рост < 50% экзофитного роста опухоли <50% exophytic tumor growth |
Полностью интрапаренхимная опухоль Completely intraparenchymal tumor |
| N – близость к почечному синусу N – nearest sinus |
≥ 7 см | 4-7 см | ≤ 4 см |
| А – переднее/заднее расположение A - anterior / posterior location |
Не имеет числового обозначения. a – переднее, р-заднее, х- другое Nonnumirical suffix. a - front, p - back, x – other | ||
| L –локализация L – location |
Кнаружи от полюсной линии Entirely above or below the polar lines | Пересекается с межполюсной линией The lrsion crosses the polar lines |
Более 50% кнутри от межполюсной линии > 50% of the mass crosses the polar line or mass is lscated entirely between the polar lines |
| ВСЕГО Total | 4 | 8 | 12 |
Таблица 2. Основные характеристика пациентов I (РРП) и II (ЛРП) групп
Table 2. Main characteristic of groups
| Характеристики обеих групп Characteristic of both groups |
РРП с тепловой ишемией RPN with warm ischemia |
ЛРП с тепловой ишемией LPN with warm ischemia |
Достоверность (р) Reliability (p) |
|
|---|---|---|---|---|
| n (количество пациентов) n (number of patients) |
133 | 69 | 64 | р>0,05 |
| Период, год Period, year |
2015, n | 1 | 3 | |
| 2016, n | 13 | 4 | ||
| 2017, n | 13 | 18 | ||
| 2018, n | 27 | 11 | ||
| 2019, n | 15 | 28 | ||
| Пол Gender |
М, n (%) | 37 (53,6%) | 38 (59,4%) | р>0,05 |
| Ж, n (%) F, n (%) |
32 (46,4%) | 26 (40,6%) | р>0,05 | |
| Возраст Age |
Средний возраст, лет Middle age, years |
61 | 61 | р>0,05 |
| Индекс массы тела (ИМТ) Body mass index (BMI) |
Средний ИМТ, кг/м2 Middle BMI, kg/m2 |
27,5 | 27,95 | р>0,05 |
| Сторона операции Operation side |
Справа, n (%) Right, n (%) | 27 (39,2%) | 31 (48,5%) | р>0,05 |
| Слева, n (%) Left, n (%) | 42 (60,8%) | 33 (51,5%) | р>0,05 | |
| R.E.N.A.L., балл/point | 4-6 | 23 (33,3%) | 23 (35,9%) | |
| 7-9 | 24 (34,8%) | 23 (35,9%) | ||
| 10-12 | 22 (31,9%) | 18 (28,2%) | ||
| Размер опухолей Tumor size |
Cр. макс. размер опухоли по данным КТ/МРТ, мм Middle Max. tumor size according to CT / MRI, mm |
39 | 40 | р>0,05 |
РЕЗУЛЬТАТЫ
Произведен анализ результатов хирургического лечения РП робот-ассистированным и лапароскопическим доступом с ишемией почки. Достоверных различий по степени сложности резекции почки по шкале R.E.N.A.L. у пациентов обеих групп обнаружено не было (р=0,79). Время операции у пациентов обеих групп статистически не различалось и составляло в среднем 155±52,6 минут для РРП, 180±39,3 минут для ЛРП (р=0,35). Объем кровопотери и время тепловой ишемии достоверно больше у пациентов II группы (р=0,014 и р=0,027 соответственно), которым выполняли ЛРП, что доказывает интраоперационные преимущества РРП над ЛРП (табл. 3).
Таблица 3. Интраоперационные показатели у пациентов I (РРП) и II (ЛРП) групп
Table 3. Intraoperative indicators of patients of I and II groups
| Группа group |
R.E.N.A.L. (Баллы, M ± m) R.E.N.A.L. (point, M ± m) |
Время операции (мин. M ± m) Operation time (min, M ± m ) |
Кровопотеря (мл, M ± m ) Blood loss (ml, M ± m) |
Время тепловой ишемии (мин, M ± m) Time of warm ischemia (min, M ± m ) |
|---|---|---|---|---|
| РРП с ишемией, RPN with ischemia | 8 ±1,99 | 155,3 ±52,61 | 160,6 ±57,8 | 12,4 ± 5,09 |
| ЛРП с ишемией LPN with ischemia | 7 ±2,06 | 180,65 ±39,3 | 207,76 ±93,48 | 20,2 ±5,38 |
| Достоверность (р) Reliability (p) | 0,79 | 0,35 | 0,014 | 0,027 |
Таблица 4. Характер послеоперационных осложнений у пациентов I (РРП) и II (ЛРП) групп по классификации Clavien- Dindo
Table 4. Postoperative complications in patients of both groups according to the classification of Clavien-Dindo
| Тип вмешательства Type of intervention |
R.E.N.A.L | Осложнения по Clavien-Dindo Clavien-Dindo Complications |
||||||
|---|---|---|---|---|---|---|---|---|
| 0 | I | II | IIIa | IIIb | IV | V | ||
| РРП с ишемией (n=69) RPN with ischemia (n=69) |
Низкая ст., n (%) Low grade, n (%) |
22 (31,8%) | 0 | 1 (1,5%) | 0 | 0 | 0 | 0 |
| Средняя ст., n (%) Middle grade, n (%) |
20 (28,9%) | 4 (5,8%) | 0 | 0 | 0 | 0 | 0 | |
| Высокая ст., n (%) High grade, n (%) |
19 (27,6%) | 2 (2,9%) | 11 (1,5%) | 0 | 0 | 0 | 0 | |
| ЛПР с ишемией (n=64) LPN with ischemia (n=64) |
Низкая ст., n (%) Low grade, n (%) |
21 (32,8%) | 1 (1,6%) | 1 (1,6%) | 0 | 0 | 1 (1,6%) | 0 |
| Средняя ст., n (%) Middle grade, n (%) |
15 (23,4%) | 2 (3,1%) | 3 (4,6)% | 0 | 1 (1,6%) | 0 | 1 (1,6%) | |
| Высокая ст., n (%) High grade, n (%) |
13 (20,3%) | 5 (7,8%) | 0 | 0 | 0 | 0 | 0 | |
Выполнено сравнение количества и характера послеоперационных осложнений у пациентов групп РРП и ЛРП. При этом осложнения I-II степени по Clavien-Dindo расценивались как легкие, от III степени и выше – как тяжелые. Было обнаружено, что количество послеоперационных осложнений достоверно не отличались (р=0,54 – для легкой степени и р=0,06 – для тяжелой степени) (рис. 1).
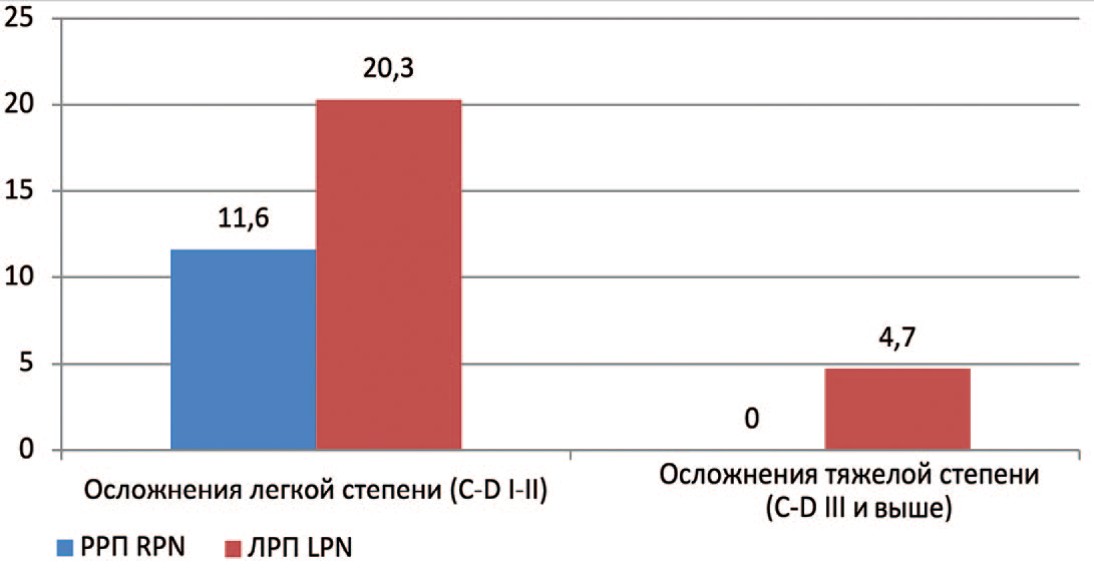
Рис. 1. Послеоперационные осложнения у пациентов I (РРП) и II (ЛРП) групп
Fig. 1. Postoperative complications of I and II groups
Тяжелые осложнения в группе РРП не отмечены, а в группе ЛРП произошли в 3-х случаях: осложнение IIIb ст. – релапароскопия на 1-е сутки послеоперационного периода по поводу ранней спаечной тонкокишечной непроходимости, осложнение IV ст. – пароксизм фибрилляции предсердий с развитием нестабильной гемодинамики, который потребовал интенсивной терапии в условиях кардиореанимационного отделения, осложнение V ст. – смерть пациента на 6-е сутки после операции в исходе острого нарушения мозгового кровообращения (табл. 4).
Длительность пребывания в стационаре достоверно не отличалась в обеих группах (р=0,42) и составила 7 к/д. Градиент снижения клиренса креатинина в послеоперационном периоде был достоверно выше у пациентов II группы, которым выполнена ЛРП и составлял 18,69±6,17, а у пациентов РРП этот показатель был равен 11,59±5,33 (р=0,0023). Положительный хирургический край достоверно чаще встречался у пациентов, которым была выполнена ЛРП (6 случаев, что составило 10,34% против 1 случая – 1,45 % в группе РРП, р= 0,031) (табл. 5, 6).
Таблица 5. Функциональные результаты у пациентов I (РРП) и II (ЛРП) групп
Table 5. Functional outcomes of I and II groups
| Группа group |
Число к/д (M ± m) Number of hospital days(M ± m) |
Градиент снижения клиренса креатинина (M ± m) Creatinine clearance reduction gradient (M ± m) |
|---|---|---|
| РРП с ишемией (n=69) RPN with ischemia (n=69) |
4 ±1,39 | 11,59 ±5,33 |
| ЛПР с ишемией (n=64) LPN with ischemia (n=64) |
5 ±1,69 | 18,69 ±6,17 |
| Достоверность (р) Reliability (p) |
0,42 | 0,0023 |
Таблица 6. Онкологические результаты у пациентов I (РРП) и II (ЛРП) групп
Table 6. Functional outcomes of I and II groups
| Группа group |
Хирургический край Surgical margin |
|
|---|---|---|
| R0 | R1 | |
| РРП с ишемией (n,%) RPN with ischemia (n,%) |
68 (98,55%) | 1 (1,45%) |
| ЛПР с ишемией (n,%) LPN with ischemia (n,%) |
58 (89,66%) | 6 (10,34%) |
| Достоверность (р) Reliability (p) |
0,031 | |
ОБСУЖДЕНИЕ
В группе РРП при схожих индексах R.E.N.A.L. достоверно ниже среднее время операции (на 16%) и среднее время тепловой ишемии (на 50%). Следствием этого является уменьшение среднего объема кровопотери на 23%, средних значений прироста креатинина в раннем послеоперационном периоде на 45%.
Интракорпоральное ушивание паренхимы почки в пределах ограниченного времени тепловой ишемии технически затруднено из-за малого объема движений лапароскопических инструментов [11, 12]. Эти трудности преодолевает роботическая система Da Vinci с большей свободой инструментов, лучшей визуализацией операционного поля и нивелирования тремора [13]. Именно эти возможности оборудования привели к более короткому времени операции, уменьшению времени тепловой ишемии и улучшению функциональных результатов, что было доказано в ранее опубликованных исследованиях, сравнивающих РРП и ЛРП, и подтверждается в результатах нашего исследования [14].
Также именно роботическая система Da Vinci предоставляет возможность эффективно выполнять резекцию почки методом «нулевой» ишемии. В настоящее время нет данных, подтверждающих, что ограниченное время ишемии (≤25 минут) имеет более высокий риск снижения почечной функции после резекции почки по сравнению с методом «нулевой ишемии» [15]. В ранее опубликованных исследованиях наблюдались значительные различия в ранних изменениях скорость клубочковой фильтрации (СКФ), что объясняется длительностью пережатия почечной артерии [16].
Таким образом, по данным авторов, РРП может давать лучшие функциональные результаты в позднем послеоперационном периоде [17]. Градиент снижения клиренса креатинина по результатам нашего исследования достоверно ниже в группе РРП, что подтверждает лучший функциональный результат в вопросе сохранности почечной функции у этой группы пациентов.
По данным многих авторов выполнение операций с использованием роботической системы позволяет добиться меньшего числа общих осложнений при выполнении операций среднего и высокого хирургического риска (R.E.N.A.L.>7) [18–20]. Частота легких осложнений по шкале Clavien-Dindo по данным нашего исследования в группах ЛРП и РРП сопоставима. Частота тяжелых осложнений по шкале Clavien-Dindo в группе ЛРП выше, чем в группе РАРП. Уменьшение числа послеоперационных осложнений высокой степени можно рассматривать как преимущество РРП над ЛРП, однако требуются дальнейшие наблюдения с учетом сопутствующих заболеваний, получаемой терапии и других факторов. Тем не менее, представленный анализ иллюстрирует эквивалентность в безопасности РРП и ЛРП для анатомически сложных опухолей почек
Онкологический результат имеет первостепенное значение при выборе подхода к хирургическому лечению опухолей почки. В нашем исследовании положительный хирургический край зоны резекции достоверно чаще встречался в группе ЛРП, чем в группе РРП. Однако отдаленные онкологические результаты нами не оценивались. По данным ряда авторов метод операции не является достоверным прогностическим фактором для 5-летней канцероспецифической выживаемости [21, 22]. В результатах исследования J.L. Tan и соавт. онкологические результаты роботических резекций почки эквиваленты результам открытых операций даже при резекции сложных опухолей [23]. Таким образом, можно говорить, что онкологическая эффективность роботических операций не уступает аналогичным методам хирургического лечения.
ВЫВОДЫ
Робот-ассистированная резекция почки является приоритетной альтернативой лапароскопической резекции почки за счет снижения времени тепловой ишемии и объема кровопотери, а также обеспечивает надежные онкологические результаты.
Для пациентов с опухолями почки средней и высокой степеней сложности по шкале R.E.N.A.L. РРП имеет наибольшее преимущество за счет снижения времени операции, времени тепловой ишемии без увеличения риска осложнений, и показывает лучшие функциональные и онкологические результаты. Требуются дальнейшие исследования с большими выборками и длительным периодом наблюдения.
ЛИТЕРАТУРА
- EAU Guidelines 2019. Ljungberg B, Albiges L, Bensalah K, Bex A, Giles RH, Hora M, et al. Renal Cell Carcinoma. [cited 2020 Oct 12]. URL: https://uroweb.org/guideline/renal-cell-carcinoma/
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J clinicians 2018;68(6):394-424. https://doi.org/10.3322/caac.21492.
- Социально значимые заболевания населения России в 2018 году (Статистические материалы). Министерство здравоохранения Российской Федерации. Департамент мониторинга, анализа и стратегического развития здравоохранения ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России. Москва 2019 г. URL: https://www.rosminzdrav.ru/ministry/61/22/stranitsa-979/statisticheskie-i-informatsionnye-materialy/statisticheskiy-sbornik-2018-god. [Socially significant diseases of the population of Russia in 2018 (Statistical materials). Ministry of Healthcare of the Russian Federation. Department of Monitoring, Analysis and Strategic Development of Healthcare of the Federal State Budgetary Institution "Central Research Institute for Organization and Informatization of Healthcare" of the Ministry of Healthcare of Russia. Moscow 2019. дата обращения 12 октября 2020. https://www.rosminzdrav.ru/ministry/61/22/stranitsa979/statisticheskie-i-informatsionnye-materialy/statisticheskiy-sbornik-2018-god. [cited 2020 Oct 2020] (In Russian)].
- Аксель Е.М., Матвеев В.Б. Статистика злокачественных новообразований мочевых и мужских половых органов в России и странах бывшего СССР. Онкоурология 2019;15(2):15–24. https://doi.org/10.17650/1726-9776-2019-15-2-15-24. [Axel E.M., Matveev V.B. Statistics of malignant tumors of urinary and male urogenital organs in russia and the countries of the former USSR. Oncourologia = Cancer Urology 2019;15(2):15– 24. https://doi.org/10.17650/1726-9776-2019-15-2-15-24. (In Russian)].
- Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровои – М.: МНИОИ им. П.А. ̆ Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. http://www.oncology.ru/service/statistics/malignant_tumors/2017.pdf. [Malignant neoplasms in Russia in 2017 (morbidity and mortality). [Ed. A.D. Kaprin, V.V. Starinsky, G.V. Petrov]. M .: P.A. Herzen MNIOI - branch of the Federal State Budgetary Institution "NMITs of Radiology" of the Ministry of Health of Russia, 2018. http://www.oncology.ru/service/statistics/malignant_tumors/2017.pdf. (In Russian)].
- Состояние онкологической помощи населению России в 2017 году под редакцией А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.;2018.236 с. [The state of cancer care for the population of Russia in 2017. [Ed. A.D. Kaprin, V.V. Starinsky, G.V. Petrov]. M .; 2018. 236 s. (In Russian)].
- Матвеев В.Б., Комаров И.Г., Алексеев Б.Я. и др. Роль лапароскопической хирургии в лечении опухолей почки. Онкоурология 2005;(3):5–9. [Matveyev V.B. Komarov I.G., Alekseyev B.Ya., Medvedev V.L., Kogan M.I., Volkova M.I.Role of laparoscopic surgery in the treatment of renal tumors. Oncourologia = Cancer Urology 2005;(3):5–9. (In Russian)].
- Ljungberg B, Cowan NC, Hanbury DC, Hora M, Kuczyk MA, Merseburger AS, et al. EAU guidelines on renal cell carcinoma: the 2010 update. Eur Urol 2010;58:398-406.
- Patel MN, Bhandari M, Menon M, Rogers CG. Robotic-assisted partial nephrectomy: Has it come of age? Indian J Urol 2009;25(4):523–528. https://doi.org/10.4103/0970-1591.57929.
- Pignot G, Bouliere F, Patard JJ. Warm ischaemia: the ultimate enemy for partial nephrectomy? Eur Urol 2010;58(3):337-9.
- Choi JE, You JH, Kim DK, Rha KH, Lee SH. Comparison of perioperative outcomes between robotic and laparoscopic partial nephrectomy: a systematic review and meta-analysis. Eur Urol 2015;67(5):891-901. https://doi.org/10.1016/j.eururo.2014.12.028.
- Shiroki R, Fukami N, Fukaya K, Kusaka M, Natsume T, Ichihara T, et al. Robot-assisted partial nephrectomy: superiority over laparoscopic partial nephrectomy. Int J Urol 2016;23(2):122-131. https://doi.org/10.1111/iju.13001.
- Wang Y, Ma X, Huang Q, Du Q, Gong H, Shang J, et al. Comparison of robot-assisted and laparoscopic partial nephrectomy for complex renal tumours with a RENAL nephrometry score ≥7: peri-operative and oncological outcomes. BJU Int 2016;117(1):126-130. https://doi.org/10.1111/bju.13214.
- Wu Z, Li M, Song S, Ye H, Yang Q, Liu B, et al. Propensity-score matched analysis comparing robot-assisted with laparoscopic partial nephrectomy. BJU Int 2015;115(3):437-45. https://doi.org/ 10.1111/bju.12774.
- Rod X, Peyronnet B, Seisen T, Pradere B, Gomez FD, Verhoest G, et al. Impact of ischaemia time on renal function after partial nephrectomy: a systematic review. BJU Int 2016;118(5):692-705. https://doi.org/10.1111/bju.13580.
- Choi JD, Park JW, Choi JY, Kim HS, Jeong BC, Jeon SS, et al. Renal damage caused by warm ischaemia during laparoscopic and robot-assisted partial nephrectomy: an assessment using Tc 99m-DTPA glomerular filtration rate. Eur Urol 2010;58(6):900-905. https://doi.org/10.1016/j.eururo.2010.08.044.
- Khalifeh A, Autorino R, Eyraud R, Samarasekera D, Laydner H, Panumatrassameeet K, et al. Three-year oncologic and renal functional outcomes after robot-assisted partial nephrectomy. Eur Urol 2013;64(5):744-750. https://doi.org/10.1016/j.eururo.2013.03.052.
- Long JA, Yakoubi R, Lee B, Guillotreau J, Autorino R, Laydneret H, at al. Robotic versus laparoscopic partial nephrectomy for complex tumors: comparison of perioperative outcomes. Eur Urol 2012;61:1257-1262. https://doi.org/10.1016/j.eururo.2012.03.012.
- Jang HJ, Song W, Suh YS, Jeong US, Jeon HG, Jeong BC, et al. Comparison of perioperative outcomes of robotic versus laparoscopic partial nephrectomy for complex renal tumors (RENAL nephrometry score of 7 or higher). Korean J Urol 2014;55(12):808-813. https://doi.org/10.4111/kju.2014.55.12.808.
- Volpe A, Garrou D, Amparore D, Naeyer GD, Porpiglia F, Ficarra V, et al. Perioperative and renal functional outcomes of elective robot-assisted partial nephrectomy (RAPN) for renal tumours with high surgical complexity. BJU Int 2014;114(6):903-909. https://doi.org/10.1111/bju.12751.
- Kizilay F, Turna B, Apaydin E, Semerci B. Comparison of long-term outcomes of laparoscopic and robot-assisted laparoscopic partial nephrectomy. Kaohsiung J Med Sci 2019;35(4):238-243. https://doi.org/10.1002/kjm2.12038.
- Leow JJ, Heah NH, Chang SL, Chong YL, Png KS. Outcomes of robotic versus laparoscopic partial nephrectomy: an updated meta-analysis of 4,919 patients. J Urol 2016;196(5):1371-1377. https://doi.org/10.1016/j.juro.2016.06.011.
- Tan JL, Frydenberg M, Grummet J, Hanegbi U, Snow R, Mann S, et al. Comparison of perioperative, renal and oncologic outcomes in robotic-assisted versus open partial nephrectomy. ANZ J Surg 2018;88(3):E194-E199. https://doi.org/10.1111/ans.14154.







