Сахарный диабет 2 типа (СД 2 типа) является одним из самых актуальных медикосоциальных заболеваний человека, а рост его заболеваемости позволяет клиницистам относить его к так называемым «неинфекционным эпидемиям XXI века», так как каждые 10-15 лет количество больных СД 2 типа удваивается, а многие ранние осложнения заболевания долгое время протекают без клинических симптомов, что существенно затрудняет их своевременную диагностику и отодвигает сроки назначения патогенетической терапии больным [1-3]. Диабетическая нефропатия – одно из наиболее грозных осложнений СД 2 типа, влекущее за собой раннюю инвалидизацию больных и их гибель от прогрессирующей терминальной хронической почечной недостаточности (ХПН) [4]. Наиболее детальная классификация диабетической нефропатии была разработана C.E. Mogensen (1983) и официально признана Всемирной Организацией Здравоохранения в качестве базовой [5]. К настоящему времени накоплен огромный научно-экспериментальный и клинический материал, свидетельствующий о том, что уже на ранних стадиях нарушения углеводного обмена происходит существенная функциональная, а затем и структурная перестройка гломерулярного и канальцевого аппаратов почек, которая постепенно, но прогрессивно ведет к формированию их заболеваний [6-8]. Сегодня наибольший практический интерес вызывает раннее нарушение углеводного обмена – инсулинорезистентность (ИР), рассматриваемая не просто как метаболический феномен, но как один из ключевых компонентов метаболического синдрома (МС), частота и выраженность которого в популяции людей уже приобрели характер «мировой эпидемии XXI века» [9, 10]. В последнее время изучение патофизиологических эффектов инсулина привело к пониманию его роли не только в патогенезе МС и андрогенного дефицита у мужчин, но и в патогенезе заболеваний почек. Поэтому выявление и коррекция ИР является сегодня не только таргетной задачей эндокринологов, но и вовлекает в лечебно-диагностический процесс врачей смежных специальностей, которые прямо или косвенно связаны с проблемами диагностики и лечения заболеваний почек: терапевтов, нефрологов, урологов, эндокринологов, трансплантологов [11-14].
ПАТОФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ИНСУЛИНОРЕЗИСТЕНТНОСТИ В ПАТОГЕНЕЗЕ ЗАБОЛЕВАНИЙ ПОЧЕК
Основная физиологическая функция инсулина сводится к поддержанию важной гомеостатической константы метаболизма человека – обеспечению нормального уровня глюкозы в крови и поддержанию адекватного обмена глюкозы как основного источника энергии внутри клетки [9, 10]. Инсулинорезистентность/гиперинсулинемия,являясь ключевым патогенетическим фактором МС, есть комплекс компенсаторно-приспособительных реакций, развивающихся на фоне ожирения, часто ассоциированного с андрогенным дефицитом у мужчин [9-12]. При развитии и прогрессировании ожирения резко снижается экспрессия гена рецептора инсулина, что ведет к уменьшению плотности рецепторов на поверхности клеток и возникновению резистентности к инсулину, а одновременное повышение уровня основного гормона жировой ткани – лептина - разрушает функциональную связь между гипофизом и гонадами, что является патогенетической основой формирования и прогрессирования андрогенного дефицита у мужчин одновременно с прогрессированием ожирения и ИР [9-12]. Развивающаяся ИР сопровождается гиперинсулинемией, которая в данном случае обеспечивает поддержание эффективности углеводного обмена и обеспечение адекватной митогенной активности жизнеспособности и деления клеток [9, 10]. Однако ИР имеет не только эндокринологический аспект как ранняя обратимая стадия СД 2 типа. Развитие ИР приводит к целому ряду негативных патофизиологических системных реакций, которые способны инициировать механизмы дестабилизации клеток и тканей внутренних органов, включая почки, вызывая в них анатомо-функциональные нарушения. Повреждающее действие гиперинсулинемии/ИР на почечную паренхиму может быть обусловлено несколькими механизмами.
Инсулинорезистентность приводит к нарушению структуры и функции нервной ткани. При этом первоначальные повреждения отмечаются в самых мелких периферических нервных окончаниях внутренних органов (слюнные железы, почки, половой член, предстательная железа), т.е., инсулинорезистентность индуцирует нейропатию, в основе которой лежит внутренняя симпатическая гиперактивность как результат гиперактивации сначала центральных α-адренорецепторов паравентрикулярных гипоталамических ядер, а затем и органного (тканевого) адренергического нейрорецепторного аппарата [15-17].
Индуцируемая инсулинорезистентностью нейропатия приводит к развитию системных и местных (органных и тканевых вазоконстрикторных) реакций и заканчивается развитием эндотелиальной дисфункции, приводящей к дефициту основного вазодилататора – оксида азота NO (т.к. 90% синтеза оксида азота происходит не в эндотелии, а в терминалях нервных окончаний сосудов) [18-20]. Это усугубляет нарушения почечного кровообращения в результате нарушения динамического равновесия между ведущими вазомодуляторами – оксидом азота (NO) и эндотелином-1 (ET-1) с преобладанием эффектов последнего [16, 19, 20]. Для почек это означает спазмы артериол клубочков, нарушения трофики почки, почечного кровотока, микроциркуляции и клубочковой фильтрации, гипоксию и ишемию почечной паренхимы [21]. Ренальная висцеральная нейропатия, длительное время протекающая бессимптомно или с минимальными клиническими проявлениями со стороны почек, обычно не диагностируется, так как доступных методов нейрофизиологического исследования почек в урологической практике в настоящее время просто нет. Однако именно она вызывает начальные нарушения тонуса верхних мочевых путей и почек, которые впоследствии могут оказаться важными причинами развития уростаза и формирования почечных камней [22-23].
Ишемия и гипоксия ткани почек вследствие ИР запускает компенсаторный каскад активации системы «ренин-ангиотензин - альдостерон», которая вносит свой дальнейший вклад в прогрессирование функциональных и микроциркуляторных нарушений в почках [24].
Любая нейропатия ассоциируется с активацией системы перекисного окисления липидов – системным оксидативным стрессом, который является мощным фактором, повреждающим клетки канальцевого эпителия и гломерулярного аппарата почек, способствуя нарушению их функций фильтрации, секреции, экскреции и реабсорбции [25, 26]. Повышенное содержание глюкозы в крови или нарушение к ней чувствительности клеток способствует гликозилированию клеточных белков и может инициировать серию аутоокислительных реакций, которые завершаются образованием и накоплением конечных продуктов гликозилирования в паренхиме почек [26]. Эти механизмы участвуют как в процессах почечного камнеобразования, так и в развитии и поддержании воспалительных заболеваний почек, во много раз усиливая нефротоксические эффекты микроорганизмов, вызывающих пиелонефрит, и нефротоксические эффекты некоторых антибактериальных препаратов [27-30]. Нарушения иннервации почек вследствие висцеральной ренальной нейропатии могут оказаться дополнительным патогенетическим фактором кистозно-ретенционных изменений в них [29]. Ожирение, ИР/СД 2 типа часто ассоциируются с кистозной болезнью почек, частота которой у больных с нарушениями углеводного обмена может достигать 58,8% [31].
Уровень инсулина в крови у мужчин обратно пропорционально коррелирует с уровнем мужских половых гормонов, что доказано многочисленными исследованиями [11, 12, 32-34]. Между дефицитом андрогенов и нарушениями обмена инсулина существует не просто патогенетическая связь, а взаимообратные корреляции [10-12]. Андрогенный дефицит у мужчин достоверно негативно влияет на клубочковую фильтрацию, физикохимические свойства мочи, выступая как литогенный фактор, а также на уродинамику верхних мочевых путей, т.е., по сути дела, на все элементы современного патогенеза такого распространенного заболевания, как уролитиаз [6, 11, 12, 32-34].
ИР и ожирение, являясь ключевыми компонентами МС, инициируют системное хроническое воспаление (цитокиновые каскадные реакции), которые активно участвуют в реализации еще одного механизма повреждающего действия на ткань почек - ренальную липотоксичность [35, 36]. Избыток жирных кислот в условиях накопления триглицеридов в паренхиматозных клетках целого ряда тканей, включая скелетные мышцы, миоциты сердца, гепатоциты, β-клетки поджелудочной железы, ренальный эпителий, приводит к хронической дисфункции клеток вследствие их повреждения [35, 36]. Триглицериды обладают токсичностью, обусловленной неэстерифицированными жирными кислотами с длинной цепью и их продуктами, такими, как керамиды и диацилглицеролы [35]. В почках эти метаболиты способны вызывать и усугублять повреждения гломерулярного и канальцевого аппарата, что ведет к развитию протеинурии как результата функциональной перегрузки мембран нефронов липидами, возникновению и прогрессированию нефропатии [37]. Индуцированная неэстерифицированными жирными кислотами с длинной цепью митохондриальная дисфункция почечных клеток является основным механизмом нарушений структуры и функции почек, приводя к развитию их заболеваний [37-39].
У инсулина и его физиологических медиаторов (в частности, инсулиноподобные факторы роста ИФР-1 и ИФР-3) имеется выраженный промитогенный эффект, который позволяет сегодня рассматривать патогенетическую связь между ожирением, ИР и онкологическими заболеваниями как достоверно доказанную [40, 41]. Исторически нарушения углеводного обмена (СД 2 типа и ИР) давно привлекали внимание онкологов, так как лица, страдающие СД 2 типа, в большей степени, чем здоро вые люди, подвержены развитию злокачественных опухолей [40, 41]. По статистике, более чем в 60% случаев злокачественное новообразование выявляется после установления диагноза СД 2 типа [40]. По мнению ряда исследователей, возможные механизмы, связанные с действием инсулина, вовлечены во все стадии онкогенеза человека: пролиферация, неоангиогенез, патологическая гиперваскуляризация [42, 43]. Это предопределяет доказанную роль цитокинов жировой ткани и инсулина в индукции злокачественных опухолей человека, включая рак почки и предстательной железы [42, 43]. Возможные механизмы канцерогенных эффектов инсулина представлены на рис. 1.
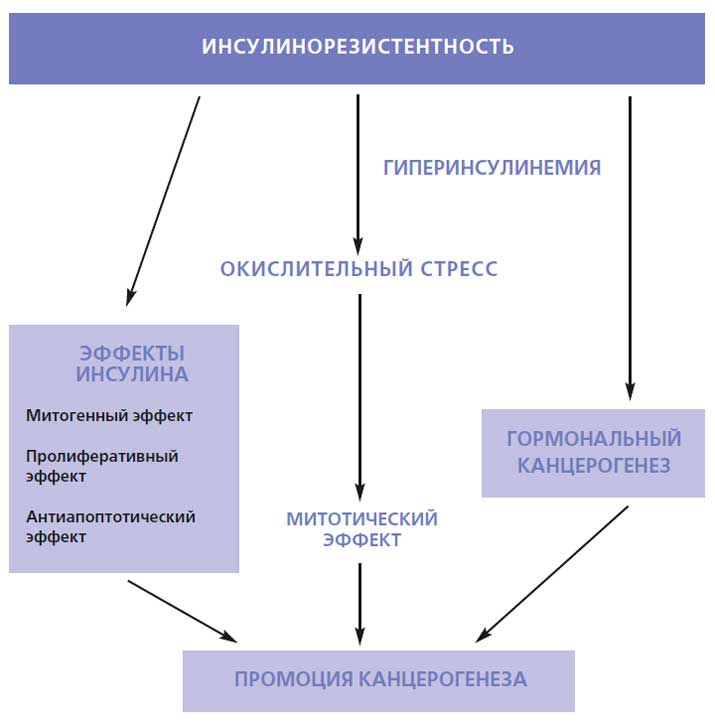
Рисунок 1. Возможные механизмы канцерогенных эффектов инсулина.
ИНСУЛИНОРЕЗИСТЕНТНОСТЬ И РАК ПОЧКИ
Рак почки является полиэтиологическим заболеванием, и существует целый ряд доказанных факторов риска его развития, в частности: пол и возраст (мужчины заболевают чаще женщин с максимумом в возрасте 70 лет); длительное курение, начатое в молодом возрасте (до 24 лет); избыточная масса тела (особенно у женщин); артериальная гипертония; применение определенных лекарственных препаратов; заболевания почек; сахарный диабет 2 типа; репродуктивные и гормональные факторы; особенности питания (употребление пиролизных аминов, образующихся при высокой температурной обработке мяса, жирной и углеводной пищи); профессиональные вредности; пролонгированное низкодозовое ионизирующее излучение [44]. Митогенные эффекты инсулина при раке почки могут опосредоваться через нарушение функции инсулиновых рецепторов здоровых клеток и клеток со злокачественным потенциалом развития [45-47]. Belfiore A. et al. (2011) показали, что повышенная экспрессия инсулиновых рецепторов в опухолевой ткани может объяснять их повышенную чувствительность к гиперинсулинемии [45]. Более того, изоформа А инсулиновых рецепторов вместе с аутокринной продукцией лиганда ИФР-2, является важным фактором роста как нормальных, так и опухолевых клеток [45]. Авторы считают, что выявление и коррекция инсулинорезистентности может иметь большее значение при проведении противоопухолевой терапии, чем предполагалось ранее. Любая противораковая терапия может стимулировать формирование или усугублять уже имеющуюся инсулинорезистентность, что ведет к снижению эффективности противоопухолевой терапии.Поэтому будущее противоопухолевой терапии видится в создании таргетного препарата к инсулиновым рецепторам с целью устранения и предотвращения усугубления инсулинорезистентности, которая ведет как к прогрессированию опухоли, так и к снижению ее чувствительности к химиопрепаратам [45]. В других исследованиях выявлено, что ИФР-1 и инсулинорезистентность инициируют фосфорилированиетирозина в рецепторах инсулина: этот механизм может быть компенсаторным при защите клеток от апоптоза, но может присутствовать при любой карциноме, в том числе, и при раке почки [46]. По мнению ряда авторов, современная терапия метастатического рака почки с использованием ингибиторов тирозин-киназы, кажущаяся эффективной, имеет и другую сторону медали: ингибирование тирозин-киназы при этом происходит как в опухолевой клетке, так и здоровой клетке. Если учесть, что тирозин-киназный механизм является одним из важнейших путей реализации эффектов инсулиновых рецепторов, то становится очевидным, что замедление прогрессирования злокачественной опухоли почки сопровождается возникновением и прогрессированием ИР [40, 41, 46]. Frasca F. et al. (2007) утверждают, что рецепторы АМФ-тирозин-киназы играют ключевую роль в развитии и прогрессировании рака у человека, так как наличие рецепторов к инсулину и тирозин-киназовых рецепторов к ИФР-1 и ИФР-2 в опухолевой клетке четко документировано [47]. По их мнению, гиперинсулинемия и нарушения функции тирозин-киназового рецептора, обуславливающие развитие ИР, играют важнейшую роль в биологии рака человека [47]. По мнению Forte V. et al. (2012), эпидемиологические данные показывают, что ожирение, МС и СД 2 типа неразрывно связаны как между собой, так и с увеличением онкологической заболеваемости [48].
Результаты собственного пилотного клинико-эпидемиологического исследования, проведенного у больных с единственной почкой после нефрэктомии по поводу почечно-клеточного рака, наглядно продемонстрировали патофизиологическую роль ожирения и ИР в канцерогенезе рака единственной почки [29, 31]. При нормальном уровне общего тестостерона частота ожирения у мужчин c единственной почкой составила 27,8%, а при андрогеном дефиците достигала 60,0% (p<0,05) [29, 31]. При этом ИР выявлялась преимущественно у гипогонадных мужчин с единственной почкой. СКФ достоверно положительно коррелировала с уровнем общего тестостерона (n=48; r=+0,245, р<0,05) [29, 31]. Частота рецидива рака в единственной почке после нефрэктомии в 10-летних наблюдениях составила 9,02%, при этом рецидив чаще наблюдался у мужчин (61,5%), чем у женщин (38,5%) (p<0,05). Одновременно с этим частота ожирения у мужчин с рецидивным раком единственной почки составила 62%, а частота впервые выявленной ИР достигала 38% [31]. Эти данные, возможно, частично объясняют роль гендерных гормонально-метаболических факторов в канцерогенезе почечно-клеточного рака [29, 31].
ИНСУЛИНОРЕЗИСТЕНТНОСТЬ И ВТОРИЧНЫЕ ПОРАЖЕНИЯ ПОЧЕК
Патогенетическая связь СД 2 типа и вторичного поражения почек давно и достоверно установлена, а многие из проведенных исследований стали классикой доказательной медицины [37, 38, 49]. По мнению Niemczyk S. et al. (2012), в настоящее время следует больше обращать внимания на эндокринологические аспекты нейропатии [37]. Проведенное авторами исследование показало, что наиболее частыми эндокринологическими нарушениями, ассоциированными с поражением почек, являются: вторичный гиперпаратиреоидизм, инсулинорезистентность, нарушения синтеза гормона роста и гиперпролактинемия [37]. По мнению Pham H. et al. (2011) ИР при заболеваниях почек развивается вследствие сопутствующих ожирения и МС [38]. Установлено, что уровень инсулина крови может неадекватно отражать степень ИР, так как нарушения функции печени и почек способны влиять на метаболизм инсулина. Однако проведенные исследования показывают, что коррекция ИР может быть важной новой терапевтической целью нефропротективной стратегии [38]. Ensling M. et al. (2011) на основании проведенного анализа баз данных PubMed (1961-2010) утверждают, что почки могут быть непосред ственной мишенью для повреждающего воздействия всех компонентов МС, включая ИР [50]. При этом достаточно часто одновременно повреждаются и кардиомиоциты, поэтому авторы склонны говорить о так называемом кардиоренальном синдроме [50].
ИНСУЛИНОРЕЗИСТЕНТНОСТЬ И УРОЛИТИАЗ
Современные эпидемиологические данные свидетельствуют о неуклонном росте заболеваемости уролитиазом на фоне параллельного увеличения частоты ожирения и МС как у мужчин, так и у женщин [6, 51-53]. Этот факт можно рассматривать как эпидемиологическое доказательство патогенетического единства уролитиаза и МС [51-53]. Наибольшее практическое значение имеет факт высокой частоты встречаемости уролитиаза у лиц среднего, самого трудоспособного возраста (20-55 лет), что обусловливает определенные финансовые потери общества в связи с временной утратой трудоспособности по поводу лечения различных клинических вариантов мочекаменной болезни [54]. Патогенетическая связь ожирения, дислипидемии и артериальной гипертонии с уролитиазом доказана многочисленными исследованиями [55-57]. Перекрестное исследование, проведенное в Италии, продемонстрировало, что мужчины с MС имеют вдвое увеличенный риск развития почечных конкрементов, чем мужчины без него [55]. Используя данные исследования NHANES III, West В. et al. (2008) также показали, что при МС риск спонтанно образующихся почечных камней в два раза выше, чем в его отсутствие [56]. При повышении числа компонентов МС пропорционально увеличивается риск камнеобразования: у 3 % больных камни образовывались без МС, при наличии 3 компонентов МС частота выявления камней составила 7,5 %, и 9,8 % выявлены у больных с 5 компонентами МС [56]. Окружность талии, высокий индекс массы тела (ИМТ), СД-2 и артериальная гипертония коррелировали с высоким риском уролитиаза [57]. Scales C.D. et al. (2007) сообщили об уменьшении соотношения «мужчины/женщины» среди больных уролитиазом [57]. Для почечных камней оно изменилось с 1,7:1 в 1997 году к 1,3:1 в 2002 году, что связано, по мнению авторов, с увеличением частоты ожирения и МС у мужчин, которые способствуют нивелированию гендерных особенностей уролитиаза [57]. Связь между факторами патогенеза МС и уролитиаза может осуществляться через уменьшение pH мочи (ацидофикацию), а ИР может выступать в роли фактора ацидофикации мочи [58]. Abate N. et al. (2004) показали, что увеличение инсулинорезистентности, определяемой на основании суточного эугликемического клэмп-теста, связано с более кислой реакцией мочи [59]. Maalouf N.M. et al. (2007) показали те же самые взаимоотношения, но использовали лабораторную модель инсулинорезистентности [60]. Кроме того, они же показали, что при увеличении числа компонентов МС экскреция аммония нарушается в большей степени. Одним из объяснений может быть инсулинорезистентность, которая, очевидно, уменьшает экскрецию аммония [60]. Инсулин показал себя как стимулятор почечного аммониогенеза в почках у крыс, собак и опоссумов [61]. Klisic J. et al. (2002) экспериментально доказали, что инсулин стимулирует (Na+/H+) обменник 3 типа в почечном эпителии, что позволяет тубулярному аммиаку трансформироваться в аммоний и, таким образом, создавать условия для развития низкой (кислой) pH мочи [62]. Когда были выявлены эти эффекты инсулина в почках, возникла мысль, что инсулинорезистентность может нарушать как аммониогенез, так и экскрецию аммония в почках [62]. Worcester E.М. et al. (2007) установили, что пациенты с идиопатической постпрандиальной экскрецией кальция выделяли большее количество кальция (по сравнению с контрольной группой) вследствие уменьшения тубулярной резорбции кальция без увеличения фильтрационной способности [63]. Возможно инсулинорезистентность - причина этого уменьшенного всасывания, заканчивающегося гиперкальциурией [63]. Поскольку инсулинорезистентность является компонентом MС, это могло бы объяснить гиперкальциурию у больных с артериальной гипертонией [63]. Одной из причин гипероксалурии у больных МС может быть увеличение эндогенного синтеза оксалатов из эндогенных гликогенных аминокислот [64]. Инсулинорезистентность может гипотетически увеличивать пул глюкозы, поэтому гликемический профиль может являться маркером обмена, т.к. метаболизм глюкозы тесно связан с эндогенным синтезом оксалатов [64]. Поэтому углеводный профиль Kabeya Y. et al. (2012) рассматривают как независимый фактор развития мочекаменной болезни [65] (рис. 2.).
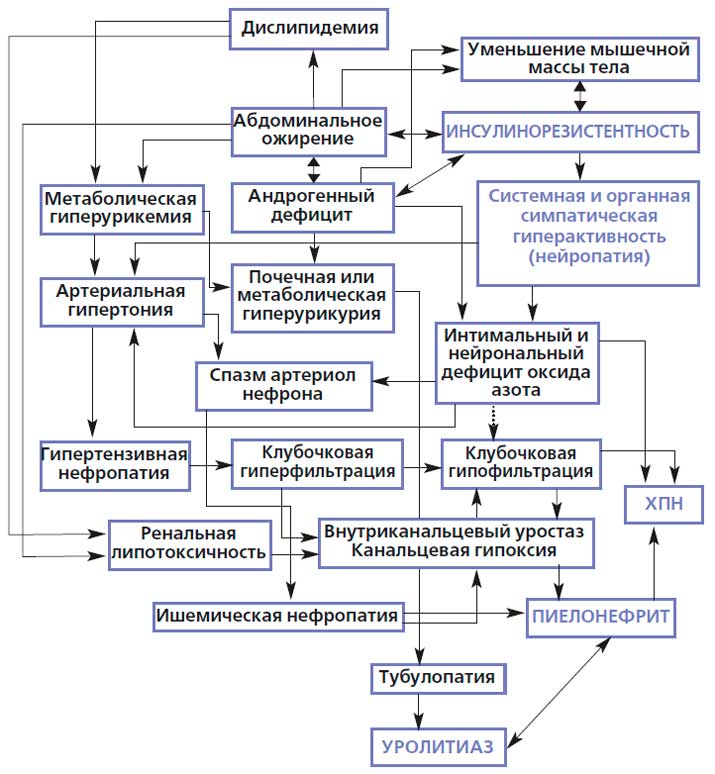
Рисунок 2. Общие патофизиологические механизмы инсулинорезистентности в патогенезе заболеваний почек.
ЗАКЛЮЧЕНИЕ
Накопившиеся в последние годы результаты многочисленных клинико-экспериментальных и эпидемиологических исследований свидетельствуют о всё более возрастающей роли системных гормонально-метаболических факторов в патогенезе большинства заболеваний человека, включая заболевания почек. Перспективным направлением патогенетической профилактики и лечения заболеваний почек является междисциплинарный подход, в рамках которого особый интерес представляет один из ключевых компонентов метаболического синдрома - инсулинорезистентность, оказывающая разносторонние патофизиологические эффекты, способные приводить к развитию и прогрессированию многих заболеваний почек, включая урологические, нефрологические и онкологические. Раннее выявление и коррекция инсулинорезистентности у больных с метаболическими нарушениями и заболеваниями почек будут способствовать как патогенетической профилактике этих заболеваний, так и оптимизации их современного лечения, стандартные схемы диагностики и терапии которых пока не учитывают индивидуальные особенности гормональнометаболического статуса пациента, а потому нередко носят длительный, рецидивирующий или прогрессирующий характер. Однако совершенно очевидно, что эффективное управление углеводным обменом у больных с различными заболеваниями почек позволит приблизиться к практической реализации задач их ранней профилактики и патогенетической терапии.
Список литературы:
- Mokdad AH, Ford ES, Bowman BA. Diabetes trends in the U.S.: 1990–1998 // Diabetes Care. 2000. Vol. 45, N 23. Р. 1278–1283.
- Geiss LS, Pan L., Cadwell B. Changes in incidence of diabetes in U.S. adults, 1997–2003 // Am J Prev Med. 2006. Vol. 24, N 30. Р. 371–377.
- Golden SH, Robinson KA, Saldanha I. Clinical review: prevalence and incidence of endocrine and metabolic disorders in the United States: a comprehensive review // J Clin Endocrinol Metab. 2009. Vol. 46, N 94. Р.1853–1878.
- Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. // М.: Медицина, 2000. 631 с.
- Mogensen CE, Christensen CK, Vittinghus E. e stages in diabetic renal disease with emphasis on the stage of incipient diabetic nephropathy // Diabetes. 1983. Vol. 32, N 34. Р. 64-78.
- Gorbachinsky I, Akpinar H, Assimos DG. Metabolic Syndrome and Urological Diseases // Rev Urol 2010. Vol. 41, N 12(4). Р. 157-180.
- Grundy SM, Cleeman JI, Daniels SR. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement // Circulation. 2005. Vol. 32, N 112. Р. 2735–2752.
- Landsberg L. Diet, obesity and hypertension: an hypothesis involving insulin, the sympathetic nervous system, and adaptive thermogenesis // Q J Med. 1986. Vol. 42, N 61. Р.1081–1090.
- Rustenbeck I. Desensitization of insulin secretion // Biochem Pharmacol. 2002. Vol. 54, N 63. Р. 1921–1935.
- Knowler WC, Barrett-Connor E, Fowler SE. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N Engl J Med. 2002. Vol. 33, N 346. Р. 393-403.
- Traish AM, Saad F, Guay A. e dark side of testosterone deficiency: II. Type 2 diabetes and insulin resistance // J Androl. 2009. Vol. 64, N 30. Р. 23–32.
- Blaak E. Gender differences in fat metabolism // Curr Opin Clin Nutr Metab Care. 2001. Vol. 26, N 4. Р. 499–502.
- Alberti G. Introduction to the metabolic syndrome // Eur Heart J. 2005. Suppl. D, N 7. Р. 3–5.
- Huang PL. A comprehensive definition for metabolic syndrome // Dis Model Mech. 2009. Vol. 34, N 2. Р. 231–237.
- Leibson CL, O’Brien PC, Atkinson E. Relative contributions of incidence and survival to increasing prevalence of adult-onset diabetes mellitus: a population-based study // Am J Epidemiol. 1997. Vol. 43, N 146. Р.12–22.
- 1McVary KT, Rademaker A, Lloyd GL, Gann P. Autonomic nervous system overactivity in men with lower urinary tract symptoms secondary to benign prostatic hyperplasia // J Urol. 2005. Pt. 1, N 174 (4). Р. 1327–1433.
- Vinik AI, Maser RE, Mitchell BD, Freeman R. Diabetic autonomic neuropathy // Diabetes Care. 2003. Vol. 26, N 34. Р. 1553–1579.
- Guay AT. ED2: erectile dysfunction = endothelial dysfunction // Endocrinol Metab Clin North Am. 2007. Vol. 25, N 36. Р. 453–463.
- Baron AD. Insulin resistance and vascular function // J Diabetes Complications. 2002. Vol. 45, N 16. Р. 92–102.
- Yassin AA, El-Sakka AI, Saad F, Gooren LJ. Metabolic syndrome, testosterone deficiency and erectile dysfunction never come alone // Andrologia. 2008. Vol. 37, N 40. Р. 259–264.
- Mravec B. Role of catecholamine-induced activation of vagal afferent pathways in regulation of sympathoadrenal system activity: negative feedback loop of stress response // Endocr Regul. 2011. Vol. 53, N 45(1). Р. 37-41.
- Rendina D, Mossetti G, De Filippo G. Association between metabolic syndrome and nephrolithiasis in an inpatient population in southern Italy: role of gender, hypertension and abdominal obesity // Nephrol Dial Transplant. 2009. Vol.44, N 24. Р. 900–906.
- Sakhaee K. Nephrolithiasis as a systemic disorder // Curr Opin Nephrol Hypertens. 2008. Vol. 38, N 17. Р. 304–309.
- Garrido AM, Griendling КК. NADPH oxidases and angiotensin II receptor signaling // Molecul Cell Endocrinol. 2009. Vol. 30, N 2. Р.148–158.
- Reddi AS, Bollineni JS. Selenium-deficient diet induces renal oxidative stress and injury via TGF-beta1 in normal and diabetic rats // Kidney Inter. 2001. Vol. 59, N 4. Р. 1342–1353.
- Mansouri E, Panahi M, Ghaffari MA, Ghorbani A. Effects of grape seed proanthocyanidin extract on oxidative stress induced by diabetes in rat kidney // Iran Biomed J. 2011. Vol. 15, N 3. Р.100–106.
- Maniu А, Perde-Schrepler М, Cosgarea М. Protective effect of LN-acetylcysteine against gentamycin ototoxicity in the organ cultures of the rat cochlea // Roman J Morphol Embryol. 2011.Vol. 52, N 1. Р. 159–164.
- Rodrigo R, Rivera G. Renal damage mediated by oxidative stress: a hypothesis of protective effects of red wine // Free Radical Biol Med. 2002. Vol. 33, N 3. Р. 409–422.
- Тюзиков И.А., Иванов А.П. Новые патогенетические механизмы заболеваний единственной почки (пилотное исследование) // Фундаментальные исследования. 2011. Часть 2, N 11. С. 366-368.
- Калинченко С.Ю., Тюзиков И.А. Метаболический синдром и уролитиаз (ли- тературный обзор) // Медицинский алфавит. Больница. 2011. N 3.С. 33-40.
- Тюзиков И.А., Мартов А.Г. Системные метаболические факторы патогенеза заболеваний единственной почки у мужчин (пилотное исследование) // Урология. 2012. N 3. С. 11-14.
- Svartberg J, von Möhlen D, Schirmer H. Association of endogenous testosterone with blood pressure and le ventricular mass in men. the Tromsø Study // Eur J Endocrinol. 2004. Vol.23, N 150. Р. 65–71.
- Печерский А.В., Домбровская Ю.А., Печерская О.В., Мороз Б.Т. Половые гормоны и регуляция экспрессии инсулиновых рецепторов // Материалы VI Российского Конгресса «Мужское здоровье» с международным участием. М. 2010. С. 308-310.
- Печерский А.В., Домбровская Ю.А., Печерская О.В., Мороз Б.Т. Роль частичного возрастного андрогенного дефицита в развитии инсулинорезистентности и нарушений микроциркуляции // Материалы Международного Конгресса по андрологии. Сочи. 2009. С. 132.
- Weinberg JM. Lipotoxicity // Kidney Int. 2006. Vol 32, N 70 (9). Р. 1560-1566.
- Schaffer JE. Lipotoxicity: when tissues overeat // Curr Opin Lipidol. 2003. Vol. 12, N 14. Р. 281–287.
- Niemczyk S, Niemczyk L, Romejko-Ciepielewska K. Basic endocrinological disorders in chronic renal failure // Endokrynol Pol. 2012. Vol. 36, N 63(3). Р. 250-257.
- Pham H, Utzschneider KM, de Boer IH. Measurement of insulin resistance in chronic kidney disease // Curr Opin Nephrol Hypertens. 2011. Vol. 15, N 20(6). Р. 640-646.
- Cheng HT, Huang JW, Chiang CK. Metabolic syndrome and insulin resistance as risk factors for development of chronic kidney disease and rapid decline in renal function in elderly // J Clin Endocrinol Metab. 2012. Vol. 33, N 97(4). Р. 1268-1276.
- Бернштейн Л.М. Антидиабетический бугуанид метформин и онкологическая заболеваемость // Сахарный диабет. 2010. N 3. С. 3-6.
- Васильев Д.А., Семенова Н.В., Бернштейн Л.М. Сахарный диабет, нарушение толерантности к глюкозе и злокачественные новообразования: степень риска и меры воздействия // Российский онкологический журнал. 2008. N 3. С. 49-54.
- Sánchez-Lara K, Morales-Graf L, Green D. Сancer and obesity // Cancer Causes Control. 2011. Vol. 34, N 22(2). Р. 291-299.
- Wu QM, Wu QY, Zhang AQ. Metabolic disturbance and insulin resistance in patients with colorectal cancer // China Gac Med Mex. 2010. Vol. 45, N 146(5). Р. 326-331.
- Аляев Ю.Г., Григорян В.А., Крапивин А.А., Султанова Е.А. Опухоль почки. // М.: ГЭОТАР-Медиа, 2002. 53 с.
- Belfiore А, Мalaguarnera R. e insulin receptor and cancer. // Endocrin Relat Cancer. 2011. Vol. 54, N 18(4). P. 125-147.
- Silbiger S, Neugarten J. Gender and human chronic renal disease. // Gend Med. 2008. Suppl. A, N 5. Р. 3–10.
- Frasca F, Pandini G, Sciacca L. e role of insulin receptors and IGF-I receptors in cancer and other diseases // Am J Clin Nutr. 2007. Vol. 22, N 86(3). Р. 843-857.
- Forte V, Pandey A, Abdelmessih R. Obesity, Diabetes, the Cardiorenal Syndrome and Risk for Cancer // Cardiorenal Med. 2012. Vol. 123, N 2(2). Р. 143-162.
- Tanner RM, Brown TM, Muntner P. Epidemiology of obesity, the metabolic syndrome and chronic kidney disease // Curr Hypertens Rep. 2012. Vol. 56, N 14(2). Р. 152-159.
- Ensling M, Steinmann W, Whaley-Connell A. Hypoglycemia: A Possible Link between Insulin Resistance, Metabolic Dyslipidemia, and Heart and Kidney Disease (the Cardiorenal Syndrome) // Cardiorenal Med. 2011. Vol. 10, N 1(1). Р. 67-74.
- Duffey BG, Pedro RN, Kiredberg C. Lithogenic risk factors in the morbidly obese population // J Urol. 2008. Vol. 23, N 179. Р.1401–1406.
- Ekeruo WO, Tan YH, Young MD. Metabolic risk factors and the impact of medical therapy on the management of nephrolithiasis in obese patients // J Urol. 2004. Vol. 31, N 172. Р.159–163.
- Аполихин О.И., Сивков А.В., Бешлиев Д.А., Солнцева Т.В., Комарова В.А. Анализ уронефрологической заболеваемости в Российской Федерации по дан- ным официальной статистики. // Экспериментальная и клиническая урология. 2010. N 1. С. 4-11.
- Голованов С.А., Сивков А.В., Дзеранов Н.К., Яненко Э.К., Дрожжева В.В. Рас- пространенность метаболических типов мочекаменной болезни в московском регионе: сравнительный анализ за период с 1990 по 2000 годы. // Эксперимен- тальная и клиническая урология. 2010. N 3. С.27-32.
- Rendina D, Mossetti G, De Filippo G. Association between metabolic syndrome and nephrolithiasis in an inpatient population in southern Italy: role of gender, hypertension and abdominal obesity // Nephrol Dial Transplant. 2009. Vol.23, N 24. Р. 900–906.
- West B, Luke A, Durazo-Arvizu RA. Metabolic syndrome and self-reported history of kidney stones: the National Health and Nutrition Examination Survey (NHANES III) 1988–1994 // Am J Kidney Dis. 2008. Vol.123, N 51. Р.741–747.
- Scales CD Jr., Curtis LH, Norris RD. Changing gender prevalence of stone disease // J Urol. 2007. Vol. 45, N 177. Р. 979–982.
- Hamm LL, Hering-Smith KS. Pathophysiology of hypocitraturic nephrolithiasis // Endocrinol Metab Clin North Am. 2002. Vol. 34, N 31. Р.885–893.
- Abate N, Chandalia M, Cabo-Chan AVJr. e metabolic syndrome and uric acid nephrolithiasis: novel features of renal manifestation of insulin resistance // Kidney Int. 2004.Vol. 56, N 65. Р.386–392.
- Maalouf NM, Cameron MA, Moe OW. Low urine pH: a novel feature of the metabolic syndrome // Clin J Am Soc Nephrol. 2007. Vol. 67, N 2. Р.883–888.
- Schwille PO, Schmiedl A, Herrmann U, Wipplinger J. Postprandial hyperinsulinaemia, insulin resistance and inappropriately high phosphaturia are features of younger males with idiopathic calcium urolithiasis: attenuation by ascorbic acid supplementation of a test meal // Urol Res. 1997. Vol. 17, N 25. Р. 49–58.
- Klisic J, Hu MC, Nief V. Insulin activates Na(+)/H(+) exchanger 3: biphasic response and glucocorticoid dependence // Am J Physiol Renal Physiol. 2002. Vol.158, N 283. Р. 532–539.
- Worcester EM, Gillen DL, Evan AP. Evidence that postprandial reduction of renal calcium reabsorption mediates hypercalciuria of patients with calcium nephrolithiasis // Am J Physiol Renal Physiol. 2007. Vol. 234, N 292. Р.66–75.
- Lemann JJr, Pleuss JA, Worcester EM. Urinary oxalate excretion increases with body size and decreases with increasing dietary calcium intake among healthy adults // Kidney Int. 1996. Vol.23, N 49. Р. 200–208.
- Kabeya Y, Kato K, Tomita M. Associations of insulin resistance and glycemic control with the risk of kidney stones // Intern Med. 2012. Vol.34, N 51(7). Р. 699-705.






