Мочекаменная болезнь является широко распространенным заболеванием, в том числе среди людей трудоспособного возраста. Частота уролитиаза варьирует от 1 до 20%; в Европейских странах данная патология встречается у 4-5% населения [1]. Международные и Российские эпидемиологические данные свидетельствуют о том, что заболеваемость и распространенность мочекаменной болезни из года в год растут. Так, в Российский Федерации по данным официальной статистики за период с 2011 по 2016 годы число страдающих от этой патологии увеличилось с 198 413 до 217 469 человек [2].
В настоящее время наибольшее распространение в хирургическом лечении мочекаменной болезни получили дистанционная литотрипсия (ДЛТ) и эндоскопические операции, в том числе, лазерные методики дробления конкрементов. Несмотря на высокую эффективность современных методов эндоскопического и дистанционного дробления камней, новые методики и технологии привнесли новые факторы риска развития послеоперационных осложнений, ведущими из которых являются инфекционно-воспалительные: пиелонефрит, синдром системной воспалительной реакции (ССВР), в том числе, уросепсис. При эндоскопических вмешательствах, по данным различных авторов, частота развития острого пиелонефрита в послеоперационном периоде достигает 87,5% [3], ССВР – 27,4%, а в 7,9% встречается уросепсис [4,5]. Инфекционно-воспалительные осложнения удлиняют сроки пребывания пациентов в стационаре и последующий реабилитационный период, удорожают лечение.
При дистанционной литотрипсии общий показатель осложнений достигает 15,3%, что ниже, чем при перкутанных и уретероскопических вмешательствах. Наиболее распространенными из них являются нарушение сердечного ритма (11-59%), бактериурия (7,7-23%), гематома (4-19%), каменная дорожка (4-7%), почечная колика (2-4%) и сепсис (1-2,7%), а также спорадические тяжелые сердечно-сосудистые события, перфорации кишечника, гематомы печени или селезенки [1].
С целью оценки основных причин и факторов риска возникновения инфекционно-воспалительных осложнений и состояния методов их профилактики были проанализированы научные публикации, содержащие материалы по данной теме, размещенные в базе PubMed, eLibrary и других доступных источниках, официальные рекомендации ведущих мировых урологических сообществ.
ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫЕ ОСЛОЖНЕНИЯ ПОСЛЕ ДИСТАНЦИОННОЙ ЛИТОТРИПСИИ И СОВРЕМЕННЫЕ МЕТОДЫ ИХ ПРОФИЛАКТИКИ
На сегодняшний день нет общепринятого консенсуса относительно необходимости антибиотикопрофилактики перед выполнением процедуры ДЛТ у пациентов без факторов риска развития пиелонефрита. Частота инфекционно-воспалительных осложнений после неосложненной ДЛТ по данным литературы составляет 1%, а в случае коралловидных конкрементов достигает 2,7%. Риск инфекционно–воспалительных осложнений значительно увеличивается в случае наличия бактериурии до проведения операции – дробления камня [6]. Так, в крупном исследовании Duvdevani M. и соавт. в 1,4% случаев из 11 500 проведенных ДЛТ развилась лихорадка до 38ºС [7]. В качестве факторов риска развития послеоперационной лихорадки авторами были выделены: положительный посев мочи (р<0,05), наличие постоянной нефростомы или мочеточникового стента (р <0,001), а также предшествующая процедуре дробления симптоматическая инфекция мочевыводящих путей (р <0,05).
В исследовании, проведенном Mira Moreno A. и соавт., были изучены культуры мочи 366 пациентов, перенесших ДЛТ без предварительной антибиотикопрофилактики. Микрофлора в моче была выявлена у 8,5% пациентов через 7 дней после процедуры ДЛТ. Из них только у 2,1% пациентов развились симптомы инфекции мочевыводящих путей, в остальных случаях имела место бессимптомная бактериурия [8]. В другом крупном двадцатилетнем исследовании, выполненном Alexander C. и соавт., не было выявлено значимых различий в показателе развития инфекционно-воспалительных осложнений после ДЛТ у пациентов, получавших предварительную антибиотикопрофилактику (1,1%), и у пациентов без таковой (1,3%) [9]. В 2012 году был опубликован метаанализ, включивший девять рандомизированных контролируемых исследований, в котором проанализированы истории болезни 1 364 пациентов, подвергшихся дистанционной литотрипсии, со стерильной перед ДЛТ мочой. Не было обнаружено существенных различий в развитии инфекционно-воспалительных осложнений после ДЛТ между группой пациентов, получавших перед ДЛТ антибиотикопрофликтику, и контрольной группой [10]. Это исследование продемонстрировало отсутствие необходимости выполнения антибиотикопрофилактики пациентам перед ДЛТ в случае отсутствия факторов риска, что нашло свое отражение в рекомендациях Европейской ассоциации урологов и Американской урологической ассоциации. При том, что недавнее исследование, проведенное учеными из Ростова-на-Дону (Коган М.И. и соавт.), показало, что моча здорового человека не является стерильной средой [11].
Американская урологическая ассоциация рекомендует проводить антибиотикопрофилактику только пациентам с факторами риска развития послеоперационных инфекционных осложнений [12]. Европейская ассоциация урологов рекомендует назначать профилактику лишь пациентам с недавно установленным мочеточниковым стентом и в случае высокой вероятности инфицирования (наличие постоянного катетера, нефростомического дренажа, инфицированного уролитиаза) [1].
ФАКТОРЫ РИСКА РАЗВИТИЯ ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ ПОСЛЕ КОНТАКТНОЙ ЛИТОТРИПСИИ
В настоящее время в лечении уролитиаза наиболее широко применяется контактная литотрипсия с использованием различных механизмов дробления камней в зависимости от типа используемого контактного литотриптера: электрогидравлическая, ультразвуковая, пневматическая, электрокинетическая или лазерная. Каждый из методов имеет свои преимущества и недостатки.
Принципы современной литотрипсии базируются на дроблении конкрементов до мелких осколков, которые легко удалить через доступы малого диаметра, однако мелкая фрагментация неизбежно сопровождается высвобождением большого количества бактерий и токсинов, заключенных в конкременте [13]. Обеспечение интраоперационной визуализации в полостной системе почки, мочеточника, мочевого пузыря достигается и, соответственно, эпизодами повышения давления постоянным током жидкости. При повышении внутрилоханочного давления возникает риск пиеловенозного рефлюкса с возникновением бактериемии и токсемии с последующим развитием пиелонефрита, ССВР и уросепсиса. Эти факторы необходимо учитывать, изучать и, по возможности, нивелировать их влияние.
Бактериурия, как фактор риска развития инфекционно-воспалительных осложнений в послеоперационном периоде
Вопрос о влиянии бактериурии на развитие инфекционно-воспалительных осложнений до сих пор остается дискутабельным. Имеется большое количество публикаций, которые показывают, что риск развития послеоперационного инфекционно-воспалительного процесса намного выше как после уретероскопии, так и после перкутанных вмешательств при выполнении их на фоне бактериурии (табл. 1) [14–19].
Считают, что бактериальная культура мочи почечных лоханок, культура бактерий из камней и пузырной мочи (даже при условии адекватного антибактериального лечения) являются важными предикторами потенциального уросепсиса [20,21]. В то же время отмечено, что лихорадка в послеоперационном периоде может возникать даже при стерильном предоперационном посеве мочи и антибактериальной профилактике, поскольку источником инфекции может быть флора внутри конкремента [1]. Некоторыми исследователями продемонстрировано, что бактериальная культура камней является более значимым предиктором сепсиса и ССВР в послеоперационном периоде, чем бактериальная флора пузырной мочи [15,20-22]. Так в трудах Mariappan P. и соавт. показано, что бактериальная флора камней и интраоперационной лоханочной мочи являются важнейшими предикторами уросепсиса после перкутанной нефролитолапаксии (ПНЛЛ). Этот же автор отмечает четырехкратный риск развития послеоперационного уросеписиса у пациентов с положительным посевом конкрементов и лоханочной мочи [21]. В этом исследовании чувствительность и специфичность культуры лоханочной мочи и посева конкрементов для прогнозирования ССВР составляли 73%/74% и 71%/82%, соответственно. Многоцентровое проспективное исследование, проведенное Walton-Diaz A. и соавт. в 2016 году, продемонстрировало слабую корреляцию между культурами, выделенными при стандартном посеве пузырной мочи и посеве внутрилоханочной мочи и камней. В то же время коэффициент соответствия между культурами лоханочной мочи и конкрементов составлял 83,3% [23]. Таким образом, флора, флотирующая в моче, менее значима для развития послеоперационных инфекционно-воспалительных осложнений, чем флора, связанная с конкрементами. Известно, что бактерии способны длительное время находиться в почечных камнях в составе биопленок. Также известно, что при проведении антимикробной терапии гибнут микроорганизмы, находящиеся в планктонной форме, в отличие от микроорганизмов, интегрированных в биопленку [3]. Эти факторы необходимо учитывать при назначении антибактериальных профилактических мероприятий.
Инфицированные конкременты и минералогический состав камня, как возможные предикторы развития инфекционно-воспалительных осложнений
По данным зарубежных авторов, распространенность камней, ассоциированных с инфекционным агентом, составляет до 30% [24]. Термин «инфекционный камень» относят к камням, в основе образования которых лежит инфекция мочевых путей (а именно бактерии, продуцирующие фермент уреазу, расщепляющий мочевую кислоту), а также вторично инфицированным камням любого химического состава, в том числе камням, нарушающим уродинамику и, как следствие, приводящиv к развитию пиелонефрита. Инфекционные камни чаще всего состоят из магния и аммония фосфата (минерал струвит), кальция фосфата (минерал апатит) и/или урата аммония. Эти камни являются следствием инфицирования мочевой системы уреазопродуцирующей флорой, и часто образуют крупные разветвленные камни, известные как коралловидные. К наиболее распространенным уреазопродуцирующим бактериям относятся Proteus spp, Klebsiella spp, Providencia spp, Morganella morganni и Staphylococcus aureus. Так же были описаны вторично инфицированные камни, которые по химическому составу не относятся к фосфату магния и аммония (струвитам) или кальций-карбонат-апатитам, но связаны с инфекцией. В группе из 125 пациентов, подвергшихся чрескожной нефролитотомии, de Cogain M.R. и его коллеги обнаружили, что 24 пациента с не струвитными камнями имели положительные культуры камней [25]. В то же время, микробиологическое исследование микрофлоры удаленных конкрементов, проведенное российскими исследователями, показало, что 51% камней (103 из 200) оказались инфицированным, и в большинстве случаев имела место микст-инфекция. При этом наиболее часто выделялись Еnterococcus faecalis, Enterococcus faecium, Staphylococcus epidermidis, Staphylococcus haemolyticus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Proteus mirabilis, Escherichia coli [26]. В исследовании, выполненном D. Margel и соавт. в 2006 году, у 25% пациентов микроорганизмы были обнаружены в камне при отсутствии роста флоры в пузырной моче [27]. J.R. Eswara и соавт. ретроспективно проанализировали свой опыт изучения флоры, ассоциированной с камнями, у пациентов, перенесших уретероскопические вмешательства. Авторы обнаружили, что культуры мочи были положительными у 7% пациентов, тогда как у 29% из конкрементов была выделена бактериальная флора. Общий уровень сепсиса составлял около 3–4% для всех пациентов, 8% для пациентов с положительной культурой, полученной из камней, и только 1% для тех, у кого были отрицательные посевы конкрементов [22]. В крупном исследовании, проведенном Parkhomenko E. и соавт., 72% пациентов со струвитным уролитиазом имели положительную культуру конкрементов [28]. Также известно, что инфицированные конкременты содержат до 40 раз больше эндотоксинов в сравнении с неинфицированными конкрементами [29].
Таблица 1. Влияние предоперационной бактериурии на развитие ССВР в послеоперационном периоде
Table 1. The influence of preoperative bacteriuria on the development of SIRS in the postoperative period
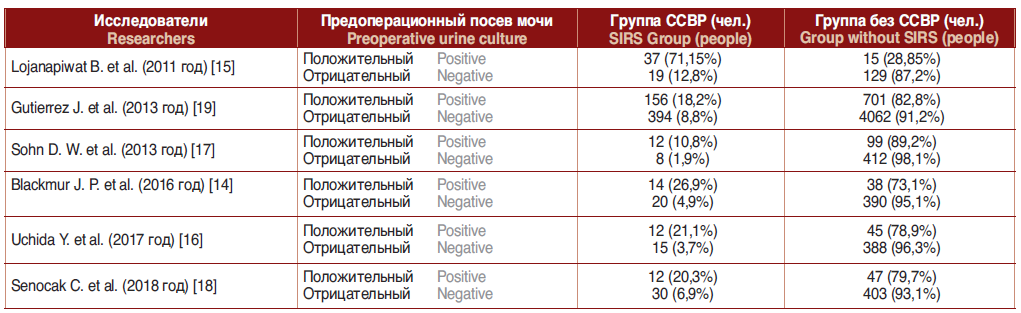
Таким образом, инфицированный уролитиаз несет риск развития в послеоперационном периоде инфекционно-воспалительных осложнений и требует поиска методик дробления, препятствующих массивному высвобождению бактериальной флоры и эндотоксинов из камня, а также методов инактивации высвободившихся при литотрипсии бактерий и их токсинов.
Размер конкрементов, время оперативного вмешательства и интраоперационное повышение внутрилоханочного давления, как факторы развития инфекционно-воспалительных осложнений
Размер камней играет роль, как один из предикторов развития послеоперационных инфекционно-воспалительных изменений. Крупные камни, т.е. больше 20 мм [1], с большей вероятностью являются инфекционными и содержат большее количество эндотоксинов [20]. К тому же, остаточные фрагменты крупных и сложных камней после ПНЛЛ могут содержать бактерии и эндотоксины, и вызывать системные осложнения [13]. Показано, что камни более 20 мм имеют больший риск развития инфекционного процесса по сравнению с размерами 20 мм или менее [21]. Размер камня более 60 мм был независимым фактором риска развития уросептического шока в послеоперационном периоде (20,5% против 6,4%) в исследовании, проведенном J. Fan и соавт. В этом же исследовании пациенты с продолжительностью оперативного вмешательства более 120 минут имели более высокую частоту развития уросепсиса (32,4% против 7,6%) [29]. Аналогичным образом, было показано, что диаметр конкремента больше 10 мм в трех измерениях увеличивает риск развития послеоперационного уросепсиса [14]. Y. Wang и соавт. в своем исследовании показал, что продолжительность оперативного вмешательства более 90 минут ассоциирована с большей частотой развития уросепсиса (p = 0,001) [30].
Установлено, что продолжительность оперативного вмешательства и пиеловенозный рефлюкс в связи с повышением внутрилоханочного давления играют значимую роль в развитии послеоперационных инфекционновоспалительных осложнений даже в случае отрицательных результатов посевов мочи на флору [19,22,30].
Особенности оперативной техники выполнения контактной литотрипсии приводят к тому, что во время выполнения уретероскопического вмешательства внутрилоханочное давление достигает максимума в момент, когда уретероскоп расположен в почечной лоханке, и снижается по мере движения к дистальному отделу мочеточника (59 см вод. ст. и 52 см вод. ст., или 44 мм рт.ст. и 39 мм рт.ст. соответственно, при ирригационном давлении 200 см вод. ст.) [31]. При вынужденном повышении давления ирригации для улучшения интраоперационной визуализации, внутрипочечное давление может достигать 446 см вод. ст. (или 328 мм рт. ст.) [32]. В многочисленных исследованиях показано, что повышение внутрилоханочного давления выше критических значений во время уретероскопических вмешательств способствует возникновению пиеловенозного рефлюкса ирригационной жидкости, содержащей токсины и бактерии, что может стать причиной развития в послеоперационном периоде инфекционно-воспалительных осложнений, включая уросепсис [33,34]. W. Zhong и соавт. в своем исследовании показали, что у пациентов, у которых во время операции поддерживалось внутрилоханочное давление выше 30 мм рт.ст. в течение более 50 секунд, чаще развивалась послеоперационная лихорадка [35].
Таким образом, размер конкремента больше 60 мм и/или время операции более 90 минут связаны с высоким риском развития в послеоперационном периоде инфекционно-воспалительных осложнений в связи с неизбежностью возникновения высокого интраоперационного внутрилоханочного давления и необходимостью использования большого объема ирригационной жидкости, что способствует ее пиеловенозным забросам.
Следовательно, одной из первостепенных задач в борьбе с инфекционно-воспалительными осложнениями при лечении больных мочекаменной болезнью является профилактика повышения внутрилоханочного давления и достижение асептического дробления конкрементов с целью снижения высвобождения и рефлюкса бактерий и токсинов в кровь.
СОВРЕМЕННЫЕ МЕТОДЫ ПРОФИЛАКТИКИ ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫХ ОСЛОЖНЕНИЙ КОНТАКТНОЙ ЛИТОТРИПСИИ С УЧЕТОМ ФАКТОРОВ РИСКА
Антибиотикопрофилактика Российское общество урологов (РОУ), Американская урологическая ассоциация (АУА), Европейская ассоциация урологов сформулировали рекомендации относительно периоперационной антибиотикопрофилактики. Так, АУА рекомендует всем пациентам, которым планируется выполнение перкутанной нефролитолапаксии, назначать предоперационную антибиотикопрофилактику за 24 часа или менее антибиотиком широкого спектра действия [12]. В рекомендациях ЕАУ [1] и РОУ [36] указано на достаточность назначения одной дозы антибиотика (рекомендации класса А) перед операцией. Тем не менее, несмотря на эти рекомендации, недавнее крупное исследование, проведенное Carlos E.C. и соавт. среди членов международного эндоурологического общества, продемонстрировало, что 21-39% практикующих оперирующих урологов проводят длительные курсы антибиотикопрофилактики до получения отрицательного результата посева мочи перед уретероскопией и перкутанной нефролитолапаксией [37].
На данный момент преимущество предоперационных курсов антибиотиков до получения отрицательного результата предоперационной культуры мочи перед выполнением перкутанной нефролитотрипсии остается неясным. В исследовании, в котором сравнивали группы пациентов, получавших или ципрофлоксацин, или цефтриаксон в различных режимах дозирования (однократно или до удаления нефростомы), не было получено статистически достоверной разницы в развитии ССВР в этих группах [38]. В похожем исследовании авторы не выявили преимуществ назначения короткого курса антибиотикопрофилактики по сравнению с однократным введением антибиотика с целью профилактики послеоперационной лихорадки [39].
В исследовании CROES Percutaneous Nephrolithotomy Global Study (2007-2009 годы) группа из 162 пациентов с отрицательными результатами посева мочи, которым была выполнена перкутанная нефролитолапаксия без проведения предоперационной антибиотикопрофилактики, была сопоставлена с такой же группой пациентов, которые получали антибиотики, согласно спектру антибиотикорезистентности в каждом медицинском учреждении, участвовавшем в исследовании [40]. Это сопоставимое исследование случай-контроль показало, что профилактика антибиотиками привела к меньшему количеству случаев лихорадки (2,5% против 7,4%) и других осложнений (1,9% против 22%) и имела более высокий уровень достижения уровня «stonefree » – полного освобождения чашечно-лоханочной системы от камней инфекционного генеза (86,3% против 74%). С другой стороны, недавнее рандомизированное контролируемое исследование показало отсутствие преимуществ предоперационной антибиотикопрофилактики у пациентов с отрицательным посевом мочи [41]. Таким образом, имеется большое количество разноречивых литературных данных по вопросу предоперационной антибактериальной профилактики – ее необходимости, обоснованности и времени проведения.
С учетом проведенных исследований, остается целесообразным профилактическое однократное назначение антибиотика широко спектра перед выполнением перкутанной нефролитолапаксии. Назначение длительных курсов антибиотиков перед операцией может быть неэффективным в связи с низким уровнем корреляции между бактериальной культурой внутрипузырной мочи и бактериальной флорой конкрементов [23].
В мире отмечается стремительный рост антибиотикорезистентности [42]. Недавние исследования продемонстрировали бактериурию, характеризующуюся множественной лекарственной устойчивостью (резистентная к трем или более вариантам антибиотиков, рекомендованных Американской урологической ассоциацией), что несет существенный независимый риск развития послеоперационного сепсиса, даже несмотря на надлежащую предоперационную антибиотикотерапию [43]. В исследовании Senocak C. и соавт. у 32,2% пациентов с положительным посевом предоперационной мочи были выделены изоляты бактерий с множественной лекарственной устойчивостью [18]. Таким образом, высокий уровень антибиотикорезистентности является значительным фактором отсутствия эффекта от эмпирического назначения препарата до операции.
Поэтому для больных мочекаменной болезнью актуальным является поиск методов профилактики инфекционно-воспалительных осложнений, отличных от антибактериальных средств, обладающих не только бактерицидным, но и нефропротективным эффектом, и не приводящим к развитию резистентности после многократного воздействия.
Профилактика лоханочно-венозного рефлюкса
Современные тенденции в развитии эндоскопической хирургии уролитиаза связаны, прежде всего, со снижением инвазивности за счет уменьшения диаметра перкутанного доступа, и внедрением новых, более эффективных литотриптеров. Так, все большую популярность стали приобретать, так называемые, mini-, microи ultraminiperc-нефролитотрипсии, обладающие безусловным преимуществом над стандартной ПНЛЛ в объеме интраоперационной кровопотери, послеоперационного болевого синдрома и сроках госпитализации в случаях, если размер конкремента не превышает 20 мм [44]. Однако, как показала практика, в связи с малым диаметром рабочего канала значительно ухудшается интраоперационная визуализация в сравнении со стандартной ПНЛЛ. Также этот фактор накладывает ограничения на использование инструментов, размеры которых должны соответствовать диаметру канала амплац-кожуха. В свою очередь, и фрагменты удаляемого конкремента должны быть, соответственно, меньше диаметра рабочего канала нефроскопа. Таким образом, метод mini-, microи ultraminiperc-нефролитотрипсии лучше всего подходит для педиатрической практики или в случае конкремента размером менее 2 см [45]. Известно, что использование инструментов меньшего калибра несет риск повышения внутрипочечного давления [46]. В исследовании Tepeler A. и соавт. было продемонстрировано повышение внутрилоханочного давления выше 30 мм рт. ст. при выполнении микроперкутанного вмешательства [46]. Чтобы предотвратить лоханочно-венозный рефлюкс, и как следствие, занос бактерий и токсинов в кровяное русло при выполнении эндоскопических вмешательств, внутрипочечное давление должно поддерживаться на уровне ниже 40 см вод. ст. (или 30 мм рт. ст.) [1]. Применение мочеточниковых кожухов во время уретероскопии позволяет снизить ирригационное давление, передаваемое почечной лоханке, а затем и паренхиме, на 57–75%. Даже когда через уретероскоп подается давление орошения 200 см вод. ст. (или 147 мм рт. ст.) внутриполостное давление остается ниже 20 и 30 см вод. ст. (или 15 и 22 мм рт. ст.) при использовании мочеточниковых кожухов диаметров 12/14 Fr и 10/12 Fr, соответственно [31]. В исследовании Chen Y. и соавт. на 1 139 пациентах было продемонстрировано преимущество использования мочеточниковых кожухов диаметром 14/16 Fr по сравнению с 12/14 Fr в предотвращении послеоперационных инфекционных осложнений при гибкой уретероскопической литотрипсии [47]. Сделан вывод, что мочеточниковые кожухи с гидрофильным покрытием «обеспечивают постоянный отток ирригационной жидкости, что позволяет улучшить качество изображения, поддерживать низкое внутрипочечное давление и сократить время операции» [1]. Тем не менее известно, что использование мочеточниковых кожухов может привести к возникновению таких послеоперационных осложнений, как персистирующая гематурия, развитие стриктуры мочеточника, экстравазация мочи и ряда других [48]. Европейская ассоциация урологов не дает четких рекомендаций по применению мочеточниковых кожухов, указывая, что «использование кожуха зависит от предпочтений хирурга» [1]. В связи с отсутствием качественных рандомизированных исследований влияния использования мочеточниковых кожухов на результат операции и течение послеоперационного периода, остается неясным вопрос целесообразности их применения в рутинной практике. Литературный анализ позволяет считать, что использование мочеточниковых кожухов возможно, и зависит от предпочтений оперирующего уролога. С учетом риска развития в послеоперационном периоде ССВР и уросепсиса, их использование может стать фактором, снижающим количество осложнений при дроблении крупных конкрементов (больше 60 мм) и при предполагаемой длительности оперативного вмешательства свыше 90 минут.
ЗАКЛЮЧЕНИЕ
Мировые данные свидетельствуют о неуклонном росте больных мочекаменной болезнью, в связи с чем растет и объем оперативных вмешательств по этому поводу. Несмотря на достигнутый прогресс в развитии малоинвазивных эндоскопических методик лечения уролитиаза, проблема профилактики инфекционно-воспалительных осложнений остается актуальной. Имеющиеся на сегодняшний день в арсенале урологов методики дробления конкрементов, несмотря на свою эффективность, не лишены ряда недостатков. В частности, мелкооскольчатое дробление камней с высвобождением бактерий и токсинов с их последующим забросом в сосудистую сеть почки в связи с интраоперационным повышением внутрилоханочного давления, может стать причиной развития послеоперационного пиелонефрита, ССВР и уросепсиса, рецидивов камнеобразования. До сих пор применение антибиотиков является основным в борьбе с уропатогенами. Тем не менее, ежегодно регистрируется неуклонный рост уровня резистентности бактерий к антибиотикам.
Исходя из этого, проблема разработки альтернативных способов литотрипсии, ограничивающих разброс осколков камней по полостной системе почки, позволяющих минимизировать повышение внутрилоханочного давления, новых методик профилактики инфекционно-воспалительных осложнений в лечении больных уролитиазом, в механизме которых предусмотрен антибактериальный эффект, является актуальным.
Литература
- EAU Guidelines on Urolithiasis [Electronic resource] (edited by C. Türk, A. Neisius, A. Petrik, C. Seitz, A. Skolarikos, A. Tepeler, K. Thomas). European Association of Urology 2017:84. https://uroweb.org/wp-content/uploads/EAUGuidelineson-Urolithiasis_2017_10-05V2.pdf.
- Александрова Г.А., Поликарпов А.В., Голубев Н.А., Оськов Ю.И., Кадулина Н.А., Беляева И.М. et al. Заболеваемость всего населения России в 2016. Статистические материалы. Часть I [Электронный ресурс]. М.: 2017: 140 с. https://www.rosminzdrav.ru/ministry/61/22/stranitsa-979/statisticheskiei-informatsionnye-materialy/statisticheskiy-sbornik-2016-god. [Aleksandrova G.A., Polikarpov A.V., Golubev N.A., Os'kov YU.I., Kadulina N.A., Belyaeva I.M. et al. The incidence of the entire population of Russia in 2016. Statistical materials. Part I [Electronic resource]. M.: 2017: 140 s. (In Russian.)].
- Толордава Э.Р. Роль бактериальный биопленок в этиопатогенезе мочекаменной болезни: автореф. дис. … канд. биол. наук. М.: 2014: 27 с. [Tolordava E.R. The role of bacterial biofilms in the etiopathogenesis of urolithiasis: author. dis. ... cand. biol. sciences. M.: 2014: 27 s. (In Russian.)].
- Liu YQ, Lu J, Hao YC, Xiao CL, Ma LL. Predicting model based on risk factors for urosepsis after percutaneous nephrolithotomy. Beijing Da Xue Xue Bao Yi Xue Ban 2018; 18;50(3):507-513.
- Koras O, Bozkurt IH, Yonguc T, Degirmenci T, Arslan B, Gunlusoy B et al. Risk factors for postoperative infectious complications following percutaneous nephrolithotomy: a prospective clinical study. Urolithiasis 2015; 43(1):55-60. doi: 10.1007/s00240-014-0730-8.
- Wollin DA, Joyce AD, Gupta M, Wong MYC, Laguna P, Gravas S et al. Antibiotic use and the prevention and management of infectious complications in stone disease. World J Urol 2017; 35(9):1369-1379. doi: 10.1007/ s00345-017-2005-9
- Duvdevani M, Lorber G, Gofrit ON, Latke A, Katz R, Landau EH et al. Fever after shockwave lithotripsy–risk factors and indications for prophylactic antimicrobial treatment. J Endourol 2010; 24(2):277-81. doi: 10.1089/end.2009.0283.
- Mira Moreno A, Montoya Lirola MD, García Tabar PJ, Galiano Baena JF, Tenza Tenza JA, Lobato Encinas JJ. Incidence of infectious complications after extracorporeal shock wave lithotripsy in patients without associated risk factors. J Urol 2014; 192(5):1446-9. doi: 10.1016/j.juro.2014.05.091.
- Alexander CE, Gowland S, Cadwallader J, Hopkins D, Reynard JM, Turney BW. Routine antibiotic prophylaxis is not required for patients undergoing shockwave lithotripsy: outcomes from a national shockwave lithotripsy database in New Zealand. J Endourol 2016; 30(11):1233-1238. DOI: 10.1089/end.2016.0345
- Lu Y, Tianyong F, Ping H, Qiang W. Antibiotic prophylaxis for shock wave lithotripsy in patients with sterile urine before treatment may be unnecessary: a systematic review and meta-analysis. J Urol 2012; 188(2):441-8. doi: 10.1016/j.juro.2012.04.014
- Коган М.И., Набока Ю.Л., Ибишев Х.С., Гудима И.А. Нестерильность мочи здорового человека – новая парадигма в медицине. Урология 2014; 5: 48-52. [Kogan M.I., Naboka YU.L., Ibishev H.S., Gudima I.A. The urine non-sterility of a healthy person is a new paradigm in medicine. Urologiya 2014; 5: 48-52. (In Russian.)].
- Assimos D, Krambeck A, Miller NL, Monga M, Murad MH, Nelson CP et al. Surgical Management of Stones: American Urological Association/Endourological Society Guideline, PART I. J Urol 2016; 196(4):1153-60. doi: 10.1016/j.juro.2016.05.090.
- Degirmenci T, Bozkurt IH, Celik S, Yarimoglu S, Basmaci I, Sefik E. Does leaving residual fragments after percutaneous nephrolithotomy in patients with positive stone culture and/or renal pelvic urine culture increase the risk of infectious complications. Urolithiasis 2018; 4. doi: 10.1007/s00240-018-1063-9
- Blackmur JP, Maitra NU, Marri RR, Housami F, Malki M, McIlhenny C. Analysis of factors' association with risk of postoperative urosepsis in patients undergoing ureteroscopy for treatment of stone disease. J Endourol 2016; 30(9):963-9. doi: 10.1089/end.2016.0300
- Lojanapiwat B, Kitirattrakarn P. Role of preoperative and intraoperative factors in mediating infection complication following percutaneous nephrolithotomy. Urol Int 2011;86(4):448-52. doi: 10.1159/000324106
- Uchida Y, Takazawa R, Kitayama S, Tsujii T. Predictive risk factors for systemic inflammatory response syndrome following ureteroscopic laser lithotripsy. Urolithiasis 2018; 46(4):375-381. doi: 10.1007/s00240-017-1000-3
- Sohn DW, Kim SW, Hong CG, Yoon BI, Ha US, Cho YH. Risk factors of infectious complication after ureteroscopic procedures of the upper urinary tract. J Infect Chemother 2013; 19(6):1102-8. doi: 10.1007/s10156-013-0632-7
- Senocak C, Ozcan C, Sahin T, Yilmaz G, Ozyuvali E, Sarikaya S et al. Risk factors of infectious complications after flexible uretero-renoscopy with laser lithotripsy. Urol J 2018; 10;15(4):158-163. doi: 10.22037/uj.v0i0.3967
- Gutierrez J, Smith A, Geavlete P, Shah H, Kural AR, de Sio M et al. Urinary tract infections and post-operative fever in percutaneous nephrolithotomy. World J Urol 2013; 31(5):1135-40. doi: 10.1007/s00345-012-0836-y
- Korets R, Graversen JA, Kates M, Mues AC, Gupta M. Post-percutaneous nephrolithotomy systemic inflammatory response: a prospective analysis of preoperative urine, renal pelvic urine and stone cultures. J Urol 2011;186(5):1899-903. doi: 10.1016/j.juro.2011.06.064
- Mariappan P, Smith G, Bariol SV, Moussa SA, Tolley DA. Stone and pelvic urine culture and sensitivity are better than bladder urine as predictors of urosepsis following percutaneous nephrolithotomy: a prospective clinical study. J Urol 2005;173(5):1610-4. doi: 10.1097/01.ju.0000154350.78826.96
- Eswara J.R., Shariftabrizi A., Sacco D. Positive stone culture is associated with a higher rate of sepsis after endourological procedures. Urolithiasis 2013;41(5):411-4. doi: 10.1007/s00240-013-0581-8
- Walton-Diaz A, Vinay JI, Barahona J, Daels P, González M, Hidalgo JP et al. Concordance of renal stone culture: PMUC, RPUC, RSC and post-PCNL sepsis—a non-randomized prospective observation cohort study. Int Urol Nephrol 2017;49(1):31-35. doi: 10.1007/s11255-016-1457-y
- Cicerello E, Mangano M, Cova GD, Merlo F, Maccatrozzo. Metabolic evaluation in patients with infected nephrolithiasis: Is it necessary? Arch Ital Urol Androl 2016;88(3):208-211. doi: 10.4081/aiua.2016.3.208
- de Cógáin MR, Lieske JC, Vrtiska TJ, Tosh PK, Krambeck AE. Secondarily infected nonstruvite urolithiasis: a prospective evaluation. Urology 2014;84(6):1295-300. doi: 10.1016/j.urology.2014.08.007
- Романова Ю.М., Мулабаев Н.С., Толордава Э.Р., Серегин А.В., Серегин И.В., Алексеева Н.В. et al. Микробные сообщества на мочевых камнях. Молекулярная генетика, микробиология и вирусология 2015; 33 (2): 20-25. [Romanova YU.M., Mulabaev N.S., Tolordava E.R., Seregin A.V., Seregin I.V., Alekseeva N.V. et al. Microbial communities on urinary stones.Molekulyarnaya genetika, mikrobiologiya i virusologiya 2015; 33 (2): 20-25. (In Russian.)].
- Margel D, Ehrlich Y, Brown N, Lask D, Livne PM, Lifshitz DA. Clinical implication of routine stone culture in percutaneous nephrolithotomy a prospective study. J Urol 2006;67(1):26-29. doi: 10.1016/j.urology.2005.08.008
- Parkhomenko E, De Fazio A, Tran T, Thai J, Blum K, Gupta M. A multiinstitutional study of struvite stones: patterns of infection and colonization. J Endourol 2017;31(5):533-537. doi: 10.1089/end.2016.0885
- Fan J, Wan S, Liu L, Zhao Z, Mai Z, Chen D et al. Predictors for uroseptic shock in patients who undergo minimally invasive percutaneous nephrolithotomy. Urolithiasis 2017;45(6):573-578. doi: 10.1007/s00240-017-0963-4
- Wang Y, Jiang F, Wang Y, Hou Y, Zhang H, Chen Q et al. Post-percutaneous nephrolithotomy septic shock and severe hemorrhage: a study of risk factors. Urol Int 2012;88(3):307-10. doi: 10.1159/000336164
- De Coninck V, Keller EX, Rodríguez-Monsalve M, Audouin M, Doizi S, Traxer O Systematic review of ureteral access sheaths: facts and myths. BJU Int 2018;122(6):959-969. doi: 10.1111/bju.14389
- Jung H, Osther PJ. Intraluminal pressure profiles during flexible ureterorenoscopy. Springerplus 2015;4:373. doi: 10.1186/s40064-015-1114-4
- Osther PJS. Risks of flexible ureterorenoscopy: pathophysiology and prevention. Urolithiasis 2018;46(1):59-67. doi: 10.1007/s00240-017-1018-6
- Osther PJ, Pedersen KV, Lildal SK, Pless MS, Andreassen KH, Osther SS et al. Pathophysiological aspects of ureterorenoscopic management of upper urinary tract calculi. Curr Opin Urol 2016;26(1):63-9. doi: 10.1097/MOU.0000000000000235
- Zhong W, Zeng G, Wu K, Li X, Chen W, Yang H. Does a smaller tract in percutaneous nephrolithotomy contribute to high renal pelvic pressure and postoperative fever? J Endourol 2008;22(9):2147-51. doi: 10.1089/ end.2008.0001
- Урология. Российские клинические рекомендации (под ред. Аляева Ю.Г., Глыбочко П.В., Пушкаря Д.Ю.) М.: Медфорум, 2017:544 с. [Urology. Russian clinical guidelines (pod red. Alyaeva YU.G., Glybochko P.V., Pushkarya D.YU.) M.: Medforum, 2017:544 s. (In Russian.)].
- Carlos EC, Youssef RF, Kaplan AG, Wollin DA, Winship BB, Eisner BH et al. Antibiotic utilization before endourological surgery for urolithiasis: endourological society survey results. J Endourol 2018;32(10):978-985. doi: 10.1089/end.2018.0494
- Demirtas A, Yildirim YE, Sofikerim M, Kaya EG, Akinsal EC, Tombul ST et al. Comparison of infection and urosepsis rates of ciprofloxacin and ceftriaxone prophylaxis before percutaneous nephrolithotomy: a prospective and randomised study. ScientificWorldJournal 2012; 2012:916381. doi: 10.1100/2012/916381
- Tuzel E, Aktepe OC, Akdogan B. Prospective comparative study of two protocols of antibiotic prophylaxis in percutaneous nephrolithotomy. J Endourol 2013;27(2):172-6. doi: 10.1089/end.2012.0331
- Gravas S, Montanari E, Geavlete P, Onal B, Skolarikos A, Pearle M et al. Postoperative infection rates in low risk patients undergoing percutaneous nephrolithotomy with and without antibiotic prophylaxis: a matched case control study. J Urol 2012;188(3):843-7. doi: 10.1016/j.juro.2012.05.007
- Chew BH, Miller NL, Abbott JE, Lange D, Humphreys MR, Pais VM Jr et al. A randomized control trial of preoperative prophylactic antibiotics prior to percutaneous nephrolithotomy in low infectious risk population: A report from the EDGE consortium. J Urol 2018;200(4):801-808. doi: 10.1016/j.juro.2018.04.062
- Ventola CL. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy and Therapeutics 2015;40(4):277-83. PMC4378521
- Patel N, Shi W, Liss M, Raheem O, Wenzler D, Schallhorn C et al. Multidrug resistant bacteriuria before percutaneous nephrolithotomy predicts for postoperative infectious complications. J Endourol 2015;29(5):531-6. doi: 10.1089/end.2014.0776
- Mishra S, Sharma R, Garg C, Kurien A, Sabnis R, Desai M. Prospective comparative study of Miniperc and standard PNL for treatment of 1 to 2 cm size renal stone. BJU Int 2011;108(6):896-9; doi: 10.1111/ j.1464-410X.2010.09936.x
- Hartman C, Gupta N, Leavitt D, Hoenig D, Okeke Z, Smith A. Advances in percutaneous stone surgery. Asian J Urol 2015;2(1):26-32. doi: 10.1016/ j.ajur.2015.04.010
- Tepeler A, Akman T, Silay MS, Akcay M, Ersoz C, Kalkan S et al. Comparison of intrarenal pelvic pressure during micro-percutaneous nephrolithotomy and conventional percutaneous nephrolithotomy. Urolithiasis 2014;42(3):275-9. doi: 10.1007/s00240-014-0646-3
- Chen Y, Liao B, Feng S, Ye D, Zeng G, Wang K, Shi M. Comparison of safety and efficacy in preventing postoperative infectious complications of a 14/16F ureteral access sheath with a 12/14F ureteral access sheath in flexible ureteroscopic lithotripsy. J Endourol 2018;32(10):923-927. doi: 10.1089/ end.2018.0222
- Berquet G, Prunel P, Verhoest G, Mathieu R, Bensalah K. The use of a ureteral access sheath does not improve stone-free rate after ureteroscopy for upper urinary tract stones. World J Urol 2014;32(1):229-32. doi: 10.1007/s00345-013-1181-5







