Проблема лечения больных доброкачественной гиперплазией предстательной железы (ДГПЖ) до сих пор остается актуальной. Согласно литературным данным 15-25% мужчин в возрасте 50-65 лет страдают этим заболеванием, которое приводит к выраженному снижению качества жизни за счет симптомов нарушения функции нижних мочевых путей (СНМП) [1]. В настоящее время считают, что в патогенезе ДГПЖ имеет значение как генетическая предрасположенность, так и дисрегуляция гормонального обмена, которая приводит к активации гиперпластических процессов в предстательной железе (ПЖ), торможению апоптоза, а также – к выделению целого ряда медиаторов, вызывающих хроническое воспаление.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ПАТОГЕНЕЗЕ ДГПЖ
Рост ПЖ, поддержка ее структуры и функции зависит от постоянного поступления в нее андрогенов. Тестостерон метаболизируется до дигидротестостерона (ДГТ) под воздействием изоэнзимов Δ,4,3кетостероид-5-α-редуктазы (5α-R). Эти энзимы локализуются на мембране ядра клеток стромы и эпителия железы. ДГТ связывается со специфическим рецептором и вызывает экспрессию целого ряда гормон-зависимых генов, запускающих механизмы деления клетки. Этот процесс зависит не только от концентрации андрогенов, главным образом ДГТ, который образуется в ПЖ из тестостерона при воздействии 5α-R 1 и 2 типов и имеет большое сродство к андрогенному рецептору (АР), но и от состояния внутриклеточных стероидных сигнальных путей, передающих сигнал от АР через лиганд-активируемый ядерный транскрипционный фактор. Это приводит к стимуляции процесса транскрипции в андрогензависимых генах, несущих ответственность за контроль клеточного цикла, течение пролиферативных процессов и выработку простатспецифического антигена (ПСА).
Постоянная стимуляция АР необходима, прежде всего, для роста и функции ПЖ. Этот процесс работает путем трансактивации домена закодированного в первом экзоне гена АР (Xq 11-12), которому в норме свойственен полиморфизм CAG, GGN и GGC повторов, кодирующих тракты полиглутамина и полиглицина [2-4]. При исследовании генетического полиморфизма некоторых генов, ответственных за метаболизм стероидов, показана их тесная связь с вероятностью возникновения ДГПЖ. Об этом свидетельствует тот факт, что у родственников – мужчин больных с ранним возникновением ДГПЖ, кумулятивный риск возникновения этого заболевания составляет 66%, тогда как в контрольной группе – лишь 17% (p=0,01) [5,6].
Кроме того, при исследовании полиморфизма генов, кодирующих 5α-R 2 типа (SRD 5A1 и SRD 5 A2), было установлено, что имеется тесная взаимосвязь между выраженностью полиморфизма генов, объемом ДГПЖ, эффективностью проводимой антиандрогенной терапии и концентрацией половых гормонов и их метаболитов [7,8].
Интересна роль α1-адренорецепторов в патогенезе ДГПЖ. Предполагают, что в ПЖ они участвуют в процессе кооперативной регуляции работы внутриклеточных эффекторов, гормонов, факторов роста, которые влияют не только на тонус гладкомышечных элементов ПЖ, но и на их объем [9].
В последнее время появилось большое число исследований, показывающих, что ДГПЖ – это иммуновоспалительное заболевание. При этом, в ткани ПЖ обнаруживают воспалительные инфильтраты, содержащие лимфоциты и макрофаги, количество которых коррелирует с объемом ДГПЖ. Они секретируют факторы роста, включая фактор роста фибробластов (FGF), цитокины: интерлейкин-1 (IL-1), интерлейкин-6 (IL-6), фактор некроза опухоли-α (TNF-α). Также наблюдают повышенную активность Т-клеток и аутоиммунные реакции, которые способствуют пролиферации стромальных и эпителиальных клеток. Было показано, что повышенное содержание в ткани при ДГПЖ провоспалительных цитокинов и цитокинов семейства IL-17 A, E, F и их рецепторов, сопровождает повышение содержания клеток воспаления и сосудов с экспрессией CD 31+, а также провоспалительных хемокинов: MCP-1/CCL2 (фактор хемотаксиса моноцитов), IP-10/CXCL10 (индуцируемый гамма-интерфероном белок), MIF (фактор ингибирующий миграцию макрофагов) [10]. Провоспалительные цитокины повышают активность циклооксигеназы-2 (COX-2) и вызывают образование простагландинов и окиси азота, что стимулирует пролиферативные процессы в ПЖ и вызывает ее отечность. Ряд авторов считают, что активные формы кислорода приводят к повреждению ткани ПЖ, так как после завершения процесса трансляции вызывают модификацию структуры ДНК и ее клеток, что может привести к малигнизации процесса [11,12].
Сахарный диабет и метаболический синдром являются факторами риска образования ДГПЖ. Отмечена взаимосвязь между резистентностью к инсулину, гиперинсулинемией и ДГПЖ. Гиперинсулинемия приводит к образованию в печени инсулиноподобных факторов роста (IGF), которые обладают митогенным и антиапоптическим эффектом. Эти факторы связываются в ПЖ со своими рецепторами и стимулирует увеличение ее объема. Концентрация IGF и белков, связывающих IGF в крови и ПЖ, коррелирует с выраженностью в ней пролиферативных процессов и участвует в регуляции образования андрогенов и гормона роста.
Гипергликемия и гиперинсулинемия также стимулируют образование в стромальных фибробластах ПЖ инсулиноподобного фактора роста -1 (IGF-1). Последний связывается со своим рецептором на эпителиальных клетках ПЖ и стимулирует их пролиферацию через целевой ген [13].
ОБЩИЕ ПОДХОДЫ К ЛЕЧЕНИЮ ДГПЖ
Современное лечение ДГПЖ / СНМП воздействует на различные звенья патогенеза этого заболевания. На первом месте стоят α1А-адреноблокаторы (доксазозин, теразозин, алфузозин, тамзулозин, силодозин): их считают препаратами выбора при ДГПЖ. Затем идут ингибиторы 5α-редуктазы (финастерид, дутастерид), которые при длительной терапии у пациентов с величиной ПЖ более 40 куб. см способны привести к уменьшению объема ДГПЖ. М-холинолитики (толтеродин, троспиума хлорид, солифенацин) и агонист β3-адренорецепторов – мирабегрон чаще используют в комбинации с α1А-адреноблокаторами для купирования проявлений гиперактивного мочевого пузыря при ДГПЖ. Тадалафил (ингибитор фосфодиэстеразы 5 типа) улучшает симптомы ДГПЖ у больных, страдающих эректильной дисфункцией. По показаниям применяют нестероидные противовоспалительные препараты [14,15]. Обсуждают возможность применения антиоксидантов при ДГПЖ [16]. Однако, все эти препараты обладают целым рядом побочных эффектов и воздействуют только на отдельные фазы патогенеза ДГПЖ.
При длительном применении необходимо использовать лекарственные средства, которые оказывают влияние на большинство звеньев патогенеза заболевания, обладают оптимальным терапевтическим действием и отсутствием побочных эффектов. В этом отношении в отдельную группу выделены фитосоединения, в том числе экстракты Serenoa repens (экстракты плодов пальмы ползучей – ЭППП), которые широко используют в Европе и США для лечения ДГПЖ и СНМП [17-19]. Наиболее известным и изученным из них является Пермиксон.
МЕХАНИЗМЫ ДЕЙСТВИЯ ПЕРМИКСОНА
Пермиксон (Permixon) представляет собой комплексную смесь свободных и эстерифицированных жирных кислот, полипренов и фитостеролов, полученных из плодов пальмы ползучей (Serenoa repens или Sabal serrulata). Препарат содержат несколько ингредиентов и поэтому при его применении возможен комплексный фармакологический эффект, действующий на различные звенья патогенеза ДГПЖ (рис. 1).
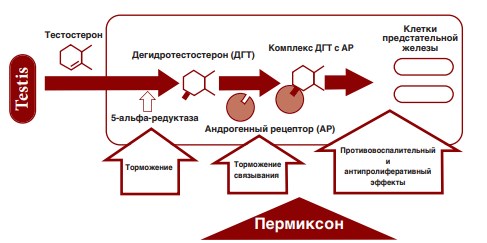
Рис.1. Патогенез ДГПЖ и механизм действия Пермиксона
Другими словами, эффект этой смеси можно сравнить с комбинированной лекарственной терапией, каждый компонент которой может обладать по отношению к другому аддитивным или синергическим действием.
Влияние Пермиксона на клеточные структуры ПЖ
При исследовании любого препарата, как правило, проводят изучение специфичности и селективности его действия. Это касается и Пермиксона. C.W. Bayne и соавт. в культуры тканей из различных органов добавили нарастающие концентрации Пермиксона. При исследовании препаратов этих культур на электронном микроскопе оказалось, что только в клетках ПЖ были отмечены выраженные структурные изменения, которые заключались в накоплении липидных капель в цитоплазме, изменении мембраны ядра, его поляризации, разрушении органелл, конденсации хроматина. Это подтвердило специфичное действие Пермиксона именно на клетки ПЖ [20]. При присоединении радиоактивной метки к входящим в состав Пермиксона свободным жирным кислотам и введении его крысам, оказалось, что в наибольших количествах метка накапливалась в ПЖ (рис. 2), что свидетельствует в пользу селективности действии лекарственного препарата на этот орган [21].
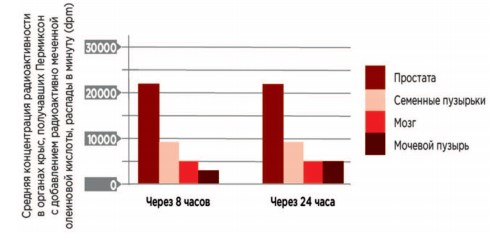
Рис. 2. Простатспецифическое действие препарата Пермиксон [21]
Таким образом, преимущественное накопление компонентов Пермиксона в ПЖ вызывает в ней морфологические изменения, которые могут отразиться на физикохимических характеристиках и повлиять на различные системы регуляции работы органа, как на клеточном, так и молекулярном уровнях.
Влияние Пермиксона на гормональный статус ПЖ
В 1998 году F. Di Silverio с соавт. сообщили, что трехмесячная терапия Пермиксоном приводит к выраженному уменьшению содержания ДГТ в ПЖ [22]. Затем в опытах in vitro на культуре эпителиальных клеток и клеток рака ПЖ было показано, что Пермиксон тормозит активность 5α-R 1 и 2 типов и не вызывает повышения концентрации простатспецифического антигена (ПСА) в культуральной среде. Это, по-видимому, связано с тем, что препарат не влияет на опосредованный АР процесс транскрипции [20,23]. Данный феномен был подтвержден и in vivo [24]. Интересно отметить, что при культивировании клеток других органов не наблюдали торможения активности 5α-R. Тем не менее, до сих пор не удалось объяснить почему Пермиксон тормозит активность 5α-R и рост ПЖ, но не влияет на продукцию эпителиальными клетками ПСА. Возможно это связано тем, что препарат воздействует на клеточную и внутриклеточные мембраны стромальных и эпителиальных клеток ПЖ, приводит к изменению микроокружения 5α-R и, как следствие, торможению ее активности. При этом Пермиксон не влияет на работу генов, от которых зависит действие андрогенов и выработка ПСА [20].
Пермиксон оказывает действие не только на активность 5α-R , но и на различные фазы метаболизма андрогенов и тормозит связывание ДГТ с АР [25]. Он также обладает и антиэстрогенной активностью. Исследование ткани ПЖ больных ДГПЖ при применении этого препарата было отмечено уменьшение количества ядерной фракции эстрогенных рецепторов [25]. Известно, что рост ПЖ зависит не только от концентрации андрогенов, но и от других гормонов, например пролактина, который принимает участие в процессах формирования гиперплазии железы. В опытах на мышах с гиперпролактинемией, вызванной введением сульпирида, было отмечено торможение Пермиксоном гиперплазии ПЖ [26]. Кроме того, удалось показать, что препарат модулирует пути трансдакции сигнала пролактина и блокирует его действие на процесс С-зависимого фосфорилирования калиевых каналов протеинкиназой [27].
Таким образом, Пермиксон обладает антиандрогенным действием, тормозит активность 5α-R, блокирует АР ПЖ, уменьшает в ней число эстрогенных рецепторов и снижает стимуляцию пролактином гиперпластических процессов. Кроме того, препарат имеет еще одно преимущество перед синтетическими ингибиторами 5α-R, так как не влияет на концентрацию ПСА.
Противовоспалительное действие Пермиксона
Противовоспалительное действие Пермиксона начали исследовать еще в 90-е годы прошлого столетия. В одной из первых работ было изучено его влияние на образование из арахидоновой кислоты полиморфоядерными лейкоцитами крови человека хемоаттрактанта нейтрофилов – лейкотриена (LTB 4) после их стимуляции ионофором А 23127. Было показано, что Пермиксон тормозит продукцию ее метаболитов: 5-HETE, 20-COOH LTB4, LTB4 и 20-OH LTB [28]. Эти результаты были подтверждены дальнейшими иммуногистохимическими исследованиями удаленного гиперплазированного участка ПЖ, которые показали, что трехмесячный прием Пермиксона вызывает резкое снижение количества В-лимфоцитов (но не T-лимфоцитов и макрофагов), TNF-α и IL-1β. При оценке по международной шкале простатических симптомов (IPSS) эти изменения коррелировали с клинически значимым улучшением состояния пациентов, что свидетельствует о противовоспалительном действии препарата [29]. Это затем нашло подтверждение в работах других авторов [30-32].
Еще одна исследовательская группа провела изучение противовоспалительной активности Пермиксона при ДГПЖ. В опытах in vitro было оценено влияние препарата на пролиферацию и жизнеспособность клеток ПЖ с использованием клеточных линий из тканей здоровой и гиперплазированной железы. В тканях при ДГПЖ были отмечены повышенные индексы пролиферативной активности. Добавление разных концентраций Пермиксона уменьшало клеточную пролиферацию во всех клеточных линиях. Наиболее выраженный эффект отметили в стромальных и эпителиальных клетках при гиперплазии ПЖ. Добавление провоспалительных медиаторов IL-6, IL-17 и FGF в клеточную культуру провоцировало выраженную пролиферацию всех трех типов клеток: стромальных, эпителиальных и здоровых. Последующее добавление Пермиксона уменьшило клеточную пролиферацию, индуцированную FGF-2 в стромальных и здоровых клетках, а IL-6 и IL-17 – в клеточной линии гиперплазированных тканей. Авторы выполнили микроматричный анализ для сравнения экспрессии генов в эпителиальных и стромальных клетках при ДГПЖ после добавления Пермиксона и без него. При добавлении препарата была выявлена, недостаточная экспрессия генов, кодирующих провоспалительные медиаторы (IL-1β, IL-6 и хемокина C-X-C motif). Также отмечено уменьшение экспрессии гена, кодирующего человеческий рецептор эпидермального фактора роста 3 (ERBB3), что привело к избыточной экспрессии человеческого гена блокировки роста (GAS1) [33].
В исследовании de la Taille A. на модели in vivo у самцов крыс линии Спрег-Доули вызвали ДГПЖ путем 14-дневного введения тестостерона пропионата. Животные были рандомизированы на три группы лечения: ЭППП ( Пермиксон), финастерид и контроль (без активного лечения). Проводили количественное определение в ПЖ мРНК для 90 генов. Оказалось, что Пермиксон обеспечил статистически значимое снижение (p<0,05) экспрессии большинства транскриптов воспалительных генов. Были получены четкие доказательства того, что он оказывает влияние на каскад арахидоновой кислоты, особенно на сигнальный путь липоксигеназы и, таким образом, воздействует на воспалительный процесс при ДГПЖ [34].
A. Latil и соавт. провели международное, рандомизированное, двойное слепое исследование влияния препарата Пермиксон на маркеры воспаления. Пациенты принимали этот препарат внутрь в дозе 320 мг/сут или тамсулозин в дозе 0,4 мг/сут в течение 3 месяцев. В десквамированных эпителиальных клетках ПЖ, выделенных из мочи после массажа ПЖ, проводили количественный анализ мРНК 29 наиболее значимых маркеров воспаления, а также исследовали белки мочи. Через 90 дней от начала терапии наблюдали снижение экспрессии генов, в среднем, для 65,4% маркеров, выявленных в группе, принимавшей Пермиксон, и для 46,2% – в группе тамсулозина. Для 15 генов, наиболее часто демонстрировавших экспрессию, разница была выше: 80% и 33%, соответственно. Кроме того, для 11 из 15 маркеров (73,3%) повышение регуляции наблюдали у меньшего числа пациентов в группе Пермиксона, по сравнению с группой тамсулозина: 4 из 15 маркеров или 26,6% (рис. 3). Оказалось, что на 90 день приема препарата уменьшение числа пациентов с наличием экспрессии белков провоспалительных хемокинов МСР-1/CCL2 и IP-10 /CХCL наблюдали только в группе Пермиксона. Кроме того, Пермиксон, по сравнению с тамсулозином, в большей степени снижал экспрессию MIF (p = 0,007). Однако, в отличие от получавших тамсулозин, в группе Пермиксона, где в начале терапии наблюдали большую экспрессию MIF, ответ на лечение по критерию IPSS оказался лучше, чем у пациентов с небольшим содержанием данного белка: среднее изменение оценки по шкале IPSS: -6,2 и -4,5 баллов, соответственно. Данные результаты впервые на клиническом уровне продемонстрировали противовоспалительные свойства Пермиксона при лечении СНМП, обусловленных ДГПЖ [35].
Таким образом, на основании приведенных данных, можно утверждать, что Пермиксон обладает противовоспалительным действием и способен предотвращать дальнейшее развитие ДГПЖ у пациентов с хроническим воспалением ПЖ.
Пермиксон – пролиферация и апоптоз
В литературе содержится информация о том, что с началом развития ДГПЖ в ее клетках наблюдают процесс торможения апоптоза [36]. Лечение Пермиксоном сопровождается увеличением апоптического индекса в клетках ПЖ, тогда как в клетках других органов этот эффект не наблюдали [32,37].
F. Vacherot и соавт. изучали влияние Пермиксона на апоптоз и пролиферацию в клетках гиперплазированной ПЖ у больных, получавших этот препарат в течение трех месяцев. Оказалось, что апоптоз / пролиферативный индекс увеличился в эпителиальных клетках в 5,5, а в стромальных клетках – в 8.8 раза, что говорит об антипролиферативных свойствах этого лекарственного средства [38].
В другом исследовании проведено изучение молекулярных маркеров, связанных с процессом апоптоза в ткани удаленной ДГПЖ после трехмесячного приема Пермиксона. Измеряли маркеры Bax и Bcl-2 (семейство Bcl-2), характеризующие, соответственно, проапоптические и антиапоптические изменения. Также определяли активность каспазы-3 – белкового эффектора апоптического каскада. Авторы показали, что по сравнению с контрольной группой, соотношение Bax/Bcl-2 и активность каспазы-3 были достоверно выше в ткани ПЖ больных, получавших препарат перед операцией [39].
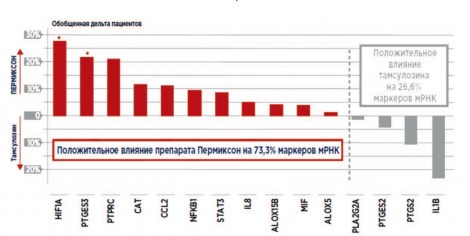
Рис. 3. Снижение уровня экспрессии генов маркеров воспаления ПЖ через 90 дней применения препарата Пермиксон [35]
Таким образом, Пермиксон обладает антипролиферативным и проапоптотическим действием.
ПЕРМИКСОН: РЕЗУЛЬТАТЫ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ
В настоящее время в библиографической базе PubMed найдены ссылки на 430 работ, в которых изучено действие препаратов пальмы ползучей. Первые из них относятся в началу 80-х годов прошлого века.
В 1991 Dathe G. и Schmid Н. в результате рандомизированного сравнительного исследования продолжительностью 6 месяцев одни из первых определили оптимальную терапевтическую дозу Пермиксона у больных с ДГПЖ. У 49 пациентов оценили эффективность двух доз препарата: 320 мг (группа I, n=24) и 960 мг (группа II, n=25) в сутки. Оказалось, что у всех больных средняя скорость мочеиспускания (Qave) и суммарный объем мочеиспускания (V) увеличивались с 16 по 24 неделю от начала приема препарата. При приеме препарата в дозе 160 мг или 480 мг два раза в сутки – нормальную скорость мочеиспускания (Qmax>14 мл/сек) наблюдали у 33% и 48% больных, соответственно. Объем остаточной мочи (Vres) снизился, начиная с 16 недели, на 27% и 32% у больных I и II групп, соответственно. При приеме препарата в дозе 320 мг/сут субъективная симптоматика исчезла у 46% больных, 960 мг в день – у 60%. В результате исследования было показано, что оптимальной терапевтической дозой Пермиксона является 320 мг/сут. [40].
Подобные результаты были получены в 1999 году в исследовании В.Н. Степанова и соавт. на 100 амбулаторных больных с ДГПЖ в рандомизированном 3-х месячном исследовании в параллельных группах. Было показано, что к концу первого месяца приема препарата значительно улучшились показатели IPSS, Qmax, Qave, V. К концу третьего месяца лечения все они, за исключением V и Qave продолжали улучшаться. Таким образом, прием Пермиксона в дозе 320 мг/сут улучшает суммарный балл IPSS и все показатели мочеиспускания. Препарат оказывает тот же эффект в дозе 160 мг два раза в день [41].
Исследование Authie D. и Cauquil J. включало 500 пациентов с ДГПЖ (средний возраст 68,2 года). У большинства из них имели место симптомы расстройства мочеиспускания: ноктурия – у 97%; дневная поллакиурия – у 67%; дизурия – у 92% и императивные позывы – у 70%. Все пациенты получали Пермиксон (320 мг/сут) в течение 3 месяцев. Авторами зарегистрирован выраженный симптоматический эффект препарата: к концу лечения средняя частота позывов в ночное время снизилась с 4,0 до 1,8, причем улучшение по данному показателю было отмечено у 82%, а полное исчезновение симптома – у 45% больных. Частота дневных мочеиспусканий сократилась с 6,3 до 4,6 у 2/3 мужчин, а уменьшение дизурии и императивности позывов достигнуто у 75 и 85% пациентов, соответственно [42].
F. Foroutan изучал клиническую эффективность Пермиксона в дозе 320 мг/сут в течение 3-х месяцев у 592 пациентов с ДГПЖ. В результате лечения отмечено статистически значимое уменьшение симптомов заболевания и снижение показателя IPSS с 17 до 10 баллов, а также достоверная положительная динамика объективных параметров: Qmax, количества остаточной мочи и объема ПЖ, хотя последнее и было незначительным: -1,84 мл [43]. Похожие результаты были получены рядом отечественных авторов в коротких несравнительных исследованиях Пермиксона [44-46].
В НИИ урологии в 1999 году проанализированы результаты лечения 48 больных ДГПЖ, которые получали Пермиксон по 160 мг дважды в день в течение 12 месяцев. Было отмечено уменьшение выраженности симптомов по шкале IPSS с 14,35 до 10,61 балла (-26,1%) через 6 месяцев и до 10,42 (27,4%) через 12 месяцев лечения. В те же периоды времени средний показатель Qmax увеличился с 10,62 до 12,60 мл/сек (+18,7%) и до 12,73 мл/сек (+19,9%) соответственно. Индекс качества жизни QOL через 6 месяцев наблюдения снизился с 3,49 до 2,60 баллов (-25,3%), достигнув к концу года 2,49 (-28,7%). Также было зарегистрировано небольшое уменьшение среднего объема предстательной железы: на 11,8% через 6 месяцев и 15,6% через 12 месяцев. Показатель ПСА не изменялся в течение всего периода лечения. Изучение эффективности Пермиксона у больных с различными исходными значениями IPSS и Qmax дало нам возможность сделать заключение о том, что препарат наиболее результативен у пациентов с умеренной выраженностью симптомов ДГПЖ (IPSS < 18) и умеренными уродинамическими нарушениями (Qmax > 10 мл/сек) [45].
Большое клиническое значение имеют данные уродинамических исследований, характеризующие влияние Пермиксона на состояние мочевого пузыря и степень инфравезикальной обструкции. На основании анализа данных комплексного уродинамического обследования больных ДГПЖ получавших, Пермиксон, был сделан вывод о том, что препарат оказывает позитивное влияние на функциональное состояние мочевого пузыря и уменьшает степень инфравезикальной обструкции. Вместе с тем, ни в одном случае полностью устранить проявления обструкции не удалось [47].
Особый интерес представляют работы, в которых сравнивали эффективность и безопасность Пермиксона с плацебо и другими лекарственными средствами. Результаты 7 плацебо-контролируемых исследований, в которых приняло участие в общей сложности 559 человек, обобщены в 1996 году G. Plosker и R. Brogden [48]. В 3-х наиболее значимых из них, где участвовало 410 больных ДГПЖ, пациенты были разделены на две практически равные группы: принимавшие Пермиксон (320 мг/сут) и плацебо. В этих исследованиях продолжительностью от одного до трех месяцев достоверно продемонстрирована клиническая эффективность препарата по сравнению с плацебо. При этом частота ночных мочеиспусканий уменьшилась на 33-46%, дневная поллакиурия – на 11-20%, a Qmax увеличилась на 29-50%, что было существенно выше, чем в группе плацебо, где аналогичные показатели составили 15-18%, 1-3% и 5-9% соответственно.
В трех других опубликованных исследованиях продолжительностью 1-2 месяца с участием 79 больных, на фоне приема Пермиксона было отмечено уменьшение ноктурии на 50-74%, снижение частоты дневных мочеиспусканий на 29-43% и рост Qmax на 26-43%, тогда как в группе плацебо эти же показатели были равны 13-39%, 8-29% и 2-19%. Лишь в одном из 7 опубликованных исследований авторы не выявили существенных различий между изучаемыми признаками.
В ряде наблюдений Пермиксон выступил в качестве эффективного средства устранения дизурии. В исследовании J. Descotes и соавт., проведенном на 176 больных ДГПЖ, показано, что в течение одного месяца дизурия уменьшилась у 31% из получавших Пермиксон (320 мг/сут) по сравнению с 16% – в группе плацебо (р<0,05) [49]. Подобные же результаты были получены в другом исследовании, охватившем 146 пациентов [50].
Предметом ряда исследований стало изучение влияния Пермиксона на объем остаточной мочи.
При этом, на фоне применения препарата уменьшение Vres относительно первоначальных значений составило 15-50% и было статистически значимым, по сравнению с группой плацебо, где наблюдали не только снижение, но и увеличение этого показателя [50,51].
Таким образом, большинство проведенных плацебо-контролируемых исследований Пермиксона достоверно продемонстрировали клиническую эффективность лечения, которая проявляется выраженным уменьшением симптомов заболевания и улучшением уродинамических показателей.
Описание клинических результатов применения Пермиксона было бы неполным без рассмотрения материалов его исследования в сравнении с другими лекарственными препаратами. Особенно интересны данные, касающиеся финастерида и α1адреноблокаторов.
Показательно широкомасштабное исследование J.С. Carraro и соавт., в ходе которого в течение 6 месяцев двойным слепым методом сравнивали эффективность и безопасность Пермиксона и финастерида. Для участия в исследовании было рандомизировано 1098 мужчин с ДГПЖ, отобранных в 87 урологических центрах 9 европейских стран. Анализ клинических результатов проведен у 1069 пациентов, из которых 536 получали Пермиксон (320 мг/сут) и 533 – финастерид (5 мг/сут). Данная работа – одно из самых крупных сравнительных исследований этих двух препаратов у пациентов с ДГПЖ [52]. Основными критериями сравнения в этом исследовании были: динамика симптомов по шкале IPSS, изменение Qmax, a также показателей качества жизни и сексуальной функции. Через 6 мес. лечения отмечено уменьшение симптомов по шкале I-PSS с 15,7 ± 5,7 до 9,5 ± 5,5 баллов (-39%) в группе финастерида и с 15,7 ± 5,9 до 9,9 ± 5,4 баллов (-37%) среди пациентов, получавших Пермиксон (р<0,001) (рис. 4). Симптоматическое улучшение уже через 6 недель превысило 20% в обеих группах. Кроме того, более 50% больных в каждой из групп к моменту окончания лечения отметили улучшение качества жизни (QOL), динамика показателя которого составила -38% у принимавших Пермиксон и 41% – у получавших финастерид. Различия итоговых значений IPSS и QOL в обеих группах, при сравнении их между собой оказались статистически недостоверными.
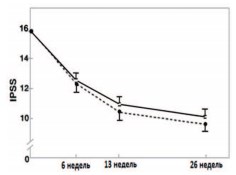
Рис. 4. Общая средняя оценка по шкале IPSS у мужчин с ДГПЖ, получающих препарат Пермиксон в дозе 320 мг (белые квадраты) или финастерид в дозе 5 мг (черные ромбы) (± 95% доверительный интервал) [53]
Половая функция по результатам анкетирования не претерпела существенных изменений на фоне терапии Пермиксоном, а у пациентов, лечившихся финастеридом, было выявлено ее некоторое ухудшение.
В обеих группах отмечено улучшение уродинамических показателей. При этом, Qmax увеличилась с 10,6 ± 2,8 до 13,3 ± 6,7 мл/с (+25%) через 6 месяцев лечения Пермиксоном и с 10,8 ± 3,1 до 14,0 ± 7,4 мл/с (+30%) в группе финастерида (р 18) и относительно сохранным мочеиспусканием (Qmax > 10 мл/с), число которых в результате лечения сократилось практически на 80% за счет перехода больных в группы с менее выраженными клиническими проявлениями. В результате применения как Пермиксона, так и финастерида, произошло незначительное, но статистически достоверное (р<0,001) уменьшение объема ПЖ. В первом случае оно составило 6%, а во втором – 18%, что свидетельствует об отсутствии четкой корреляции между ослаблением симптоматики и изменением объема железы.
В ходе описываемого сравнительного исследования была изучена зависимость результатов лечения Пермиксоном от объема ПЖ. Оказалось, что клиническая эффективность Пермиксона не зависит от исходного объема железы. Было также отмечено значительное (на 41%) снижение уровня ПСА в группе финастерида (р<0,001), тогда как у принимавших Пермиксон этот показатель существенно не изменился (+3%). Указанное различие является статистически значимым.
Таким образом, описанное исследование продемонстрировало, что Пермиксон и финастерид одинаково эффективно воздействуют на симптомы ДГПЖ, качество жизни и уродинамические показатели, при статистических различиях в динамике уровней ПСА и влиянии на половую функцию в пользу Пермиксона.
Представляют интерес сравнительные исследования Пермиксона и α1-адреноблокаторов. Так, M. Grasso и соавт. изучили результаты применения Пермиксона (320 мг/сут) у 31 больного и альфузозина (2,5 мг 3 раза в день) у 32 пациентов с ДГПЖ в течение 3 недель лечения. Эффективность препаратов оценивали с использованием шкалы Boyarsky и критерия Qmax. В результате лечения уменьшение симптомов составило 27% в первой группе и 39% во второй (р<0,01). Увеличение Qmax также было, в целом, достоверным, но более выраженным во второй группе (+51%) по сравнению с первой (+27%), хотя различия между ними и не были статистически столь значимыми [53].
В 2002 году в 11 странах Европы было проведено 12-месячное двойное слепое рандомизированное сравнительное исследование Пермиксона и тамсулозина (PERMAL), которое включило 811 больных ДГПЖ с оценкой СНМП по шкале I-PSS ≥10 баллов. После 4-недельного вводного периода 704 пациента были случайным образом распределены в группы тамсулозина (0,4 мг/сут; n=354) и Пермиксона (320 мг/сут; n=350). В начале исследования и периодически в течение года у пациентов проводили оценку по шкале IPSS, шкале качества жизни – QOL и измеряли Qmax. Через 12 месяцев в каждой группе лечения показатели IPSS снизились на 4,4 балла, какие-либо различия в улучшении ирритативных или обструктивных симптомов отсутствовали (рис. 5). Повышение показателя Qmax было сопоставимо в обеих группах: 1,8 мл/с – для препарата Пермиксон, 1,9 мл/с – для тамсулозина. Уровень ПСА оставался неизменным на фоне небольшого снижения объема ПЖ у пациентов, принимавших Пермиксон. Оба препарата продемонстрировали хорошую переносимость, однако в группе тамсулозина чаще наблюдали нарушения эякуляции. Это исследование показало, что эффективность применения Пермиксона и тамсулозина при лечении СНМП у мужчин с ДГПЖ на протяжении 12 месяцев практически одинакова, с преимуществом безопасности растительного препарата [54].
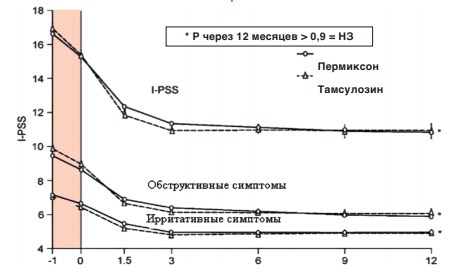
Рис. 5 Изменение среднего профиля оценки Пермиксона и Тамсулозина по шкале I-PSS с течением времени [55]
В другой работе эта же группа авторов дополнительно проанализировала результаты лечения 124 больных с выраженными проявлениями СНМП (IPSS>19), получавших тамсулозин (n=59) и Пермиксон (n=65). Через 12 месяцев общий показатель IPSS снизился в группе тамсулозина на 5,8, а в группе Пермиксона – на 7,8 баллов, что составило, соответственно, 25% и 35,2% от исходного уровня. Оказалось, что чем выше были исходные показатели IPSS в группе Пермиксона, тем больше они снижались в процессе терапии. В этой группе улучшение наступало через 3 месяца после начала лечения и оставалось на том же уровне весь период наблюдения. В группе тамсулозина Qmax увеличилась на 1,7 мл/сек, а в группе Пермиксона – на 1,2 мл/сек. Объем ПЖ снизился при приеме тамсулозина на 0,9 см3, а при приеме Пермиксона – на 2,2 см3. Таким образом, Пермиксон (320 мг/сут) и тамзулосин (0,4 мг/сут), принимаемые в течение 12 месяцев, вызывают сопоставимое улучшение симптомов и показателей мочеиспускания у пациентов с выраженными СНМП/ДГПЖ [55]. Похожие результаты были получены и в ходе сравнения Пермиксона с празозином [56].
Принципиальные выводы о клинической эффективности Пермиксона были сделаны по итогам метаанализа, представленного P. Boyle и соавт. в 2004 году [57]. В работе были обобщены материалы 12 основных плацебо-контролируемых и сравнительных исследований Пермиксона, включавших результаты лечения 2794 больных ДГПЖ. С высокой степенью статистической достоверности авторам удалось продемонстрировать: лечение Пермиксоном приводит к увеличению Qmax дополнительно на 1,87±0,55 мл/сек по сравнению с плацебо (р<0,001); терапия Пермиксоном уменьшает частоту ночных мочеиспускании на 0,55± 0,10 по сравнению с плацебо (р<0,001).
Таким образом, сегодня можно с уверенностью констатировать, что клиническая эффективность Пермиксона по отношению к плацебо статистически доказана.
Важнейшей характеристикой любого лекарственного средства является его переносимость. Данные клинических испытаний Пермиксона у пациентов с ДГПЖ, получавших его в дозе по 160 мг дважды в день (320 мг/сут), свидетельствуют, что препарат легко переносится большинством (94,4%) пациентов. Только у 2-3% мужчин, принявших участие в двух широкомасштабных несравнительных исследованиях (1092 человека), наблюдали какиелибо побочные эффекты. В основном, это были незначительные жалобы на нарушение функции желудочно-кишечного тракта (тошнота), которые исчезали самостоятельно при приеме препарата во время еды. Ни у одного из пациентов терапия не была прервана в связи с каким-либо осложнением [42,43].
В ходе описанного выше международного мультицентрового двойного слепого рандомизированного сравнительного исследования эффективности и безопасности Пермиксона и финастерида, не отмечено значимых различий их переносимости. Жалобы на боль в животе, диарею, запор, тошноту были наиболее часты среди нежелательных явлений и характерны в равной мере как для Пермиксона, так и для финастерида. Отрицательного влияния Пермиксона на половую функцию не зарегистрировано, а снижение либидо и половой потенции чаще ассоциировали с финастеридом [52].
Более того, как показали G. D'Ottavio и соавт. при изучении влияния 3-месячного курса терапии Пермиксоном (320 мг/сут) на фертильность у мужчин относительно молодого возраста (средний возраст 36 лет) с сохраненной эякуляцией, в течение 12 месяцев наблюдения ни по одному из параметров (объем эякулята, концентрация и подвижность сперматозоидов) не отмечено каких-либо значимых отклонений. У этих больных отсутствовали побочные эффекты и не было зарегистрировано по сравнению с исходными данными существенных изменений лабораторных параметров крови. Пермиксон не влиял на либидо, половую потенцию и не вызывал гинекомастии [58]. Приведенные данные являются основанием для расширения показаний к применению препарата у лиц молодого возраста и у больных, страдающих хроническим простатитом.
Клинически важны исследования по лечению хронического простатита (ХП) ЭППП в сочетании с антибактериальными препаратами. Так, V. Magri и соавт. наблюдали в течение 6 недель 137 больных, которым для лечения ХП был назначен ципрофлоксацин, альфузозин и ЭППП. Ремиссию заболевания наблюдали у 94% больных, стойкий эффект сохранялся в течение 30 месяцев наблюдения [59].
В отдельном исследовании K. Stamatiou и N. Pierris разделили 56 больных ХП на 2 группы. Первая – в течение 15 дней получала прулифлоксацин в дозе 600 мг, больные второй группы в течение 8 недель дополнительно принимали ЭППП. У больных, получавших ЭППП, по сравнению с пациентами первой группы наблюдали полное исчезновение болевого синдрома, СНМП и статистически недостоверную эрадикацию всех возбудителей [60].
G. Busetto c cоавт. провели исследование на 210 больных с бактериальным простатитом, половина которых принимала только прулифлоксацин в дозе 600 мг в течение 21 дня, а другой группе пациентов дополнительно был назначен ЭППП в дозе 320 мг/сут, Lactobacillus Sporogenes (200 мг) и арбутин (100 мг). Оказалось, что через два месяца наблюдения у больных первой группы биологический рецидив заболевания составил 27,6%, а второй – 7,8%. У больных второй группы, согласно опроснику NIHCPSI, через 6 месяцев после окончания терапии была меньшая выраженность СНМП. Этот показатель в первой группе был 13,25, а второй – лишь 3,67 балла [61]. Таким образом, комбинация антибактериальной терапии с ЭППП, к которым относится и Пермиксон, улучшает течение и симптоматику ХП и снижает вероятность рецидива заболевания.
Особый интерес вызывает опубликованный в 2016 году G. Novara и соавт. систематический обзор и метаанализ всех рандомизированных клинических исследований (РКИ) применения Пермиксона при ДГПЖ и СНМП с использованием баз данных Medline, Scopus и Web of Science. Авторами выполнен поиск по термину «Serenoa repens» во всех рубриках. Отбору подлежали только РКИ, в которых изучали эффективность и безопасность препарата Пермиксон при лечении СНМП/ ДГПЖ. В рамках систематического поиска было выделено 12 РКИ: в 7 исследованиях сравнивали препарат Пермиксон и плацебо; в 2 исследованиях сравнивали Пермиксон и тамсулозин; в 2 исследованиях Пермиксон в комбинации с тамсулозином сравнивали, соответственно, с плацебо в комбинации с тамсулозином и с тамсулозином в виде монотерапии; еще в 1 исследовании провели сравнительную оценку препаратов Пермиксон и финастерида.
Оказалось, что в сравнении с плацебо Пермиксон значительно более эффективно сокращал частоту ночных мочеиспусканий (взвешенная разность средних значений – WMD – 0,31; p = 0,03) и увеличивал максимальную скорость потока мочи (Qmax; WMD 3,37; p<0,0001). Для препарата Пермиксон и плацебо были получены сопоставимые показатели общей частоты нежелательных явлений (отношение шансов – ОШ 1,12; p=0,92) и выбывания из исследования (ОШ 1,52; p = 0,60).
Пермиксон продемонстрировал аналогичную эффективность в сравнении с тамсулозином, применяемым в виде монотерапии и финастеридом, применяемым в виде краткосрочной терапии, с точки зрения улучшения балла по шкале IPSS (WMD 1,15; 95% доверительный интервал – ДИ 1,11–3,40; p=0,32) и показателей Qmax (WMD 0,16; 95% ДИ 0,60–0,28; p=0,48). В сравнении с монотерапией тамсулозином комбинация Пермиксона и тамсулозина показала более высокую эффективность с точки зрения улучшения СНМП (WMD 0,31; 95% ДИ 0,13– 0,48; p<0,01), но не показателей Qmax (WMD 0,10; 95% ДИ -0,02–0,21; p=0,10). Препарат Пермиксон продемонстрировал благоприятный профиль безопасности, оказав крайне ограниченное влияние на нарушение эякуляции в сравнении с тамсулозином (0,5% и 4%, соответственно, p=0,007) и снижение либидо и потенции, в сравнении с краткосрочной терапией финастеридом (2,2% и 1,5% в сравнении с 3% и 2,8%, соответственно).
Был сделан вывод, что препарат Пермиксон сокращал частоту ночных мочеиспусканий и улучшал показатели Qmax в сравнении с плацебо, а также не уступал по эффективности тамсулозину и краткосрочной терапии финастеридом с точки зрения улучшения СНМП. Более того, он продемонстрировал благоприятный профиль безопасности, оказав весьма ограниченное влияние на сексуальную функцию, показатели которой в значительной степени зависят от всех лекарственных препаратов, используемых для лечения СНМП/ДГПЖ. Кроме того, авторы считают, что исследования, в которых выражают сомнение об эффективности экстрактов плодов пальмы ползучей при лечении СНМП/ДГПЖ, не распространяются на препарат Пермиксон [62].
ЗАКЛЮЧЕНИЕ
Пермиксон является эффективным и безопасным средством патогенетической терапии ДГПЖ, воздействующим на ряд факторов развития и прогрессирования этого заболевания. Он обладает тройным действием на предстательную железу: антиандрогенным, противовоспалительным и антипролиферативным. Вместе с тем, мы считаем, что о патогенетическом действии препарата можно говорить лишь с позиций его длительного применения, с учетом времени, необходимого для клинической реализации эффекта ингибирования 5α-редуктазы. При проведении коротких курсов терапии Пермиксоном на первый план, вероятно, выступает его противовоспалительное и противоотечное действие. В многочисленных исследованиях отмечено статистически достоверное воздействие препарата на симптомы и клинические проявления ДГПЖ в сравнении с плацебо и другими лекарственными средствами.
Способность влиять на патогенез ДГПЖ на нескольких уровнях определяет место препарата Пермиксон и позволяет выделить группы больных, предпочтительные для такого лечения:
1. Больные с умеренной выраженностью симптомов заболевания (IPSS < 18) и уродинамических нарушений (Qmax>10 мл/с). Им может быть рекомендована длительная (многомесячная) терапия препаратом Пермиксон с целью предотвращения дальнейшего прогрессирования симптомов ДГПЖ, с оценкой результатов лечения через 1012 мес.;
2. Больные с манифестной симптоматикой (IPSS >18) и умеренной выраженностью уродинамических нарушений (Qmax >10 мл/с). Если через 3-6 месяцев лечения препаратом Пермиксон не наступило существенного симптоматического улучшения, необходимо рассмотреть вопрос об изменении проводимой медикаментозной терапии;
3. Больные гиперплазией предстательной железы в сочетании с хроническим простатитом. Терапия препаратом Пермиксон возможна в комплексе с антибактериальными и/или противоспалительными препаратами и физиотерапией. В этом случае Пермиксон назначают с учетом его противовоспалительного и противоотечного действия. После стихания явлений хронического простатита тактику дальнейшего лечения определяют так же, как в группах 1 и 2.
4. Больные относительно молодого возраста с сохранной половой функцией и клиническими признаками хронического простатита. Использование препарата Пермиксон в качестве элемента комбинированной медикаментозной терапии, в первую очередь совместно с α1-адреноблокаторами и антибиотиками, позволяет улучшить результаты лечения.
Показано, что эффективность Пермиксона, возрастает с продолжительностью лечения, которое должно быть рассчитано на многие месяцы (не менее 4-6 мес.), а то и годы. С одной стороны, это необходимо учитывать специалистам, планирующим лечение препаратом Пермиксон, а с другой – на это надо ориентировать и пациентов при обсуждении с ними программы медикаментозной терапии ДГПЖ.
Препарат практически не имеет противопоказаний, не влияет на уровень ПСА и не затрудняет диагностику рака ПЖ. Не описано случаев его взаимодействия с другими лекарственными средствами, что расширяет возможности применения Пермиксона у лиц пожилого возраста с отягощенным соматическим статусом.
ЛИТЕРАТУРА
1. Mobley D, Feibus A, Baum N. Benign prostatic hyperplasia and urinary symptoms: Evaluation and treatment. Postgrad Med 2015; 127: 301307. doi:10.1080/00325481.2015.1018799
2. Konwar R, Chattopadhyay N, Bid HK. Genetic polymorphism and pathogenesis of benign prostatic hyperplasia. BJU Int 2008; 102: 536544. doi:10.1111/j.1464-410X.2008.07667.x
3. Zeegers MP, Kiemeney LA, Nieder AM, Ostrer H. How strong is the association between CAG and GGN repeat length polymorphisms in the androgen receptor gene and prostate cancer risk? Cancer Epidemiol Biomarkers Prev 2004; 13: 1765-1771.
4.Kramer G, Steiner GE, Handisurya A, Stix U, Haitel A, Knerer B, et al. Increased expression of lymphocyte-derived cytokines in benign hyperplastic prostate tissue, identification of the producing cell types, and effect of differentially expressed cytokines on stromal cell proliferation. Prostate 2002;52(1):43-58. DOI:10.1002/pros.10084
5. Park T, Choi JY. Efficacy and safety of dutasteride for the treatment of symptomatic benign prostatic hyperplasia (BPH): a systematic review and meta-analysis. World J Urol 2014; 32: 1093-1105. doi:10.1007/s00345-014-1258-9
6. Bartsch G, Rittmaster RS, Klocker H. Dihydrotestosterone and the concept of 5alpha-reductase inhibition in human benign prostatic hyperplasia. World J Urol 2002;19: 413-425.
7. Gu X, Na R, Huang T, Wang L, Tao S, Tian L, et al. SRD5A1 and SRD5A2 are associated with treatment for benign prostatic hyperplasia with the combination of 5α-reductase inhibitors and α-adrenergic receptor antagonists J Urol 2013;190(2):615-619. doi:10.1016/j.juro.2013.03.024
8. Rył A, Rotter I, Grzywacz A, Małecka I, Skonieczna-Żydecka K, Grzesiak K, et al. Molecular Analysis of the SRD5A1 and SRD5A2 Genes in Patients with Benign Prostatic Hyperplasia with Regard to Metabolic Parameters and Selected Hormone Levels. Int J Environ Res Public Health 2017;14(11): 1318-1322. doi:10.3390/ijerph14111318
9. Hennenberg M1, Stief CG, Gratzke C. Prostatic α1-adrenoceptors: new concepts of function, regulation, and intracellular signaling. Neurourol Urodyn 2014;33(7):1074-1085. doi: 10.1002/nau.22467
10. Latil A, Petrissans MT, Roquet J, Robert G, de la Taille A. Effects of Hexanic extract of Serenoa Repens (Permixon® 160 mg) on Inflammation Biomarkers in The Treatment of Lower Urinary Tract Symptoms Related to benign Prostatic Hyperplasia. Prostate 2015;75:1857-1867. doi: 10.1002/pros.23059
11. Sciarra A, Mariotti G, Salciccia S, Autran Gomez A, Monti S, Toscano V, et al. Prostate growth and inflammation. J Steroid Biochem Mol Biol 2008; 108: 254-260. doi:10.1016/j.jsbmb.2007.09.013
12. Naber KG, Weidner W. Chronic prostatitisan infectious disease? J Antimicrob Chemother 2000; 46:157-161
13. Wang Z, Olumi AF. Diabetes, growth hormone-insulin-like growth factor pathways and asso-ciation to benign prostatic hyperplasia. Differentiation 2011; 82:261-271. doi: 10.1016/j.diff.2011.04.004
14. Van Asseldonk B, Barkin J, Elterman DS. Medical therapy for benign prostatic hyperplasia: a review. Can J Urol 2015;22( Suppl 1):7-17.
15. Kahokehr A, Vather R, Nixon A, Hill AG . Non-steroidal antiinflammatory drugs for lower urinary tract symptoms in benign prostatic hyperplasia: systematic review and meta-analysis of randomized controlled trials. BJU Int 2013;111(2): 304-311. doi:10.1111/j.1464-410X.2012.11559.x
16. Minciullo PL, Inferrera A, Navarra M, Calapai G, Magno C, Gangemi S.Oxidative Stress in Benign.Prostatic Hyperplasia:A Systematic Review. Urol Int 2015;94:249–254. doi:10.1159/000366210
17. Cornu JN, Cussenot O, Haab F, Lukacs B. A widespread population study of actual medical management of lower urinary tract symptoms related to benign prostatic hyperplasia across Europe and beyond official clinical guidelines. Eur Urol 2010; 58:450-6. doi:10.1016/ j.eururo.2010.05.045
18. Lukacs B, Cornu JN, Aout M, Tessier N, Hodée C, Haab F, et al. Management of lower urinary tract symptoms related to benign prostatic hyperplasia in real-life practice in France: a comprehensive population study. Eur Uro 2013;64:493-501. doi:10.1016/j.eururo.2013.02.026
19. Scaglione F, Lucini V, Pannacci M, Dugnani S, Leone C. Comparison of the potency of 10 different brands of Serenoa repens extracts. Eur Rev Med Pharmacol Sci 2012;16:569-574.
20. Bayne CW, Donnelly F, Ross M, Habib FK. Serenoa repens (Permixon): a 5alpha-reductase types I and II inhibitor—new evidence in a coculture model of BPH. Prostate 1999;40:232–241.
21. Chevalier G, Benard P, Cousse H, Bengone T. Distribution study of radioactivity in rats after oral administration of the lipido/sterolic extract of Serenoa repens (Permixon) supplemented with [1-14C]-lauric acid, [1-14C]-oleic acid or [4-14C]-beta-sitosterol. Eur J Drug Metab Pharmacokinet 1997;22:73–83.
22. Di Silverio F, Monti S, Sciarra A, Varasano PA, Martini C, Lanzara S, et al. Effects of long-term treatment with Serenoa repens (Permixon) on the concentrations and regional distribution of androgens and epidermal growth factor in benign prostatic hyperplasia 1998; Prostate 37:77–83.
23. Habib FK, Ross M, Ho CK, Lyons V, Chapman K. Serenoa repens (Permixon) inhibits the 5alpha-reductase activity of human prostate cancer cell lines without interfering with PSA expression. Int J Cancer 2005;114:190–194. doi:10.1002/ijc.20701
24. Dreikorn K, Lowe F, Borkowski A. Other medical therapies. In: Chatelain C, Denis L, Foo KT, Khoury S, McConnell J.[Eds.] Benign prostatic hyperplasia. Plymouth, UK: Health Publica-tions; 2001. p. 481–511. 5. Ravenna L, Di Silverio F, Russo MA, Salvatori L, Morgante E, Morrone S, et al. Effects of the lipidosterolic extract of Serenoa repens (Permixon) on human prostatic cell lines. Prostate 1996;29(4):219–30.
26. Van Coppenolle F, Le Bourhis X, Carpentier F, Delaby G, Cousse H, Raynaud JP, et al. Pharmacological effects of the lipidosterolic extract of Serenoa repens (Permixon) on rat prostate hyperplasia induced by hyperprolactinemia: comparison with finasteride. Prostate 2000;43(1):49-58
27. Vacher, P., Prevarskaya, N., Skyrma, R., Audy, M.C.,Vacher, A.M., Odessa, M.F. et al. The lipidosterolic extract from Serenoa repens interferes with prolactin receptor signal transduction. J Biomed Sci 1995;2(4):357-365.
28. Paubert-Braquet M, Mencia Huerta JM, Cousse H, Braquet P. Effect of the lipidic lipidosterolic extract of Serenoa repens (Permixon) on the ionophore A23187-stimulated production of leukotriene B4 (LTB4) from human polymorphonuclear neutrophils. Prostaglandins Leukot Essent Fatty Acids 1997;57:299–304.
29. Vela Navarrete R, Garcia Cardoso JV, Barat A, Manzarbeitia F, Lopez Farre A. BPH and in-flammation: pharmacological effects of Permixon on histological and molecular inflammatory markers.Results of a doubleblind pilot clinical assay. Eur Urol 2003;44:549–55
30. Di Silverio F, Gentile V, De Matteis A , et al. Distribution of inflammation, premalignant le-sions, incidental carcinoma in histologically confirmed benign prostatic hyperplasia: a retrospective analysis. Eur Urol 2003;43:164–75.
31. Steiner GE, Newman ME, Paikl D, Stix U, Memaran-Dagda N, Lee C, Marberger MJ. Expression and function of proinflammatory interleukin IL-17 and IL-17 receptor in normal, benign hyperplastic, and malignant prostate. Prostate 2003; 56:171-182. DOI: 10.1002/ pros.10238
32.Кудрявцев Ю.В., Сивков А.В., Разумов С.В., Медведев А.А., Кочетов С.А. Морфологические изменения в ткани предстательной железы больных с доброкачественной гиперплазией предстательной железы при лечении пермиксоном. Урология 2004;(5):10-11
33. Sirab N, Robert G, Fasolo V,Descazeaud A, Vacherot F, de la Taille, et al. Lipidosterolic extract of Serenoa repens modulates the expression of inflammation related-genes in benign prostatic hyperplasia epithelial and stromal cells. Int J Mol Sci 2013; 14:14301-14320. doi: 10.3390/ ijms140714301
34. De la Taille A.Therapeutic Approach: The Importance of сontrolling Prostatic Inflammation. Eur Urol Suppl 2013; 12(5): 116-122. doi: http://dx.doi.org/10.1016/j.eursup.2013.08.003
35. Latil A, Pétrissans MT, Rouquet J, de la Taille A. Effects of hexanic extract of Serenoa repens (Permixon® 160 mg) on inflammation biomarkers in the treatment of lower urinary tract symptoms related to benign prostatic hyperplasia. Prostate 2015;75(16):1857-1867. doi: 10.1002/pros.23059
36. Kyprianou N, Tu H, Jacobs SC. Apoptotic versus proliferative activities in human benign prostatic hyperplasia. Hum Pathol 1996;27: 668–675.
37. Bayne CW, Ross M, Donnelly F, Habib FK. The selectivity and specificity of the actions of the lipido-sterolic extract of Serenoa repens (Permixon) on the prostate. J Urol 2000;164:876–881.
38. Vacherot F, Azzouz M, Gil-Diez-De-Medina S, Colombel M, De La Taille A, Lefrère Belda MA, et al. Induction of apoptosis and inhibition of cell proliferation by the lipido-sterolic extract of Serenoa repens (LSESr, Permixon in benign prostatic hyperplasia). Prostate 2000;45:259–266.
39. Vela-Navarrete R, Escribano-Burgos M, Farre AL, Garcia-Cardoso J, Manzarbeitia F, Carras-co C. Serenoa repens treatment modifies bax/ bcl-2 index expression and caspase-3 activity in prostatic tissue from patients with benign prostatic hyperplasia. J Urol 2005;173:507–510. doi: 10.1097/01.ju.0000150533.94952.25
40. Dathe G, Schmid H. Phytotherapie der benignen Prostata hyperplasie (BPH) mit Extractum Serenoa repens (Permixon®). Urologie 1991;31:220-223
41. Stepanov VN, Siniakova LA, Sarrazin B, Raynaud JP. Efficacy and tolerability of the lipidos-terolic extract of Serenoa repens (Permixon®) in benign prostatic hyperplasia: a double-blind com-parative study of two dosage regimens. Adv Ther 1999;16:231-241.
42. Authié, D., Cauquil, J. Appréciation de l’efficacité de Permixon® en pratique quotidienne. C R Ther Pharmacol Clin 1987; 56:4–13.
43. Foroutan F. Wirksamkeit und Vertraglichkeit von Permixon® bei einem grosseren Patienten-kollektiv (592 Patienten) unter Praxisbedingungen. J Urol Urogynakol 1997;2:17–21.
44. Лопаткин Н.А, Пытель Ю.А., Сивков А.В., Винаров А.З., Гориловский Л.М., Медведев А.А. Результаты долгосрочного применения Пермиксона® у больных с симптомами нару-шения функции нижних мочевых путей, обусловленными доброкачественной гиперплазией предстательной железы. Урология 2004; (2):3-7
45. Сивков А.В. Пермиксон: механизм действия, клиническая эффективность и место в ле-чении ДГПЖ. В кн.: Доброкачественная гиперплазия предстательной железы. [под ред. Н.А.Лопаткина], М.: 1999, С. 117-133.
46. Аляев Ю.Г., Винаров А.З., Локшин К.Л., Спивак Л.Г. Пятилетний опыт лечения пермиксоном (Serenoa repens, "Pierre Fabre Medicament") больных гиперплазией простаты. Урология 2002;(1):23-25.
47. Винаров А.З. Медикаментозное лечение больных гиперплазией предстательной железы: Aвтореф. дис… докт. мед. наук. М.: 1999. 40 с.
48. Plosker G.L. and Brogden R.N. Serenoa repens (Permixon®). A review of its pharmacology and therapeutic efficacy in benign prostatic hyperplasia. Drugs Aging 1996;9:379-395.
49. Descotes JL, Rambeaud JJ, Deschaseaux P, Faure G. Placebo-controlled evaluation of the effi-cacy and tolerability of Permixon® in benign prostatic hyperperplasia after exclusion of placebo responders. Clin Drug Invest 1995;9:291-297.
50. Cukier J, Ducassou J, Le Guillou M, , Leriche A, Lobel B, Toubol J. Permixon versus place-bo, resultats d'une étude multicentrique. Comptes Rend Ther Pharmacol Clin 1985; 4:15–21
51. Champault G, Patel JC, Bonnard AM. A double-blind trial of an extract of the plant Serenoa repens in benign prostatic hyperplasia. Br J Clin Pharmac 1984; 18: 461-462.
52. Carraro JC, Raynaud JP, Koch G, Chisholm GD, Di Silverio F, Teillac P, et al. Comparison of phytotherapy (Permixon®) with finasteride in the treatment of benign prostate hyperplasia: a ran-domized international study of 1,098 patients. Prostate 1996; 29: 231-240.
53. Grasso M, Montesano A, Buonaguidi A, Castelli M, Lania C, Rigatti P, et al, Comparative ef-fects of alfuzosin versus Serenoa repens in the treatment of symptomatic benign prostatic hyper-plasia. Arch Esp de Urol 1995;48:97-103.
54. Debruyne F, Koch G, Boyle P, Da Silva FC, Gillenwater JG, Hamdy FC, et al. Comparison of a phytotherapeutic agent (Permixon) with an alpha-blocker (Tamsulosin) in the treatment of benign prostatic hyperplasia: a 1-year randomized international study. Eur Urol. 2002;41(5):497-506.
55. Debruyne F, Boyle P, Da Silva FC, Gillenwater JG, Hamdy FC, Perrin P, et al. Evaluation of the clinical benefit of Permixon® and Tamsulosin® in severe BPH Patients – PERMAL Study Subset Analysis. Eur Urol 2004; 45:773-780. doi:10.1016/j.eururo.2004.01.015
56. Adriazola Semino M, Lozano Ortega JL, Garcia Cobo E, Tejada Bañez E, Romero Rodriguez F. Symptomatic treatment of benign prostatic hypertrophy. Comparative study of prazosin and Serenoa repens. Arch Esp Urol 1992;45:211-213
57. Boyle P, Robertson C, Lowe F, Roehrborn C. Updated meta-analysis of clinical trials of Serenoa repens extract in the treatment of symptomatic benign prostatic hyperplasia. BJU Int 2004;93:751-756. doi: 10.1111/j.1464-410X.2003.04735.x
58. D’Ottavio G, Lagana A, Zappavigna D. Changes in seminal parameters after long-term treat-ment with Serenoa repens. Urologia 1987;54:616-621.
59. Magri V , Trinchieri A, Pozzi G , Restelli A , Garlaschi MC , Torresani E, et al. Efficacy of repeated cycles of combination therapy for the eradication of infecting organisms in chronic bacte-rial prostatitis. Int J Antimicrob Agents. 2007; 29: 549–556. doi: 0.1016/ j.ijantimicag.2006.09.027
60. Stamatiou K, Pierris N. Serenoa repens extract additionally to quinolones in the treatment of chronic bacterial prostatitis. The preliminary results of a long term observational study. Arch Ital Urol Androl 2013; 85,(4):190-196 . doi: 10.4081/aiua.2013.4.190
61. Busetto GM, Giovannone R, Ferro M, Tricarico S, Del Giudice F, Matei DV, et al. Chronic bacterial prostatitis: efficacy of shortlasting antibiotic therapy with prulifloxacin (Unidrox®) in association with saw palmetto extract, lactobacillus sporogens and arbutin (Lactorepens®). BMC Urology 2014;14:53. doi: 10.1186/1471-2490-14-53
62. Novara G , Giannarini G , Alcaraz A, Co´zar-Olmo JM , Descazeaud A, Montorsi F, et al. Efficacy and Safety of Hexanic Lipidosterolic Extract of Serenoa repens (Permixon) in the Treatment of Lower Urinary Tract Symptoms Due to Benign Prostatic Hyperplasia: Systematic Review and Metaanalysis of Randomized Controlled Trials. Еur Urol Focus 2016;2(5): 553-554.doi:http://dx.doi.org/10.1016/j.euf.2016.04.002







