Лучевая терапия является одним из основных методов лечения онкологической патологии органов малого таза. Известно, что ткани различных органов имеют существенно разные, нередко сильно персонифицированные пороги устойчивости к ионизирующем излучению [1,2]. В результате воздействия ионизирующего излучения, наряду с опухолевыми, гибнут недифференцированные клетки, отвечающие за регенерацию тканей [3]. Все эти факторы лежат в основе тканевых и органных реакций на облучение [4-6]. Одним из основных побочных эффектов облучения по поводу злокачественных новообразований органов малого таза является лучевой цистит.
Исследования патогенеза и прогнозирования степени тяжести радиационно-индуцированных повреждений мочевого пузыря проводятся более двадцати лет [7]. Для прогнозирования реакции нормальных тканей на воздействие ионизирующего излучения созданы и изучены различные модели, учитывающие тип тканей и особенности взаимодействия с ними ионизирующей радиации [8,9]. Анализ литературных данных показал, что повышенный риск развития тяжелых радиационно-индуцированных повреждений имеют пациенты с сахарным диабетом [10], патологией сердечно-сосудистой системы [11], заболеваниями, передающимися половым путем в анамнезе, в том числе с ВИЧ-инфекцией [12] и системными заболеваниями соединительной ткани [13], а также с хроническими воспалительными заболеваниями кишечника и мочевого пузыря, в том числе циститом [14-16]. Тем не менее, несмотря на выделение групп риска, до настоящего времени отсутствуют методы предсказания развития тяжелых осложнений лучевого лечения со стороны мочевого пузыря у конкретных пациенток.
Задняя стенка и мочепузырный треугольник являются «горячими» зонами при проведении лучевой терапии, поскольку именно они получают дозу, превышающую толерантное значение для мочевого пузыря [17]. Важную роль в патогенезе лучевого повреждения играет деструкция коллагеновых волокон мочевого пузыря, так как именно с ней связаны изменения сосудистой стенки и последующая облитерация сосудов, которая приводит к гипоксии и дистрофическим изменениям тканей [18,19]. Известно, что матриксные структуры – волокнистый компонент (коллагеновые и эластические волокна) и аморфный компонент (гликопротеины, гликозаминогликаны, протеогликаны и их агенты) – биохимически и функционально связаны. Они играют важнейшую роль в регуляции тканевого метаболизма, являясь для клеток опорными структурами и химическими раздражителями [20].
Состояние соединительнотканных подэпителиальных структур в мочевом пузыре пациентов после лучевой терапии изучены нашей исследовательской группой в предыдущих работах [21,22]. Для изучения состояния соединительнотканного матрикса на уровне общей архитектоники ткани была использована кросс-поляризационная оптическая когерентная томография (КП ОКТ) [22]. Являясь методом прижизненной визуализации, КП ОКТ имеет пространственное разрешение порядка 15 мкм при глубине зондирования 1- 1,5 мм, что позволяет характеризовать изменения нормальной структуры тканей стенки мочевого пузыря по свойствам общего обратного рассеяния зондирующего излучения, а также регистрировать изменения состояния подэпителиальных коллагенсодержащих компонентов слизистой оболочки мочевого пузыря по свойствам кросс-рассеяния от волокнистых структур. В ряде работ показано, что кросс-рассеяние позволяет выявлять качественные и количественные изменения топологии волокон коллагена [23,24]. Ранее нами было показано, что признаками лучевого цистита различной степени тяжести на КП ОКТ изображениях стенки мочевого пузыря являются изменения именно подэпителиальных соединительнотканных структур. Для ранних циститов характерна потеря контраста изображений в кополяризации и резкое ослабление и даже исчезновении сигнала в кроссполяризации, что является признаком серьезных структурных изменений коллагеновых волокон, их дезорганизации. При поздних лучевых циститах на фоне атрофии эпителиального слоя отмечается выраженный фиброз подэпителиальных соединительнотканных структур. Однако визуальная оценка КП ОКТ изображений имеет определенные недостатки, главным из которых является зависимость интерпретации изображений от квалификации специалиста. Кроме того, при визуальной оценке изображений отсутствует возможность прогнозирования развития той или иной степени лучевого повреждения ткани мочевого пузыря.
Современные подходы к диагностике и мониторингу патологических состояний различного генеза предполагают наличие информационно-технологической поддержки процесса диагностики и сопровождения лечения на основе численного анализа медицинских изображений, полученных с помощью многообразных методов визуализации. Количественная оценка изображений позволяет во-первых, извлекать дополнительную информацию, которую невозможно получить при интерпретации «невооруженным глазом»; вовторых, численный анализ и автоматическая классификация изображений делают метод «оператор-независимым», т.е. повышают вероятность получения объективного, независимого от квалификации исследователя результата. Наконец, сопоставление количественных показателей может стать основой для разработки предиктивных критериев метода.
В данной работе предложен алгоритм количественной оценки оптических изображений, полученных методом КП ОКТ, и определены прогностические критерии степени лучевых осложнений со стороны мочевого пузыря при лучевой терапии органов малого таза.
Цель: на основе КП ОКТ данных разработать метод оперативной диагностики состояния соединительнотканного матрикса мочевого пузыря, позволяющий с определенной точностью рассчитать вероятность развития его тяжелых осложнений при лучевой терапии заболеваний органов малого таза.
МАТЕРИАЛЫ И МЕТОДЫ
Метод КП ОКТ
Качественные изменения соединительнотканного матрикса мочевого пузыря (топология коллагенсодержащих волокон) определялись у пациенток, получавших консультацию или лечение в клинике урологии ГБУЗ НО «Нижегородская областная клиническая больница им. Н.А. Семашко» по поводу хронического рецидивирующего цистита (n-28), лучевого цистита различной степени тяжести (n-21) на основе цистоскопии с КП ОКТ исследованием и гистологического исследования. У пациенток, которые получали лечение по поводу мочекаменной болезни, камней верхних мочевых путей, мочевой пузырь был принят за нормальный (n=5).
Использованный в данной работе прибор «ОКТ-1300У» имеет следующие характеристики. Источникомизлучения служит суперлюминесцентный диод, рабочая длина волны 1310 нм, ширина спектра 130 нм, что обеспечивает аксиальное разрешение 15 мкм. Латеральное разрешение составляет 25 мкм. При сканировании ткани по глубине получается профиль рассеяния излучения по глубине или А-скан, из которых при поперечном сканировании строится 2D изображение. Использование в качестве зондирующего поляризованного излучения позволяет строить два сопряженных друг с другом ОКТ изображения: в исходной (ко-поляризации) и ортогональной исходной (кросс-) поляризациях, что имеет решающее значение при оптическом разделении имеющихся в ткани не волокнистых (клетки) и волокнистых (коллагенсодержащие компоненты) элементов. 2D ОКТ изображение в каждой поляризации имеет размер 1,8x1,3 (ширина х высота) мм2 , в рабочем окне программы они объединены в одно КП ОКТ изображение.
Группы КП ОКТ изображений
КП ОКТ изображения мочевого пузыря при разных патологических состояниях и в норме получены in vivo с использованием эндоскопического контактного торцевого зонда. Для морфологической верификации патологии из области дна мочевого пузыря выполняли забор биопсийного материала резектоскопом с последующей окраской гистологических препаратов гематоксилином и эозином. Проведение исследования одобрено решением Этического комитета НижГМА (протокол №14 от 10 декабря 2013 г.). Все пациенты подписывали Информированное согласие.
Полученные наборы КП ОКТ изображений стенкимочевого пузыря в соответствие с клиническим диагнозом и гистологическим заключением разделены на 4 группы: условная норма с минимальными проявлениями воспалительного процесса (n=22), хронический цистит с преобладанием атрофии эпителия и фиброзом в слизистой и подслизистой структурах (n=122), лучевое поражение I-II (n=40) и III-IV (n=34) степеней тяжести.
Алгоритм для автоматической идентификации патологических изменений по КП ОКТ изображениям
Поскольку патологические процессы мочевого пузыря имеют характерные проявления на КП ОКТ изображениях, существует возможность построить алгоритм автоматической идентификации патологических изменений.Для построения такого алгоритма необходимо представить каждое изображение как набор чисел, после чего создать функцию, принимающую в качестве аргумента данные числа и выдающую в качестве результата значение между 0 и 1, соответствующее вероятности того, что данное КП ОКТ изображение ткани принадлежит к определенному морфологическому типу. Таким образом, задача построения алгоритма классификации может быть условно разделена на две отдельные задачи: 1) представление каждого изображения в виде набора чисел (построение характеристического вектора); 2) создание функции, связывающей набор чисел, характеризующих данное изображение, и вероятность принадлежности данного изображения к одному из целевых классов.
Основной информацией, получаемой с помощью КП ОКТ прибора, является распределение рассеивателей по глубине в ко- и кросс- поляризациях, так называемый А-скан. Набор А-сканов составляет КП ОКТ изображение. Таким образом, особенности КП ОКТ изображений, характерные для различных состояний мочевого пузыря, могут быть зарегистрированы на отдельных А-сканах, и КП ОКТ изображение может быть с определенной точностью описано с помощью усредненного А-скана. Сам по себе А-скан представляет собой 256 чисел, соответствующих величине рассеяния на каждой глубине в исходной поляризации и 256 чисел, соответствующих величине рассеяния на каждой глубине в ортогональной поляризации. Данные 512 чисел в принципе могут быть использованы в качестве искомого набора, характеризующего состояние ткани. Однако уменьшение данного числа является желательным для более эффективного решения второй части задачи – создания алгоритма классификации: связывающей набор чисел, характеризующих данное изображение, и вероятность принадлежности данного изображения одному из целевых классов. Это позволит данной функции выдавать результаты, более устойчивые к индивидуальным особенностям изображений, не связанным с развивающимися в ткани патологическими процессами.
Для описания каждого изображения с помощью набора чисел, усредненный А-скан в ко- и кроссполяризациях раскладывался по трем базисам ортогональных функций. Первый набор ортогональных векторов получен методом главных компонент из всего набора записанных А-сканов; второй набор получен из набора А-сканов, составляющих КП ОКТ изображения нормального мочевого пузыря; третий – из набора А-сканов, составляющих КП ОКТ изображения мочевого пузыря с патологией.
Наблюдаемые А-сканы в обеих поляризациях рассматривались как один вектор с размерностью 512. Метод главных компонент позволяет представить данные измерения в виде суммы базисных векторов, причем основная информация о распределении содержится лишь в ограниченном количестве данных векторов. В настоящей работе оказалось достаточным использовать 8 первых коэффициентов для каждого из трех базисов, итого 24 значения. В качестве функции, связывающей полученный набор из 24 чисел, характеризующих данное изображение, и вероятность принадлежности данного изображения одному из целевых классов, использовался алгоритм классификации, известный как случайный лес решающих деревьев (Random Forest Tree) [25,26]. В качестве результата примененный алгоритм действий выдавал число в диапазоне 0-1, которое можно интерпретировать как вероятность того, что исследуемое КП ОКТ изображение принадлежит к определенному классу (норма в случае классификации норма/цистит и радиационное поражение I-II степени в случае дифференциации степеней радиационного поражения). В зависимости от выбранного значения данной величины, разделяющей интересующие состояния мочевого пузыря, алгоритм анализа КП ОКТ изображений дает различные значения чувствительности / специфичности / диагностической точности, которые проанализированы в разделе «Результаты».
Поскольку точностьметода классификации увеличивается вместе с увеличениемколичества входных данных (из-за того, что алгоритм Random Forest Tree имеет возможность вычленить систематические закономерности, не сбиваясь на индивидуальные особенности отдельных изображений), каждое полученное КП ОКТ изображение автоматически разбивалось на 15 фрагментов меньшего размера, что позволило эффективно увеличить количество входных данных для построения классификатора. При этом половина данных изображений была использована для обучения методики алгоритма, вторая половина – для анализа результатов.
РЕЗУЛЬТАТЫ
КП ОКТ изображения, характерные для каждой из исследуемых групп (нормы и 3-х групп патологии), представлены на рисунке 1. КП ОКТ изображения нормального мочевого пузыря структурные: можно видеть горизонтально направленные слои: тонкий верхний слой со средней интенсивностью сигнала, соответствующий уротелию (40-60 мкм); второй слой с высокой интенсивностью сигнала включает субэпителиальные соединительнотканные структуры, включая собственную пластинку слизистой оболочки и подслизистую оболочку. Граница уротелий – подлежащая соединительная ткань при этом четкая; нижний третий слой с низким уровнем сигнала соответствует мышечной оболочке (рис. 1а). Наиболее четко соединительнотканные структуры видныв кросс-поляризации как яркий ОКТ-сигнал, сигнал от уротелия имышечной оболочки при этом на уровне фона (рис. 1а, верхняя часть изображения, цифра 2). При хроническом цистите в ко-поляризации четко определяется контраст продольных структур внутри соединительнотканного слоя (рис. 1б, нижняя часть изображения); в кросс-поляризации соединительнотканные подэпителиальные структурыопределяются на ту же глубину, что и в ко-поляризации и имеют высокий уровень сигнала (рис. 1б, верхняя часть изображения).
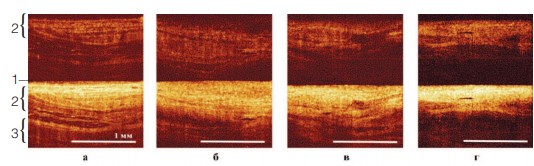
Рис.1. КП ОКТ изображения стенки мочевого пузыря в норме (а), при хроническом цистите (б), при I-II (в) и III-IV (г) степенях радиационного повреждения. Верхняя часть каждого изображения – кросс-поляризация, нижняя часть – ко-поляризация
При II степени тяжести осложнений лучевой терапии морфологически структура внеклеточного соединительнотканного матрикса (коллагеновых и эластических волокон) сохраняется на фоне их уплотнения, при этом КП ОКТ изображения, полученные in vivo, характеризуются истончением и атрофией первого (эпителиального) слоя, расширением второго слоя (соединительнотканных структур) иногда на всю глубину изображения, с большей интенсивностью сигнала от него (рис. 1в). Для III степени тяжести лучевого поражения характерны: атрофия эпителиального слоя с одновременным выраженным фиброзом соединительнотканных структур, что проявляется исчезновением первого слоя и ярким гомогенным ОКТ-сигналом от второго слоя, что можно заметить по кросс-поляризации (рис. 1г, верхняя часть изображения).
Визуальная оценка КП ОКТ изображений требует от практикующего врача знания морфологических особенностей строения стенки мочевого пузыря при исследуемых патологиях и значительного опыта их интерпретации. В данной работе предложен метод оперативной автоматической оценки состояния соединительнотканного матрикса мочевого пузыря на основе КП ОКТ данных.
Способность построенной предсказательной модели отличать КП ОКТ изображения нормальной ткани мочевого пузыря от хронического цистита и различать клинические группы радиационного поражения была исследована с помощью анализа кривой ошибок. Данная кривая строится на плоскости по градациям истинно-положительная пропорция – ложно-положительная пропорция.Для каждого возможного значения порога, разделяющего два интересующих случая, на данной плоскости ставятся соответствующие значения пропорции истинно-определенных случаев и ложно – положительных результатов. В случае предложенного алгоритма, интересующими случаями являются либо норма/цистит, либо радиационный цистит I-II/III-IV степени, а значением, разделяющим данные группы – величина в диапазоне 0-1 (вероятность целевого изображения принадлежать к определенному типу), выдаваемая разработанным алгоритмом в качестве результата.
Кривая ошибок для классификации норма/цистит приведена на рисунке 2; в таблице 1 приведены некоторые из возможных значений порога, разделяющего данные состояния мочевого пузыря по КП ОКТ изображениям, а также значения чувствительности/специфичности/диагностической точности, соответствующие данной величине порога. Подобное представление позволяет выбрать порог, обеспечивающий либо максимальную диагностическую точность, либо оптимальный баланс чувствительности и специфичности.
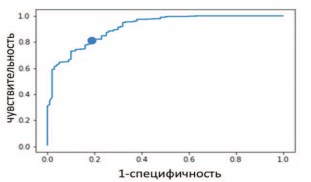
Рис.2. Кривая ошибок для групп нормы и хронического цистита. Точкой отмечен предлагаемый выбор порога (0,86), обеспечивающий, по мнению авторов, оптимальное сочетание чувствительности (82%) и специфичности (82%)
Таблица 1. Диагностическая ценность метода при использовании различных значений критерия для градации норма/хронический цистит
| Значения порога вычисляемого критерия | Чувствительность, % | Специфичность, % | Диагностическая точность, % |
|---|---|---|---|
| 0,90 | 72 | 90 | 75 |
| 0,86 | 82 | 82 | 82 |
| 0,77 | 90 | 69 | 89 |
Аналогичные результаты для классификации степеней тяжести радиационного поражения приведены на рисунке 3 и в таблице 2.
Таблица 2. Диагностическая ценность метода при использовании различных значений критерия для градации I-II/III-IV степеней радиационного поражения
| Значения порога вычисляемого критерия | Чувствительность, % | Специфичность, % | Диагностическая точность, % |
|---|---|---|---|
| 0,51 | 77 | 91 | 85 |
| 0,44 | 84 | 84 | 84 |
| 0,37 | 90 | 76 | 82 |
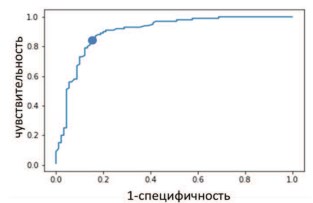
Рис. 3. Кривая ошибок для групп I-II и III-IV степени радиационного поражения. Точкой отмечен предлагаемый выбор порога, обеспечивающий, по мнению авторов, оптимальное сочетание чувствительности (84%) и специфичности (84%)
Эффективность критерия для каждого попарного предсказания составила: для градации норма – хронический цистит чувствительность – 82%, специфичность – 82% (площадь под кривой ошибок 0,91) (рис. 2); для градации I-II – III-IV степеней радиационного поражения чувствительность – 84%, специфичность – 84% (площадь под кривой ошибок 0,89) (рис. 3).
ОБСУЖДЕНИЕ
Известно, что в мочевом пузыре способность тканей к репарации после лучевого повреждения зависит от исходного состояния тканей [15]. Ранее нашей исследовательской группой был проведен КП ОКТ мониторинг радиационно-индуцированных повреждений мочевого пузыря для использования в клинической практике. Метод КП ОКТ зарекомендовал себя, как высокочувствительный при диагностике онкологической патологии мочевого пузыря [23].
Мультимодальный подход к изучению изменения состояния коллагеновых волокон при осложнениях со стороны мочевого пузыря после лучевой терапии позволил нам интерполировать результаты, полученные методами световой, нелинейной [21] и атомно-силовой микроскопии [27], на результаты КП ОКТ исследований.
В результате накопленного значительного опыта исследовательского коллектива определено, что для опытного исследователя, знакомого с морфологическими особенностями строения мочевого пузыря при различной патологии, анализ КП ОКТ изображений не представляет проблем. Однако для начинающего специалиста – уролога, выполняющегоКП ОКТ исследование, анализ КП ОКТ изображений может быть затруднителен. Данная работа посвящена созданию независящего от квалификации исследователя метода, позволяющего на основе КП ОКТ данных оперативно оценить вероятность развития тяжелых осложнений со стороны мочевого пузыря при планировании лучевой терапии, а также верифицировать необратимые изменения в мочевом пузыре в постлучевом периоде.
Оперативная автоматическая оценка состояния соединительнотканного матрикса мочевого пузыря на основе КП ОКТ данных для возможности предсказания развития тяжелых необратимых изменений его ткани при лучевой терапии других органов малого таза до настоящего времени оставалась нерешенной в современной онкоурологии. Предложенный в данной работе алгоритм классификации состояний мочевого пузыря на основе КП ОКТ изображений является важнымшагомдля решения выше обозначенной задачи и может способствовать внедрению технологии КП ОКТ в широкую урологическую практику, поскольку позволяет получать результаты с предсказуемой чувствительностью и специфичностью в независимости от опыта и квалификации оператора КП ОКТ установки.
ЗАКЛЮЧЕНИЕ
Создан независящий от квалификации исследователя метод, позволяющий на основе КП ОКТ данных оперативно оценить вероятность развития тяжелых осложнений со стороны мочевого пузыря при планировании лучевой терапии, а также верифицировать необратимые изменения в мочевом пузыре (III-IV клиническая степень осложнений), от обратимых изменений (I-II клиническая степень осложнений) в период после облучения. На основе предложенного метода возможно создание компьютерной программы анализа КП ОКТ изображений во время проведения обследования пациента. Работа поддержана грантом РФФИ № 16-07-00655.
ЛИТЕРАТУРА
- Dörr W. Radiation effect in normal tissue –principles of damage and protection. Nuklearmedizin 2010; 49(1): 53-58.
- Жизнеспособность клеток, облученных в малых дозах: теоретические и клинические аспекты [под ред. Т. Альпер, пер. с анг.]. М.: Медицина, 1979, 343 с.
- Hur W, Yoon S K. Molecular pathogenesis of radiation-induced cell toxicity in stem cells. Int J Mol Sci 2017;18(12): 2749. doi: 10.3390/ijms18122749.
- Dörr W, Hendry JH. Consequential late effectsin normal tissues. Radiother Oncol 2001;61(3): 223–231.
- Рич Д.П., Д'Амико Э.В. В кн. Онкоурология [пер. с англ.; под ред. О.Б. Лорана]. М.: Издательство БИНОМ, 2011. С. 72.
- Линденбратен Л.Д. Лясс Ф.М. Медицинская радиология. М.: Медицина, 1979. 392 с.
- Stewart FA. Mechanism of bladder damage and repair aer treatment with radiation and cytostatic drugs. J Cancer 1986; 53(VII): 280-291.
- Sullivan L, Williams SG, Tai KH, Foroudi F, Cleeve L, Duchesne GM. Urethral stricture following high dose rate brachytherapy for prostate cancer. Radiother Oncol. 2009;91:232–236. doi: 10.1016/j.radonc.2008.
- Trott KR, Doerr W, Facoetti A, Hopewell J, Langendijk J, Luijk P, et al. Biological mechanisms of normal tissue damage: Importance for the design of NTCP models. Radiother Oncol 2012;105(1):79-85. http://dx.doi.org/10.1016/j.radonc.2012.05.008.].
- Herold DM, Hanlon AL, Hanks GE. Diabetes mellitus: a predictor for late radiation morbidity. Int J Radiat Oncol Biol Phys 1999;43(3):475-479.
- Hamstra DA, Stenmark MH, Ritter T, Litzenberg D, Jackson W, Johnson S, et al. Age and comorbid illness are associatedwith late rectal toxicity following dose-escalated radiation therapy for prostate cancer. Int J Radiat Oncol Biol Phys 2013; 85(5): 1246-1253. http//dx.doi.org/10.1016/j.ijrobp.2012.10.042.
- Eifel PJ, Jhingran A, Bodurka DC, Levenback C, ames H. Correlation of smoking history and other patient characteristics with major complications of pelvic radiation therapy for cervical cancer. J Clin Oncol 2002;20(17):3651-3657. doi: 10.1200/JCO.2002.10.128
- Shadad AK, Sullivan FJ, Martin JD, Egan LJ. Gastrointestinal radiation injury: Prevention and treatment. World J Gastroenterol 2013; 19(2): 199-208. doi: 10.3748/wjg.v19.i2.199.
- Willett CG, Ooi CJ, Zietman AL, Menon V, Goldberg S, Sands BE, Podolsky DK. Acute and late toxicity of patients with inflammatory bowel disease undergoing irradiation for abdominal and pelvic neoplasms. Int J Radiat Oncol Biol Phys 2000;46(4): 995-998.
- КапринА.Д., Титова В.А., Крейнина Ю.М., КостинА.А. Урологические осложнения в онкогинекологической практике: диагностика, интервенционная и консервативная коррекция. Москва; 2011; 168 с.
- Каприн А.Д., Титова В.А., Ашрафян Л.А., Костин А.А., Крейнина Ю.М. Интервенционные технологии при урологических осложнениях многокомпонентных программ лечения гинекологических опухолей. Онкохирургия 2008;(1):74.
- ПавловА.С., Симакина Е.П., Бриккер И.Н., Фадеева М.А., Карякина Н.Ф., РепинаА.Г., Мардашева Л.В. Гистограммы доза-объем для оценки доз излучения при дистанционной лучевой терапии. Материалы I Конгресса Российского общества онкоурологов (Москва, 4-5 окт.2006г.) Российское общество онкоурологов: Б.и., 2006.- С 47- 48..
- Важенин А.В., Фокин А.А., Терешин О. С. Артериопатия как позднее осложнение лучевой терапии опухолей. Вопросы онкологии 2005;51( 4):485-487.
- Kochueva M, Dudenkova V, Kuznetsov S, Varlamova A, Sergeeva E, Kiseleva E, Maslennikova A. Quantitative assessment of radiation-induced changes of bladder and rectum collagen structure using optical methods. J Biomed Opt 2018;23(9):1-8. doi: 10.1117/1.JBO.23.9.091417.
- Шафранов В.В., Борхунова Е.Н., Таганов А.В., Короткий Н.Г. Келоидные рубцы у детей. Москва: Династия, 2006. 112 с.
- Streltsova OS, Maslennikova AV, Yunusova KE, Dudenkova VV, Kiseleva EB, Kochueva МV, et al. Nonlinear microscopy in studying extracellular matrix state of the urinary bladderin severe complications aer radiation therapy of female pelvic tumors. Sovremennye Tehnologii v Medicine 2017; 9(2):19-26.
- Стрельцова О.С., Дуденкова В.В., Масленникова А.В., Киселева Е.Б., Тарарова Е.А., Юнусова К.Э., Синякова Л.А. Роль структурных изменений внеклеточного матрикса мочевого пузыря в возникновении побочных эффектов лучевой терапии разной степени тяжести. Урология 2018;( 2):14-19.
- Gladkova N.,Kiseleva E., Streltsova O., Prodanets N., Snopova L.,Karabut M., et al.Combined use of fluorescence cystoscopy and cross-polarization OCT for diagnosis of bladder cancer and correlation with immunohistochemical markers. J Biophotonics 2013;6(9):687-98. doi: 10.1002/jbio.201200105.
- Kiseleva Е.B., Kirillin M.Yu., Feldchtein F.I., Vitkin I.A., Sergeeva E.A., Zagaynova E.V., Streltzova O.S., Shakhov B.E., Gubarkova E.V., Gladkova N.D. Differential diagnosis of human bladder mucosa pathologies in vivo with cross-polarization optical coherence tomography. Biomed Opt Express 2015;6(4):1464-76. doi: 10.1364/BOE.6.001464. eCollection 2015.
- Liaw A, Wiener M. Classification and regression by random Forest. R news 2002;2(3), 18-22.
- Breiman L. Random forests. Machine learning 2001;45(1), 5-32.
- Киселева Е.Б., Губарькова К.В., Дуденкова В.В., Тимашев П.С., Котова С.Л., Тимофеева Л.Б., и др. Комплементарное исследование состояния коллагена при заболеваниях мочевого пузыря методами кросс-поляризационной оптической когерентной томографии, нелинейной и атомно-силовой микроскопии. Современные технологии в медицине. 2017;9(1):7-20. doi: 10.17691/stm2017.9.1.01.







