Под нейрогенной дисфункцией мочевого пузыря (НДМП) следует понимать разнообразные формы нарушения его резервуарной и эвакуаторной функции, развивающиеся вследствие поражения нервной системы на ее различных уровнях – от коры головного мозга до интрамурального аппарата [1,3,5,8,9,16,17,19]. Несмотря на пограничный характер данной патологии исследования НДМП ведутся, чаще всего, в рамках одной специальности [4,6,7,18]. До настоящего времени нет единого мнения в отношении этиологии данного заболевания. Большинство авторов занимающихся изучением НДМП, отмечают ведущую роль нарушений нервной системы в развитии заболевания [13,14,20], но акцент в лечении делается все же на стабилизацию функционального состояния мочевого пузыря различными методами симптоматической терапии [2,15,21]. При этом явно недооцениваются перспективы лечения самого очага поражения нервной системы как первопричины заболевания [10]. На наш взгляд, топическая диагностика поражений нервной системы и целенаправленное терапевтическое воздействие на указанные структуры в сочетании с симптоматической терапией функциональных расстройств мочевого пузыря могут существенно улучшить результаты лечения НДМП, которые до настоящего времени остаются пока еще малоутешительными. Несмотря на достигнутые определенные успехи в этом направлении общая эффективность проводимого лечения у больных НДМП остается пока еще невысокой: 44,4% – у пациентов с поражением конуса и эпиконуса спинного мозга и 50,0-70,5% – у детей с высокими уровнями поражения центральной нервной системы (цервикальный и церебральный) [1,7]. Таким образом, остаются нерешенными вопросы качества жизни детей с нейрогенной дисфункцией мочевого пузыря и вторичным энурезом, а также вопросы рецидивирующей инфекции мочевыводящих путей при клинических формах НДМП, сопровождающихся нарушениями уродинамики [11,12,21]. Все это обуславливает актуальность обсуждения проблемы НДМП и требует дальнейших усилий научных работников и практических врачей различных специальностей в изучении этой патологии детского возраста.
МАТЕРИАЛЫ И МЕТОДЫ
Под нашим наблюдением находились 133 ребенка с НДМП в возрасте от 3 до 14 лет, из них мальчиков было 63, девочек – 70. Распределение пациентов по возрасту было следующим: от 3 до 7 лет – 39 детей, от 8 до 11 лет– 55, от 12 до 14 лет – 39 детей. У 52% пациентов наряду с НДМП определялся вторичный энурез. Всем детям проводилось комплексное урологическое (включая уродинамическое) и неврологическое обследование, включающее в себя ЭМГ, РЭГ, ЭхоЭГ, ЭЭГ (электроэнцефалограмма). По результатам неврологического обследования пациенты были распределены на группы по уровню поражения нервной системы– церебральный, цервикальный, поясничнокрестцовый, сочетанный и отдельная группа объединила пациентов с невротическими состояниями (табл. 1).
Таблица 1. Распределение пациентов в зависимости от уровня поражения нервной системы
| Уровень поражения | Количество больных | |
|---|---|---|
| абс. | % | |
| Церебральный | 22 | 16,5 |
| Цервикальный | 59 | 44,4 |
| Пояснично-крестцовый | 31 | 23,3 |
| Сочетанный | 18 | 13,5 |
| Невротические состояния | 3 | 2,3 |
| Всего | 133 | 100,0 |
Функциональное состояние мочевого пузыря и уретры по данным уродинамических исследований в зависимости от уровня поражения нервной системы представлено в таблице 2. Всем пациентам, распределенным по перечисленным выше группам, были выполнены ретроградная цистометрия и профилометрия уретры, в зависимости от результатов пациенты были распределены на тех, у кого были выявлены нормо-, гипер- и гипорефлексия, а также нормальный, повышенный и сниженный тонус, соответственно.
Таблица 2. Данные уродинамических исследований у больных с НДМП при различных уровнях поражения нервной системы
| Уровень поражения нервной системы | Данные уродинамических исследований | |||||
|---|---|---|---|---|---|---|
| Ретроградная цистометрия | Профилометрия уретры | |||||
| Нормо- рефлексия | Гиперрефлексия | Гипорефлексия | Нормальный тонус | Повышенный тонус | Сниженный тонус | |
| Церебральный (n=22) | 5 (22.7%) | 17(77,3%) | - | 5 (22,7%) | 17(77.3%) | - |
| Цервикальный (n=59) | 13(22%) | 46 (78%) | - | 33 (56%) | 26 (44%) | - |
| Пояснично- крестцовый (п=31) | 3 (9.7%) | - | 28 (90.3%) | 17(54,8%) | 14(45,2%) | |
| Сочетанный (п=18) | 3(16.7%) | 10(55.5%) | 5(27.8) | 3(16.7%) | 10(55.5) | 5(27,8%) |
| Невротические состояния (п=3) | 1 (33.3%) | 2 (66.7%) | - | 1 (33.3%) | 2(66,7%) | - |
Лечение пациентов проводили с учетом функционального состояния мочевого пузыря и уровня (или очага) поражения нервной системы. Основное (фоновое) неврологическое лечение назначалось при участии невропатолога. При церебральных поражениях больным назначались препараты, улучшающие метаболизм нервной ткани и восстанавливающие в ней обменные процессы: витамины группы В, АТФ, кокарбоксилаза, ноотропил (пирацетам, аминалон, энцефабол, церебролизин), глутаминовая кислота как препарат, улучшающий кислородный обмен, повышающий устойчивость нервной ткани к гипоксии, стимулирующий ее регенерацию. При наличии симптомов гиперактивности в качестве седативных препаратов назначали настойку валерианы или пустырника, глицин или тенотен детский.
Проводились также различные физиотерапевтические процедуры и, прежде всего, электрофорез со спазмолитиками на различные отделы позвоночника и спинного мозга (рис. 1). У больных с клиникой родовой травмы шейного отдела позвоночника и позвоночных артерий электроды накладывались поперечно на верхне-шейный отдел позвоночника: один электрод на рукоятку грудины, другой – на шейнозатылочную область. В качестве спазмолитика использовали 1% раствор эуфиллина или 1% раствор никотиновой кислоты. Сила тока не превышала 5-7 мА, а длительность процедуры – не более 8-10 мин. Курс лечения состоял из 10-12 процедур. При поражении терминальных отделов спинного мозга электрофорез со спазмолитиками проводили с двух полей по продольной методике на область L1-Lv-S1, т. е. у места вхождения в спинно-мозговой канал артерии Депрож-Готтерона (L1v-Lv). При поражении зоны поясничного утолщения электроды накладывали на уровне Dlx-Ll позвонков – зона кровоснабжения артерии Адамкевича, которая на уровне Dxl-Dx11 позвонков входит в спинномозговой канал.
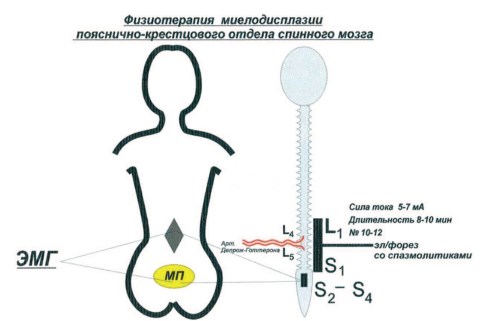
Рис. 1. Схема проведения физиотерапии при миелодисплазии пояснично-крестцового отдела спинного мозга
После курса электрофореза со спазмолитиками на те же области назначали индуктотермию или парафин-озокеритовые аппликации – метод глубокого теплового воздействия на нервную ткань спинного мозга. Таким образом, после улучшения гемодинамики в пораженных сегментах спинного мозга методом электрофореза со спазмолитиками, глубокого прогревания индуктотермией или парафином заметно улучшались обменные процессы в нервной ткани. Одновременный прием ноотропных препаратов на фоне проводимой физиотерапии, на наш взгляд, постепенно приводит к регенерации пораженных участков спинного мозга (или их «созреванию» при миелодисплазии) и восстановлению функций иннервируемых ими органов.
При наличии спастических явлений в нижних конечностях, гипертонусе мышц тазовой диафрагмы назначали расслабляющий массаж мышц промежности и нижних конечностей, а при вялых парезах этих мышц – тонизирующий массаж. При истинном сфинктерном недержании мочи (и кала) назначали лечебную гимнастику на укрепление мышц промежности по Кегелю. При проявлениях микционной недостаточности (нарушение накопления и выведения мочи) – упражнения на укрепление мышц передней брюшной стенки с целью повышения абдоминального давления. Дифференцированно назначали препараты, нормализующие деятельность вегетативной нервной системы – при парасимпатикотонии назначали холинолитические препараты, а при дистонии вегетативной нервной системы – вегетотропные препараты. В лечении больных с незаторможенным мочевым пузырем (при парасимпатикотонии) использовали спазмекс по 2,5 мг 2 раза в сутки с 6-летнего возраста, продолжительность терапии составила 1 месяц.
Одновременно с фоновым (неврологическим) лечением проводили лечение, направленное на стабилизацию функции мочевого пузыря, профилактику и ликвидацию различных осложнений, возникших в результате как неврологических, так и урологических нарушений. При этом использовали консервативные и хирургические методы лечения. Характер симптоматической терапии зависел прежде всего от функционального состояния мочевого пузыря. Больным с гиперрефлексией детрузора назначали тепловые процедуры (парафин-озокеритовые аппликации) на надлобковую область, КВЧ-терапию или лазеротерапию на биологически активные точки (меридиан мочевого пузыря – V 2, V 14, V 19) и проекцию мочевого пузыря. Низкоинтенсивное лазерное облучение (гелий-неоновый лазер) дает хороший лечебный эффект и при непосредственном воздействии на мочевой пузырь (внутрипузырное лазерное облучение). Применялся гелий-неоновый лазер с диаметром светового пятна 6-7 мс, плотностью мощности 1 МВт/см2, экспозиция составила 3,4,5,7,10,5,4,3 мин (возрастание и убывание), длительность курса лечения 10 дней. При таком воздействии лазера на мочевой пузырь восстанавливался регионарный кровоток, устранялась гипоксия детрузора, которая играет значительную роль в формировании гиперрефлексии мочевого пузыря [3].
Из фармакологических препаратов при гиперрефлексии мочевого пузыря пациентам назначали пикамилон (0,075-1,3 мг/кг) 3 раза в день в течение 30 дней, спазмекс по 2,5 мг 2 раза в день в течение 4 недель. Преимущество последнего препарата (в сравнении с дриптаном, детрузитолом и др.) в том, что он не проникает через гематоэнцефалический барьер и может назначаться уже с 6-летнего возраста (очень важно у детей с перинатальными поражениями головного мозга), что отражено в инструкции к препарату. Кроме того, спазмекс оказался весьма эффективным и при синдроме вторичного энуреза на фоне гиперрефлексии детрузора. Также пациентам ректально назначались свечи с красавкой (беладонной) курсом до 10 дней.
Больным с гипорефлексией детрузора и скрытой миелодисплазией пояснично- крестцового отдела спинного мозга проводилась электростимуляция мочевого пузыря. Для восстановления нормального мочеиспускания применяли высокую трансректалъную электростимуляцию мочевою пузыря. При этом активный электрод вводили на глубину 5-8 см в зависимости от возраста пациента, частота тока составляла 120 Гц, длительность импульса – 3 мс, продолжительность сеанса электролечения – 18-20 мин. Курс электролечения составил 10-12 дней. Из фармакологических препаратов этой группе больных назначали витамин В12 внутримышечно в сочетании с фолиевой кислотой per os в течение 10 дней, прозерин в инъекциях или порошках в возрастной дозировке до 20-30 дней.
Больным с детрузорно-сфинктерной диссинергией и гипертонусом мышц урогенитальной диафрагмы назначали миорелаксанты: сирдалуд или мидокалм per os. Данные препараты подавляют полисинаптические спинно-мозговые рефлексы и понижают повышенный тонус поперечно-полосатых мышц промежности. Расслабление поперечнополосатой мускулатуры тазового дна позволяло снизить повышенное уретральное сопротивление. Эффективность лечения контролировали с помощью ультразвукового исследования (УЗИ) мочевого пузыря до и после мочеиспускания, а также урофлоуметрии (УФМ) (фармакопроба с миорелаксантами) (рис 2, 3).
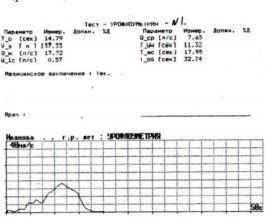
Рис. 2. Урофлоуметрия исходная у пациентов с детрузорно-сфинктерной диссинергией и гипертонусом мышц урогенитальной диафрагмы
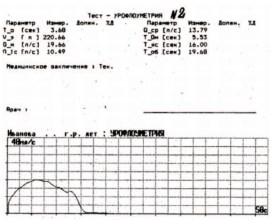
Рис. 3. Урофлоуметрия на фоне курсового приема мидокалма (через 30 мин после внутримышечного введения разовой дозы препарата: уменьшилось время задержки акта мочеиспускания и увеличилась максимальная и средняя скорость потока мочи)
При гипо- и арефлекторном мочевом пузыре у детей с грубой миелодисплазией терминальных сегментов спинного мозга применяли различные методы лечения, в том числе и только паллиативные, к которым относились принудительный ритм мочеиспускания и периодическая катетеризация мочевого пузыря. Принудительный ритм мочеиспускания с вовлечением мышц брюшного пресса (брюшной тип мочеиспускания) назначали во всех случаях при компенсированной микционной недостаточности.
Эффективность паллиативного лечения контролировали с помощью УЗИ мочевого пузыря до и после мочеиспускания. Если после натуживания и микции (иногда в 2- 3 приема) остаточная моча не определялась или определялась в небольшом количестве (до 10-15% от исходного объема), то этот метод лечения считался приемлемым для данного пациента. Большую помощь в лечении подобных пациентов оказывали детские психологи, которые во время сеансов психотерапии давали пациентам «установку» на принудительный ритм мочеиспускания. В случаях неэффективности при больших объемах остаточной мочи (до 20-25% и более) проводили периодическую катетеризацию мочевого пузыря – у 6 (19,4%) детей из 31 с перинатальной патологией пояснично-крестцового отдела спинного мозга. Режим катетеризации назначали индивидуально (от 5 до 6 раз в течение дня). Таким образом, устранение Ее хронической задержки мочи, а следовательно, и ишемии детрузора позволяло предупредить развитие различных осложнений (пузырномочеточниковый рефлюкс, уретерогидронефроз, хронический пиелонефрит), которые в итоге приводят к развитию хронической почечной недостаточности (ХПН).
Показанием к хирургическому лечению НДМП, на наш взгляд, являются: резистентность к консервативной терапии и угроза быстрого развития ХПН. Предпочтение отдавалось малоинвазивным хирургическим вмешательствам. При гиперрефлекторной форме НДМП (10 детей) применяли методику гидродилатации мочевого пузыря «наутомляемость» (5-6 дилатаций на курс лечения), что приводило к увеличению объемов мочевого пузыря, первого и второго позывов при цистометрии на 30-35%. После введения в практику лечения НДМП фармакологических препаратов, снижающих тонус детрузор (дриптан, спазмекс), необходимость в подобных хирургических манипуляциях отпала. У больных с гипорефлекторной формой НДМП оперативные методы лечения применялись значительно чаще. При этом учитывались преобладающие клинические синдромы заболевания (хроническая задержка мочи, недержание мочи, сочетание этих симптомов), стадии микционной недостаточности и угроза развития ХПН. При выраженных нарушениях уродинамики верхних и нижних мочевых путей, чаще всего у детей оперированных по поводу спинномозговой грыжи, угрозе или уже развившейся ХПН больным накладывали цистокутанеостому (8 детей). В процессе длительной консервативной терапии периодически проводили контрольное обследование мочевыводящей системы (УЗИ 1 раз в 3 месяца, цистометрия 1 раз в 6 месяцев) в целях определения динамики заболевания. После восстановления рефлекторной деятельности мочевого пузыря (3 ребенка за время наблюдения в течение 3 лет) проводили иссечение и «закрытие» цистокутанестомы с последующим принудительным ритмом акта мочеиспускания. Одному больному с истинным (сфинктерным) недержанием мочи проведена операция пластики шейки мочевого пузыря по В.М. Державину с хорошими функциональными результатами.
Таблица 3. Оперативные методы лечения и инвазивные вмешательства у детей с НДМП
| Уровень поражения ЦНС | Вид оперативного вмешательства | Катетеризация мочевого пузыря | Итого | |
|---|---|---|---|---|
| Цисто-кутанеостомия | Дилатация уретры | |||
| Церебральный (n=22) | (4,5%) | 2 (9,1%) | – | 3(13,6%) |
| Цервикальный (n=59) | 3 (5,1%) | – | – | 3 (5,1%) |
| Пояснично- крестцовый (n=31) | 8 (25,8%) | 4(12,9%) | 6 (19,4%) | 18(58,1%) |
| Сочетанный (n=18) | – | 1 (5,6%) | – | 1(5,6%) |
| Невротические состояния (n=3) | – | (33,3%) | – | 1 (33,3%) |
| Всего (n =133) | 12 (9,0%) | 8 (6,0%) | 6 (4,5%) | 26 (19,5%) |
При детрузорно-сфинктерной диссинергии и гипертонусе урогенитальной диафрагмы наряду с консервативной терапией у 7 больных проводили поднаркозную дилатацию мембранозной части уретры механическим уретродилататором (рис. 4).

Рис. 4. Механический уретродилататор
При сопутствующих запорах выполняли пальцевую дилатацию анального сфинктера по Рекамье. У всех 7 больных после дилатации уретры на фоне проводимой консервативной терапии исчез повышенный тонус мышц тазового дна, о чем свидетельствовало снижение уретрального давления до нормальных цифр по данным профилометрии уретры и УФМ.
Видыоперативных вмешательств и манипуляций у больных с НДМП при различных уровнях поражения ЦНС представлены в таблице 3.
Таким образом, описанные выше комбинированные методы лечения различных клинических форм НДМП у детей позволили существенно улучшить результаты лечения (табл. 4).
Таблица 4. Результаты лечения 133 больных с НДМП через 1 год
| Уровень поражения ЦНС | Результат лечения | ||
|---|---|---|---|
| Без динамики | Улучшение | Излечение | |
| Церебральный (п=22) | - | 19(86,41%) | 3 (13,6%) |
| Цервикальный (п=59) | - | 45 (76,3%) | 14 (23,7% |
| Пояснично-крестцовый (п=31) | - | 30 (96,8%) | 1 (3,2%) |
| Сочетанный (п= 18) | - | 15 (83,3%) | 3 (16,7%) |
| Невротические состояния (п=3) | - | 2 (66,7%) | 1 (33,3%) |
| Всего (п =133) | - | 111 (83,5%) | 22 (16,5%) |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты лечения всех больных оценивались при катамнестическом обследовании не ранее одного года после завершения этапного лечения. При этом учитывались жалобы больного, клиническая симптоматика, данные лабораторных исследований, УФМ, УЗИ почек и мочевого пузыря до и после мочеиспускания. Инвазивные методы контрольной диагностики (микционная цистоуретрография, цистоуретроскопия с калибровкой уретры) назначали строго по показаниям. Результаты лечения, полученные через 1 год в каждой из 5 клинических групп больных, отражены в таблице 4.
Последующее этапное лечение, проводимое курсами через 3 мес., позволило значительно улучшить вышеизложенные показатели. Результаты лечения через 3 года реабилитации больных отражены в таблице 5
Таблица 5. Результаты лечения 133 больных с НДМП после завершения этапного лечения через 3 года
| Уровень поражения ЦНС | Результат лечения | ||
|---|---|---|---|
| Без динамики | Улучшение | Излечение | |
| Церебральный (п=22) | - | 14 (63.6%) | 8 (36.4%) |
| Цервикальный (п=59) | - | 29 (49.2%) | 30(50.8%) |
| Пояснично-крестцовый (п=31) | - | 25 (80.6%) | 6(19.4%) |
| Сочетанный (п= 18) | - | 12(66.7%) | 6 (33.3%) |
| Невротические состояния (п=3) | - | 1 (33.3%) | 2 (66.7%) |
| Всего (п =133) | - | 81 (60,9%) | 52(39.1%) |
Наилучшие результаты лечения получены в группе больных с «высоким» уровнем поражения ЦНС и, прежде всего, у больных с последствиями родовой травмы шейного отдела позвоночника. Менее оптимистическими оказались результаты лечения больных энурезом и миелодисплазией пояснично-крестцового отдела спинного мозга.
ЗАКЛЮЧЕНИЕ
- Лечение НДМП у детей и подростков должно проводиться индивидуально у каждого больного с учетом уровня и характера поражения нервной системы, а также функционального состояния мочевого пузыря и мышц урогенитальной диафрагмы.
- При лечении НДМП у детей и подростков основной или базисной должна быть терапия первичного очага поражения нервной системы
- При антенатальных, диспластических поражениях нервной системы прогноз заболевания в плане полного выздоровления при проведении консервативной терапии, чаще всего, сомнительный, в связи с чем у этой группы пациентов целесообразно применять и оперативные (предпочтительнее малоинвазивные) методы лечения при наличии медицинских показаний к ним. Основой успешной реабилитации детей с НДМП должен быть принцип этапного лечения и преемственности этих больных при «передаче» их во взрослую сеть с постоянной и длительной диспансеризацией с участием врачей-специалистов смежных специальностей (уролога, нефролога, невропатолога).
ЛИТЕРАТУРА
- Билялов М.Г. Роль вегетативной нервной системы в генезе нейрогенной дисфункции мочевого пузыря по типу незаторможенности у детей и ее коррекция: автореф. дис. канд. мед. наук/ М.Г. Билялов. Казань, 1998; 20.
- БондаренкоС.Г.,Абрамов Г.Г.Этаноловая блокада при резистентнойформе нестабильногомочевого пузыря у детей . Детская хирургия. 2004 (1):31-33.
- Вишневский Е.Л. Важнейшие итоги и перспективыисследований в урологии детского возраста. Е.Л. Вишневский, В.Г. Гельд // Российский вестник перинатологии и педиатрии. 2002(6); 44-48.
- Вишневский Е.Л. Диагностика и лечение нейрогенных дисфункций мочевого пузыря у детей. Педиатрия. 1997; 3: 42-44.
- Вишневский Е.Л. Клиническая оценка расстройств мочеиспускания. Е.Л. Вишневский, О.Б. Лоран, А.Е. Вишневский. М., 2001:95.
- Державин В.М., Вишневский Е.Л., Гусарова Т.Н.Диагностика и лечение нейрогенногомочевого пузыря у детей: Методическое пособие. Москва. 1993.
- Игнатьев Р.О. Эффективность малоинвазивных хирургических методов лечения расстройств эвакуаторнойфункции толстой кишки у детей смиелодисплазией: автореф. дис…канд.мед. наук. Р.О. Игнатьев. М., 2003:20.
- Кириллов В.И. Нейрогенные дисфункции мочевого пузыря у детей. Кириллов В.И., Киреева Н.Г // РМЖ.1998(9):7.
- Кольбе О.Б., Сазонов О.Н., Моисеев А.Б. и др. Сочетанные нарушения функции мочевого пузыря и толстой кишки у детей. Педиатрия. 2003; 6: 91-94.
- Морозов В.И., Ахунзянов А.А., Билялов М.Г., Байбиков Р.С. Неврологические аспекты диагностики нейрогенной дисфункции мочевого пузыря у детей. Детская хирургия, 2000(2):18-22.
- Морозов В.И., Рашитов Л.Ф. Энурез и нейрогенные дисфункции мочевого пузыря у детей: Метод. пособие. Казань. 2011: 59 c.
- Морозов В.И., Рашитов Л.Ф., Морозов Д.В. Нейрогенные дисфункции висцеральных органов у детей (хирургические и педиатрические аспекты). Казань. 2008: 152 c.
- Мохорт В.А., Гресь А.А. Лечение сочетанных неврогенных дисфункция мочевого пузыря и прямой кишки. Хирургия. 1985; 9: 57-61.
- Нестеренко О.В. Дифференцированный алгоритм лечения детей с первичным ночным энурезом. Нестеренко О.В., Горемыкин В.И., Елизарова С.Ю., Сидорович О.В. Современные проблемы науки и образования. 2013(2).
- Нестеренко О.В., Горемыкин В.И., Мещерякова Е,Е,, Елизарова С.Ю., Сидорович О.В. Нарушения уродинамики у детей с вторичным хроническим пиелонефритом. Научное обозрение. Медицинские науки. 2014(2):82-82.
- РудаковаЭ.А. Дисфункциимочевого пузыря у детей раннего возраста: автореф. дис. докт.мед. наук / Э.А. Рудакова. М., 1995:28.
- Салов П.П. Нейрогенные дисфункции тазовых органов. П.П. Салов. Новокузнецк, 2002:592.
- Albright L., Pollcck E.,Adelson P.D. Principles and Practice of Pediatric Neurosurgery. NewYork. 1999: 291-320.
- Function of Hollow Viscera in Children with Constipation and Voiding Difficulties. C. Lucanto, S.B. Bauer, P.E. Hyman, A.F. Flores. Dig Dis Sci 2000;45,(7):1274-1280.
- Sturm M., Cheng Y. The Management of the Pediatric Neurogenic Bladder. 2016. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4992015/
- Vega, P.J.M. High-pressure bladder: an underlying factor mediating renal damage in the absence of reflux? / P.J.M. Vega, L.A. Pascual. BJU Jnt. 2001;(86);6:581-584.







