Острое повреждение почек является важной клинической проблемой, затрагивающей 5- 7% всех госпитализированных пациентов с высоким уровнем смертности и связанными с этим расходами на здравоохранение [1-4]. Ишемия с последующей реперфузией (ИР) является основной причиной острого почечного повреждения [3,5]. ИР почек инициирует изменения в почечном кровотоке, сосудистых эндотелиальных клетках, эпителиальных клетках почечных канальцев и лейкоцитах с гибелью клеток и истощением запасов АТФ, которые приводят к нарушению функции почек. Одним из ранних событий в ИР почек является повреждение эндотелия, что приводит к нарушению функционального состояния сосудов [6].
Таким образом, поиск инновационных молекул, влияющих на функциональное состояние эндотелия является одной из терапевтических стратегий нефропротекции для предупреждения развития острого почечного повреждения.
Целью нашего исследования явилось изучение возможности профилактики ишемически-реперфузионных повреждений почек селективным ингибитором аргиназы II – KUD975.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводили на крысах-самцах линии Wistar массой 180-220 г в соответствии с требованиями ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики», с соблюдением «European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS No. 123». Все крысы были разделены на следующие экспериментальные группы, по 10 животных в каждой:
- I – ложнооперированные (л/о) (24 часа);
- II – ложнооперированные (72 часа); III – контрольная, моделирование 40-минутной ишемии-реперфузии почек (24 часа реперфузии);
- IV – контрольная, моделирование 40-минутной ИР почек (72 часа реперфузии);
- V – профилактическое однократное внутрижелудочное введение селективного ингибитора аргиназы II – KUD975 в дозе 1 мг/кг за 120 минут до моделирования патологии (24 часа реперфузии);
- VI – профилактическое однократное внутрижелудочное введение селективного ингибитора аргиназы II – KUD975 в дозе 1 мг/кг за 120 минут до моделирования патологии (72 часа реперфузии);
- VII – профилактическое однократное внутрижелудочное введение селективного ингибитора аргиназы II – KUD975 в дозе 3 мг/кг за 120 минут до моделирования патологии (24 часа реперфузии);
- VIII – профилактическое однократное внутрижелудочное введение селективного ингибитора аргиназы II – KUD975 в дозе 3 мг/кг за 120 минут до моделирования патологии (72 часа реперфузии);
- IX – профилактическое однократное внутрибрюшинное введение L- норвалина в дозе 100 мг/кг однократно за 30 минут до моделирования патологии (24 часа реперфузии);
- X – профилактическое однократное внутрибрюшинное введение L- норвалина в дозе 100 мг/кг однократно за 30 минут до моделирования патологии (72 часа реперфузии);
Моделирование ишемии-реперфузии почек
д наркозом(хлоралгидрат, 300 мг/кг) выполнялась срединная лапаротомия. Петли кишечника отодвигали в сторону и с разницей в 5 минут производили наложение атравматичных сосудистых зажимов на почечные ножки на 40 минут. Ложнооперированные животные не подвергались двусторонней ишемии почек, им в брюшную полость вводился 0,9% раствор натрия хлорида (4-5 мл) и рана послойно ушивалась.
Измерение уровня микроциркуляции
Уровень микроциркуляции измеряли через 5 минут, 24 или 72 часа реперфузии в зависимости от экспериментальной группы, выражая значения в перфузионных единицах (ПЕ) и осуществляли с помощью аппаратно-программного комплекса MP100 (Biopac System, Inc., США) с модулем лазерной допплеровской флоуметрии (ЛДФ) LDF100C и поверхностного датчика TSD143. Регистрация и обработка результатов производилась с помощью программного обеспечения AcqKnowledge версии 3.8.1.
Измерение концентрации креатинина, мочевины, натрия
В группах I, III, V, VII и IX сбор мочи осуществляли в метаболических клетках во временном промежутке 12 - 24 часа после окончания ишемии. В группах II, IV, VI, VIII и X сбор мочи осуществляли в метаболических клетках во временном промежутке 48- 72 часа после окончания ишемии. Далее под наркозом производили релапаротомию и отбирали кровь из правого желудочка для биохимических исследований. Измерялся суточный диурез.
Концентрацию уровня креатинина, мочевины и натрия в сыворотке крови и моче измеряли по общепринятой методике.
Расчет скорости клубочковой фильтрации ифракционной экскреции натрия
Клиренс эндогенного креатинина (скорость клубочковой фильтрации (СКФ) рассчитывался следующим образом:

Фракционная экскреция натрия (ФЭН) рассчитывалась по следующей формуле:

Статистическая обработка данных
Для всех данных была применена описательная статистика: данные проверены на нормальность распределения. В случае нормального распределения были подсчитаны среднее значение (M) и стандартная ошибка среднего (m). Межгрупповые различия анализировались параметрическими (t-критерий Стьюдента) или непараметрическими (критерий Манна Уитни) методами, в зависимости от типа распределения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Моделирование ишемии-реперфузии почек приводило к росту креатинина и мочевины (рис. 1,2). Параллельно росту креатинина падала скорость клубочковой фильтрации, уровень которой к третьим суткам составлял лишь 0,06±0,01 мл/мин (рис. 3). Канальцевые повреждения также нарастали от первых к третьим суткам эксперимента, что выражалось в значительном росте фракционной экскреции натрия (рис. 4). Микроциркуляторные нарушения также отмечались во всех временных точках эксперимента (табл. 1).
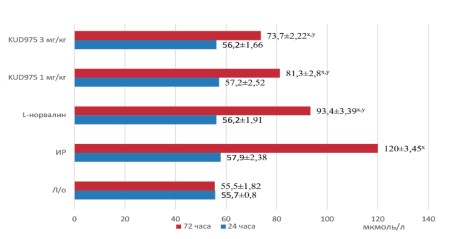
Рис. 1. Динамика сывороточной концентрации креатинина в экспериментальных группах Примечание: x – р<0,05 в сравнении с группой ложнооперированных животных; y – р<0,05 в сравнении с группой ишемии- реперфузии
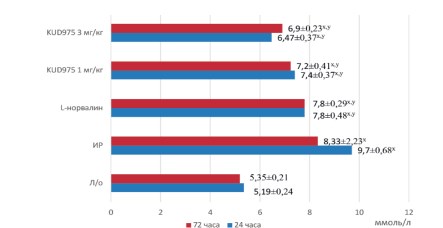
Рис. 2. Динамика сывороточной концентрации мочевины в экспериментальных группах Примечание: x – р<0,05 в сравнении с группой ложнооперированных животных; y – р<0,05 в сравнении с группой ишемии-реперфузии
Таблица 1. Динамика уровня микроциркуляции при введении изучаемых веществ (М±m; n=10)
| Экспериментальная группа | 5 минут | 24 часа | 72 часа |
|---|---|---|---|
| Ложнооперированные | 904,5±60,4 | 870,5±98 | 859±68,0 |
| Ишемия-реперфузия | 209±24,4 x | 418,1±46,0x | 315,5±13,8x |
| Ишемия-реперфузия + L-норвалин | 437,9±29,1x,y | 657,9±18,8x,y | 441,4±11,6x,y |
| Ишемия-реперфузия + KUD975 1 мг/кг | 431,1±32,9 x,y | 691,8±23,5x,y | 485±16,4x,y |
| Ишемия-реперфузия + KUD975 3 мг/кг | 604,7±43,5 x,y | 718,2±44,5x,y | 653,6±62,0x,y |
Примечание: x – р<0,05 в сравнении с группой ложнооперированных животных; y – р<0,05 в сравнении с группой ишемии- реперфузии
Профилактическое введение селективного ингибитора аргиназы II на фоне моделирования ишемии-реперфузии почек приводило к значимому росту СКФ до 0,24±0,02 мл/мин и 0,31±0,02 мл/мин через 24 часа реперфузии в дозах 1 мг/кг и 3 мг/кг, соответственно. Неселективный ингибитор аргиназ L-норвалин оказывал менее выраженное влияние на СКФ, восстанавливая данный показатель до 0,21±0,02 мл/мин (рис. 3).
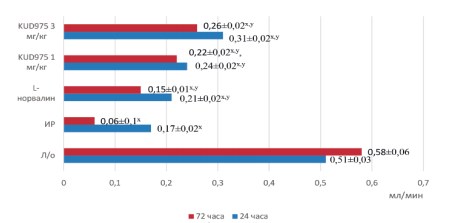
Рис. 3. Динамика скорости клубочковой фильтрации в экспериментальных группах
Примечание: x – р<0,05 в сравнении с группой ложнооперированных животных; y – р<0,05 в сравнении с группой ишемии-реперфузии
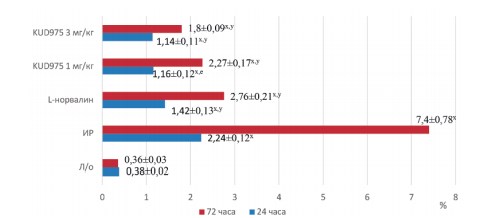
Рис. 4. Динамика фракционной экскреции натрия в экспериментальных группах
Примечание: x – р<0,05 в сравнении с группой ложнооперированных животных; y – р<0,05 в сравнении с группой ишемии-реперфузии
На 3-и сутки эксперимента также отмечалось дозозависимое улучшение фильтрационной способности почек, выражающееся в снижении концентрации сывороточного креатинина до 81,3±2,8 мкмоль/л и 73,7±2,22 мкмоль/л и восстановлении СКФ до 0,22±0,02 мл/мин и 0,26±0,0 мл/мин на фоне применения KUD975 в дозах 1 мг/кг и 3 мг/кг соответственно (рис. 1, 3).
Сывороточные значения концентрации мочевины подчинялись тем же закономерностям, что и сывороточная концентрация креатинина: снижались под действием KUD975 как на первые, так и третьи сутки эксперимента. Неселективный ингибитор аргиназы II оказывал менее выраженный эффект, причем фармакологическая коррекция L-норвалином на 3 сутки эксперимента не позволила достигнуть значений, достоверно отличающихся от группы ишемии-реперфузии (рис. 2).
На фоне применения KUD975 в дозах 1 мг/кг и 3 мг/кг отмечалось улучшение функционального состояния почечных канальцев, регистрируемое по снижению ФЭН которая была выражена в большей степени на 3-и сутки эксперимента и составляла 2,27±0,17% и 1,8±0,09% соответственно (рис. 4).
Однократное профилактическое применение селективного ингибитора аргиназы II KUD975 в дозах 1 мг/кг и 3 мг/кг за 120 минут до начала ишемии приводило к восстановлению уровня микроциркуляции во всех временных точках эксперимента, превосходя статистически достоверно показатели группы с применением неселективного ингибитора аргиназы II L-норвалина (p<0,05).
ЗАКЛЮЧЕНИЕ
Аргиназы являются перспективными мишенями для коррекции дисфункции эндотелия при сердечно-сосудистых заболеваниях [7- 11]. В недавнем исследовании было продемонстрировано, что как активность аргиназы в почках, так и экспрессия аргиназы II увеличиваются после ишемии-реперфузии почек [6]. Фармакологическая блокада или генетический дефицит аргиназы II опосредует защиту тканей почек после ишемии-реперфузии, что отражается в виде снижения в плазме крови креатинина и мочевины, сохранении морфологической структуры почек, уменьшении апоптоза, инфильтрации воспалительными клетками и снижении уровня провоспалительных цитокинов. Таким образом, блокирование аргиназы возможно использовать в качестве терапевтического метода профилактики ОПП.
В настоящем исследовании мы продемонстрировали, что профилактическое применение селективного ингибитора аргиназы II улучшает функциональное состояние почек, превосходя по эффективности L-норвалин, что подтверждает гипотезу о блокировании аргиназы II в качестве терапевтического метода профилактики острого почечного повреждения. Результаты проведенного исследования показали, что профилактическое применение KUD975 дозозависимо приводит к снижению сывороточной концентрации маркеров почечного повреждения, росту скорости клубочковой фильтрации, снижению фракционной экскреции натрия и уменьшению микроциркуляторных нарушений во все временные точки эксперимента.
Таким образом, показано, что профилактика ишемически-реперфузионных повреждений почек селективным ингибитором аргиназы II – KUD975 является перспективной стратегией предупреждения острого почечного повреждения.
ЛИТЕРАТУРА
- Bellomo R, Kellum JA, Ronco C. Acute kidney injury. Lancet 2012;380:756-766. doi:10.1016/S0140-6736(11)61454-2.
- Liangos O, Wald R, O'Bell JW, Price L, Pereira BJ, Jaber BL. Epidemiology and outcomes of acute renal failure in hospitalized patients: a national survey. Clin J Am Soc Nephrol 2006;1(1):43-51. doi:10.2215/CJN.00220605.
- Bonventre JV, Weinberg JM. Recent advancesin the pathophysiology of ischemic acute renal failure. J Am Soc Nephrol 2003;14(8):2199-2210.
- Shramenko KK, Gorodnik GA, Shano VP, Kuznetsova IV, Grigorenko AP, Potapov VV. Pharmacological correction of intercept hemodynamics in acute kidney damage (part 1). Research result: pharmacology and clinical pharmacology 2017;3(3): 110-120. doi: 10.18413/2313-8971-2017-3-3-110-120.
- Rabb H. Doesstatin pretreatmentreduce the risk of contrast-induced nephropathy? Nat Clin Pract Nephrol. 2006; 2(3):124-125.
- Raup-Konsavage WM, Gao T, Cooper TK, Morris SM Jr, Reeves WB, Awad AS. Arginase-2 mediatesrenal ischemia-reperfusion injury. Am J Physiol 2017; 313(2): F522-F534. doi:10.1152/ajprenal.00620.2016.
- Kudryavtsev KV, Korokin MV, Gudyrev OS. Pharmacological efficacy of an inhibitor of arginase-2 KUD975 with L-NAME-induced endothelial dysfunction. Research result: pharmacology and clinical pharmacology 2017; 3(1): 10-17. doi: 10.18413/2500-235X-2017-3-1-10-17.
- Zhang C, Hein TW, Wang W, Chang CI, Kuo L.Constitutive expression of arginase in microvascular endothelial cells counteracts nitric oxide-mediated vasodilatory function. FASEB J 2001;15(7):1264-1266.
- Berkowitz DE, White R, Li D, Minhas KM, Cernetich A, Kim S, Burke S, et al. Arginase reciprocally regulates nitric oxide synthase activity and contributes to endothelial dysfunction in aging blood vessels. Circulation 2003;108(16): 2000-2006.
- Koklin IS. Use of selective inhibitors of arginase 2 and tadalafil in combined compensation of homocysteine-induced endothelial dysfunction. Research result: pharmacology and clinical pharmacology 2015;1(1):13-19. doi: 10.18413/2500-235X-2015-1-4-15-20
- Yakushev VI, Pokrovskii MV.Cardiovascular effects of an arginase IIselective inhibitor. Research result: pharmacology and clinical pharmacology 2016;2(3):28-46. doi: 10.18413/2500-235X -2016-2-3-28-45







