Инфекции мочевыводящих путей были впервые задокументирована в Египте в 1550 г. до н.э. и до сих пор рецидивирующая инфекция мочевыводящих путей (рИМП) у взрослых женщин является одной из наиболее распространенных бактериальных инфекций на планете [1]. Бактерии из влагалища или фекалий заселяют периуретральную область, затем мочевой пузырь, вызывая симптомы цистита. Риск инфицирования мочевыводящих путей (ИМП) в течение жизни у взрослых женщин составляет около 40%, а заболеваемость достигает пика на третьем и девятом десятилетиях. Ежегодная заболеваемость однократным эпизодом ИМП составляет 3%, причем до 44% из этих женщин переносят рецидив в течение 1 года [2,3].
Хотя рецидивирующие ИМП, как правило, не угрожают жизни, высокая заболеваемость значительно увеличивает расходы на медицинское обслуживание и оказывает негативное влияние на качество жизни пациентов [4].
Диагностика и лечение ИМП в мире обходятся в несколько миллиардов долларов в год, из них только в Соединенных Штатах - около 2 миллиардов долларов в год [5].
МАТЕРИАЛЫ И МЕТОДЫ
Текущая обзорная статья была нацелена на описание перспективных терапевтических стратегий для лечения и профилактики ИМП. С этой целью были исследованы различные базы данных, в том числе Google Scholar, база данных Cochrane, PubMed и т. д. Поиск проводился по ключевым словам «профилактика», «рецидивирующие инфекции мочевых путей», «D-манноза», «проантоцианидины», «арбутин». Было проанализировано более 50 наиболее интересных и значимых статей.
РЕЗУЛЬТАТЫ
Этиология и патогенез
Основным возбудителем неосложненных инфекций мочевыводящих путей (НИМП) является уропатогенная E. coli, выявляемая у 65-90% пациентов. Реже возбудителями ИМП могут быть S. saprophyticus, P. mirabilis, Enterococcus spp., Klebsiella spp. и другие представители семейства Enterobacteriaceae.
Важным фактором вирулентности уропатогенных штаммов E. coli и других представителей семейства Enterobacteriaceae является способность к адгезии уроэпителию с помощью особых биомолекул – адгезинов – фимбрий типа S, L, пили 1 типа, О- и К, антигены полисахаридной капсулы микроба, а также РАР-пили (pyelonephritis-associated P pili) и адгезина FimH (рис. 1). Проникновение уропатогенов в мочевыводящие пути происходит восходящим, реже – нисходящим (гематогенным) путем. Спектр возбудителей гематогенных ИМП ограничен и представлен обычно относительно редкими микроорганизмами, такими как S. aureus, Candida, Mycobacterium tuberculosis.
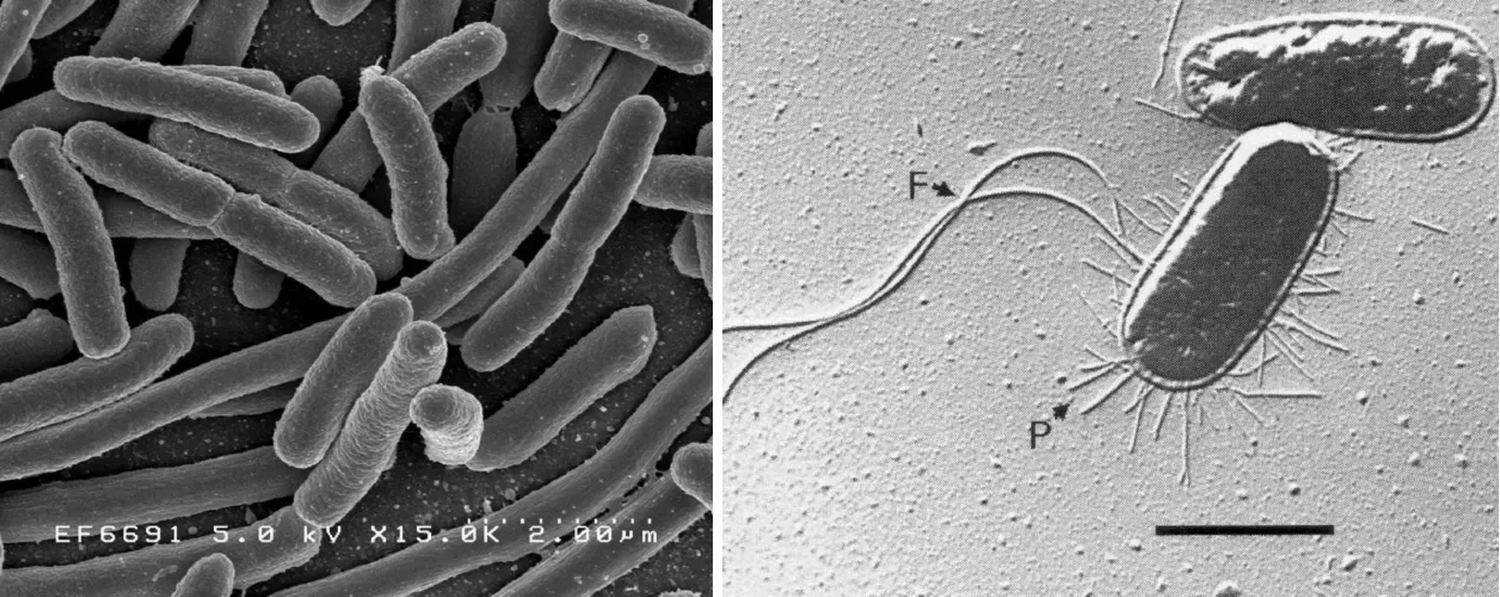
Рис. 1. E.coli: слева – сканирующая электронная микроскопия; справа – трансмисионная электронная мироскопия, видны нитевидные фимбрии (F – пили, P – жгутики)
Fig. 1. E.coli: on the left - scanning electron microscopy; on the right - transmission electron microscopy, filamentous fimbriae visible. (F - pili, P - flagella)
Факторы риска рецидифирующей ИМП
Факторы риска рецидивирующей ИМП различаются у женщин в репродуктивном возрасте и в постменопаузе. У женщин репродуктивного возраста преобладают поведенческие факторы риска, такие как частота половых актов, смена полового партнера, использование спермицидов и диафрагмы в качестве методов контрацепции [6– 9]. Было обнаружено, что все эти факторы риска усиливают вагинальную и уретральную колонизацию кишечной палочкой [9]. В одном из хорошо обоснованных исследований типа «случай-контроль» женщин в возрасте 18–30 лет с рецидивирующими ИМП сравнивали с женщинами, у которых не было ИМП в анамнезе [10].
Первые в десять раз чаще имели сексуальные контакты более девяти раз в месяц в предыдущем году, почти в два раза чаще использовали спермициды в предыдущем году и сообщали о большем количестве сексуальных партнеров. Не поведенческие факторы риска, такие как материнская история ИМП, предыдущий случай ИМП в возрасте младше 15 лет и более короткое расстояние между уретрой и анусом, позволяют предположить, что генетика и анатомия таза также играют важную роль [8,11]. Кроме того, недавнее ретроспективное исследование показало, что у женщин в пременопаузе с рецидивирующими ИМП также значительно ниже уровень 25-гидроксивитамина D, что свидетельствует о его дефиците [12].
Для женщин в постменопаузе факторы риска заметно различаются и включают дефицит эстрогена, цистоцеле, урогенитальные операции в анамнезе, большой объем остаточной мочи и предшествующую ИМП [9]. Эти женщины также имеют относительное истощение уровня лактобацилл во влагалище и увеличение доли кишечной палочки по сравнению с женщинами в репродуктивном возрасте. Это возрастное изменение нормальной микрофлоры влагалища, особенно потеря лактобацилл, продуцирующих перекись водорода, может предрасполагать женщин к колонизации кишечной палочкой во время полового акт, а также к ИМП [13,14].
Профилактика ИМП
Антибактериальная профилактика
Профилактическое лечение рИПМ длительными курсами антимикробной терапии с низкими дозами является стандартной практикой, и крупнейший мета-анализ, проведенный Кокрановским сотрудничеством, показывает, что это снижает частоту рецидивов до 80% [15]. Это исследование, посвященное изучению эффективности профилактического применения антибиотиков, выявил снижение симптоматической ИМП на 85% по сравнению с плацебо (ОР 0,15, 95% ДИ от 0,08 до 0,28). Данный мета-анализ включал 19 исследований с информацией об исходах у 1120 женщин. Авторы пришли к выводу, что непрерывная антибиотикопрофилактика в течение 6–12 месяцев снижает частоту ИМП во время профилактики по сравнению с плацебо. Однако в группе, получавшей антибиотики, было выявлено больше побочных эффектов, включая вагинальный и оральный кандидоз и желудочно-кишечные симптомы. Только два исследования показали, что при последующем наблюдении частота симптоматических ИМП после применения антибиотиков для лечения была такого же уровня, как у женщин, получавших плацебо. Это, однако, предполагает, что преимущества антибиотиков не сохраняются после прекращения лечения.
Вместе с тем, широкое и неадекватное применение антибиотиков являются основной движущей силой в развитии устойчивости к антибиотикам и могут привести к устойчивости не только микроорганизмов-возбудителей рИПМ, но и комменсальной флоры [16]. Предыдущие рандомизированные исследования продемонстрировали трехкратное увеличение частоты резистентности к противомикробным препаратам по сравнению с плацебо. Несколько исследований подтвердили появление резистентных организмов в фекальном резервуаре и моче у женщин, которые принимают пролонгированные антибиотики [17,18]. Наблюдаемая картина резистентности ограничивалась не только назначенным антибиотиком, но и целым рядом других антибиотиков, обычно используемых для лечения симптоматической ИМП. Кроме того, обнаружение резистентных микроорганизмов может произойти уже после нескольких недель профилактической антибиотикотерапии [18].
Использование эффективных стратегий профилактики ИМП без антибиотиков снизит риск появления у пациентов резистентных микроорганизмов и последующей трудно поддающейся лечению клинической инфекции, вызванных этими бактериями. Частота мультимикробной резистентности к противомикробным препаратам у женщин в постменопаузе, страдающих от рИПМ, составляет около 25%, и было показано, что она увеличивается до более чем 80% после пролонгированных антибиотиков [5].
Целесообразность использования профилактических методов лечения рИМП без антибиотиков была подчеркнута в недавних руководствах Великобритании, Европы и США по сокращению «побочного ущерба» от использования антибиотиков путем минимизации риска развития резистентности [19]. Лидеры мнений на страновом и на международном уровне включают это в рекомендации по предотвращению избыточного применения антибиотиков и разумном назначение антибиотиков в качестве ключевых компонентов планов действий и стратегий по снижению устойчивости к противомикробным препаратам [20]. Безусловно необходимы тщательно спланированные научные исследования, обеспечивающие надежные доказательства, по крайней мере, эквивалентной эффективности неантибиотического лечения, для того, чтобы дополнительно информировать авторов рекомендаций и политиков и обосновывать рекомендации по альтернативным методам лечения, избегая длительного применения антибиотиков.
Изменения образа жизни
Пациенток следует обучать и информировать о поведенческих факторах риска рецидивирующих ИМП, таких как сексуальная активность [21]. Аналогично, женщинам в пременопаузе, применяющим спермициды или вагинальные диафрагмы, должны быть предложены альтернативные формы контрацепции [22]. Следует отметить, что в ряде исследований не удалось выявить какуюлибо связь между рецидивирующими ИМП и особенностями мочеиспускания до или после полового акта, частотой мочеиспускания, привычками отсроченного мочеиспускания, схемами интимной гиигены, спринцеванием, использованием гидромассажных ванн, жемчужных ванн, индексом массы тела (ИМТ), использования плотной одежды, типа нижнего белья, ездой на велосипеде и объемом потребляемой жидкости [8,10]. Следовательно, пациенты должны быть проинформированы о таких мифах.
Пищевые привычки
Исследователи обнаружили, что некоторые диетические факторы также связаны с пониженным риском ИМП, включая количество потребляемого свежего сока, особенно ягодного сока. В одном из интервенционных исследований было показано, что частое употребление свежих соков, особенно ягодных соков, и кисломолочных продуктов, содержащих пробиотические бактерии, было связано со сниженным риском рецидива ИМП: отношение рисков (ОР) возникновения ИМП составляло 0,66 (95% ДИ: 0,48 - 0,92) для 0,2 л свежего сока. При этом употребление ягодного сока по сравнению с другими соками дает ОР 0,28 (95% ДИ: 0,14 - 0,56). Употребление кисломолочных продуктов 3 раза в неделю и более дало ОР 0,21 (95% ДИ: 0,06 - 0,66) относительно потребления < 1 раз/нед. Кисломолочные продукты, содержащие пробиотические бактерии, также, по-видимому, связаны с более низким риском ИМП. Таким образом, изменение диетических привычек может быть первым шагом к профилактике ИМП у женщин [23].
D-манноза D-манноза – это простой углевод, который по своей структуре похож на глюкозу. D-манноза быстро всасывается и достигает органов через 30 минут, после чего она выделяется с мочой в полностью неизмененном виде. D-манноза не усваивается клетками организма и практически не влияет на углеводный обмен.
Уже в течение некоторого времени порошок D-маннозы рекомендуется как альтернатива антибиотикотерапии, так как при местном применении он снижает способность уропатогенной E.coli связываться с эпителиальными клетками мочевого пузыря [24–27].
В настоящее время Национальный институт здоровья и качества медицинской помощи Великобритании (NICE) рекомендует применение D-маннозы при рецидивирующих инфекциях мочевых путей [28].
Основным фармакологическим действием D-маннозы является предотвращение прикрепления уропатогенной кишечной палочки (E.coli) к клеткам слизистой мочевого пузыря.
Механизм действия D-маннозы связан с одним из факторов патогенности E.coli – фимбриями. Фимбрии – это нити, которыми бактерия прикрепляется к клеткам слизистой мочевого пузыря. На кончике этих нитей расположен белок адгезин FimH. Во время бактериальной колонизации FimH связывается с углеводсодержащими гликопротеиновыми рецепторами в эпителии мочевыводящих путей. Поскольку D-манноза сходна по структуре с сайтом связывания уротелиальных рецепторов этого гликопротеина, она действует как конкурентный ингибитор бактериальной адгезии. В достаточной концентрации в моче D-манноза вызывает насыщение адгезинов FimH и препятствует связыванию бактерий с уротелиальными рецепторами (рис. 2) [25,29].
Животные модели показали значимое снижение бактериальной нагрузки при использовании D-маннозы [30]. Рандомизированное исследование в сравнении с продолжительной профилактикой нитрофурантоином показало, что применение D-маннозы в течение 6 месяцев снижает вероятность развития рецидива с 60% до 15% по сравнению с группой, не получавшей какой-либо профилактики. Эффективность D-маннозы в профилактике обострений цистита оказалось сходной с нитрофурантоином (рис. 3) [27].
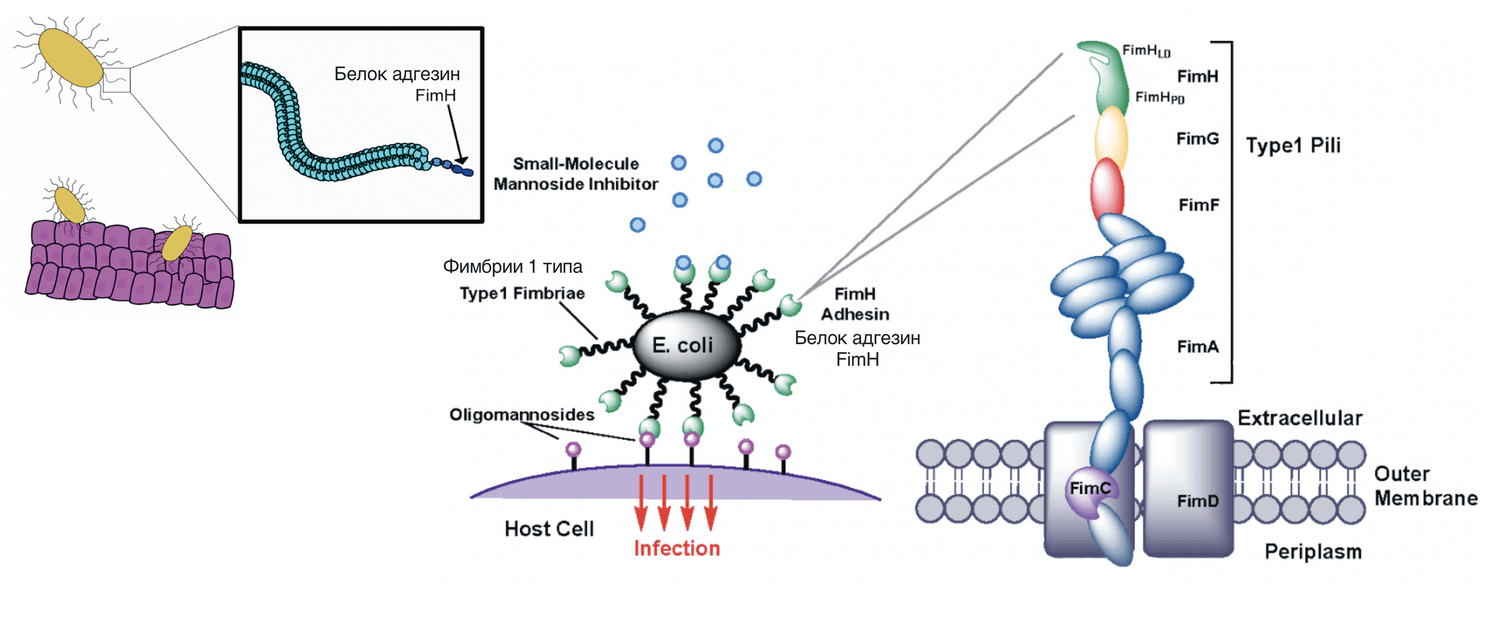
Рис. 2. Структура адгезина FimH и его связывание с маннозидным остатком [50]
Fig. 2. The structure of adhesin FimH and its binding to the mannoside residue [50]
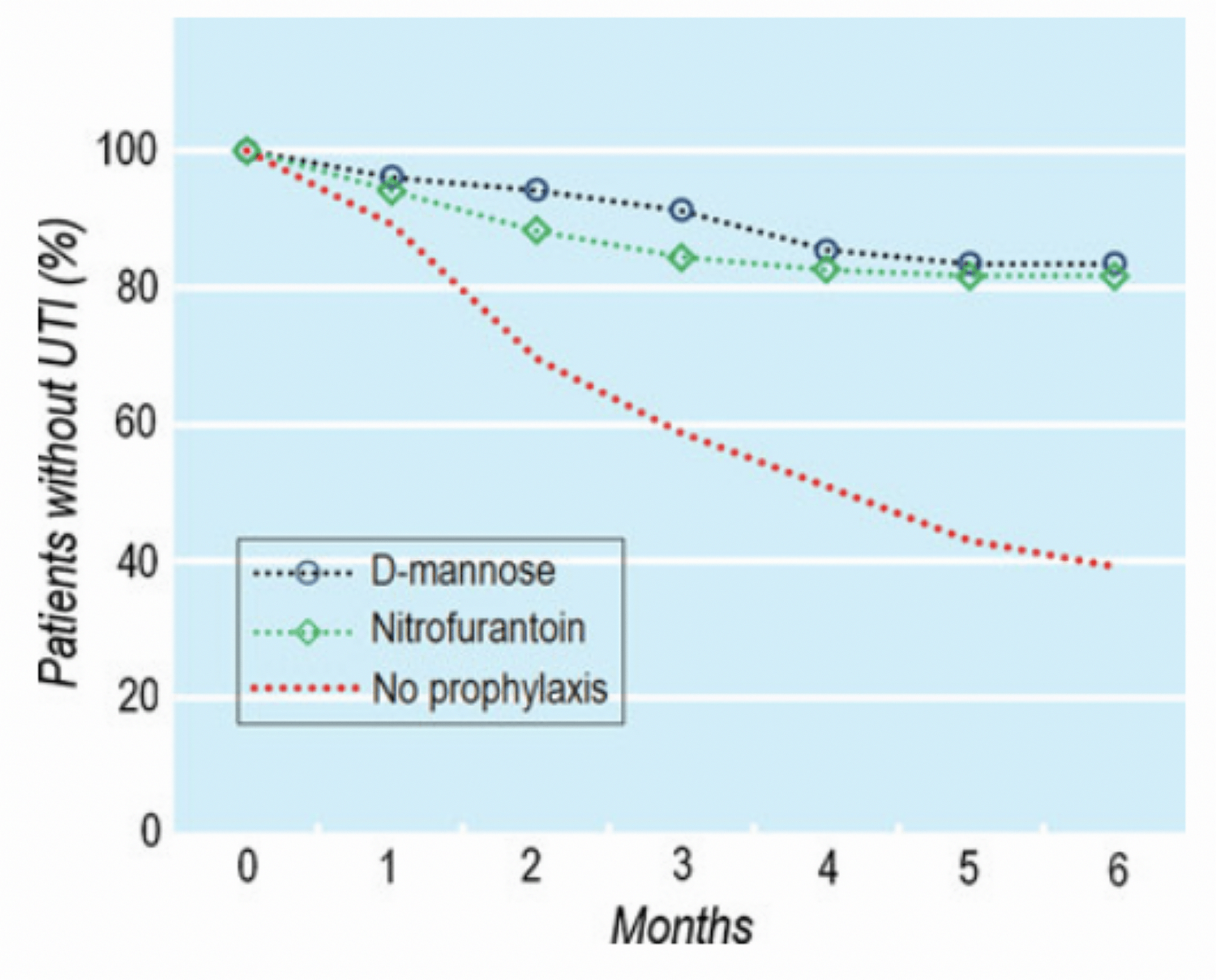
Рис. 3. Доля пациентов без рецидива ИМП на фоне профилактики D-маннозой и нитрофурантоином [31]
Fif. 3. The proportion of patients without recurrence of UTI against the background of prevention of D-mannose and nitrofurantoin [31]
В другом исследовании при сравнении с интермиттирующей антибиотикопрофилактикой (ко-тримоксазол 600 мг на ночь 1 неделя в месяц) применение D-маннозы показало достоверно более высокую эффективность в продлении периода ремиссии (52,7± 11,2 дней для ко-тримоксазола против 200±50,7 дней для D-маннозы) [31].
По результатам другого исследования даже кратковременное применение D-маннозы в течение 2 недель достоверно снижает с 33,3% до 4,5% частоту рецидивирования при наблюдении в течение 12 месяцев [32].
Экстракт виноградных косточек (олигомерные проантоцианидины, OPC)
Проантоцианидины – это класс полифенолов, открытый в 1947 году Джеком Маселье из Университета Бордо, Франция. Он впервые подробно изучил OPC после прочтения отчета экспедиции исследователя Жака Картье в 1534 году по реке Святого Лаврентия, в которой экипаж Картье, застрявший в ледяных потоках и умирающий от цинги, выжил после того, как коренные американцы дали им чай, сваренный из коры и иголок местного вида сосны. Позже Масьелье предположил, что составляющие сосны содержали витамин С и флавоноиды, которые помогли команде восстановиться [33].
Мономерами многих OPC являются катехины, эпикатехины и их эфиры галловой кислоты. При этом понятие OPC относится только к димерам и тримерам. Традиционным источником проантоцанидинов в урологической практике считается клюква. Однако, клинические испытания не смогли подтвердить, что проантоцианидины клюквы, могут стать альтернативой антибиотикопрофилактике для ИМП: 1) научное заключение Европейского агентства по безопасности пищевых продуктов 2014 года отвергло физиологическое доказательство того, что проантоцианидины клюквы играют роль в ингибировании бактериальных патогенов, участвующих в ИМП [34]; 2) в обзоре Кокрановского сотрудничества 2012 года сделан вывод о том, что «клюквенный сок в настоящее время не может быть рекомендован для профилактики ИМП» [35,36]. Вероятно, подобные результаты обусловлены низким содержанием OPC в препаратах клюквы. Современные исследования показывают, что содержание олигомерных проантоцианидинов (OPC) в виноградных косточках в 10 раз выше, чем в клюкве [37], поэтому они могут быть более ценным их источником.
Связи между мономерами обуславливают способность OPC связываться с белками, такими как адгезины, присутствующие на фимбрии E. сoli и, как считается, ингибируют бактериальные инфекции мочевыводящих путей [38]. Механизм действия ОРС при рецидивирующих ИПМ также обусловлен снижением выработки провоспалительных цитокинов (интерлейкина-1β, фактора некроза опухолей-α) [39], снижением выработки пероксида водорода макрофагами [40,41]. Также ОРС оказывают антиоксидантный эффект. [42]. Кроме того, проантоцианидины показали способность усиливать активность антибиотиков (ципрофлоксацина) [43].
Экстракт толокнянки обыкновенной (Арбутин)
Листья вечнозеленого растения Arctostaphylos uvaursi уже много лет успешно применяются в лечении инфекционно-воспалительных заболеваний мочевой системы. При пероральном приеме в мочу высвобождается до 90,7% арбутина, что создает среду, бактерицидную по отношению к E. coli, P. mirabilis, P. aeruginosa, S. aureus и 70 другим видам бактерий, обитающих в мочевой системе [44].
В организме человека арбутин трансформируется в гидрохинон, который и оказывает основной антибактериальный эффект. Гидрохиноновые конъюгаты выделяются в основном с мочой с небольшим количеством свободного гидрохинона, присутствующего в моче здоровых людей [45]. Гидрохинон, являясь фенольным соединением, оказывает прямое цитотоксическое действие на бактериальные клетки. Гидрохинон действует специфически на клеточную мембрану и инактивирует ферменты внутри цитоплазмы, образуя нестабильные комплексы. Липофильные молекулы гидрохинона захватываются мембранными фосфолипидами бактерий. При этом происходят следующие процессы: если концентрация низкая, составляющие клетки (нуклеиновые кислоты, глутаминовая кислота) высвобождаются во внешнюю среду и клетка погибает. Если концентрация высокая, гидрохинон ингибирует пермеазу (фермент, обеспечивающий трансмембранный перенос веществ), тем самым вызывая денатурацию бактериальных белков и лизис клеточной мембраны [46].
Антимикробная активность арбутина также обусловлена тем, что он повышает гидрофобность поверхности микробных клеток и тем самым предотвращает адгезию к клеточным стенкам мочевыводящих путей, и вызывает агглютинацию бактерий [47,48]. Толокнянка также действует как мочегонное средство, помогая избавиться от инфекции из мочевыводящих путей, дополнительно предотвращая бактериальную адгезию и колонизацию.
Экстракт толокнянки одобрен Германской комиссией Е (аналог американской FDA для фитопрепаратов) к использованию для лечения инфекций мочевыводящих путей, в том числе, вызванного P. vulgaris, E. coli, U. urealyticum, M. hominis, S. aureus, Ps. aeruginosa, E. faecalis и C. аlbicans [49].
Кроме того, было обнаружено, что применение арбутин-содержащих экстрактов в сочетании с антибактериальными препаратами является более эффективным и менее токсичным при лечении ИМП по сравнению с монотерапией антибиотиками [48].
ВЫВОДЫ
Инфекция мочевыводящих путей относится к числу наиболее распространенных заболеваний в развивающихся, а также в развитых странах мира с более высоким уровнем заболеваемости среди женщин. Для лечения ИМП используются различные антибиотики в зависимости от тяжести заболевания. Но устойчивость к антибиотикам стала новой проблемой для клиницистов, сталкивающихся с рецидивирующими ИМП. В качестве альтернативымогут быть предложены, некоторые как растительные препараты и иные молекулы, которые в ряде случаев оказываются наилучшим терапевтическим и профилактическим средством и часто рассматриваются как оптимальный вариант длительной профилактики. Одним из современных решений в этой области является биологически активный комплекс «Цисталис», который содержит D-маннозу, олигомерные проантоцианидины и арбутин из экстракта Толокнянки и предназначен для применения пациентами с острым и рецидивирующим циститом.
ЛИТЕРАТУРА
- Nickel JC. Management of urinary tract infections: Historical perspective and current strategies: Part 1 - Before antibiotics. J Urol 2005;173: 21–6. doi: 10.1097/01.ju.0000141496.59533.b2.
- Laupland KB, Ross T, Pitout JDD, Church DL, Gregson DB. Community-onset urinary tract infections: A population-based assessment. Infection. 2007;35(3):150–3. doi: 10.1007/s15010-007-6180-2.
- Ikahelmo R, Siitonen A, Heiskanen T, Karkkainen U, Kuosmanen P, Lipponen P, et al. Recurrence of Urinary Tract Infection in a Primary Care Setting: Analysis of a I-Year Follow-up of 179 Women. Clin Infect Dis 1996;22(1):91–9. doi: 10.1093/clinids/22.1.91.
- Renard J, Ballarini S, Mascarenhas T, Zahran M, Quimper E, Choucair J, et al. Recurrent Lower Urinary Tract Infections Have a Detrimental Effect on Patient Quality of Life: a Prospective, Observational Study. Infect Dis Ther 2015;4(1):125–35. doi: 10.1007/s40121-014-0054-6.
- Foxman B. Epidemiology of urinary tract infections: Incidence, morbidity, and economic costs. Am J Med 2002;113(1 SUPPL. 1):5–13. doi: 10.1016/S0002-9343(02)01054-9.
- Fihn SD. Acute uncomplicated urinary tract infection in women. N Engl J Med 2003;349(3):259–66. doi: 10.1056/NEJMcp030027.
- Kodner CM, Thomas Gupton EK. Recurrent urinary tract infections in women: Diagnosis and management. Am Fam Physician. 2010;82(6):638–43.
- Epp A, Larochelle A, Lovatsis D, Walter JE, Easton W, Farrell SA, et al. Recurrent Urinary Tract Infection. J Obstet Gynaecol Canada 2010;32(11):1082–90. doi: 10.1016/S1701-2163(16)34717-X.
- Franco AVM. Recurrent urinary tract infections. Best Pract Res Clin Obstet Gynaecol 2005 Dec;19(6):861-73. doi: 10.1016/j.bpobgyn.2005.08.003.
- Scholes D, Hooton TM, Roberts PL, Stapleton AE, Gupta K, Stamm WE. Risk Factors for Recurrent Urinary Tract Infection in Young Women. J Infect Dis 2000;182(4):1177–82. doi: 10.1086/315827.
- Hooton TM, Stapleton AE, Roberts PL, Winter C, Scholes D, Bavendam T, et al. Perineal Anatomy and Urine-Voiding Characteristics of Young Women with and without Recurrent Urinary Tract Infections. Clin Infect Dis 1999;29(6):1600–1. doi: 10.1086/313528.
- Nseir W, Taha M, Nemarny H, Mograbi J. The association between serum levels of vitamin D and recurrent urinary tract infections in premenopausal women. Int J Infect Dis 2013;17(12). doi: 10.1016/ j.ijid.2013.06.007.
- Gupta K, Stapleton AE, Hooton TM, Roberts PL, Fennell CL, Stamm WE. Inverse Association of H2O2-Producing Lactobacilli and Vaginal Escherichia coli Colonization in Women with Recurrent Urinary Tract Infections. J Infect Dis 1998;178(2):446–50. doi: 10.1086/515635.
- Gupta K, Trautner BW. Diagnosis and management of recurrent urinary tract infections in non-pregnant women. BMJ (Online). 2013;346 :f3140. doi: 10.1136/bmj.f3140.
- Albert X, Huertas I, Pereiro I, Sanfélix J, Gosalbes V, Perrotta C. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004; doi: 10.1002/14651858.cd001209.pub2
- Beerepoot MAJ, Ter Riet G, Nys S, Van Der Wal WM, De Borgie CAJM, De Reijke TM, et al. Lactobacilli vs antibiotics to prevent urinary tract infections: A randomized, double-blind, noninferiority trial in postmenopausal women. Arch Intern Med 2012;172(9):704–12. doi: 10.1001/archinternmed.2012.777.
- Murray BE, Rensimer ER, Dupont HL. Emergence of High-Level Trimethoprim Resistance in Fecal Escherichia coli during Oral Administration of Trimethoprim or Trimethoprim-Sulfamethoxazole. N Engl J Med 1982;306(3):130–5. doi: 10.1056/NEJM198201213060302.
- Kahlmeter G. Cross-resistance and associated resistance in 2478 Escherichia coli isolates from the Pan-European ECO{middle dot} SENS Project surveying the antimicrobial susceptibility of pathogens from uncomplicated urinary tract infections. J Antimicrob Chemother 2003;52(1):128–31. doi: 10.1093/jac/dkg280.
- Kessel AS, Sharland M. The new UK antimicrobial resistance strategy and action plan: A major societal, political, clinical, and research challenge. BMJ 2013;346(7899). doi: 10.1136/bmj.f1601
- Gupta K, Hooton TM, Naber KG, Wullt B, Colgan R, Miller LG, et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. Clin Infect Dis 2011;52(5).doi: 10.1093/cid/ciq257 .
- Health ProtectionAgency. Management of infection guidance for primary care for consultation & local adaption. Guidelines. 2014;(November):1–38.
- Treatment of urinary tract infections in nonpregnant women. Obstet Gynecol 2008;111(3):785–94. doi: 10.1097/AOG.0b013e318169f6ef.
- Kontiokari T, Laitinen J, Järvi L, Pokka T, Sundqvist K, Uhari M. Dietary factors protecting women from urinary tract infection. Am J Clin Nutr 2003; doi: 10.1093/ajcn/77.3.600.
- Hung CS, Bouckaert J, Hung D, Pinkner J, Widberg C, DeFusco A, et al. Structural basis of tropism of Escherichia coli to the bladder during urinary tract infection. Mol Microbiol 2002;44(4):903–15. doi: 10.1046/j.1365-2958.2002.02915.x.
- Bouckaert J, Berglund J, Schembri M, De Genst E, Cools L, Wuhrer M, et al. Receptor binding studies disclose a novel class of high-affinity inhibitors of the Escherichia coli FimH adhesin. Mol Microbiol 2005;55(2):441–55. doi: 10.1111/j.1365-2958.2004.04415.x.
- Cusumano CK, Pinkner JS, Han Z, Greene SE, Ford BA, Crowley JR, et al. Treatment and prevention of urinary tract infection with orally active FimH inhibitors. Sci Transl Med 2011;3(109). doi: 10.1126/ scitranslmed.3003021.
- Kranjčec B, Papeš D, Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: A randomized clinical trial. World J Urol 2014;32(1):79–84. doi: 10.1007/s00345-013-1091-6.
- Urinary tract infection (recurrent): antimicrobial prescribing. [Internet]. 2018. URL: http://tinyurl.com/ya74guo6.
- King SS, Young DA, Nequin LG, Carnevale EM. Use of specific sugars to inhibit bacterial adherence to equine endometrium in vitro. Am J Vet Res 2000;61(4):446–9. doi: 10.2460/ajvr.2000.61.446.
- Michaels EK, Chmiel JS, Plotkin BJ, Schaeffer AJ. Effect of D-mannose and D-glucose on Escherichia coli bacteriuria in rats. Urol Res 1983;11(2):97–102. doi: 10.1007/BF00256954.
- Porru D, Parmigiani A, Tinelli C, Barletta D, Choussos D, Di Franco C, et al. Oral D-mannose in recurrent urinary tract infections in women: A pilot study. J Clin Urol 2014;7(3):208–13. doi: 10.1177/2051415813518332.
- Domenici L, Monti M, Bracchi C, Giorgini M, Colagiovanni V, Muzii L, et al. D-mannose: a promising support for acute urinary tract infections in women. A pilot study. Eur Rev Med Pharmacol Sci [Internet]. 2016;20(13):2920–5. URL: http://www.ncbi.nlm.nih.gov/ pubmed/27424995.
- Murray MT. Procyanidolic Oligomers. In: Textbook of Natural Medicine. 2013. p. 995–1000.
- Scientific Opinion on the substantiation of a health claim related to CranMax® and reduction of the risk of urinary tract infection by inhibiting the adhesion of certain bacteria in the urinary tract pursuant to Article 14 of Regulation (EC) No 1924/2006. EFSA J. 2016;12(5):3657–68. doi: 10.2903/j.efsa.2014.3657.
- Jepson RG, Williams G, Craig JC. Cranberries for preventing urinary tract infections. Sao Paulo Med J 2013;131(5):363. doi: 10.1590/1516-3180.20131315T1.
- Cranberry (Vaccinii macrocarpi fructus). In: ESCOP Monographs: The scientific foundation for herbal medicinal products. New York: ESCOP (Exeter), Georg ieme Verlarg (Stuttgart), Thieme New York; 2009. p. 255–69.
- Beecher GR. Proanthocyanidins: Biological activities associated with human health. Pharm Biol. 2004;42(SUPPL.):2–20. doi: 10.1080/13880200490893474.
- Howell AB. Bioactive compounds in cranberries and their role in prevention of urinary tract infections. Mol Nutr Food Res. 2007 Jun;51(6):732-7.. doi: 10.1002/mnfr.200700038.
- Li WG, Zhang XY, Wu YJ, Tian X. Anti-inflammatory effect and mechanism of proanthocyanidins from grape seeds. Acta Pharmacol Sin [Internet]. 2001;22(12):1117–20. URL: http://www.ncbi.nlm.nih.gov/ pubmed/11749811.
- Bayeta E, Lau BHS. Pycnogenol inhibits generation of inflammatory mediators in macrophages. Nutr Res 2000;20(2):249–59. doi: 10.1016/S0271-5317(99)00157-8.
- Blazsó G, Gábor M, Rohdewald P. Antiinflammatory activities of procyanidin-containing extracts from Pinus pinaster Ait. after oral and cutaneous application. Pharmazie 1997;52(5):380–2.
- Chang WC, Hsu FL. Inhibition of platelet aggregation and arachidonate metabolism in platelets by procyanidins. Prostaglandins, Leukot Essent Fat Acids 1989;38(3):181–8. doi: 10.1016/0952-3278(89)90070-7.
- Vadekeetil A, Alexandar V, Chhibber S, Harjai K. Adjuvant effect of cranberry proanthocyanidin active fraction on antivirulent property of ciprofloxacin against Pseudomonas aeruginosa. Microb Pathog 2016; doi: 10.1016/j.micpath.2015.11.024.
- Committee on herbal medicinal products (HMPC). Assessment report on Arctostaphylos uva-ursi (L.) Spreng., folium. European Medicines Agency. 2012.
- Quintus J, Kovar KA, Link P, Hamacher H. Urinary excretion of arbutin metabolites after oral administration of bearberry leaf extracts. Planta Med 2005;71(2):147–52. doi: 10.1055/s-2005-837782.
- Maris P. Modes of action of disinfectants. Rev Sci Tech [Internet]. 1995;14(1):47–55. URL: http://www.ncbi.nlm.nih.gov/ pubmed/7548971.
- De Arriba SG, Stammwitz U, Pickartz S, Coclik V, Bodinet C, Nolte KU. Anderungen des urin-pH-werts haben keinen einfluss auf die wirksamkeit von Uvae ursi folium. Zr Phytother 2010;31: 95–7. doi: 10.1055/s-0030-1247652
- Geetha RV, Roy A, Lakshmi T. Nature’s weapon against urinary tract infections [Internet]. International Journal of Drug Development and Research. 2011;3: 85–100. URL: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L363060510
- Rotblatt M. Herbal Medicine: ExpandedCommission E Monographs.Ann Intern Med 2013;133(6):487. doi: 10.7326/0003-4819-133-6-200009190-00031
- Laurel K. Mydock-McGrane, Thomas J. Hannan & James W. Janetka Rational design strategies for FimH antagonists: new drugs on the horizon for urinary tract infection and Crohn’s disease. Expert Opin Drug Discov 2017;12:7, 711-731, DOI: 10.1080/17460441.2017.1331216







