ВВЕДЕНИЕ
Лечение инфекций мочевых путей (ИМП) зачастую является сложной задачей, что в большинстве случаев обусловлено трудностями диагностики причин развития ИМП и выявления факторов риска, приводящих к постоянному рецидивированию заболевания. При первом посещении врач не может ответить на вопрос: «Является ли данный эпизод инфекции неосложненной ИМП?» Ведь только обследовав пациентку, можно установить причину развития дизурии, болей над лоном, макрогематурии и т.д. и назначить терапию согласно принятым рекомендациям. Только такой подход позволит избежать бесконтрольного приема антимикробных препаратов, в том числе и фторхинолонов, развития анитбиотикорезистентности, перехода инфекции в хроническую форму, нарушения нормального биоценоза кишечника и влагалища.
Бактерии семейства Enterobacterales являются наиболее частым этиологическим агентом развития ИМП, однако в ряде случаев никакого бактериального агента выявить не удается, а основным клиническим признаком наравне с дизурией является макрогематурия [1, 2]. В настоящее время все большее внимание уделяется влиянию вирусных инфекций на развитие ИМП как у взрослых, так и у детей [3-9]. Явление вирусурии также достаточно активно обсуждается в литературе [3-12]. По данным различных авторов, вирусы группы герпес-вирусов, папилломавирусов, аденовирусов могут являться причиной развития стойкой дизурии [5, 13]. Следует отметить, что герпес-вирусы: вирус простого герпеса (ВПГ) 1 и 2 типов, цитомегаловирус (ЦМВ), вирус Эпштейна-Барр (ВЭБ) способны вызывать вторичную иммуносупрессию и усугублять течение бактериальной инфекции, приводя к развитию рецидивов [11, 12, 14]. Прием антимикробных препаратов при наличии вирусной составляющей еще больше усугубляет процесс за счет подавления нормальной флоры.
Цель: изучить причины возникновения геморрагических циститов, разработать алгоритм обследования указанных пациенток, а также подобрать рациональную терапию.
МАТЕРИАЛЫ И МЕТОДЫ
В урологическое отделение ГБУЗ «ГКБ им. В.П. Демихова ДЗМ» за 2019 год была госпитализирована 61 пациентка с клинической картиной острого геморрагического цистита в возрасте от 18 до 89 лет (средний возраст составил 55,56±21,82 г.). Это составляет 59,2% от всех пациенток, госпитализированных в отделение по поводу воспалительных заболеваний нижних мочевых путей. Больным проводилось стандартное обследование: общий анализ мочи, посев мочи на флору и чувствительность к антибиотикам, ультразвуковое исследование почек и мочевого пузыря, цистоскопия по показаниям.
Учитывая высокую частоту наличия вирусных инфекций как этиологического фактора развития геморрагического цистита на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО Минздрава России был разработан алгоритм обследования указанной категории больных, дополнительно включающий метод полимеразной цепной реакции (ПЦР) первой порции мочи (соскоба из уретры) на наличие ВРГ 1 и 2 типов, ЦМВ, ВЭБ в период обострения, иммуноферментный анализ (ИФА) с определением иммуноглобулинов G и M к ВПГ 1 и 2 типов, ЦМВ и ВЭБ, посев отделяемого из влагалища на флору и чувствительность к антибиотикам с обязательным указанием количества лактобацилл.
По данному алгоритму на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО Минздрава России было обследовано 214 пациенток, из них 154 (72%) пациентки были в возрасте от 18 до 44 лет.
РЕЗУЛЬТАТЫ
При обследовании 61 пациентки в урологическом отделении ГБУЗ «ГКБ им. В.П. Демихова ДЗМ» выявлено, что передозировка антикоагулянтов у пациенток пожилого возраста, имеющих отягощенный кардиологический, неврологический анамнез (фибрилляция предсердий, хроническая ишемия головного мозга, перенесенное острое нарушение мозгового кровообращения и т.д.) как причина развития макрогематурии и дизурических явлений, имела место в 18% случаев (11 больных). Постлучевой цистит (лучевая терапия по поводу рака шейки матки в 2 случаях и рака влагалища у 1 пациентки) был у трех больных. Им выполнена трансуретральная резекция стенки мочевого пузыря и коагуляция кровоточащих сосудов). В двух случаях анамнестически имелась опухоль мочевого пузыря, однако гистологически рецидив опухоли не подтвержден. В остальных случаях пациентки заболели остро и в связи с выраженной дизурией и макрогематурией были госпитализированы в урологическое отделение.
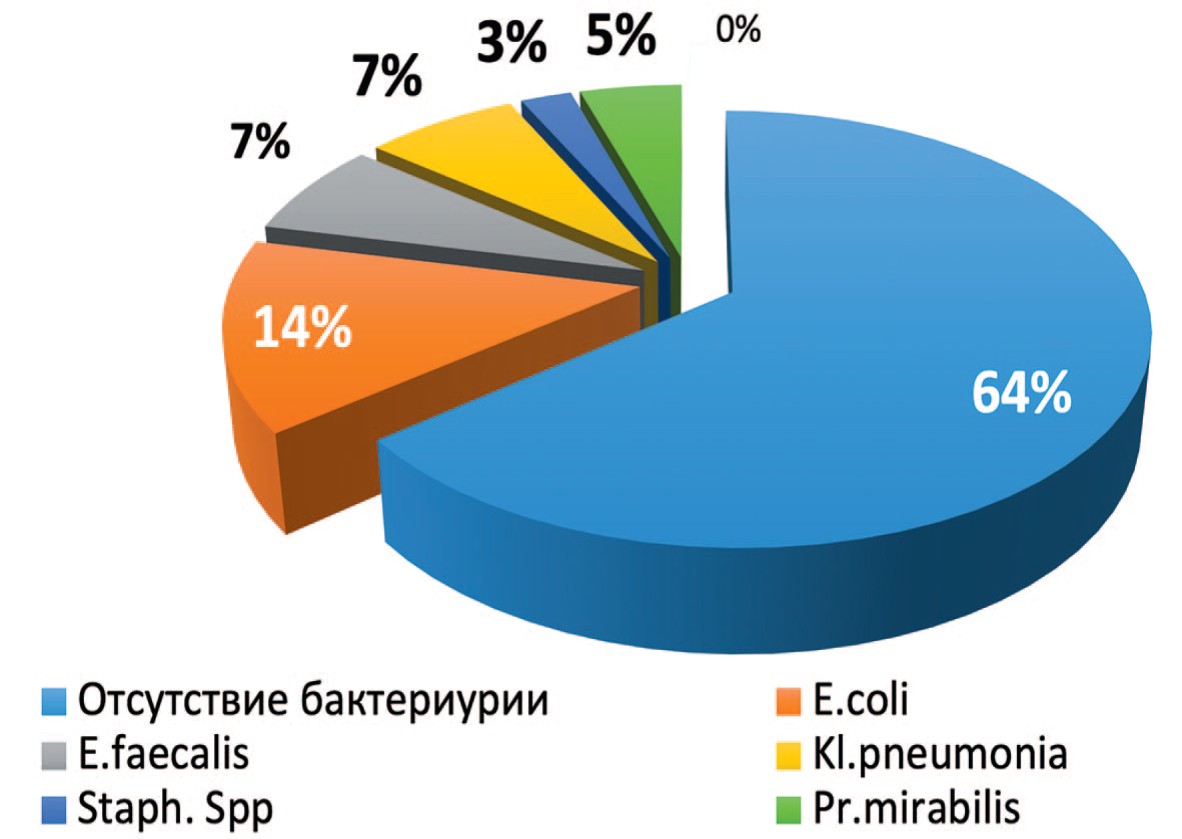
Рис. 1. Данные бактериологического анализа мочи
Fig. 1. The results of bacteriological analysis of urine
Отсутствие лейкоцитурии и бактериурии, наличие микро- или макрогематурии, стерильные посевы мочи, изменения, характерные для вирусного поражения стенки мочевого пузыря в виде множественных петехиальных кровоизлияний, выявленные нами при цистоскопии, позволили нам предположить именно вирусную этиологию заболевания (рис. 2).
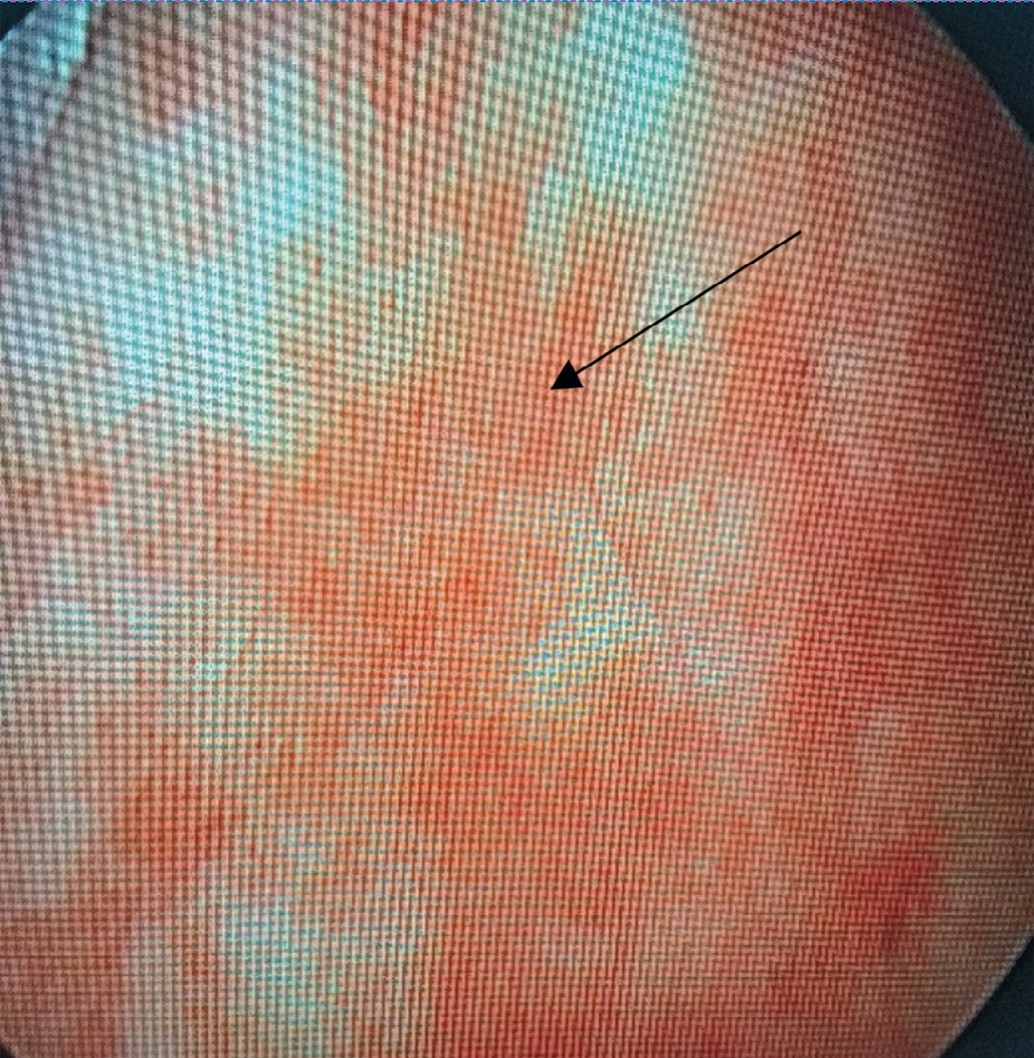
Рис. 2. Цистоскопическая картина геморрагического цистита. Множественные петехиальные кровоизлияния
Fig. 2. Cystoscopic picture of hemorrhagic cystitis. Multiple petechial hemorrhages
Пациентки с геморрагическим циститом не нуждаются в госпитализации, однако наличие гематурии вызывает беспокойство и, как правило, они настаивают на госпитализации для исключения опухолевого процесса.
И таким образом доля геморрагических циститов предположительно вирусной этиологии, вирусных уретритов в структуре воспалительных заболеваний нижних мочевых путей увеличивается, что диктует необходимость создания потенциально нового алгоритма обследования этой категории больных и этиологически обоснованной терапии.
Подобный алгоритм был разработан на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО МЗ РФ (табл. 1).
Таблица 1. Алгоритм диагностики рецидивирующих (геморрагических) циститов
Table 1. Diagnostic algorithm for recurrent (hemorrhagic) urinary tract infections
|
ТЩАТЕЛЬНО СОБРАННЫЙ АНАМНЕЗ! С выявлением таких факторов риска, как раннее начало половой жизни, частая смена половых партнеров, наличие инвазивных манипуляций, сопутствующие хронические гинекологические заболевания, дисбиозы влагалища. Наличие вирусных инфекций (лабиального и генитального герпеса, ЦМВ, ВЭБ, вируса папилломы человека (ВПЧ) как высокого, так и низкого онкогенного риска) у пациентки и ее половых партнеров. Наличие эрозии шейки матки, ассоциированной с ВПЧ и/или дисплазия эпителия (CIN) II-III ст, ВПЧ(+). |
| Влагалищный осмотр с проведением пробы O’Donnell |
| Общий анализ мочи |
| Посев мочи, посев отделяемого из влагалища на флору и чувствительность к антибиотикам с обязательным указанием количества лактобацилл!! |
| Обследование на наличие инфекций передающихся половым путем (ИППП), включая вирусные инфекции (ВПГ 1 и 2 типов, ЦМВ, ВЭБ, ВПЧ высокого онкогенного риска) ИФА на исследование противовирусных антител к указанным вирусам. |
| Ультразвуковое исследование почек, мочевого пузыря с определением остаточной мочи, органов малого таза с допплерографией |
| Цистоскопия с биопсией |
| Осмотр гинекологом |
Наличие хронической герпесвирусной латентной инфекции (ХГВИ) выявлено у 83 (37%) из 214 обследованных пациенток на кафедре урологии и хирургической андрологии, что подтверждено данными анамнеза, результатами ИФА с увеличением уровня иммуноглобулинов G в десятки и сотни раз. Уровень антител к ВПГ 1 и 2 типов у пациенток с геморрагическим циститом без лейкоцитурии и стерильным бактериологическим посевом мочи достоверно выше, чем у пациенток с геморрагическим циститом и выявленным возбудителем в 2,6 раз (р<0,05). Подобное увеличение показателей противовирусных антител свидетельствует не о носительстве, а о присутствии именно ХГВИ. Может иметь место повышение антител не только к ВПГ и 2 типов, но и к другим герпес-вирусам: к ЦМВ (клинический пример 1) и ВЭБ (клинический пример 2).
Сочетанная герпес-вирусная инфекция в виде микст-инфекции ВПГ 1 и 2 типа и ЦМВ выявлена в 66,3% случаев, в остальных – дополнительно выявлен ВЭБ.
Цистоскопия с биопсией слизистой мочевого пузыря выполнена 32 больным. Морфологическими особенностями вирусного геморрагического цистита являются койлоцитоз, выявленный у 29(90%) пациенток (рис. 3) и изменения клеток по типу «тутовых ягод» отмечены у 18(50,2%) пациенток (рис. 4).
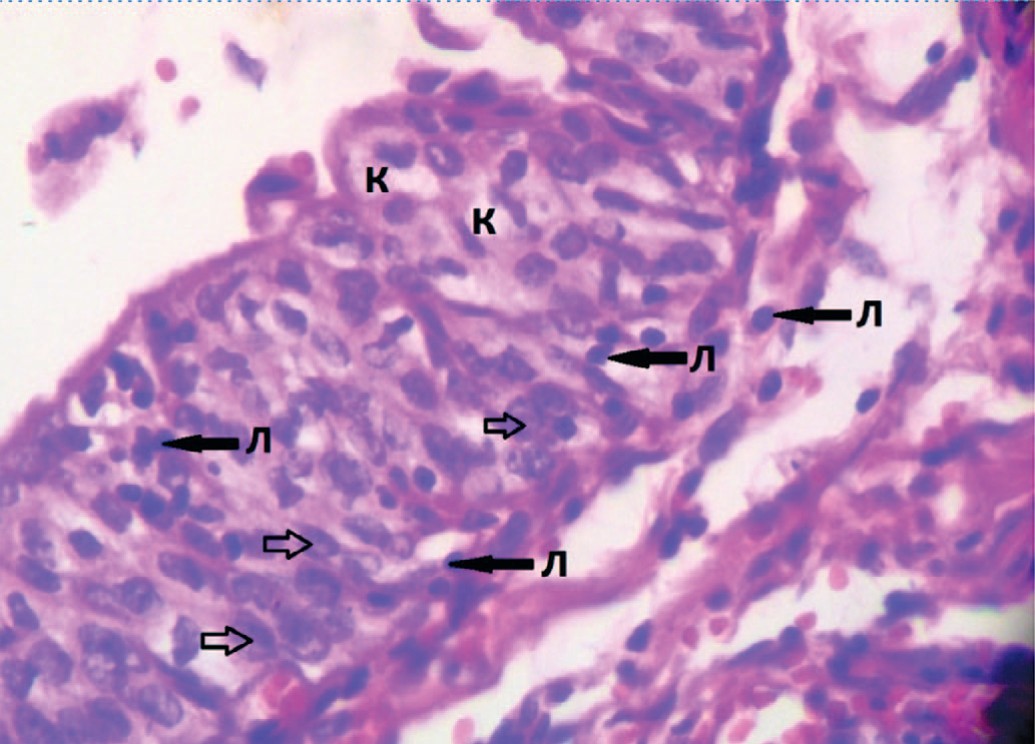
Рис. 3. Фрагмент биоптата мочевого пузыря с признаками выраженного воспалительного инфильтрата, с преобладанием лимфоцитов (Л), признаки внутриклеточной инфекции: койлоцитоз (К), внутриядерные включения (обозначены стрелками). Окраска гематоксилин – эозин ув. 40х/0,65
Fig. 3. A fragment of a bladder biopsy with signs of severe inflammatory infiltrate, with a predominance of lymphocytes (L), signs of intracellular infection : coylocytosis (K), intracellular inclusions (indicated by arrows). Color of hematoxylineosin UV. 40x/0.65
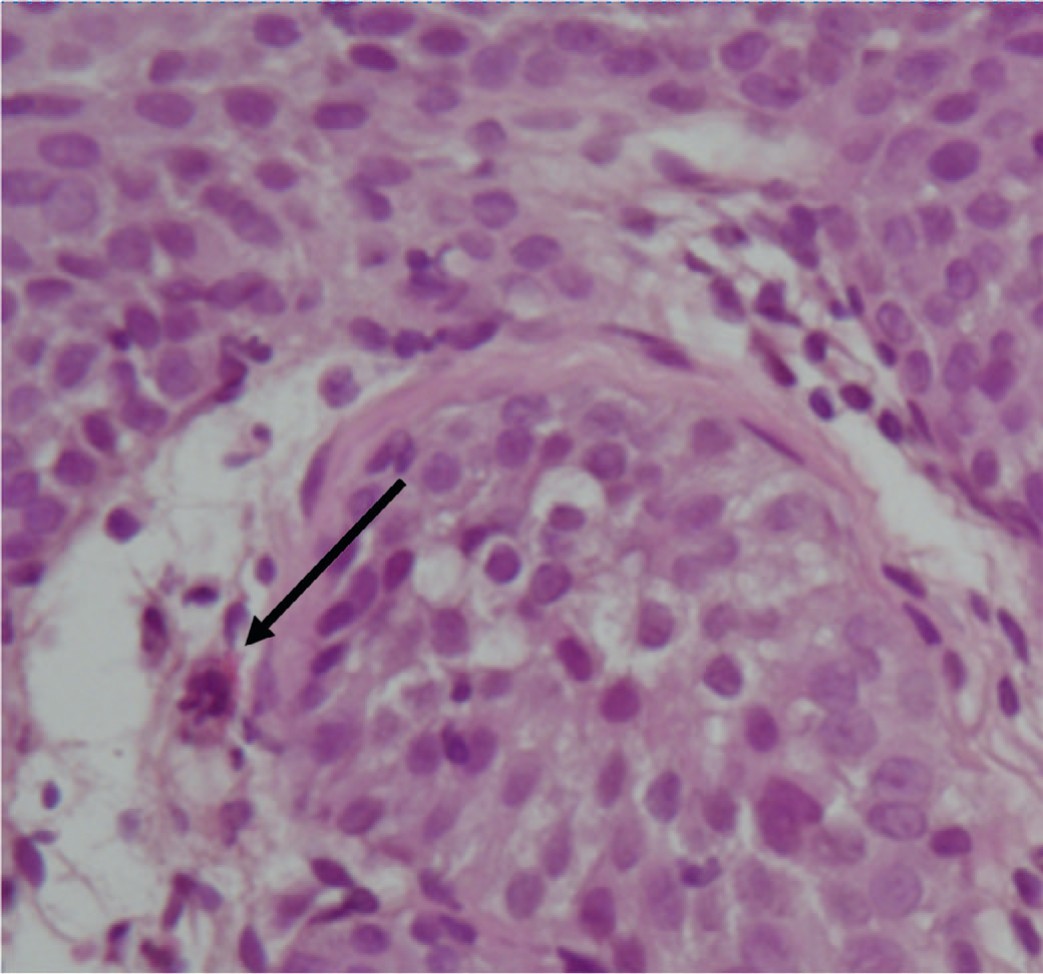
Рис. 4. Фрагмент биоптата мочевого пузыря с признаками выраженного воспалительного инфильтрата, наличие изменений клеток по типу «тутовых ягод». Окр. гематоксилин-эозин. Увеличение 10х10
Fig. 4. A fragment of a bladder biopsy with signs of severe inflammatory infiltrate, presence of cell changes of the «mulberry type»
Приведенные ниже клинические примеры показывают эффективность применения разработанного нами алгоритма.
Клинический пример 1. Пациентка Д., 33 лет. В течение 3 лет страдает рецидивирующим циститом, периодически с примесью крови. В межрецидивный период беспокоят жжение, боли, дискомфорт в уретре, выраженная астения, диспареуния. Следует отметить, что симптоматика усиливалась во время ОРВИ, что на наш взгляд, является одним из патогномоничных признаков вирусной этиологии цистита. Неоднократно получала курсы антимикробной терапии (левофлоксацин, фуразидин, супракс, фосфомицина трометамол) с частичным положительным эффектом. Бактериурии, лейкоцитурии не выявлено. Страдает лабиальным герпесом (рецидивы примерно 1-2 раза в год). По данным ИФА выявлено повышение уровня противовирусных антител к ЦМВ: IgG к ВПГ 1 и 2 типов 9,7 инд.поз., анти-ЦМВ IgG – 228.7 ед/мл (положительный – более 6 ед/мл), анти-ВЭБ IgG-EBNA – 15,5 ед/мл, анти-ВЭБ IgG-VCA – 21,2 ед/мл. Больной назначена длительная супрессивная противовирусная терапия с положительным эффектом. Через 6 месяцев уровень антител к ЦМВ снизился до 8,5 ед/мл.
Клинический пример 2. Пациентка Б., 56 лет. Постменопауза. В течение 20 лет страдает генитальным герпесом. В последнее время обострения 2-3 раза в год. Геморрагический цистит в течение последних 2 лет, в межрецидивный период беспокоят дискомфорт и жжение при мочеиспускании. Лейкоцитурии, бактериурии нет, в соскобах из уретры, взятых вне обострения вирусного поражения не выявлено. Поэтому очень важно проводить обследование в острый период (выполнение ПЦР первой порции мочи и/или взятие соскобов из уретры). Цистоскопическая картина геморрагического цистита. Однако обнаружено выраженное повышение уровня противовирусных антител к ВПГ 1 и 2 типов, ЦМВ, ВЭБ: анти-ВПГ 1 типа IgG – 222 ед/мл, анти-ВПГ 2 типа IgG – 3 ед/мл (более 22 ед/мл – положительно), анти-ЦМВ IgG – 407,8 ед/мл (положительный – более 1 ед/мл), анти-ВЭБ IgG-EBNA – 196 ед/мл (более 20 ед/мл –положительно), анти-ВЭБ IgG-VCA – 505 ед/мл (более 20 ед/мл – положительно). Назначена длительная противовирусная терапия с положительным эффектом.
Клинический пример 3. Пациентка Х., 26 лет, госпитализирована в экстренном порядке в ГКБ им. С. П. Боткина с жалобами на примесь крови в моче со сгустками, учащенное и болезненное мочеиспускание, рези в конце мочеиспускания, жжение в области наружных половых органов. Вышеуказанные жалобы беспокоят в течение суток. За медицинской помощью не обращалась. Самостоятельно не лечилась.
В анамнезе у пациентки рецидивирующий цистит в течение трех лет. Обострения возникали трижды за последние 6 месяцев. Лечение и обследование проходила амбулаторно у уролога. В общеклиническом анализе мочи определялись лейкоциты до 10 в поле зрения, эритроциты до 2 в поле зрения. Все бактериологические посевы мочи были стерильны. Проводились курсы антибактериальной терапии (Фосфомицином, Фторхинолонами, Нитрофуранами), противовоспалительная терапия (Диклофенак) с незначительным временным эффектом. При этом жжение в области уретры сохранялось. По данным гинекологического анамнеза: менструация с 13 лет, регулярные, обильные, болезненные. Беременности и гинекологические заболевания у пациентки отсутствуют. Половая жизнь с 18 лет. Контрацепция барьерная. Половой жизнью не живет последние 6 месяцев, в связи с диспареунией.
При обследовании в приемном отделении в общем анализе мочи эритроциты покрывают все поля зрения. По данным ультразвукового исследования (УЗИ) мочевыделительной системы конкрементов, объемных образований, нарушения уродинамики не выявлено. Мочевой пузырь с четким ровным контуром, без пристеночных образований. Остаточной мочи нет. Теней подозрительных на конкременты при обзорной урографии не выявлено. При поступлении в приемном отделении осмотрена гинекологом: данных за острую гинекологическую патологию на момент осмотра нет.
Пациентка госпитализирована в урологическое отделение ГБУЗ ГКБ им. С.П. Боткина ДЗМ с предварительным диагнозом: острый геморрагический цистит. В отделении взята моча на бактериологический посев и цитологическое исследование с определением атипичных клеток. Назначена антибактериальная (Ципрофлоксацин), гемостатическая (Этамзилат), противовоспалительная (Диклофенак) терапия. На 3-е сутки госпитализации отмечалась положительная динамика в виде купирования гематурии и уменьшения дизурических явлений. Результат бактериалогического анализа мочи – рост микрофлоры не выявлен, во всех трех порциях мочи атипичные клетки не определяются.
В связи с сохраняющимся дискомфортом в области уретры пациентка осмотрена на гинекологическом кресле. При осмотре в области наружных половых губ определяются характерные для герпеса множественные везикулезные элементы полициклической фестончатой формы с прозрачным содержимым.
Подробный сбор анамнеза позволил выяснить, что лабиальный герпес пациентку беспокоит на протяжении трех лет, за последние 6 месяцев рецидивы герпеса участились. Лечилась самостоятельно Ацикловиром местно.
Пациентка выписана с заключительным клиническим диагнозом: Острый геморрагический цистит. Генитальный герпес. Даны рекомендации по дальнейшему обследованию. Амбулаторно выполнен урогенитальный мазок из трех локусов (уретра, цервикальный канал, влагалище). Качественный ПЦР анализ в режиме реального времени соскоба слизистой уретры выявил ВПГ 2 типа. Иммуноферментный анализ (ELISA) показал повышение титра антител (ВПГ 1 IgG – 144,3; ВПГ 2 IgG – 130,5). ПЦР мочи в режиме реального времени выявил ВПГ 1 и 2 типа (HSV 1,2 – 8,6x102).
Пациентка направлена в герпетический центр, где подтвержден ранее установленный диагноз: генитальный герпес. Назначена противовирусная терапия: Валацикловир в дозировке 500 мг 2 раза в сутки в течение 5 дней, затем поддерживающая терапия 500 мг 1 раз в день в течение 3 мес.
Через 2 недели в плановом порядке выполнена цистоскопия с щипковой биопсией. При осмотре наружных половых органов везикулярные высыпания имели остаточные следы. Цистоскопическая картина имела характерные особенности слизистой. В области устьев и мочепузырного треугольника определялись белесоватые бляшки, несколько похожие на изменения слизистой при лейкоплакии.
При морфологическом исследовании биоптатов стенки мочевого пузыря, взятых при щипковой биопсии, выявлено наличие койлоцитоза и изменения клеток по типу «тутовой ягоды» как патогномоничного признака герпесвирсной инфекции.
В дальнейшем при наблюдении в течение года пациентка не отмечала рецидивов герпесвирусной инфекции и циститов. Продолжительное отсутствие дизурии, диспареунии и жжения в области уретры улучшило качество жизни, позволило вернуться к половой жизни и родить здорового ребенка.
После дообследования и подтверждения вирусной природы заболевания всем пациенткам проводилась противовирусная терапия, которая при рецидиве заболевания продолжалась в режиме супрессивной от 3 до 6 месяцев. Если вирусная инфекция являлась ко-фактором развития воспалительных и дисбиотических заболеваний урогенитального тракта, то в таком случае при обострении заболевания терапия начиналась с симптоматического лечения – применения препарата, оказывающего местный анальгетический эффект и облегчающего симптомы дизурии, затем согласно рекомендациям по лечению острого цистита – применение фосфомицина трометамола или препаратов нитрофуранового ряда. При сочетании с воспалительными гинекологическими заболеваниями применялась местная антимикробная терапия. При известном бактериальном возбудителе, антимикробная терапия назначалась согласно посеву мочи. Применение указанного алгоритма диагностики и лечения рецидвивирующей инфекции нижних мочевых путей у женщин позволило установить вирусную природу заболевания, а также увеличить безрецидивный период от 6 до 12 месяцев, улучшить качество жизни пациенток, избавив их от симптомов уретрита, диспареунии, а самое главное, исключить опухоль мочевого пузыря, как причину макрогематурии, т.е. способствовало решению социальной и демографической проблемы.
ОБСУЖДЕНИЕ
В клинической практике мы все чаще сталкиваемся с обращением больных по поводу неоднократных рецидивов цистита, у которых применение антибактериальных препаратов приводит к временному улучшению или не помогает совсем. В отличие от типичных для бактериального цистита предрасполагающих факторов, таких как половой акт, переохлаждение, у этой категории больных обострение чаще всего возникает на фоне стрессовых ситуаций, после смены климата, и часто сопровождается макрогематурией. Вирусными циститами и/или уретритами чаще всего страдают преимущественно женщины молодого возраста с различными сопутствующими воспалительными заболеваниями и имеющие проблемы с иммунитетом. Кроме того, симптомы уретрита присутствуют и в межрецидивный период. Неоднократные, часто необоснованные, курсы антибактериальной терапии способствуют развитию дисбиозов влагалища, дисбактериозов, что также усугубляет выраженность проблемы. Наличие диспареунии заставляет пациенток отказываться от половой жизни, что делает проблему не только медицинской, но и социальной, т.к. приводит к нарушению деторождения.
На сегодняшний день данные о роли вирусов в развитии урологических заболеваний крайне разрознены, мозаичны и не систематизированы [5]. Присутствие койлоцитов при морфологическом исследовании, как проявление папилломавирусной инфекции, является наиболее достоверным признаком вирусного поражения стенки мочевого пузыря как по нашим данным, так и поданным литературы [3-5]. Что касается герпес-вирусных инфекций, то по данным российских исследователей ДНК ВПГ 1 типа выявлен в моче и биоптатах мочевого пузыря в 7,1% случаев у пациентов, страдающих хроническим циститом [15-16]. А. Ito и соавт. указывают на этиологическую роль ВПГ 2 типа в развитии негонококкового уретрита у мужчин без видимых герпетических высыпаний [17]. По данным литературы, бессимптомное течение генитального герпеса зарегистрировано в 20% случаев, а в 60% – атипичное [18, 19]. В нашем исследовании у трети больных выявлена латентная вирусная инфекция, в большинстве случаев имела место микст-инфекция (ВПГ 1 и 2 типов, ЦМВ, ВЭБ), в связи с чем применение традиционной антимикробной терапии является неэффективным методом лечения.
Следует отметить, что герпес-вирусные инфекции являются медико-социально проблемой и требуют комплексного подхода к лечению этой категории больных, так как герпетические инфекции влияют на репродуктивное здоровье как женщин, так и мужчин. В заключении ключевых экспертов по итогам междициплинарного научного заседания на тему: «Диагностика, лечение, профилактика вирус-ассоциированных заболеваний: пути решения» (Сочи, 9 сентября 2019 года) под председательством член-корр. РАН, д.м.н., проф., В.Е. Радзинского отмечено, что установлена роль вирусных инфекций (ВПЧ, ВПГ, ЦМВ) в «безвозвратных» репродуктивных потерях; риск вирусных заболеваний (ВПЧ, ВПГ, ЦМВ) выше у лиц с недостаточностью противоинфекционной защиты; вирусные инфекции (ВПЧ, ВПГ, ЦМВ) ускользают от врожденного иммунного ответа хозяина, в частности подавляя продукцию интерферона и.т.д.[20].
ВЫВОДЫ
Таким образом, цистит вирусной этиологии в настоящее время представляет собой реальность, что подтверждается данными литературы. С учетом частоты рецидивов и неэффективности традиционной терапии тщательное обследование больных должно включать в себя не только посев мочи и обследование на инфекции, передающиеся половым путем, но и применение методов, позволяющих исключить или подтвердить вирусную природу заболевания.
ЛИТЕРАТУРА
- Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Перепанова Т.С., Козлов Р.С. и исследовательская группа «ДАРМИС-2018». Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «ДАРМИС2018». Клиническая и антимикробная терапия 2019;21(2):134-146. [Palagin I.S., Sukhorukova M.V., Dekhnich A.V., Edelstein M.V., Perepanova T.S., Kozlov R.S. and «DARMIS-2018» Study Group* Antimicrobial resistance of pathogens causing community-acquired urinary tract infections in Russia: results of multicenter study «DARMIS-2018». Klinicheskaya i antimikrobnaya terapiya = Clinical and Antimicrobial Therapy 2019;21(2):134-146. (In Russian)]. https://doi.org/10.36488/cmac.2019.2.134-146.
- Перепанова Т.С., Козлов Р.С., Руднов В.А., Синякова Л.А. и соавт. Федеральные кинические рекомендации «Антимикробная терапия и профилактика инфекции почек, мочевыводящих путей и мужских половых органов». М:2020; с. 150. [Perepanova T.S., Kozlov R.S., Rudnov V.A., Sinyakova L.A. Federal clinical recommendations “Antimicrobial therapy and prevention of infections of the kidneys, urinary tract and male genital organs.” – M: 2020. P. 150. (In Russian)].
- Лоран О.Б., Синякова Л.А., Незовибатько Я.И. Геморрагический цистит у женщин: эпидемиология, этиология, патогенез, диагностика. Consillium Medicum 2017;19(7):50-55 [Loran O.B., Sinyakova L.A., Nezovibatko Ya.I. Hemorrhagic cystitis in women: epidemiology, etiology, pathogenesis, diagnosis. Consillium Medicum 2017;19(7):50-55. (In Russian)].
- Ибишев Х.С., Крахоткин Д.В., Васильев А.А., Крайний П.А. Рецидивирующая инфекция нижних мочевых путей вирусной этиологии. Вестник урологии 2017;5(1):26-31. [Ibishev Kh.S., Krahotkin D.V., Vasiliev A.A., Krayniy P.A. Recurrent infection of the lower urinary tract of viral etiology. Urology Herald = Vestnik urologii 2017;5(1):26-31. (In Russian)].
- Крахоткин Д.В., Иванов С.Н., Набока Ю.Л., Коган М.И., Гудима И.А., Ильяш А.В. и соавт. Вирусные патогены при урологических заболеваниях. Медицинский вестник юга России 2018;9(4):14-21. [Krahotkin D.V., Ivanov S.N., Naboka Yu.L., Kogan M.I., Gudima I.A., Ilyash A.V. et al. Viral pathogens in urological diseases. Medical Bulletin of the South of Russia = Meditsinskiy vestnik yuga Rossii 2018;9(4):14-21. (In Russian)].
- Молочков В.А., Семенова Т.Б., Киселев В.И., Молочков А.В. Генитальные вирусные инфекции. М.: «Издательство БИНОМ», 2009. 208 с. [Molochkov V.A., Semenova T.B., Kiselev V.I., Molochkov A.V. Genital viral infections. M.: “Publishing house BINOM” 2009.208 s. (In Russian)].
- Atilla E, Yalciner M, Atilla PA, Ates C, Bozdag SC, Yuksel MK, et al. Is cytomegalovirus a risk factor for haemorrhagic cystitis in allogeneic haematopoietic stem cell transplantation recipients? Antivir Ther 2018;23(8):647-653. https://doi.org/10.3851/IMP3252.
- Badawi H, Ahmed H, Aboul Fadl L, Helmi A, Fam N, Diab M, et. al. Herpes simplex virus type‐2 in Egyptian patients with bladder cancer or cystitis. APMIS 2010;118(1):37-44. https://doi.org/10.1111/j.1600-0463.2009.02556.x.
- Мелехина Е.В., Чугунова О.Л., Филиппов А.В. К вопросу о роли вирусов в формировании хронических инфекций органов мочевой системы. Российский медицинский журнал 2013;2:27-30. [Melekhina E.V., Chugunova O.L., Filippov A.V. On the role of viruses in the formation of chronic infections of the urinary tract system. Rossiyskiy meditsinskiy zhurnal=Russian Medical Journal 2013;2:27-30. (In Russian)].
- Gourinat AC, O’Connor O, Calvez E, Goarant C, Dupont-Rouzeyrol M. Detection of Zika virus in urine. Emerg Infect Dis 2015;21(1):84–86. https://doi.org/10.3201/eid2101.140894.
- Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека. Руководство для врачей. Спб:. СпецЛит, 2013. 2-е изд., перераб. и доп. 670 с. [Isakov V.A., Arkhipova E.I., Isakov D.V. Herpesvirus infection. A guide for physicians. SPb:. Spetslit, 2013. 2-e Izd., the reslave. 670 р. (In Russian)].
- Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека. Руководство для врачей. Спб.: СпецЛит, 2006. 303 c. [Isakov V.A., Arkhipova E.I., Isakov D.V. Human Herpesvirus infections. A guidelines for physicians. St. Petersburg:Spec.lit,2006. 303 р. (In Russian)].
- Деревянко Т.И., Рыжков В.В. Вирусные инфекции: вирус папилломы человека и генитальный герпес 1 и 2 типов как причина хронического рецидивирующего цистита с выраженным дизурическим синдромом у женщин с гипоспадией и гипермобильностью уретры. Урология 2015;4:29-33. [Derevyanko T.I., Ryzhkov V.V. Viral infections: human papillomavirus and genital herpes types 1 and 2 as a cause of chronic recurrent cystitis with severe dysuric syndrome in women with hypospadias and hypermobility of the urethra. Urology= Urologiya 2015;4:29-33. (In Russian)].
- Кондратенко И.В. Блогов А.А. Первичные иммунодефициты. — М.: Изд МЕДПРАКТИКА-М, 2005. 232 с.[ Kondratenko V.I. Blogov A. Primary immunodeficiencies. M.: Publishing house of medical practice-M, 2005. P. 232. (In Russian)].
- Набока Ю.Л., Ильяш А.В., Крахоткин Д.В. Вирусо-бактериальные ассоциации, верифицированные в моче здоровых людей (пилотное исследование). Вестник урологии 2018;6(3):44-49. [Naboka Yu.L., Ilyash A.V., Krahotkin D.V. Viral-bacterial associations verified in the urine of healthy people (pilot study). Vestnik urologii = Bulletin of urology 2018;6(3):44-49. (In Russian)]. https://doi.org/10.21886/2308-6424-2018-6-3-44-49.
- Набока Ю.Л., Гудима И.А., Коган М.И., Ибишев Х.С., Черницкая М.Л. Микробный спектр мочи и биоптатов мочевого пузыря у женщин с хроническим рецидивирующим циститом. Урология 2013;4:16-18. [Naboka Y.L., Gudima I.A., Kogan M.I., Ibishev H.S., Chernitskaya M.L. Microbial spectrum of urine and bladder biopsies in women with chronic recurrent cystitis. Urologiya = Urology 2013;4:16-18. (In Russian)].
- Ito S, Yasuda M, Kondo H, Yamada Y, Nakane K, Mizutani K, et al. Clinical courses of herpes simplex virus-induced urethritis in men. J Infect Chemother 2017;23(10):717-719. https://doi.org/10.1016/j.jiac.2017.03.017
- Ashley RL, Wald A. Genital Herpes: Review of the Epidemic and Potential use of type-specific serology. Clinical microbiology reviews, Jan.1999. P.1-8.
- РОДВК – «Федеральные клинические рекомендации по ведению больных опоясывающим герпесом»; Москва, 2015. [Federal clinical guidelines for the management of patients with herpes zoster”; Moscow, 2015. (In Russian)].
- Хрянин А.А. В поисках интерферона. Status Praesens (гинекология, акушерство, бесплодный брак) 2020;1:79-83. [Khryanin A. A. In search of the interferon. Status Praesens (gynecology, obstetrics, infertile marriage) 2020;1:79-83. (In Russian)].







