ВВЕДЕНИЕ
Рак мочевого пузыря (РМП) занимает 10-е место в мире в структуре всех злокачественных новообразований. По данным Международного агентства по изучению рака (International Agency for Research on Cancer – IARC) и Всемирной организации здравоохранения (проект GLOBOCAN) количество впервые выявленных случаев РМП в мире в 2020 г. составило 573 278 (3%), а смертность достигла 212 536 случаев (2,1%) (рис. 1). РМП чаще диагностируется у мужчин, чем у женщин – 9,5 и 3,3 на 100 000 населения соответственно. Согласно данным H. Sung с соавт., РМП выявляется у мужчин в 4 раза чаще, чем у женщин, и занимает 6 место по распространенности [1].
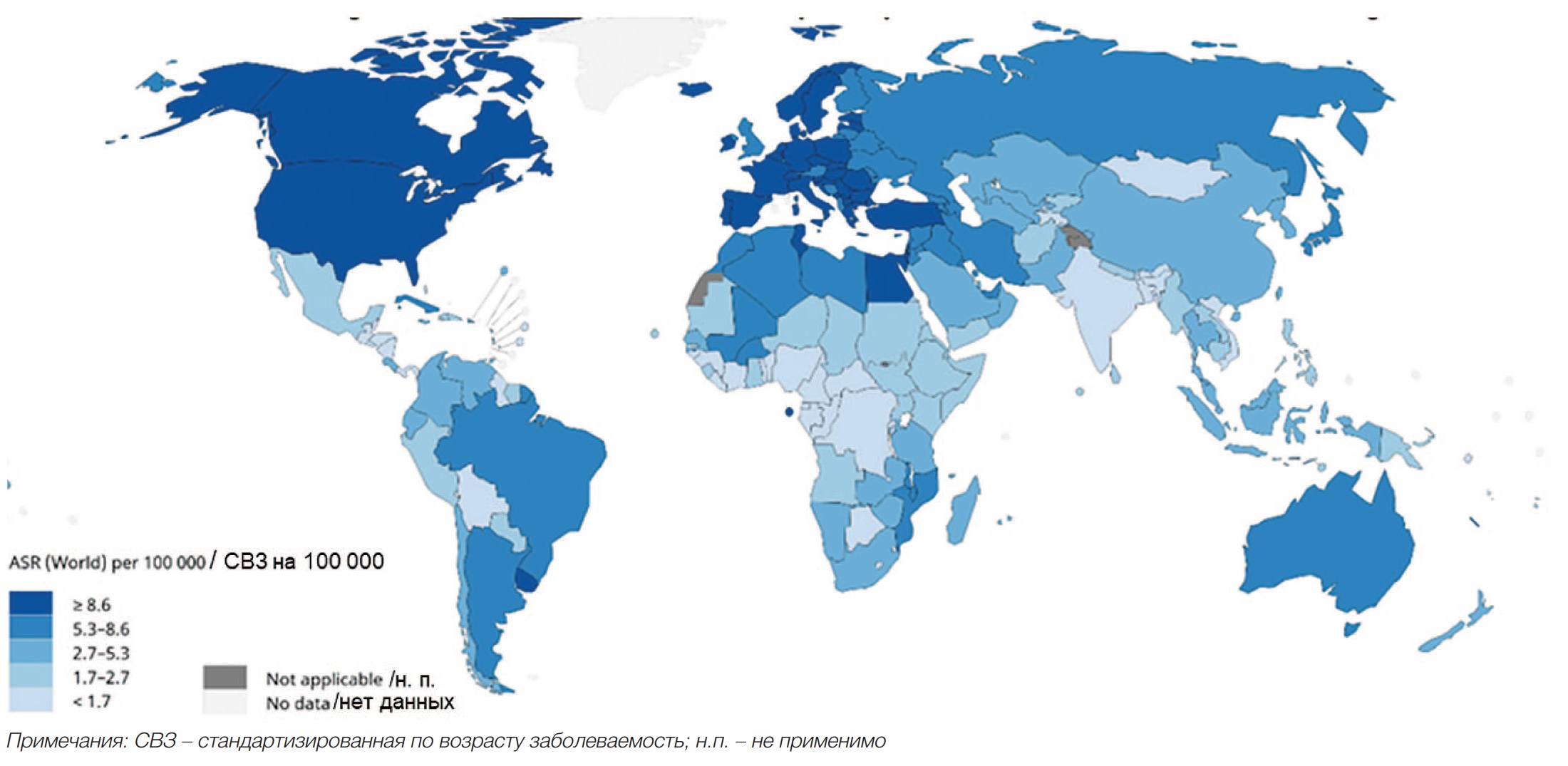
Рис. 1. Cтандартизированная по возрасту заболеваемость РМП в общей популяции [1]
Fig. 1. Age-standardized incidence of bladder cancer in the general population [1]
Примерно 80% случаев РМП диагностируется в возрасте 65 лет и старше [2]. При этом генетическая предрасположенность к РМП подтверждается всего у 7% пациентов [3]. Неинвазивный РМП, как правило, диагностируется у 2/3 пациентов [4]. В 40% случаях заболевание прогрессирует до мышечно-инвазивного рака мочевого пузыря (МИРМП) в течение 5 лет [5, 6]. При этом общая 5-летняя выживаемость (ОВ) при МИРМП после проведения комплексного лечения составляет 58% [7].
В РФ отмечается аналогичный общемировому паттерн распространенности РМП. По данным А.Д. Каприна и соавт. в 2020 году показатель заболеваемости РМП составил 5,6 на 100 000 населения, средний годовой темп прироста был равен 1,9%, что свидетельствует о нерешенной медико-социальной проблеме. Данное заболевание выявлялось в 3,5 раза чаще у мужчин, чем у женщин (11 903 случаев среди мужчин против 3 389 среди женщин). Средний возраст заболевших составлял 67,2 лет. Доля локализованных форм, допускающих проведение радикальных методов лечения (хирургического, лучевого, комбинированного и комплексного) равнялась 78%. За последние 10 лет отмечается снижение смертности от РМП на 14,2% [8].
Радикальная цистэктомия (РЦЭ) с расширенной тазовой лимфаденэктомией (ТЛЭ) является золотым стандартом хирургического лечения больных неметастатическим МИРМП и персистирующим неинвазивным РМП высокой степени злокачественности, как правило, выполняется открытыми хирургическими способами [9, 10]. У мужчин стандартный объем РЦЭ включает удаление единым блоком мочевого пузыря и предстательной железы с семенными пузырьками. У женщин РЦЭ подразумевает выполнение передней экзентерации органов малого таза. Также обязательно выполнять двустороннюю расширенную ТЛЭ.
Активное развитие и внедрение новых медицинских технологий приводит к постепенной смене медико-технологического ландшафта, внедрению новых медицинских технологий, в частности переход на РА хирургию.
Целью настоящего обзора является систематизация данных исследований, оценивающих клинические аспекты применения робот-ассистированной цистэктомии (РАЦЭ) с интракорпоральным формированием ортотопического мочевого резервуара.
МАТЕРИАЛЫ И МЕТОДЫ
Обзор медицинской литературы, опубликованной в период с 2000 по 2022 г., был проведен с использованием информационно-аналитических систем MEDLINE, Scopus, Clinicaltrials.gov, Google Scholar и Web of Science. Стратегия поиска проводилась в соответствии с критериями PICO (Пациент–Вмешательство–Сравнение–Исход). Для поиска медицинской литературы были использованы следующие ключевые слова: робот-ассистированная цистэктомия (robot-assisted cystectomy), РАЦЭ (RARC), ортотопический необладдер (orthotopic neobladder), интракорпоральная РАЦЭ (intracorporeal RARC), экстракорпоральная РАЦЭ (extracorporeal RARC), рак мочевого пузыря (bladder cancer), функциональные исходы (functional outcomes) и клинические исходы (clinical outcomes). Обзор выполнен в соответствии с контрольным перечнем предпочтительных элементов отчетности для систематических обзоров и метаанализов (PRISMA) [11]. Критерий исключения: резюме, обзорные статьи, заметки и комментарии редактора, главы из книг; экспериментальные и лабораторные исследования на животных или кадаврах. Было отобрано 475 оригинальных публикаций, из них в анализ включено 71 оригинальная научная статья по теме исследования.
РЕЗУЛЬТАТЫ
Эволюция роботической хирургии
История развития робот-ассистированной (РА) хирургии начинается с первого применения роботов PUMA 200 и PUMA 500 при проведении точечной биопсии головного мозга в 1985 г. [12]. В этом же году в Ванкувере была использована первая роботическая система Arthrobot для позиционирования ноги пациента при проведении ортопедической операции [13].
Через 3 года B. Davies и соавт. выполнили первую РА трансуретральную резекцию предстательной железы с помощью системы Puma 560 [14]. Данная операция стала основой для разработки робота PROBOT, который был представлен в 1991 г. [15].
В 1992 г. были опубликованы первые данные о клиническом применении ROBODOC, он обеспечил возможность проведения операций по замене тазобедренного сустава [16].
Дальнейшее развитие роботизированных систем было проведено в исследовательском институте SRI International и Intuitive Surgical с внедрением хирургической системы da Vinci Surgical System и компьютерного движения с роботизированной хирургической системой AESOP и ZEUS [17]. Эволюция роботических систем кратко представлена на рисунке 2 [18-28].
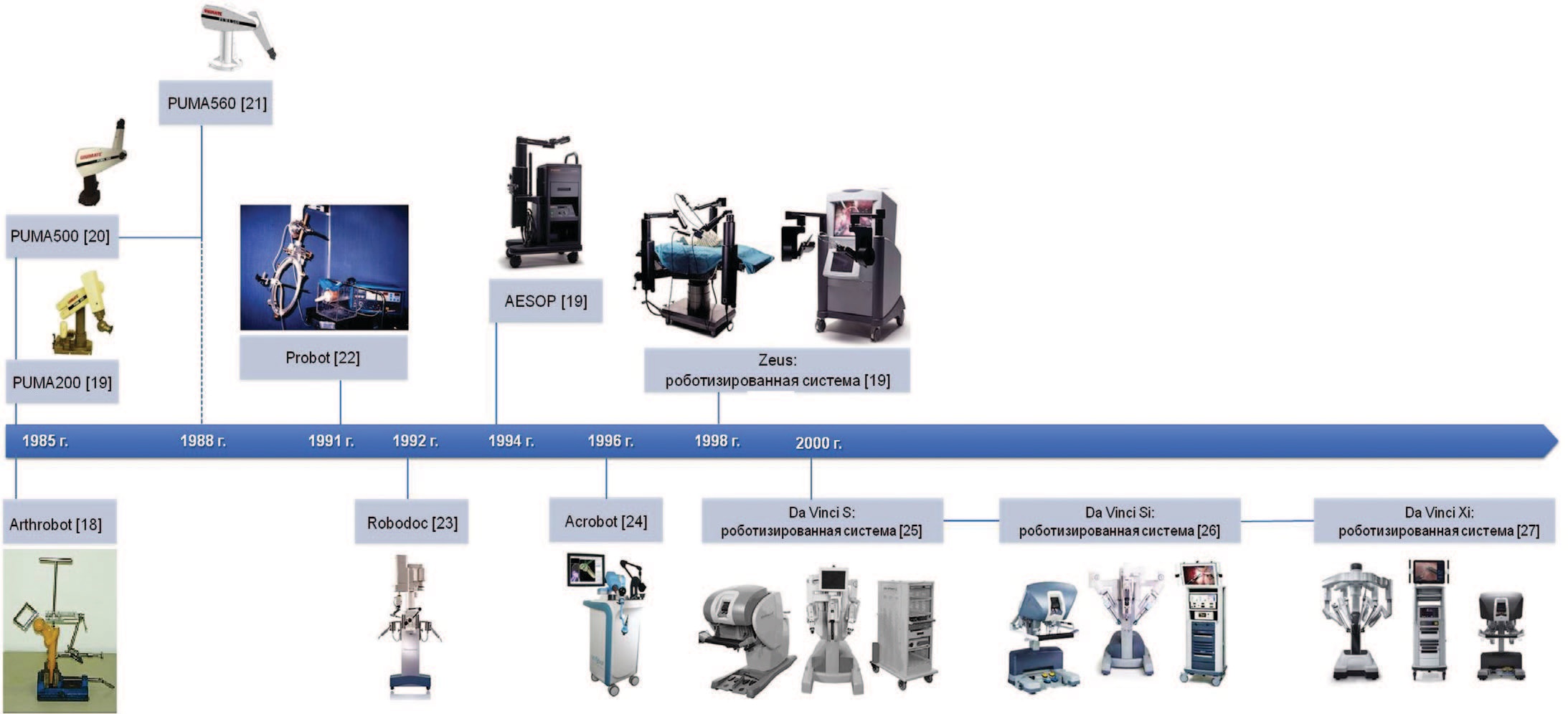
Рис. 2. Эволюция роботических систем [18-27]
Fig. 2. Evolution of surgical robots [18-27]
Первая роботизированная операция была проведена в Медицинском центре Университета штата Огайо в Колумбусе, штат Огайо, под руководством R.E. Michler.
Первую РАЦЭ на роботизированной системе Da Vinci выполнил M. Menon в 2003 году. Первыми пациентами стали 3 женщины с переходно-клеточным РМП. Хирургическое вмешательство выполнялось с использованием традиционного переднего доступа у одной пациентки. В остальных случаях использована новая методика, которая позволила сохранить уретру, матку, влагалище и оба яичника. Мочевой пузырь был заключен в эндоскопический мешок и удален через небольшой субумбиликальный разрез. В двух случаях для реконструкции мочевыводящих органов использован илеальный кондуит, в одном выполнено ортотопическое формирование необладдера. Среднее время операции составило 160 минут (130 минут для илеального кондуита и 180 минут для ортотопического необладдера). Средний объем кровопотери составил менее 100 мл. В среднем проведено удаление 12 лимфатических узлов (от 3 до 21). Опухолевые клетки в краях срезов отсутствовали [29].
Благоприятные клинические исходы пациентов, отсутствие периоперационных осложнений и минимальная инвазивность вмешательства сделали РАЦЭ перспективной альтернативой открытой РЦЭ.
В 2003 г. W.D. Beecken и соавт. опубликовал результаты первой интракорпоральной РАЦЭ. Хирургическое вмешательство было выполнено на роботической системе Da Vinci без осложнений. Время операции составило 8,5 часов, кровопотеря – 200 мл [30].
В 2010 г. в мире насчитывалось всего 500 случаев РАЦЭ, в 2012 г. эта цифра удвоилась и достигла ~ 1000 случаев [31, 32]. В настоящее время доля интракорпоральной РАЦЭ в структуре всех хирургических вмешательств у больных РМП составляет 17% [33].
По данным Международного консорциума роботической цистэктомии (International Robotic Cystectomy Consortium) количество РАЦЭ с интракорпоральным формированием необладдера в Европе увеличилось с 9% в 2005 г. до 97% в 2016 г., а в мире достигло показателя 54% в 2018 г. [34, 35].
Предоперационная подготовка при РАЦЭ
Принципиальных различий в предоперационной подготовке пациентов к РАЦЭ и РЦЭ нет. В предоперационный период пациентам рекомендуется устранение модифицируемых факторов риска – дыхательная гимнастика, отказ от курения, диета и изменение образа жизни [36, 37]. Традиционно пациенты проходят обследование сердечно-сосудистой системы, желудка и кишечника.
Согласно локальным методическим рекомендациям по РАЦЭ в предоперационную подготовку входят: профилактическая инъекции антибактериального препарата, профилактика тромбообразования (инъекции низкомолекулярного гепарина, компрессионные чулки или бинты, а также ранняя мобилизация пациента). Пациентам, которым планируется кишечная деривация мочи, проводится стандартная подготовка кишечника с предоперационной антибиотикопрофилактикой, коррекцией водно-электролитных, белковых нарушений. Назогастральный зонд и уретральный катетер устанавливаются после выполнения анестезиологического пособия [38]. Следует отметить, что преимущества предоперационной подготовки кишечника в отношении минимизации послеоперационной инфекции и несостоятельности кишечных анастомозов не доказаны [39, 40].
Актуальным остается вопрос о применимости протокола ускоренного выздоровления в хирургии (enhanced recovery after surgery, ERAS) в предоперационной подготовке пациентов к интракорпоральной РАЦЭ. ERAS – стандартизированный протокол по уходу за пациентом, в основе которого лежит принцип прецизионности и мультидисциплинарности: образование пациента и его вовлечение в процесс лечения, соблюдение диеты до и после операции, стандартизацию программы анестезии, снижение стресса и раннюю мобилизацию пациента [41].
Согласно протоколу ERAS пациентам при отсутствии признаков пареза желудка показан прием жидкости с высоким содержанием углеводов за 2 часа до операции и отказ от твердой пищи за 6 часов до операции. Пероральная углеводная нагрузка показана только пациентам без сахарного диабета [42].
По данным ряда исследований применение протокола ERAS оказывает положительное влияние на частоту развития послеоперационных осложнений как в ранний послеоперационный период, так и через 90 дней после операции, сокращает время пребывания в стационаре [43-45].
РЦЭ классифицируется как условно чистая операция и в периоперационном периоде в качестве соответствующей хирургической помощи используются антибиотики. Рациональное использование антибактериальных препаратов и не злоупотребление ими в послеоперационном периоде – основная задача в послеоперационном периоде.
Особенности докинга при выполнении интракорпоральной РАЦЭ
Для выполнения РАЦЭ пациента укладывают в дорсальное положение после индукции анестезии. Под зоны потенциального сдавления, а также под руки и икры пациента укладываются валики для профилактики позиционной травмы нервов. Руки пациента надежно фиксируются. Далее поверх валика на грудную клетку накладывается фиксирующий пластырь на шелковой основе шириной 7 см для предотвращения смещения туловища при помещении больного в положение Тренделенбурга. Производится подготовка операционного поля. При разведении ножных секций ноги больного фиксируются бинтом.
Методы установки портов зависят от предпочтений хирурга. Первый метод включает установку порта для камеры на 2 см выше пупка, при этом роботические порты устанавливаются в форме треугольника на расстоянии раскрытой ладони (примерно 11 см) латеральнее верхней части пупка; 15-мм ассистентский порт устанавливается на расстоянии 2 см справа от передней верхней подвздошной ости; 12-мм ассистентский порт – в правом верхнем квадранте. Третий роботический порт, 10-мм, – на ширине ладони латеральнее левого роботического порта. Порты располагаются в виде перевернутой буквы V. Альтернативный метод установки включает установку 12-мм порта камеры на расстоянии 24 см выше лобкового симфиза. Далее наносится разметка для установки других портов. Роботические порты устанавливаются на расстоянии 8 см вдоль линии от порта камеры к передней верхней подвздошной ости на ипсилатеральной стороне. Третий роботический порт устанавливается с левой стороны туловища пациента на 8 см латеральнее левого роботического порта.
Ассистентские порты располагаются с правой стороны туловища пациента. 15-мм порт устанавливается на 8 см латеральнее правого роботического порта, 12-мм порт – на 10 см выше правого роботического порта. Порты могут располагаться зеркально при необходимости работы ассистента с левой стороны. Выбор того или иного метода зависит от предпочтения хирурга. Тем не менее, при интракорпоральном отведении мочи рекомендуется установка ассистентских портов с левой стороны по причине более простых технических манипуляций на работе с подвздошной кишкой. Все манипуляции по забору изолированного сегмента подвздошной кишки подразумевают обычно аппаратные манипуляции, что предпочтительней выполнять с левой стороны.
Затем больного помещают в положение Тренделенбурга для установки латеральных портов. Более того, это упрощает выполнение хирургического вмешательства на органах малого таза за счет смещения тонкой кишки краниально. После этого осуществляется докинг тележки пациента. В правой роботической руке используются монополярные ножницы, в левой – биполярный пинцет, в третьей роботической руке – зажим ProGrasp. В начале операции используется оптика 0°, далее оптика 30°, а также два роботических иглодержателя.
Хирургическая техника выполнения интракорпоральной РАЦЭ
После РЦЭ и ТЛЭ ортотопический необладдер по Studer формируется из изолированного сегмента подвздошной кишки длиной 50-60 см (25 см проксимальнее илеоцекального перехода для профилактики синдрома мальабсорбции). Далее выполняется детубуляризация резецированного сегмента длиной 40-45 см по противобрыжеечному краю с сохранением тубулярности проксимальной части длиной 15 см. Мочеточники имплантируется в проксимальный участок сегмента подвздошной кишки по любой безрефлюксной методике, какой предпочтительней владеет хирург. Наиболее часто применяемые анастомозы по типу «конец в бок» или по Wallace в различных модификациях. До завершения формирования задней поверхности необладдера хирургическая техника идентична традиционной технике по Studer. Проходимость тонкой кишки восстанавливается любым надежным способом, которым владеет оперирующий хирург: ручной шовный анастомоз или аппаратный. Формирование ортотопического резервуара проводится вручную путем наложения непрерывных швов материалом Monocryl 3-0/ Vicril 3-0/Viloc 3-0.
Модифицированная техника. В настоящее время известно несколько десятков различных модификаций формирования ортотопического необладдера из изолированного сегмента подвздошной кишки. Большинство методик происходит из открытой хирургии. Некоторые пластики имеют сугубо исторический интерес, целый ряд пластик существует как малоизвестные модификации или как авторские методики. Основным функциональным критерием является формирование резервуара низкого давления: не более 40 см вод. ст., как непременное условие удовлетворительной континенции мочи. Таким образом, хирург волен использовать собственные наработки и технические приемы при формировании конструкции резервуара.
Кривая обучения интракорпоральной методики РАЦЭ
Следует отметить, что скорость выполнения РАЦЭ с интракорпоральным формированием необладдера и частота периоперационных осложнений непосредственно зависят от пациентопотока, приходящегося на хирургический центр, и опыта выполнения данной операции хирургом [34]. Принимая во внимание техническую сложность выполнения данного вмешательства, большая часть исследований в настоящее время посвящена оценке периоперационных осложнений в начале кривой обучения. Многие исследования являются одноцентровыми, анализирующими результаты лечения в начале кривой обучения. В связи с этим на интракорпоральную РАЦЭ отбираются пациенты с более «сохранным» профилем, что может привести к проблеме неоднородной выборки и нести риск системной ошибки [46]. Соответственно результаты оценки исходов в начале кривой обучения могут не отражать реальной ситуации.
По данным Международного консорциума роботической цистэктомии осложнения 3–5 степени по ClavienDindo при интракопоральной РАЦЭ значимо снизились с 25% в 2005 г. до 6% в 2015 г., в отличие от аналогичного показателя при экстракорпоральной РАЦЭ (13% – в 2006 г. и 14% – в 2015 г.) [47, 48]. Консорциум также зафиксировал сокращение продолжительности выполнения интракорпоральной РАЦЭ и более низкую расчетную кровопотерю, в отличие от экстракорпорального подхода. Исследователи приходят к выводу о том, что интракорпоральное формирование необладдера является более предпочительным для пациента, но более сложным хирургическим вмешательством, которое требует длительного обучения хирургов [49].
Согласно данным Рабочей группы по роботической хирургии Европейского общества урологов, для выхода на плато кривой обучения и достижения оптимального показателя частоты развития серьезных осложнений >3 степени потребуется выполнение 137 операций (95% ДИ; ОР 80–193), 90-дневных осложнений – 97 операций (95% ДИ; ОР 41–154), времени проведения вмешательства – 75 операций (95% ДИ; ОР 65–86), расчетного объема кровопотери – 88 операций (95% ДИ; ОР 70–106) и длительности пребывания в стационаре – 198 операций (95% ДИ; ОР 70–106) [34].
Таким образом на этапе обучения хирурга пациенты могут подвергаться более высокому риску развития осложнений, связанных с хирургическим вмешательством. Повсеместное внедрение интракорпоральной РАЦЭ в рутинную клиническую практику приведет к увеличению годовой нагрузки и позволит ускорить выход на плато кривой обучения. В настоящее время есть ряд симуляционных роботических платформ для обучения хирургов вне операционной [50]. Симуляционное обучение навыкам проведения вмешательства позволило снизить риск технических ошибок на 60% и повысить безопасность пациентов [51-53].
Клинические исходы пациентов после РАЦЭ и РЦЭ
За последнее время проведен ряд ретроспективных, обсервационных и рандомизированных контролируемых исследований (РКИ) по сопоставительной оценке частоты достижения первичных и вторичных конечных точек (количество удаленных лимфатических узлов), периоперационных исходов, онкологического контроля, частоты развития осложнений, ОВ и опухолево-специфической выживаемости (ОСВ) у пациентов после РАЦЭ и РЦЭ [54-57].
Исследовательская группа из Университета Северной Каролины под руководством J. Nix и соавт. провела первое РКИ по оценке эффективности РАЦЭ по сравнению с РЦЭ. Первичной конечной точкой явилось количество удаленных лимфатических узлов. В общей сложности в исследование был включен 41 пациент, рандомизированные в группы РАЦЭ (n=21) и РЦЭ (n=20) [58]. В среднем 19 лимфатических узлов были удалены в группе РАЦЭ против 18 – в группе РЦЭ. При этом в обеих группах отсутствовали опухолевые клетки в краях резекции [58]. Вторичные конечные точки включали объем кровопотери, время выполнения операции, время восстановления работы кишечника после операции, послеоперационное обезболивание и длительность пребывания пациента в стационаре [58]. Пациенты, перенесшие РАЦЭ, имели меньший объем кровопотери, меньшую потребность в послеоперационном обезболивании и более короткие сроки пребывания в стационаре, несмотря на более длительное время выполнения хирургического вмешательства [58].
В исследовании под руководством B.H. Bochner, проводимого на базе Мемориального онкологического центра имени Слоуна-Кеттеринга (Memorial Sloan Kettering Cancer Center), первичной конечной точкой явилась 90-дневная частота развития осложнений (степень 2-5) по классификации Clavien-Dindo [56]. Всего в исследование было включено 118 пациентов, из них 60 пациентов – в группу РАЦЭ и 58 пациентов – в группу РЦЭ. В связи с относительно высокой частотой осложнений 2-5 степеней через 90 дней после хирургического вмешательства, исследование было прекращено. Согласно представленным данным, осложнения 2-5 степеней развились у 37 (62%) пациентов в группе РАЦЭ и у 38 (66%) пациентов в группе РЦЭ. Также проводилась оценка частоты достижения вторичных конечных точек. Объем интраоперационной кровопотери был меньше в группе РАЦЭ, однако продолжительность выполнения хирургического вмешательства была больше. Были получены аналогичные результаты по отсутствию опухолевых клеток в краях резекции и количеству удаленных лимфатических узлов в обеих группах [56]. Среднее время пребывания в стационаре значимо не различалось между двумя группами, так же как и показатели качества жизни через 3 и 6 месяцев после операции. При этом РАЦЭ уступает РЦЭ по данным анализа затрат на лечение [56].
Исследовательская группа под руководством D.J. Parekh из Техасского университета в Сан-Антонио (University of Texas Health Sciences Center at San Antonio), провела РКИ, сравнив РАЦЭ и РЦЭ с позиции частоты достижения первичных конечных точек, которые включали возможность рандомизации, удаление лимфатических узлов и наличие опухолевых клеток в краях резекции [59]. Вторичные конечные точки включали качество жизни и функциональное восстановление [59]. Всего в исследование было включено 46 пациентов, 39 из которых были включены в дальнейший анализ (20 пациентов в группе РАЦЭ и 19 в группе РЦЭ) [59]. Как и в других исследованиях, в группе РАЦЭ отмечены наименьший объем интраоперационной кровопотери и тенденция к сокращению длительности пребывания в стационаре. Частота осложнений, количество удаленных лимфатических узлов и наличие опухолевых клеток в краях резекции значимо не различались между группами [59].
Результаты вышеприведенных исследований являются одноцентровыми и могут содержать ошибку случайной выборки из-за критериев включения пациентов [54]. В связи с этим актуальным представляется рассмотрение результатов исследования RAZOR – первого многоцентрового, открытого, рандомизированного исследования фазы 3, в котором выполнена сопоставительная оценка РАЦЭ и РЦЭ в общей когорте из 350 пациентов (n=176 – группа РАЦЭ и n=174 – группа РЦЭ). Двухлетняя выживаемость без признаков прогрессирования заболевания (ВБП) составила 72,3% (95% ДИ 64,3-78,8) в группе РАЦЭ и 71,6% (95% ДИ 63,6-78,2) в группе РЦЭ, что свидетельствует о том, что РАЦЭ не уступает РЦЭ. Данный вывод также подтвердился при проведении модифицированного анализа всех рандомизированных пациентов.
В течение 2-летнего периода наблюдения 28 (19%) из 150 пациентов в группе РАЦЭ и 32 (21%) из 152 пациентов в группе РЦЭ умерли от прогрессирования РМП. Десять (7%) из 150 пациентов в группе РАЦЭ и 11 (7%) из 152 пациентов в группе РЦЭ умерли от причин, не связанных с РМП. Рецидив также развился у 11 (7%) в группе РАЦЭ и 7 (5%) пациентов в группе РЦЭ. Доля пациентов с локальными рецидивами значимо не различалась в группах исследования (n=6 (4%) из 150 пациентов в группе РАЦЭ против n=4 (3%) в группе РЦЭ, р=0,54), как и доля пациентов с локальным рецидивом в ложе удаленного мочевого пузыря (n=6 (4%) из 150 пациентов в группе РАЦЭ против n=2 (1%) в группе РЦЭ, р=0,17). ВБП ухудшалась пропорционально прогрессированию опухолевого процесса. Расчетная кровопотеря была значительно ниже в группе РАЦЭ. Пациентам данной группы реже требовалось периоперационной гемотрансфузия, чем пациентам в группе РЦЭ (24% против 45% соответственно). Среднее время пребывания пациентов в стационаре было ниже в группе РАЦЭ, при этом 29% пациентов в группе РАЦЭ провели в стационаре менее 5 дней (против 18% в группе РЦЭ) [60].
В исследовании A. Yu и соавт. выявлено, что пациенты старшей возрастной группы лучше переносят РАЦЭ в отличие от РЦЭ. Показатель летальности в группе РАЦЭ составил 2,2% против 4,6% в группе РЦЭ (р=0,027). При многофакторном анализе проведение РАЦЭ ассоциировано с более низкой внутрибольничной смертностью у восьмидесятилетних пациентов (ОШ 0,46; 95% ДИ 0,22–0,99; р=0,047) [61].
Следует отметить, что в данных исследованиях представлена сравнительная оценка РАЦЭ с экстракорпоральным формированием необладдера и РЦЭ, что не может свидетельствовать о недостатках или преимуществах интракорпорального подхода [56, 62]. В настоящее время данные о результатах интракорпоральной РАЦЭ с формированием необладдера по Studer и клинических исходах пациентов немногочисленны.
Клинические исходы пациентов после интракорпоральной РАЦЭ
Очевидными преимуществами интракорпорального подхода являются минимальная травматизация, защита кишечника внутри брюшной полости, меньшее время гипотермии, снижение объема интраоперационной кровопотери, отсутствие необходимости в обширной диссекции мочеточника, что впоследствии может привести к формированию стриктуры мочеточника [48, 63, 64]. Однако при сравнении экстракорпорального и интракорпорального подходов в ряде исследований представлены противоречивые данные [65]. В исследованиях с относительно небольшим количеством пациентов не выявлены различия в частоте развития осложнений или частоте повторных госпитализаций через 30 и 90 дней после хирургического вмешательства [66, 67]. Однако по данным сравнительного исследования по оценке хирургических исходов пациентов после интракорпоральной (n = 1094) и экстракорпоральной (n=1031) РАЦЭ продемонстрировано увеличение частоты развития всех осложнений в группе интракорпорального доступа (43% в группе экстракорпорального против 58% в группе интракорпорального доступа, р<0,001). Тем не менее, после проведения многофакторного анализа не выявлено корреляций между способом деривации мочи, частотой повторных госпитализаций и частотой развития осложнений более тяжелой категории [48]. В настоящее время проводится несколько рандомизированных исследований по дальнейшей оценки эффективности и безопасности интракорпоральной РАЦЭ.
В исследовании M.M. Desai и соавт. были включены 132 пациента, перенесших интракорпоральную РАЦЭ. Развитие осложнений в 30-дневный период выявлено у 47% пациентов, у 27% пациентов осложнения развились в отдаленном периоде (30-90 дней). Осложнения 1-2 степени по классификации Clavien-Dindo наблюдались в 32% случаев, а более выраженные осложнения (3-4 степени) у 15% пациентов в течение 30 дней после операции. В течение 30-90 дней осложнения 1-2 степени выявлены у 14% пациентов и 3-4 степени – у 13% пациентов. Наиболее частыми причинами осложнений явились инфекции (всего 28,8%, сепсис – 14,4%, инфекции мочевыводящих путей – 12,9%) и проблемы, связанные с мочеиспусканием (подтекание мочи – 4,5%, стриктуры мочеточника – 3,5%) [68].
В метаанализе E. Browne и соавт., в который было включено 32 оригинальных исследования по сравнению двух методик выполнения РАЦЭ с ортотопическим формированием необладдера и с формированием кондуита из сегмента подвздошной кишки, с общим количеством пациентов 46 787, выявлено, что пациенты в группе ортотопического необладдера достоверно чаще подвергались реоперации, в отличие от пациентов с кондуитом (ОШ 1,76, 95% ДИ 1,24; 2,50, р<0,01). Инфекции мочевыводящих путей также чаще встречались у пациентов в группе ортотопического необладдера (30,4% против 26,1%, ОШ 0,67, 95% ДИ 0,58; 0,77, р<0,01). В 9 исследованиях проводилась оценка частоты развития стриктуры мочеточника. Согласно представленным данным, это осложнение достоверно чаще встречалось в группе ортотопического формирования необладдера (8,8% против 7,0%, ОШ 0,70, 95% ДИ 0,55; 0,89, р<0,01). Однако частота развития послеоперационных осложнений была выше в группе с формированием кондуита из подвздошного сегмента кишки и составила 15 659 (61,9%) случаев против 5 102 (60,1%) случаев в группе ортотопического необладдера (ОШ 1,16, 95% ДИ 1,09; 1,22, р<0,01). При проведении анализа по подгруппам выявлено, что осложнений 1-2 степени по Clavien-Dindo чаще встречались в группе ортотопического необладдера, а осложнения 3-5 степени – в группе с формированием кондуита из сегмента подвздошной кишки. Смертность также была выше в группе с формированием необладдера из сегмента подвздошной кишки и составила 9,6% против 1,6% в группе ортотопического необладдера (ОШ 6,29, 95% ДИ 5,30; 7,48, р<0,01) [69]. Следует отметить, что данный метаанализ имеет ряд ограничений, которые необходимо принимать во внимание при интерпретации результатов: включение в анализ как ретроспективных, так и проспективных исследований случай-контроль, относительно небольшие размеры выборки. Кроме того, часть данных была представлены в виде медианы и диапазона, вероятность случайной ошибки выборки при включении пациентов в группу ортотопического формирования необладдера.
Интересным представляется ретроспективное исследование G. Simone и соавт. по сравнению интракорпоральной РАЦЭ и РЦЭ (n=363 пациента, минимальная продолжительность наблюдения – 2 года). В группу РЦЭ включены 299, в группу РАЦЭ с интракорпоральным формированием необладдера – 64 пациента. Пациенты, перенесшие открытую операцию, чаще были мужчинами (p=0,08), с более высокой стадией pT (p=0,003), более низкой частотой гистологической верификации уротелиальной карциномы (р=0,05) и меньшей частотой применения неоадъювантной химиотерапии (p<0,001). После проведения псевдорандомизации пациенты из группы РАЦЭ были сопоставлены с 46 пациентами из группы РЦЭ. Две группы исходно не различались по клиникоанамнестическим параметрам. Пациенты в группе РЦЭ имели более высокую частоту периоперационных осложнений (91,3% против 42,2%, p=0,001). В частности в группе РЦЭ зафиксирована наибольшая потребность в проведении гемотрансфузии в ранний послеоперационный период по сравнению с группой РАЦЭ (63% против 9,4% соответственно). При анализе Каплана-Майера двухлетняя безрецидивная выживаемость (БРВ) в группах РАЦЭ и РЦЭ была сопоставима – 87,8 против 84,4, трехлетняя – 79,3 против 84,4, 4-летняя: 79,3 против 73,4, соответственно. Группы также не различались по двухлетней ОСВ (89,6 в группе РАЦЭ против 88,3 в группе РЦЭ) и показателю ОВ (85,2 в группе РАЦЭ против 86,3 в группе РЦЭ). При многофакторном регрессионном анализе Кокса хирургический доступ, стадия pT, стадия pN и количество удаленных лимфатических узлов явились независимыми предикторами БРВ в общей когорте пациентов [62].
Следует отметить, что меньший объем интраоперационной кровопотери и, как следствие, отсутствие необходимости проведения гемотрансфузии в периоперационном периоде ассоциировано с благоприятными онкологическими исходами. Так, в исследовании М. Moschini и соавт. было выявлено, что интраоперационная гемотрансфузия оказывает негативное влияние и ассоциирована с более высоким риском рецидива (HR 1,24; p<0,04), онкоспецифической смертностью (HR 1,60; p<0,02) и общей смертностью (HR 1,45; p<0,03) [70].
В ретроспективное исследование D. Ranti и соавт. были включены 522 пациента, которым была выполнена РАЦЭ по двум методикам: группа 1 (n=125) – с ортотопическим формирование необладдера и группа 2 (n=430) – с формированием кондуита из участка подвздошной кишки. При сравнении двух методов исследования выявлено, что группы значимо не различались по частоте повторных госпитализаций, времени с момента хирургического вмешательства до повторной госпитализации и частоте развития осложнений [71].
В 2022 г. представлены предварительные результаты одноцентрового РКИ, проводимого под руководством R. Mastroianni и соавт., в котором проводится сравнение РЦЭ и РАЦЭ с интракорпоральным формированием необладдера. В обшей сложности в исследование включены 274 пациента в период с 2018 г. по 2020 г. Из них, 96 пациентов были исключены и направлены на паллиативное лечение, 62 пациентам было отказано в рандомизации, 116 пациентов включены в исследование. По данным анализа периоперационного периода, частота гемотрансфузий была выше в группе РЦЭ, по сравнению с РАЦЭ (41% против 22% соответственно, р=0,046). Абсолютное снижение риска составило 19% (95% ДИ, ОШ 2–36). Гомогенное распределение клинических стадий сменилось гомогенным распределением стадий pT и pN при сопоставимом количестве удаленных лимфатических узлов. Частота повторных госпитализаций была сопоставима в обеих группах через 30 дней (7% в группе РАЦЭ против 5% в группе РЦЭ), 90 дней (16% в группе РАЦЭ против 12% в группе РЦЭ) и 180 дней (19% в группе РАЦЭ против 14% в группе РЦЭ). В периоперационный период группы значимо не различались по частоте развития осложнений низкой и высокой степени. Через 6 месяцев после вмешательства в группе РЦЭ отмечается более частное недержание мочи в ночное время по сравнению с пациентами в группе РАЦЭ. При медиане наблюдения 6 месяцев после операции умерли 9 пациентов (5 в группе РАЦЭ, 4 в группе РЦЭ), из них 6 – в связи с прогрессированием РМП (4 – в группе РАЦЭ, 2 – в группе РЦЭ). Однако проведенный анализ Каплана-Мейера не показал наличия достоверных различий в ОСВ, ОВ и БРВ между двумя группами [57].
ВЫВОДЫ
Роботизированные технологии позволили изменить подход к хирургическому лечению МИРМП за последние 15 лет. Благодаря постоянной адаптации технологии и увеличению опыта хирургов, использование РАЦЭ ожидаемо становится более актуальным и количество операций увеличивается с течением времени. Доказано, что данная хирургическая методика может быть более точной, эффективной и безопасной. Многочисленные исследования предварительно показали благоприятные аспекты выполнимости, безопасности и эффективности данной хирургической методики лечения. Хотя для того, чтобы сделать окончательный вывод, требуются доказательства более высокого уровня относительно эффективности РАЦЭ по сравнению с открытой операцией. Что касается периоперационных осложнений и данных выживаемости, на наш взгляд, РАЦЭ будет продолжать улучшать качество жизни пациентов и развиваться как перспективный и жизнеспособный вариант в лечении РМП. Кроме того, продолжается совершенствоваться РА техника интракорпорального формирования необладдера, что делает более широкое внедрение этой техники в клиническую практику в ближайшем будущем.
ЛИТЕРАТУРА
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021;71(3):209-49. https://doi.org/10.3322/caac.21660.
2. Mushtaq J, Thurairaja R, Nair R. Bladder cancer. Surgery 2019;37(9):529-37. https://doi.org/10.1016/j.mpsur.2019.07.003.
3. Al-Zalabani A, Stewart K, Wesselius A, Schols AM, Zeegers M. Modifiable risk factors for the prevention of bladder cancer: a systematic review of meta-analyses. Eur J Epidemiol 2016;31(9):811–51. https://doi.org/10.1007/s10654-016-0138-6.
4. He H, Xie H, Chen Y, Li C, Han D, Xu F, et al. Global, regional, and national burdens of bladder cancer in 2017: estimates from the 2017 global burden of disease study. BMC Public Health 2020;20(1):1693. https://doi.org/10.1186/s12889-020-09835-7.
5. Cumberbatch K, He T, Thorogood Z, Gartrell BA. Emerging drugs for urothelial (bladder) cancer. Expert Opin Emerg Drugs 2017;22(2):149-64. https://doi.org/10.1080/14728214.2017.1336536.
6. Netto GJ, Tafe LJ. Emerging bladder Cancer biomarkers and targets of therapy. Urol Clin North Am 2016;43(1):63-76. https://doi.org/10.1016/j.ucl.2015.08.006.
7. Рак мочевого пузыря: клинические рекомендации [Электронный ресурс]. URL: https://oncology-association.ru/wp-content/uploads/2020/09/rak_mochevogo_ puzyrja.pdf-26. (Дата обращения: 22 июня 2022). [Bladder cancer: clinical guidelines. [Cited 2022 Jun 22]. URL: https://oncology-association.ru/wp-content/ uploads/2020/09/rak_mochevogo_puzyrja.pdf-26. (In Russian)].
8. Каприн А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2020 году (заболеваемости и смертность). М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России 2021; 252 с. [Kaprin A.D., Starinsky V.V., Shakhzadova A.O. Malignant neoplasms in Russia in 2020 (morbidity and mortality). Moscow: P.A. Herzen Moscow State Medical Research Institute − Branch of the Federal State Budgetary Institution NMIC of Radiology of the Ministry of Health of Russia 2021;252 p. (In Russian)].
9. Chang SS, Bochner BH, Chou R, Dreicer R, Kamat AM, Lerner SP, et al. Treatment of non-metastatic muscle-invasive bladder cancer: AUA/ASCO/ASTRO/SUO guideline. J Urol 2017;198(3):552-9. https://doi.org/10.1016/j.juro.2017.04.086.
10. Chang SS, Boorjian SA, Chou R, Clark PE, Daneshmand S, Konety BR, et al. Diagnosis and treatment of non-muscle invasive bladder cancer: AUA/SUO guideline. J Urol 2016;196(4):1021-9. https://doi.org/10.1016/j.juro.2016.06.049.
11. Moher D, Altman DG, Liberati A, Tetzlaff J. PRISMA statement. Epidemiology 2011;22(1):128. https://doi.org/10.1097/EDE.0b013e3181fe7825.
12. Kwoh YS, Hou J, Jonckheere EA, Hayati S. A robot with improved absolute positioning accuracy for CT guided stereotactic brain surgery. IEEE Trans Biomed Eng 1988;35(2):153-60. https://doi.org/10.1109/10.1354.
13. Lechky O. World’s first surgical robot in B.C. [Electronic resource]. [Cited 2022 Jun 22]. URL: https://www.brianday.ca/imagez/1051_28738.pdf .
14. Davies B. A review of robotics in surgery. Proc Inst Mech Eng 2000;214(1):129-40. https://doi.org/10.1243/0954411001535309.
15. Harris SJ, Arambula-Cosio F, Mei Q, Hibberd RD, Davies BL, Wickham JE, et al. The Probot-an active robot for prostate resection. Proc Inst Mech Eng H 1997;211(4):317-25. https://doi.org/10.1243/0954411971534449.
16. Paul HA, Bargar WL, Mittlestadt B, Musits B, Taylor RH, Kazanzides P, et al. Development of a surgical robot for cementless total hip arthroplasty. Clin Orthop Relat Res 1992;(285):57-66. https://doi.org/10.1097/00003086-199212000-00010.
17. Meadows M. Computer-assisted surgery: an update. FDA Consum 2005;39(4):16-7.
18. Kwon DS, Yoon YS, Lee JJ, Ko SY, Huh KH, Chung JH, et al. ARTHROBOT: a new surgical robot system for total hip arthroplasty. Proceedings 2001 IEEE/RSJ International Conference on Intelligent Robots and Systems. Expanding the Societal Role of Robotics in the the Next Millennium (Cat. No.01CH37180) 2001(2):1123-8. https://doi.org/10.1109/IROS.2001.976319.
19. Gokce A. Robotic thoracic surgery. In health sciences theory, current researches and new trends [Duran N., Keskina S., Demir C. eds]. Montenegro: IVPE 2020;182-200.
20. Guzmán-Giménez J, Valera Fernández Á, Mata Amela V, Díaz-Rodríguez MÁ. Synthesis of the inverse kinematic model of non-redundant open-chain robotic systems using groebner basis theory. Appl Sci 2020(10):2781. https://doi.org/10.3390/ app10082781.
21. Neri GL. Robot PUMA 560. GrabCAD Community [Electronic resource]. 2013. [Cited 2022 Mar 17]. URL: https://grabcad.com/library/robot-puma-560.
22. Ganapati P. Surgical robots operate with precision. Wired [Electronic resource] 2009. [Cited 2022 Feb 14]. URL: https://www.wired.com/2009/09/ surgical-robots.
23. Aïdan P, Bechara M. Gasless trans-axillary robotic thyroidectomy: the introduction and principle. Gland Surg 2017;6(3):229-35. https://doi.org/10.21037/gs.2017.03.19.
24. Siddiqi A, Horan T, Molloy RM, Bloomfield MR, Patel PD, Piuzzi NS. A clinical review of robotic navigation in total knee arthroplasty: historical systems to modern design. EFORT Open Rev 2021;6(4):252-69. http://doi.org/10.1302/2058-5241.6.200071.
25. Choi YD, Chung JS. Radical prostatectomy: respective roles and comparisons of robotic and open surgeries. J Korean Med Assoc 2010;53(2):119-25. https://doi.org/10.5124/jkma.2010.53.2.119.
26. McGuinness LA, Prasad Rai B. Robotics in urology. Ann R Coll Surg Engl 2018;100(6_sup):38-44. https://doi.org/10.1308/rcsann.supp1.38.
27. Bhogal RH, Pericleous S, Khan AZ. Robotic Liver Surgery. In: Tsoulfas G, Rodrigo L, editors. Liver disease and surgery. London: Intech Open. [Electronic resource] 2019. [Cited 2022 Aug 04]. URL: https://www.intechopen.com/chapters/68250. https://doi.org/10.5772/intechopen.87995.
28. McConnell PI, Schneeberger EW, Michler RE. History and development of robotic cardiac surgery. Problems in General Surgery 2003;20(2):20–30. https://doi.org/10.1097/01.sgs.0000081182.03671.6e.
29. Menon M, Hemal AK, Tewari A, Shrivastava A, Shoma AM, Abol-Ein H, et al. Robot-assisted radical cystectomy and urinary diversion in female patients: technique with preservation of the uterus and vagina. J Am Coll Surg 2004;198(3):386-93. https://doi.org/10.1016/j.jamcollsurg.2003.11.010.
30. Beecken WD, Wolfram M, Engl T, Bentas W, Probst M, Blaheta R, et al. Roboticassisted laparoscopic radical cystectomy and intra-abdominal formation of an orthotopic ileal neobladder. Eur Urol 2003;44(3):337-9. https://doi.org/10.1016/ s0302-2838(03)00301-4.
31. Davis JW, Castle EP, Pruthi RS, Ornstein DK, Guru KA. Robot-assisted radical cystectomy: an expert panel review of the current status and future direction. Urol Oncol 2010;28(5):480–6. https://doi.org/10.1016/j.urolonc.2009.11.014.
32. Tyritzis SI, Hosseini A, Jonsson M, Adding C, Nilsson A, Wiklund NP. Robot-assisted intracorporeal formation of the ileal neobladder. J Endourol 2012;26(12):1570–5. https://doi.org/10.1089/end.2012.0424.
33. Maqboul F, Thinagaran JKR, Dovey Z, Wiklund P. The contemporary status of robotic intracorporeal neobladder. Mini-invasive Surg 2021(5):44. http://dx.doi.org/10.20517/2574-1225.2021.54.
34. Wijburg CJ, Hannink G, Michels CTJ, Weijerman PC, Issa R, Tay A, et al. Learning curve analysis for intracorporeal robot-assisted radical cystectomy: results from the EAU Robotic Urology Section Scientific Working Group. Eur Urol Open Sci 2022(39):55-61. https://doi.org/10.1016/j.euros.2022.03.004.
35. Zamboni S, Soria F, Mathieu R, Xylinas E, Abufaraj M, Andrea DD, et al. Differences in trends in the use of robot-assisted and open radical cystectomy and changes over time in peri-operative outcomes among selected centres in North America and Europe: an international multicentre collaboration. BJU Int 2019(124):656-64. https://doi.org/10.1111/bju.14791.
36. Lone Z, Hall S, Terakawa T, Ahmed YE, Elsayed AS, Aldhaam N, et al. Accuracy of American College of Surgeons national surgical quality improvement program universal surgical risk calculator in predicting complications following robotassisted radical cystectomy at a National Comprehensive Cancer Center. J Endourol 2019;33(5):383–8. https://doi.org/10.1089/end.2019.0093.
37. Ahmed YE, Hussein AA, Kozlowski J, Guru KA. Robot-assisted radical cystectomy in men: technique of spaces. J Endourol 2018;32(S1):S44–S48. https://doi.org/10.1089/end.2017.0719.
38. Колонтарев К.Б., Медведев В.Л., Семенякин И.В., Ковылина М.В., Прилепская Е.А., Пушкарь Д.Ю. Робот-ассистированная радикальная цистэктомия: методические рекомендации; М.: ИД «АБВ-пресс» 2018;36 с. [Kolontarev K.B., Medvedev V. L., Semenyakin I. V., Kovylina M. V., Prilepskaya E. A., Pushkar D. Yu. Robot-assisted radical cystectomy: guidelines. Moscow: ABV-press publishing house, 2018; 36 p. (In Russian)].
39. Kurpad R, Woods M. Robot-assisted radical cystectomy. J Surg Oncol 2015;112(7):728-35. https://doi.org/10.1002/jso.24009.
40. Collins JW, Patel H, Adding C, Annerstedt M, Dasgupta P, Khan SM, et al. Enhanced recovery after robot-assisted radical cystectomy: EAU robotic urology section scientific working group consensus view. Eur Urol 2016;70(70):649–60. https://doi.org/10.1016/j.eururo.2016.05.020.
41. Tamhankar AS, Ahluwalia P, Patil SR, Nambiath S, Gautam G. Implementation of ERAS protocol in robot-assisted radical cystectomy with intracorporeal ileal conduit urinary diversion: an outcome analysis beyond the learning curve. Indian J Urol 2020;36(1):37-43. https://doi.org/10.4103/iju.IJU_207_19.
42. Vukovic N, Dinic L. Enhanced recovery after surgery protocols in major urologic surgery. Front Med (Lausanne) 2019(5):93. https://doi.org/10.3389/fmed.2018.00093.
43. Moschini M, Stabile A, Mattei A, Montorsi F, Cathelineau X, Sanchez-Salas R. Enhanced recovery after surgery (ERAS) in radical cystectomy patients: from consensus to evidences. Int Braz J Urol 2019;45(4):655-7. https://doi.org/10.1590/ S1677-5538.IBJU.2019.04.02.
44. Lannes F, Walz J, Maubon T, Rybikowski S, Fakhfakh S, Picini M, et al. Enhanced recovery after surgery for radical cystectomy decreases postoperative complications at different times. Urol Int 2022;106(2):171-9. https://doi.org/10.1159/000518163.
45. Zhang H, Wang H, Zhu M, Xu Z, Shen Y, Zhu Y, et al. Implementation of enhanced recovery after surgery in patients undergoing radical cystectomy: a retrospective cohort study. Eur J Surg Oncol 2020;46(1):202-8. https://doi.org/10.1016/ j.ejso.2019.07.021.
46. Aron M, Gill IS. Robotic radical cystectomy: so far, so good ― what next? Eur Urol 2015;67(3):361-2. https://doi.org/10.1016/j.eururo.2014.12.054.
47. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg 2004;240(2):205-13. https://doi.org/10.1097/01.sla.0000133083.54934.ae.
48. Hussein AA, May PR, Jing Z, Ahmed YE, Wijburg CJ, Canda AE, et al. Outcomes of intracorporeal urinary diversion after robot-assisted radical cystectomy: results from the International Robotic Cystectomy Consortium. J Urol 2018;199(5):1302-11. https://doi.org/10.1016/j.juro.2017.12.045.
49. Tanneru K, Jazayeri SB, Kumar J, Alam MU, Norez D, Nguyen S, et al. Intracorporeal versus extracorporeal urinary diversion following robot-assisted radical cystectomy: a meta-analysis, cumulative analysis, and systematic review. J Robot Surg 2021;15(3):321-33. https://doi.org/10.1007/s11701-020-01174-4.
50. Puliatti S, Mazzone E, Dell’Oglio P. Training in robot-assisted surgery. Curr Opin Urol 2020;30(1):65-72. https://doi.org/10.1097/MOU.0000000000000687.
51. Larcher A, De Naeyer G, Turri F, Dell’Oglio P, Capitanio U, Collins JW, et al. The ERUS curriculum for robot-assisted partial nephrectomy: structure definition and pilot clinical validation. Eur Urol 2019;75(6):1023-31. https://doi.org/10.1016/ j.eururo.2019.02.031.
52. Mazzone E, Puliatti S, Amato M, Bunting B, Rocco B, Montorsi F, et al. A systematic review and meta-analysis on the impact of proficiency-based progression simulation training on performance outcomes. Ann Surg 2021;274(2):281-9. https://doi.org/10.1097/ SLA.0000000000004650.
53. Dell’Oglio P, Turri F, Larcher A, et al. Definition of a structured training curriculum for robot-assisted radical cystectomy with intracorporeal ileal conduit in male patients: a Delphi consensus study led by the ERUS educational board. Eur Urol Focus 2022;8(1):160-4. https://doi.org/10.1016/j.euf.2020.12.015. https://doi.org/10.1016/ j.euf.2020.12.015.
54. Khan MS, Gan C, Ahmed K, Ismail AF, Watkins J, Summers JA, et al. A single-centre early phase randomised controlled three-arm trial of open, robotic, and laparoscopic radical cystectomy (CORAL). Eur Urol 2016;69(4):613-21. https://doi.org/10.1016/j.eururo.2015.07.038.
55. Messer JC, Punnen S, Fitzgerald J, Svatek R, Parekh DJ. Health-related quality of life from a prospective randomised clinical trial of robot-assisted laparoscopic vs open radical cystectomy. BJU Int 2014;114(6):896-902. https://doi.org/10.1111/bju.12818.
56. Bochner BH, Dalbagni G, Sjoberg DD, Silberstein J, Keren Paz GE, Donat SM, et al. Comparing open radical cystectomy and robot-assisted laparoscopic radical cystectomy: a randomized clinical trial. Eur Urol 2015;67(6):1042-50. https://doi.org/10.1016/j.eururo.2014.11.043.
57. Mastroianni R, Ferriero M, Tuderti G, Anceschi U, Bove AM, Brassetti A, et al. Open radical cystectomy versus robot-assisted radical cystectomy with intracorporeal urinary diversion: early outcomes of a single-center randomized controlled trial. J Urol 2022;207(5):982-92. https://doi.org/10.1097/JU.0000000000002422.
58. Nix J, Smith A, Kurpad R, Nielsen ME, Wallen EM, Pruthi RS. Prospective randomized controlled trial of robotic versus open radical cystectomy for bladder cancer: perioperative and pathologic results. Eur Urol 2010;57(2):196–201. https://doi.org/10.1016/j.eururo.2009.10.024.
59. Parekh DJ, Messer J, Fitzgerald J, Ercole B, Svatek R. Perioperative outcomes and oncologic efficacy from a pilot prospective randomized clinical trial of open versus robotic assisted radical cystectomy. J Urol 2013;189(2):474–9. https://doi.org/10.1016/ j.juro.2012.09.077.
60. Parekh DJ, Reis IM, Castle EP, Gonzalgo ML, Woods ME, Svatek RS, et al. Robotassisted radical cystectomy versus open radical cystectomy in patients with bladder cancer (RAZOR): an open-label, randomised, phase 3, non-inferiority trial. Lancet 2018;391(10139):2525-36. https://doi.org/10.1016/S0140-6736(18)30996-6.
61. Yu A, Wang Y, Mossanen M, Preston M, Carvalho FL, Chung BI, et al. Robotic-assisted radical cystectomy is associated with lower perioperative mortality in octogenarians. Urol Oncol 2022;40(4):163.e19-163.e23. https://doi.org/10.1016/ j.urolonc.2021.08.027.
62. Simone G, Tuderti G, Misuraca L, Anceschi U, Ferriero M, Minisola F, et al. Perioperative and mid-term oncologic outcomes of robotic assisted radical cystectomy with totally intracorporeal neobladder: Results of a propensity score matched comparison with open cohort from a single-centre series. Eur J Surg Oncol 2018;44(9):1432-8. https://doi.org/10.1016/j.ejso.2018.04.006.
63. Hosseini A, Ebbing J, Collins J. Clinical outcomes of robot-assisted radical cystectomy and continent urinary diversion. Scand J Urol 2019;53(2-3):81-8. https://doi.org/10.1080/21681805.2019.1598486.
64. Сhan KG, Collins JW, Wiklund NP. Robot-assisted radical cystectomy: extracorporeal vs intracorporeal urinary diversion. J Urol 2015;193(5):1467–9. https://doi.org/10.1016/j.juro.2015.02.042.
65. Pfail JL, Garden EB, Gul Z, Katims AB, Rosenzweig SJ, Razdan S, et al. Implementation of a nonopioid protocol following robot-assisted radicalcystectomy with intracorporeal urinary diversion. Urol Oncol 2021;39(7):436.e9-436.e16. https://doi.org/10.1016/j.urolonc.2021.01.002.
66. Lenfant L, Verhoest G, Campi R, Parra J, Graffeille V, Masson-Lecomte A, et al. Perioperative outcomes and complications of intracorporeal vs extracorporeal urinary diversion after robot-assisted radical cystectomy for bladder cancer: a real-life, multi-institutional french study. World J Urol 2018;36(11):1711-8. https://doi.org/10.1007/s00345-018-2313-8.
67. Bertolo R, Agudelo J, Garisto J, Armanyous S, Fergany A, Kaouk J. Perioperative outcomes and complications after robotic radical cystectomy with intracorporeal or extracorporeal ileal conduit urinary diversion: head-to-head comparison from a single-institutional prospective study. Urology 2019(129):98-105. https://doi.org/10.1016/j.urology.2018.11.059.
68. Desai MM, Gill IS, de Castro Abreu AL, Hosseini A, Nyberg T, Adding C, et al. Robotic intracorporeal orthotopic neobladder during radical cystectomy in 132 patients. J Urol 2014;192(6):1734–40. https://doi.org/10.1016/j.juro.2014.06.087.
69. Browne E, Lawrentschuk N, Jack GS, Davis NF. A systematic review and metaanalysis of the long-term outcomes of ileal conduit and orthotopic neobladder urinary diversion. Can Urol Assoc J 2021;15(1):E48-E57. https://doi.org/10.5489/cuaj.6466.
70. Moschini M, Dell' Oglio P, Capogrosso P, Cucchiara V, Luzzago S, Gandaglia G, et al. Effect of allogeneic intraoperative blood transfusion on survival in patients treated with radical cystectomy for nonmetastatic bladder cancer: results from a single high-volume institution. Clin Genitourin Cancer 2015;13(6):562-7. https://doi.org/10.1016/j.clgc.2015.04.009.
71. Ranti D, Pfail J, Garcia M, Razdan S, Bieber C, Rosenzweig S, et al. Neobladder creation in patients with chronic kidney disease: a viable diversion strategy. Urol







